カドヘリン
川内 健史
慶應義塾大学 医学部
DOI:10.14931/bsd.2401 原稿受付日:2012年8月28日 原稿完成日:2012年9月14日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
英語名:cadherin 独:Cadherine 仏:cadhérine
| Cadherin domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Ribbon representation of a repeating unit in the extracellular E-cadherin ectodomain of the mouse (Mus Musculus) [1] | |||||||||
| Identifiers | |||||||||
| Symbol | Cadherin | ||||||||
| Pfam | PF00028 | ||||||||
| InterPro | IPR002126 | ||||||||
| SMART | CA | ||||||||
| PROSITE | PDOC00205 | ||||||||
| SCOP | 1nci | ||||||||
| SUPERFAMILY | 1nci | ||||||||
| |||||||||
カドヘリンは、カルシウム依存的に細胞と細胞を接着させる作用をもつ主要な細胞接着分子であり、竹市雅俊によって発見・命名された。カドヘリン(Cadherin)の名前は、Calcium(カルシウム)+ Adherence(接着)に由来する。カドヘリンは、細胞外領域にECドメイン(カドヘリン・リピートとも呼ばれる)をもつ細胞膜タンパク質であり、ヒトでは100種類を超えるスーパーファミリーを形成している。そのほとんどが膜貫通ドメインをもつが、T-カドヘリン(CDH13)はGPIアンカーを介して細胞膜と結合している。カドヘリンは、上皮細胞におけるアドへレンス・ジャンクションや神経細胞におけるシナプスを含む細胞-細胞間接着部位に局在し、主にホモフィリックな接着機能を介して細胞間相互作用を制御するが、細胞内へシグナルを伝える受容体として働く場合もある[2][3]。
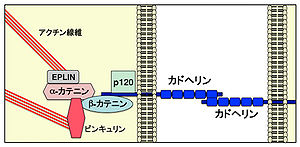
クラッシックカドヘリンは、細胞外領域にECドメイン(青の長方形)を5個もち、その細胞内領域で、カテニン(βカテニン、p120カテニン)と結合する[4]
カドヘリンスーパーファミリー
カドヘリンスーパーファミリーは、クラッシックカドヘリンと非クラッシックカドヘリンに大別される。
クラシックカドヘリン
クラッシックカドヘリンは5個のECドメインと1個の膜貫通領域をもつ(図1)。なお、デスモソームに局在するデスモソーマルカドヘリンも同様の分子構造をもつが、細胞内ドメインなどの配列が異なり、非クラッシクカドヘリンに分類される(下記参照)。クラッシックカドヘリンは、タイプIとタイプIIに分けられる。最も研究が進んでいるE-カドヘリン(CDH1)やN-カドヘリン(CDH2)は、タイプIに含まれる(表1)。クラッシックカドヘリンおよびデスモソーマルカドヘリンの細胞内領域には、カテニンと呼ばれる分子群が結合する。βカテニンとP120カテニンはクラッシックカドヘリンの細胞内領域に直接結合するのに対して、αカテニンはβカテニンを介して間接的に結合する(図1)。これらのカテニンやその結合分子(ビンキュリン、エプリンなど)は、カドヘリンと細胞骨格をつなぐなどの重要な働きをもつ。
| タイプI | CDH1 (E-カドヘリン), CDH2 (N-カドヘリン), CDH3 (P-カドヘリン), CDH4 (R-カドヘリン), CDH15 (M-カドヘリン) |
| タイプII | CDH5 (VE-カドヘリン), CDH6 (K-カドヘリン), CDH7, CDH8, CDH9, CDH10, CDH11 (OB-カドヘリン), CDH12, CDH18, CDH19, CDH20, CDH22, CDH24 |
表1.クラッシックカドヘリンの分類
非クラシックカドヘリン
カドヘリンの分類は論文によって異なる場合もあるが、非クラッシックカドヘリンは、皮膚や心筋などにみられる強固な細胞間接着であるデスモソームに局在するデスモソーマルカドヘリン(デスモグレイン、デスモコリン)、GPIアンカー型のT-カドヘリン(CDH13)、プロトカドヘリン、7回膜貫通型で平面極性の制御因子であるCelsr(ショウジョウバエのFlamingo)、Fatとその結合相手であるDachsousなどが知られている。
プロトカドヘリンのうち、プロトカドヘリンα、β、γ遺伝子は、それぞれゲノム上に遺伝子クラスターを形成しており、例えばプロトカドヘリンα遺伝子のクラスターからは、N末端側が異なるエクソンにコードされた10種類以上のタンパク質が作られるが、1つの神経細胞には1種類のプロトカドヘリンαアイソフォームのみが発現すると考えられている[5]。
脳におけるカドヘリンの機能
神経管形成
神経系は外胚葉由来であり、外胚葉が陥没した管(神経管)から脳・脊髄が形成される。外胚葉における上皮の頂端(apical)側が神経管の内腔側になり、神経管の内腔は脳室となる。神経管の形成に伴い、E-カドヘリンの発現が消失し、N-カドヘリンに置き換わることが知られている。神経管の形成には、N-カドヘリンとプロトカドヘリン19が協調的に働くことが必要であることが、ゼブラフィッシュを用いた実験系で示されている[6]。
神経前駆細胞
脳を構成する神経細胞は、発生期において脳室近辺に存在する神経前駆細胞から産生される。神経前駆細胞はいくつかの種類に分類されるが、脳室に面した細胞層である脳室帯に存在する放射状グリア(グリアという名前が付いているが、その実体は神経前駆細胞である)は、神経細胞のみならず他の種類の神経前駆細胞も産生する、主要な神経前駆細胞である。
発生期大脳皮質の脳室帯に存在する神経前駆細胞(放射状グリア)は、その頂端側(脳室側)にN-カドヘリンを強く発現しており、N-カドヘリン遺伝子破壊マウスでは、脳室帯の構造が崩壊する[7](図2)。このマウスでは、神経前駆細胞から神経細胞への分化については大きな影響がないが、N-カドヘリンを個体レベルでノックダウン(RNA干渉法を用いた発現抑制)すると、神経分化が促進されることが報告されている[8]。
神経細胞移動
カドヘリンは脳の様々な領域で機能しているが、図2にはひとつの例として発生期のにおけるカドヘリン(主にN-カドヘリン)の役割を示した。N-カドヘリンは、神経前駆細胞同士の接着を制御することにより、脳室帯の構造を維持している。さらに、N-カドヘリンは神経細胞が放射状突起(神経前駆細胞由来の長い突起)に接着するためにも必要であり、(放射状突起に沿った移動)を含む神経細胞移動に重要な役割を果たす。移動中の神経細胞は、後方(脳室側:図の下側)に軸索を伸長するが、様々な脳の領域において軸索伸長にもカドヘリンが必要である(本文参照)。また、移動を終了した細胞は樹状突起を成熟させ、別の神経細胞のとの間にシナプスを形成するが、カドヘリンは、維持、さらに(など)においても重要な役割を果たす。
脳室近辺で誕生した神経細胞は、脳室側から最終配置部位までの長い距離を移動することにより、脳の層構造や神経核が形成される。例えば、ほ乳類の大脳皮質は特徴的6な層構造を示すが、これは、脳室帯もしくは脳室下帯で誕生した神経細胞が、複雑な形態変化を伴う多段階の移動を行うことによって構築される[9](図2)。
発生期大脳皮質における神経細胞移動は多段階であることが知られているが、その大部分は、神経前駆細胞由来の長い突起(放射状突起)に沿って移動する「ロコモーション様式」である(図2)。ロコモーション様式で移動する神経細胞は、N-カドヘリン依存的に放射状突起に接着する。さらに、一部のN-カドヘリンがRabファミリー低分子量Gタンパク質依存的に神経細胞内に取り込まれ、再び細胞膜へとリサイクルされることにより、ちょうどN-カドヘリンという「足」を引っ込めて、再びそれを前へと踏み出すようにして、神経細胞は放射状突起の上を「歩いて」いると考えられている[10](図2)。また、ロコモーション様式以外の移動様式においてもN-カドヘリンが関与していることが報告されているが[11][12]、その下流のメカニズムについては今後の課題である。
大脳皮質以外の領域においても、菱脳唇(rhombic lip)由来の小脳顆粒細胞の移動にN-カドヘリンが必要であることが、ゼブラフィッシュを用いた実験系で示されている[13]。また、マウスにおいて、下菱脳唇(lower rhombic lip)から外側網様体核(lateral reticular nucleus: LRN)および副楔状束核(external cuneate nucleus: ECN)へ向かう神経細胞は、N-カドヘリンとカドヘリン11依存的に移動することが報告されている[14]。すなわち、カドヘリンは層構造のみならず神経核の形成にも関与していると考えられる。
神経突起伸長
神経細胞は、最終配置部位への移動中もしくは移動終了後に軸索や樹状突起を伸長し、神経回路網を形成する。軸索が正しく伸長するためにはN-カドヘリンが必要であることが、ゼブラフィッシュの網膜などで示されている[15]。また、ラットの海馬由来の初代培養神経細胞を用いた実験系により、N-カドヘリン依存性の細胞接着を支点としてアクチン細胞骨格が動く(actin flow)ことにより、神経突起が伸長するというモデルが提唱されている[16](図2)。
N-カドヘリンと同じくタイプI-クラッシックカドヘリンに属するR-カドヘリン(CDH4)や、非クラッシックカドヘリンのひとつOL-プロトカドヘリン(プロトカドヘリン10)などが軸索の伸長に関与することが知られている[17][18]。OL-プロトカドヘリンは線条体の神経細胞の軸索に発現し、その伸長を制御する。この線条体から伸びる軸索は、大脳皮質から視床や脊髄へ投射する軸索や、反対に視床から大脳皮質へと投射する軸索が正常に伸長するために必要であり、OL-プロトカドヘリンの遺伝子破壊マウスでは、これらすべての軸索伸長が異常となる。
視床は、脳の様々な領域からの入力を受け、その情報を大脳皮質へと伝える領域である。例えば、視床は、網膜神経節細胞(retinal ganglion cell: RGC)からの入力を受けている。このRGCの軸索とその投射先の神経細胞は、どちらもカドヘリン6を発現しており、カドヘリン6の遺伝子破壊マウスでは、RGCから視床への投射が異常となる[19]。このように、神経細胞が特定の脳領域へと投射するための分子基盤は、少なくとも一部はカドヘリンのホモフィリックな接着で説明ができる。神経細胞の投射先の選別がカドヘリンの種類によって決められているという仮説を、カドヘリン・コード(もしくはカドヘリン接着コード)仮説と呼ぶ。
視床へ集まった情報は、視床から大脳皮質へと投射する軸索(Thalamocortical axon:視床皮質軸索)によって、大脳皮質の4層へと伝えられる。大脳皮質と視床のスライス組織を共培養することにより、視床皮質軸索の伸長を再現できるが、ここでN-カドヘリンの機能を阻害すると、視床皮質軸索は4層で止まることができなくなり、さらに表層まで伸長し続ける[20]。すなわち、N-カドヘリンは軸索が正しい領域に投射するためにも必要である。
情報の受け手側となる樹状突起の形態形成においても、カドヘリンが関与する。小脳のプルキンエ細胞や網膜のアマクリン細胞などにおいて、同一細胞から伸びる樹状突起は、互いに反発し合うことにより、重なることなく突起を広げることが知られているが(これをself-avoidanceと呼ぶ)、プロトカドヘリンγの遺伝子クラスター(マウスでは22個の遺伝子が含まれる)を欠失させると、網膜のコリン作動性アマクリン細胞(Retinal starburst amacrine cell)などにおいてself-avoidanceが異常となり、本来は互いに反発して広がるはず樹状突起が接着して重なり合ってしまう[21]。
シナプス形成と高次脳機能
神経細胞の興奮は、軸索末端からシナプスを介して、情報の受け手側の神経細胞の樹状突起へと伝達される。情報が出力される側(軸索側)の細胞をシナプス前細胞、入力側(樹状突起側)をシナプス後細胞と呼ぶ。興奮性シナプスは、樹状突起上に形成された短い膜突出(フィロポディア)が成熟してマッシュルーム型となり(これをスパインと呼ぶ)、このスパインに軸索が投射することにより形成される。シナプス前細胞においてシナプス小胞が放出される領域はアクティブ・ゾーン、シナプス後細胞において神経伝達物質の受容体やその裏打ちタンパク質が濃縮する部位はシナプス後肥厚(post-synaptic density)と呼ばれ、カドヘリンはこれらの構造にも観察されるが、むしろその辺縁部に強く局在する[22]。カドヘリンの活性は、スパインの形成や神経活動依存的なスパインの肥大化に必要であることが示されている[23][24](図2)。
海馬CA3領域の神経細胞(CA3錐体細胞)は、その樹状突起の近位部にて、歯状回の顆粒細胞の軸索(苔状線維)からの入力を受ける。CA3錐体細胞の樹状突起近位部には、N-カドヘリンが局在する。このN-カドヘリンの局在は、ネクチンという免疫グロブリンスーパーファミリーに属する細胞-細胞間接着分子によって決められている[25]。(ネクチンがカドヘリンを細胞接着部位にリクルートすることは、上皮細胞のアドへレンス・ジャンクションなどでも観察されていることから、組織を問わず一般的な現象であると考えられる。)
ネクチンは、ホモフィリックだけではなく、ヘテロフィリックな結合活性ももち、ネクチン-1とネクチン-3は、それぞれのホモフィリックな接着(ネクチン-1同士もしくはネクチン-3同士)よりも、ヘテロフィリックな接着(ネクチン-1とネクチン-3)の方が強いことが知られている。ネクチン-1は海馬の歯状回顆粒細胞から伸びる苔状線維に発現し、ネクチン-3はCA3錐体細胞の樹状突起近位部に局在し、ネクチン-1もしくはネクチン-3の遺伝子破壊マウスの海馬では、これらの神経細胞の間に形成されるシナプスの数が減少する[26]。また、歯状回の顆粒細胞から伸長する苔状線維が正しく投射するためにはカドヘリン8が必要であり、苔状線維とCA3錐体細胞の樹状突起の間のシナプスが形成されるためには、カドヘリン9が必要であることも報告されている[27][28]。
このように、カドヘリンは、神経細胞移動や神経突起伸長のみならず、シナプス形成においても重要な役割を果たすことから、神経活動や脳の高次機能にも何らかの役割を果たしていることが予想される。実際、N-カドヘリンはAMPA型グルタミン酸受容体(グルタミン酸は興奮性神経細胞の主要な神経伝達物質)の輸送や、海馬CA3錐体細胞由来のシャッファー側枝からの入力を受けるCA1錐体細胞のシナプスにおける長期増強に関与する[29][30]。さらに、海馬におけるN-カドヘリンの機能阻害は、文脈依存的恐怖記憶の形成が低下する[31]。また、カドヘリン-11の遺伝子破壊マウスは、恐怖や不安に関する行動が異常となることが知られている[32]。
これらの研究成果より、カドヘリンスーパーファミリーは、多種類の神経細胞が複雑な神経回路網を構築し、シナプスを介した神経伝達を通して高次機能を発揮する過程において、多様かつ重要な役割を果たしていると考えられる。
関連項目
参考文献
- ↑
Harrison, O.J., Jin, X., Hong, S., Bahna, F., Ahlsen, G., Brasch, J., ..., & Honig, B. (2011).
The extracellular architecture of adherens junctions revealed by crystal structures of type I cadherins. Structure (London, England : 1993), 19(2), 244-56. [PubMed:21300292] [PMC] [WorldCat] [DOI] - ↑
Hirano, S., & Takeichi, M. (2012).
Cadherins in brain morphogenesis and wiring. Physiological reviews, 92(2), 597-634. [PubMed:22535893] [WorldCat] [DOI] - ↑
Meng, W., & Takeichi, M. (2009).
Adherens junction: molecular architecture and regulation. Cold Spring Harbor perspectives in biology, 1(6), a002899. [PubMed:20457565] [PMC] [WorldCat] [DOI] - ↑
Kawauchi, T. (2012).
Cell adhesion and its endocytic regulation in cell migration during neural development and cancer metastasis. International journal of molecular sciences, 13(4), 4564-90. [PubMed:22605996] [PMC] [WorldCat] [DOI] - ↑
Esumi, S., Kakazu, N., Taguchi, Y., Hirayama, T., Sasaki, A., Hirabayashi, T., ..., & Yagi, T. (2005).
Monoallelic yet combinatorial expression of variable exons of the protocadherin-alpha gene cluster in single neurons. Nature genetics, 37(2), 171-6. [PubMed:15640798] [WorldCat] [DOI] - ↑
Biswas, S., Emond, M.R., & Jontes, J.D. (2010).
Protocadherin-19 and N-cadherin interact to control cell movements during anterior neurulation. The Journal of cell biology, 191(5), 1029-41. [PubMed:21115806] [PMC] [WorldCat] [DOI] - ↑
Kadowaki, M., Nakamura, S., Machon, O., Krauss, S., Radice, G.L., & Takeichi, M. (2007).
N-cadherin mediates cortical organization in the mouse brain. Developmental biology, 304(1), 22-33. [PubMed:17222817] [WorldCat] [DOI] - ↑
Zhang, J., Woodhead, G.J., Swaminathan, S.K., Noles, S.R., McQuinn, E.R., Pisarek, A.J., ..., & Chenn, A. (2010).
Cortical neural precursors inhibit their own differentiation via N-cadherin maintenance of beta-catenin signaling. Developmental cell, 18(3), 472-9. [PubMed:20230753] [PMC] [WorldCat] [DOI] - ↑
Kawauchi, T., & Hoshino, M. (2008).
Molecular pathways regulating cytoskeletal organization and morphological changes in migrating neurons. Developmental neuroscience, 30(1-3), 36-46. [PubMed:18075253] [WorldCat] [DOI] - ↑
Kawauchi, T., Sekine, K., Shikanai, M., Chihama, K., Tomita, K., Kubo, K., ..., & Hoshino, M. (2010).
Rab GTPases-dependent endocytic pathways regulate neuronal migration and maturation through N-cadherin trafficking. Neuron, 67(4), 588-602. [PubMed:20797536] [WorldCat] [DOI] - ↑
Franco, S.J., Martinez-Garay, I., Gil-Sanz, C., Harkins-Perry, S.R., & Müller, U. (2011).
Reelin regulates cadherin function via Dab1/Rap1 to control neuronal migration and lamination in the neocortex. Neuron, 69(3), 482-97. [PubMed:21315259] [PMC] [WorldCat] [DOI] - ↑
Jossin, Y., & Cooper, J.A. (2011).
Reelin, Rap1 and N-cadherin orient the migration of multipolar neurons in the developing neocortex. Nature neuroscience, 14(6), 697-703. [PubMed:21516100] [PMC] [WorldCat] [DOI] - ↑
Rieger, S., Senghaas, N., Walch, A., & Köster, R.W. (2009).
Cadherin-2 controls directional chain migration of cerebellar granule neurons. PLoS biology, 7(11), e1000240. [PubMed:19901980] [PMC] [WorldCat] [DOI] - ↑
Taniguchi, H., Kawauchi, D., Nishida, K., & Murakami, F. (2006).
Classic cadherins regulate tangential migration of precerebellar neurons in the caudal hindbrain. Development (Cambridge, England), 133(10), 1923-31. [PubMed:16611692] [WorldCat] [DOI] - ↑
Masai, I., Lele, Z., Yamaguchi, M., Komori, A., Nakata, A., Nishiwaki, Y., ..., & Okamoto, H. (2003).
N-cadherin mediates retinal lamination, maintenance of forebrain compartments and patterning of retinal neurites. Development (Cambridge, England), 130(11), 2479-94. [PubMed:12702661] [WorldCat] [DOI] - ↑
Bard, L., Boscher, C., Lambert, M., Mège, R.M., Choquet, D., & Thoumine, O. (2008).
A molecular clutch between the actin flow and N-cadherin adhesions drives growth cone migration. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(23), 5879-90. [PubMed:18524892] [PMC] [WorldCat] [DOI] - ↑
Andrews, G.L., & Mastick, G.S. (2003).
R-cadherin is a Pax6-regulated, growth-promoting cue for pioneer axons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(30), 9873-80. [PubMed:14586016] [PMC] [WorldCat] - ↑
Uemura, M., Nakao, S., Suzuki, S.T., Takeichi, M., & Hirano, S. (2007).
OL-Protocadherin is essential for growth of striatal axons and thalamocortical projections. Nature neuroscience, 10(9), 1151-9. [PubMed:17721516] [WorldCat] [DOI] - ↑
Osterhout, J.A., Josten, N., Yamada, J., Pan, F., Wu, S.W., Nguyen, P.L., ..., & Huberman, A.D. (2011).
Cadherin-6 mediates axon-target matching in a non-image-forming visual circuit. Neuron, 71(4), 632-9. [PubMed:21867880] [PMC] [WorldCat] [DOI] - ↑
Poskanzer, K., Needleman, L.A., Bozdagi, O., & Huntley, G.W. (2003).
N-cadherin regulates ingrowth and laminar targeting of thalamocortical axons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(6), 2294-305. [PubMed:12657688] [PMC] [WorldCat] - ↑
Lefebvre, J.L., Kostadinov, D., Chen, W.V., Maniatis, T., & Sanes, J.R. (2012).
Protocadherins mediate dendritic self-avoidance in the mammalian nervous system. Nature, 488(7412), 517-21. [PubMed:22842903] [PMC] [WorldCat] [DOI] - ↑
Uchida, N., Honjo, Y., Johnson, K.R., Wheelock, M.J., & Takeichi, M. (1996).
The catenin/cadherin adhesion system is localized in synaptic junctions bordering transmitter release zones. The Journal of cell biology, 135(3), 767-79. [PubMed:8909549] [PMC] [WorldCat] [DOI] - ↑
Togashi, H., Abe, K., Mizoguchi, A., Takaoka, K., Chisaka, O., & Takeichi, M. (2002).
Cadherin regulates dendritic spine morphogenesis. Neuron, 35(1), 77-89. [PubMed:12123610] [WorldCat] [DOI] - ↑
Okamura, K., Tanaka, H., Yagita, Y., Saeki, Y., Taguchi, A., Hiraoka, Y., ..., & Miki, N. (2004).
Cadherin activity is required for activity-induced spine remodeling. The Journal of cell biology, 167(5), 961-72. [PubMed:15569714] [PMC] [WorldCat] [DOI] - ↑
Mizoguchi, A., Nakanishi, H., Kimura, K., Matsubara, K., Ozaki-Kuroda, K., Katata, T., ..., & Takai, Y. (2002).
Nectin: an adhesion molecule involved in formation of synapses. The Journal of cell biology, 156(3), 555-65. [PubMed:11827984] [PMC] [WorldCat] [DOI] - ↑
Honda, T., Sakisaka, T., Yamada, T., Kumazawa, N., Hoshino, T., Kajita, M., ..., & Takai, Y. (2006).
Involvement of nectins in the formation of puncta adherentia junctions and the mossy fiber trajectory in the mouse hippocampus. Molecular and cellular neurosciences, 31(2), 315-25. [PubMed:16300961] [WorldCat] [DOI] - ↑
Bekirov, I.H., Nagy, V., Svoronos, A., Huntley, G.W., & Benson, D.L. (2008).
Cadherin-8 and N-cadherin differentially regulate pre- and postsynaptic development of the hippocampal mossy fiber pathway. Hippocampus, 18(4), 349-63. [PubMed:18064706] [PMC] [WorldCat] [DOI] - ↑
Williams, M.E., Wilke, S.A., Daggett, A., Davis, E., Otto, S., Ravi, D., ..., & Ghosh, A. (2011).
Cadherin-9 regulates synapse-specific differentiation in the developing hippocampus. Neuron, 71(4), 640-55. [PubMed:21867881] [PMC] [WorldCat] [DOI] - ↑
Nuriya, M., & Huganir, R.L. (2006).
Regulation of AMPA receptor trafficking by N-cadherin. Journal of neurochemistry, 97(3), 652-61. [PubMed:16515543] [WorldCat] [DOI] - ↑
Bozdagi, O., Shan, W., Tanaka, H., Benson, D.L., & Huntley, G.W. (2000).
Increasing numbers of synaptic puncta during late-phase LTP: N-cadherin is synthesized, recruited to synaptic sites, and required for potentiation. Neuron, 28(1), 245-59. [PubMed:11086998] [WorldCat] [DOI] - ↑
Schrick, C., Fischer, A., Srivastava, D.P., Tronson, N.C., Penzes, P., & Radulovic, J. (2007).
N-cadherin regulates cytoskeletally associated IQGAP1/ERK signaling and memory formation. Neuron, 55(5), 786-98. [PubMed:17785185] [PMC] [WorldCat] [DOI] - ↑
Manabe, T., Togashi, H., Uchida, N., Suzuki, S.C., Hayakawa, Y., Yamamoto, M., ..., & Chisaka, O. (2000).
Loss of cadherin-11 adhesion receptor enhances plastic changes in hippocampal synapses and modifies behavioral responses. Molecular and cellular neurosciences, 15(6), 534-46. [PubMed:10860580] [WorldCat] [DOI]