「初代培養」の版間の差分
細編集の要約なし |
Hitoshigoto (トーク | 投稿記録) 細編集の要約なし |
||
| (2人の利用者による、間の3版が非表示) | |||
| 1行目: | 1行目: | ||
英:primary culture | 英:primary culture | ||
生物の最も基本的な構成単位である細胞は、様々な方法によって生体外で[[wikipedia:JA:培養|培養]]することが可能である。なかでも、動物・植物の[[wikipedia:JA:組織 (生物学)|組織]]を直接用いた細胞培養のことを“初代培養”という。初代培養細胞は生体内に近い状態を維持していると考えられるため、様々な研究に用いることができる。 神経組織を構成する細胞に関しては、ニューロン(神経細胞)、グリア細胞(神経膠細胞)である[[アストロサイト]]、[[オリゴデンドロサイト]]、[[シュワン細胞]]、[[ミクログリア]]など、神経系細胞のほとんどが初代培養可能である<ref>'''Doering, LC.'''<br>Protocols for Neural Cell Culture: Fourth Edition.<br>''Springer Protocols Handbooks'':2004</ref>。一般的に、継代を経ない培養のことを初代培養と呼ぶことが多いが、[[グリア]]細胞の培養系は継代を経る場合もあり、広義な初代培養に含められる。[[グリア]]細胞の場合でも、何世代も継代が可能な株化培養細胞とは異なって継代回数が限られている場合が多い。<br> | 生物の最も基本的な構成単位である細胞は、様々な方法によって生体外で[[wikipedia:JA:培養|培養]]することが可能である。なかでも、動物・植物の[[wikipedia:JA:組織 (生物学)|組織]]を直接用いた細胞培養のことを“初代培養”という。初代培養細胞は生体内に近い状態を維持していると考えられるため、様々な研究に用いることができる。 神経組織を構成する細胞に関しては、ニューロン(神経細胞)、グリア細胞(神経膠細胞)である[[アストロサイト]]、[[オリゴデンドロサイト]]、[[シュワン細胞]]、[[ミクログリア]]など、神経系細胞のほとんどが初代培養可能である<ref>'''Doering, LC.'''<br>Protocols for Neural Cell Culture: Fourth Edition.<br>''Springer Protocols Handbooks'':2004</ref>。一般的に、継代を経ない培養のことを初代培養と呼ぶことが多いが、[[グリア]]細胞の培養系は継代を経る場合もあり、広義な初代培養に含められる。[[グリア]]細胞の場合でも、何世代も継代が可能な株化培養細胞とは異なって継代回数が限られている場合が多い。<br> | ||
<br> | |||
== ニューロンの初代培養の歴史 == | == ニューロンの初代培養の歴史 == | ||
19世紀中頃に、[[wikipedia:Wilhelm His, Sr.|Wilhelm His]]はニューロンの軸索がどのように形成されるのかについて、[[軸索]]は発生期に[[細胞体]]からの突起として出現するという仮説を提唱した。これは、分裂した細胞が鎖状につながることによって軸索を形成するという説とともに論議をよんだ。Hisの仮説は、後年の[[wikipedia:JA:サンティアゴ・ラモン・イ・カハール|Cajal]]らの組織学的解析によって支持されていたが、より直接的に証明する必要があった。そのため、アメリカのHarrisonらはニューロンの突起伸長を’生きたまま’観察するための方法を考案した。それは、カエル胚から採取した[[神経管]]をカエルの[[wikipedia:JA:リンパ液|リンパ液]]中で培養する方法である。この方法によりニューロンの突起伸長を経時的に観察することが可能となり、軸索は細胞体からの突起が伸長することによって形成されることを直接的に証明した<ref><pubmed> 13711840 </pubmed></ref>。このことが、いわゆる組織培養(広義の初代培養)の始めであるとされている。後年、[[wikipedia:JA:レナート・ドゥルベッコ|ダルベッコ]]らによって開発された[[wikipedia:JA:トリプシン|トリプシン]]を用いて組織を解離し、単一細胞として培養する方法、また、[[wikipedia:JA:培地|培地]]や添加剤の改良などを経て、現在の神経系初代培養技術が確立した。<br> | |||
<br> | |||
== ニューロンの初代培養 == | == ニューロンの初代培養 == | ||
| 20行目: | 15行目: | ||
[[Image:Hippocampal primary neuron.jpg|frame|right|280x205px|'''図1 海馬培養ニューロン'''<br>培養開始3日後。スケールバー、50 µm]] | [[Image:Hippocampal primary neuron.jpg|frame|right|280x205px|'''図1 海馬培養ニューロン'''<br>培養開始3日後。スケールバー、50 µm]] | ||
[[脊髄]][[後根神経節]]や、[[皮質]]および[[海馬]]由来のニューロンの培養が一般的に用いられている。[[wikipedia:JA:マウス|マウス]]、[[wikipedia:JA:ラット|ラット]]のみならず[[wikipedia:JA:ニワトリ|ニワトリ]]、[[wikipedia:JA:カエル|カエル]]など多様な生物のニューロンの初代培養系が確立されている。主に胎生期の動物の[[脳]]や脊髄を摘出し、顕微鏡下でおおまかに目的の部位を切り出す。これを細胞解離酵素(トリプシンなど)で処理し、細胞を解離する。この細胞をあらかじめ[[wikipedia:JA:ラミニン|ラミニン]]や[[wikipedia:Polylysine|ポリ-L-リシン]]などでコートした培養皿に播く。培養後一日程で、神経突起の伸長が観察される(図1)。また、およそ7日後には[[シナプス]]の形成が認められ、軸索伸長のメカニズムや[[樹状突起]]の形成、さらには電気生理学的な性質を解析することが可能である。海馬由来のニューロンの場合5ヶ月程度培養したという報告があるが<ref | [[脊髄]][[後根神経節]]や、[[皮質]]および[[海馬]]由来のニューロンの培養が一般的に用いられている。[[wikipedia:JA:マウス|マウス]]、[[wikipedia:JA:ラット|ラット]]のみならず[[wikipedia:JA:ニワトリ|ニワトリ]]、[[wikipedia:JA:カエル|カエル]]など多様な生物のニューロンの初代培養系が確立されている。主に胎生期の動物の[[脳]]や脊髄を摘出し、顕微鏡下でおおまかに目的の部位を切り出す。これを細胞解離酵素(トリプシンなど)で処理し、細胞を解離する。この細胞をあらかじめ[[wikipedia:JA:ラミニン|ラミニン]]や[[wikipedia:Polylysine|ポリ-L-リシン]]などでコートした培養皿に播く。培養後一日程で、神経突起の伸長が観察される(図1)。また、およそ7日後には[[シナプス]]の形成が認められ、軸索伸長のメカニズムや[[樹状突起]]の形成、さらには電気生理学的な性質を解析することが可能である。海馬由来のニューロンの場合5ヶ月程度培養したという報告があるが<ref><pubmed> 8475109 </pubmed></ref>、[[運動ニューロン]]などは長期間の培養が困難である。 | ||
== グリア細胞の初代培養 == | == グリア細胞の初代培養 == | ||
グリア系細胞の初代培養は、ニューロンの培養より後期の脳組織を材料として用いる事が多い([[wikipedia:JA:齧歯類|齧歯類]]では生後0-3日目程度)。神経組織を細胞解離酵素で処理し、[[wikipedia:JA:血清|血清]]存在下の培地で培養すると、様々なグリア細胞が増殖する。このグリア系細胞を、培養基質に対する接着性などの違いを利用して分離することによって、それぞれアストロサイト、オリゴデンドロサイト、ミクログリアの初代培養が可能である。また、細胞表面抗原に対する[[wikipedia:JA:モノクローナル抗体|モノクローナル抗体]]([[グリア系前駆細胞]]のマーカーであるA2B5抗体、オリゴデンドロサイト前駆細胞のマーカーであるO4抗体など)によって、解離した細胞をペトリディッシュ上に吸着することにより、特定の細胞種を分離するimmunopanning法もしばしば用いられる<ref | グリア系細胞の初代培養は、ニューロンの培養より後期の脳組織を材料として用いる事が多い([[wikipedia:JA:齧歯類|齧歯類]]では生後0-3日目程度)。神経組織を細胞解離酵素で処理し、[[wikipedia:JA:血清|血清]]存在下の培地で培養すると、様々なグリア細胞が増殖する。このグリア系細胞を、培養基質に対する接着性などの違いを利用して分離することによって、それぞれアストロサイト、オリゴデンドロサイト、ミクログリアの初代培養が可能である。また、細胞表面抗原に対する[[wikipedia:JA:モノクローナル抗体|モノクローナル抗体]]([[グリア系前駆細胞]]のマーカーであるA2B5抗体、オリゴデンドロサイト前駆細胞のマーカーであるO4抗体など)によって、解離した細胞をペトリディッシュ上に吸着することにより、特定の細胞種を分離するimmunopanning法もしばしば用いられる<ref><pubmed> 8475109 </pubmed></ref>。[[末梢神経]]系に存在するシュワン細胞は、主にマウスやラットの[[坐骨神経]]から単離する。 | ||
=== アストロサイトの初代培養 === | === アストロサイトの初代培養 === | ||
フラスコ内でグリア混合培養を増殖させて[[wikipedia:JA:コンフルエント|コンフルエント]]にする。そのフラスコを激しく振とうすることによって、接着性の弱いミクログリアやオリゴデンドロサイト前駆細胞を除く。その後、残存した細胞をトリプシンなどで処理し、新たなプレートに播種する。全細胞におけるアストロサイトの純度は、アストロサイトマーカーである[[グリア線維性酸性タンパク質]](GFAP)に対する抗体を用いた免疫染色で確認することができる。<br>上記の培養法と異なり、より生体内条件に近いとされるアストロサイトの培養方法が近年報告されている<ref><pubmed> 21903074 </pubmed></ref>。これは、前述のimmunopanning法によってアストロサイトを吸着し、培養する方法である。 | フラスコ内でグリア混合培養を増殖させて[[wikipedia:JA:コンフルエント|コンフルエント]]にする。そのフラスコを激しく振とうすることによって、接着性の弱いミクログリアやオリゴデンドロサイト前駆細胞を除く。その後、残存した細胞をトリプシンなどで処理し、新たなプレートに播種する。全細胞におけるアストロサイトの純度は、アストロサイトマーカーである[[グリア線維性酸性タンパク質]](GFAP)に対する抗体を用いた免疫染色で確認することができる。<br>上記の培養法と異なり、より生体内条件に近いとされるアストロサイトの培養方法が近年報告されている<ref><pubmed> 21903074 </pubmed></ref>。これは、前述のimmunopanning法によってアストロサイトを吸着し、培養する方法である。<br> | ||
=== オリゴデンドロサイトの初代培養 === | === オリゴデンドロサイトの初代培養 === | ||
| 38行目: | 33行目: | ||
前項のペトリディッシュ上に付着した細胞を回収することによって純度の高いミクログリアの培養系が得られる。培地に[[wikipedia:JA:リポ多糖|リポ多糖]](LPS)などを添加すると、ミクログリアの活性化が誘導され、様々な[[wikipedia:JA:サイトカイン|サイトカイン]]の放出が誘発される。そのため、いわゆる炎症性(反応性)ミクログリアのモデルとして用いられる。 | 前項のペトリディッシュ上に付着した細胞を回収することによって純度の高いミクログリアの培養系が得られる。培地に[[wikipedia:JA:リポ多糖|リポ多糖]](LPS)などを添加すると、ミクログリアの活性化が誘導され、様々な[[wikipedia:JA:サイトカイン|サイトカイン]]の放出が誘発される。そのため、いわゆる炎症性(反応性)ミクログリアのモデルとして用いられる。 | ||
== | == 参考文献 == | ||
<references /> | |||
< | <br> (執筆者:後藤仁志、小野勝彦、野村真 担当編集委員:大隅典子) | ||
2013年3月25日 (月) 14:32時点における版
英:primary culture
生物の最も基本的な構成単位である細胞は、様々な方法によって生体外で培養することが可能である。なかでも、動物・植物の組織を直接用いた細胞培養のことを“初代培養”という。初代培養細胞は生体内に近い状態を維持していると考えられるため、様々な研究に用いることができる。 神経組織を構成する細胞に関しては、ニューロン(神経細胞)、グリア細胞(神経膠細胞)であるアストロサイト、オリゴデンドロサイト、シュワン細胞、ミクログリアなど、神経系細胞のほとんどが初代培養可能である[1]。一般的に、継代を経ない培養のことを初代培養と呼ぶことが多いが、グリア細胞の培養系は継代を経る場合もあり、広義な初代培養に含められる。グリア細胞の場合でも、何世代も継代が可能な株化培養細胞とは異なって継代回数が限られている場合が多い。
ニューロンの初代培養の歴史
19世紀中頃に、Wilhelm Hisはニューロンの軸索がどのように形成されるのかについて、軸索は発生期に細胞体からの突起として出現するという仮説を提唱した。これは、分裂した細胞が鎖状につながることによって軸索を形成するという説とともに論議をよんだ。Hisの仮説は、後年のCajalらの組織学的解析によって支持されていたが、より直接的に証明する必要があった。そのため、アメリカのHarrisonらはニューロンの突起伸長を’生きたまま’観察するための方法を考案した。それは、カエル胚から採取した神経管をカエルのリンパ液中で培養する方法である。この方法によりニューロンの突起伸長を経時的に観察することが可能となり、軸索は細胞体からの突起が伸長することによって形成されることを直接的に証明した[2]。このことが、いわゆる組織培養(広義の初代培養)の始めであるとされている。後年、ダルベッコらによって開発されたトリプシンを用いて組織を解離し、単一細胞として培養する方法、また、培地や添加剤の改良などを経て、現在の神経系初代培養技術が確立した。
ニューロンの初代培養
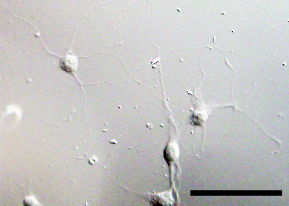
培養開始3日後。スケールバー、50 µm
脊髄後根神経節や、皮質および海馬由来のニューロンの培養が一般的に用いられている。マウス、ラットのみならずニワトリ、カエルなど多様な生物のニューロンの初代培養系が確立されている。主に胎生期の動物の脳や脊髄を摘出し、顕微鏡下でおおまかに目的の部位を切り出す。これを細胞解離酵素(トリプシンなど)で処理し、細胞を解離する。この細胞をあらかじめラミニンやポリ-L-リシンなどでコートした培養皿に播く。培養後一日程で、神経突起の伸長が観察される(図1)。また、およそ7日後にはシナプスの形成が認められ、軸索伸長のメカニズムや樹状突起の形成、さらには電気生理学的な性質を解析することが可能である。海馬由来のニューロンの場合5ヶ月程度培養したという報告があるが[3]、運動ニューロンなどは長期間の培養が困難である。
グリア細胞の初代培養
グリア系細胞の初代培養は、ニューロンの培養より後期の脳組織を材料として用いる事が多い(齧歯類では生後0-3日目程度)。神経組織を細胞解離酵素で処理し、血清存在下の培地で培養すると、様々なグリア細胞が増殖する。このグリア系細胞を、培養基質に対する接着性などの違いを利用して分離することによって、それぞれアストロサイト、オリゴデンドロサイト、ミクログリアの初代培養が可能である。また、細胞表面抗原に対するモノクローナル抗体(グリア系前駆細胞のマーカーであるA2B5抗体、オリゴデンドロサイト前駆細胞のマーカーであるO4抗体など)によって、解離した細胞をペトリディッシュ上に吸着することにより、特定の細胞種を分離するimmunopanning法もしばしば用いられる[4]。末梢神経系に存在するシュワン細胞は、主にマウスやラットの坐骨神経から単離する。
アストロサイトの初代培養
フラスコ内でグリア混合培養を増殖させてコンフルエントにする。そのフラスコを激しく振とうすることによって、接着性の弱いミクログリアやオリゴデンドロサイト前駆細胞を除く。その後、残存した細胞をトリプシンなどで処理し、新たなプレートに播種する。全細胞におけるアストロサイトの純度は、アストロサイトマーカーであるグリア線維性酸性タンパク質(GFAP)に対する抗体を用いた免疫染色で確認することができる。
上記の培養法と異なり、より生体内条件に近いとされるアストロサイトの培養方法が近年報告されている[5]。これは、前述のimmunopanning法によってアストロサイトを吸着し、培養する方法である。
オリゴデンドロサイトの初代培養
フラスコ内で培養したグリア混合培養をコンフルエントとなるまで培養し、振とうすることによってアストロサイト以外の細胞を培養上清中に回収する。その後、コートしていないペトリディッシュ上に上清を入れて静置する。この過程で接着能力の高いミクログリアはペトリ皿上に接着し、オリゴデンドロサイト前駆細胞は付着せず上清中に浮遊したままとなる[6]。そこで、上清を単離し、無血清培地にPDGFやbFGFを添加した培地で培養することによって、オリゴデンドロサイト前駆細胞を増殖させることができる。培地を分化培地(血小板由来成長因子(PDGF), 塩基性線維芽細胞成長因子(bFGF))を含まない、トリヨードサイロニンを含む培地)で培養することによって、ミエリンの形成が誘導される。尚、ラット脳を材料とした場合であれば上記の方法で培養が可能であるが、マウス脳では困難である。そのため、マウス脳を材料とする場合には、一旦神経幹細胞からニューロスフェアを形成させ、そこからオリゴデンドロサイトを分化誘導する方法が一般的である[7]。
ミクログリアの初代培養
前項のペトリディッシュ上に付着した細胞を回収することによって純度の高いミクログリアの培養系が得られる。培地にリポ多糖(LPS)などを添加すると、ミクログリアの活性化が誘導され、様々なサイトカインの放出が誘発される。そのため、いわゆる炎症性(反応性)ミクログリアのモデルとして用いられる。
参考文献
- ↑ Doering, LC.
Protocols for Neural Cell Culture: Fourth Edition.
Springer Protocols Handbooks:2004 - ↑
HARRISON, R.G. (1959).
The outgrowth of the nerve fiber as a mode of protoplasmic movement. The Journal of experimental zoology, 142, 5-73. [PubMed:13711840] [WorldCat] [DOI] - ↑
Ray, J., Peterson, D.A., Schinstine, M., & Gage, F.H. (1993).
Proliferation, differentiation, and long-term culture of primary hippocampal neurons. Proceedings of the National Academy of Sciences of the United States of America, 90(8), 3602-6. [PubMed:8475109] [PMC] [WorldCat] [DOI] - ↑
Ray, J., Peterson, D.A., Schinstine, M., & Gage, F.H. (1993).
Proliferation, differentiation, and long-term culture of primary hippocampal neurons. Proceedings of the National Academy of Sciences of the United States of America, 90(8), 3602-6. [PubMed:8475109] [PMC] [WorldCat] [DOI] - ↑
Foo, L.C., Allen, N.J., Bushong, E.A., Ventura, P.B., Chung, W.S., Zhou, L., ..., & Barres, B.A. (2011).
Development of a method for the purification and culture of rodent astrocytes. Neuron, 71(5), 799-811. [PubMed:21903074] [PMC] [WorldCat] [DOI] - ↑
Chen, Y., Balasubramaniyan, V., Peng, J., Hurlock, E.C., Tallquist, M., Li, J., & Lu, Q.R. (2007).
Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nature protocols, 2(5), 1044-51. [PubMed:17546009] [WorldCat] [DOI] - ↑
Chen, Y., Balasubramaniyan, V., Peng, J., Hurlock, E.C., Tallquist, M., Li, J., & Lu, Q.R. (2007).
Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nature protocols, 2(5), 1044-51. [PubMed:17546009] [WorldCat] [DOI]
(執筆者:後藤仁志、小野勝彦、野村真 担当編集委員:大隅典子)