「抑制性神経細胞」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 1行目: | 1行目: | ||
中枢神経系には興奮性神経細胞の他に多数の抑制性神経細胞が存在する。大脳皮質では約20%の神経細胞がGABAを伝達物質としてもつGABA作動性抑制性神経細胞である。大脳皮質の抑制性神経細胞の大多数は、局所回路において作用することから介在神経細胞(interneuron)とも呼ばれ、興奮性神経細胞からの出力を調整し、出力の同期性を制御したり、過剰興奮を防ぐなど重要な機能をもつ。大脳皮質における抑制性神経細胞は樹状突起上に棘突起が乏しい(aspiny)といった共通の特徴を有するものの、形態・機能・マーカータンパク質の発現などの点からは非常な多様性をもつ。例えば大脳皮質には、形態的には大型バスケット細胞、小型バスケット細胞、ネストバスケット細胞、シャンデリア細胞、紡錘細胞、ダブルブーケ細胞、マルチノッチ細胞などが存在する。シナプスを形成する部位からは、興奮性神経細胞上の樹状突起、細胞体、軸索部分にそれぞれ特化した抑制性神経細胞が存在し、その機能と密接に関連する。軸索に形成された抑制性シナプスは、興奮性神経細胞からの出力を強力に抑制し、シナプス前抑制と呼ばれる。遠位樹状突起に形成された抑制性シナプスは、近傍の樹状突起への興奮性入力を局所的に微調節する。抑制性神経細胞が発現するマーカータンパク質からはParvalbumin、Somatostatin、Calretinin、さらにCalretinin陽性細胞の中にはNeuropeptide YやVasoactive Intestinal Polypeptideなどを発現する抑制性神経細胞に分類される。 | |||
抑制性神経細胞から放出されたGABAやグリシンは、シナプス後膜において[[GABA<sub>A</sub>]]及び/もしくは[[グリシン]]受容体の活性化を介してClイオン透過性を上昇させる。Cl平衡電位が静止膜電位より深い場合には過分極応答を引き起こす。Cl平衡電位が静止膜電位と近い場合においても、Clイオン透過性の亢進によって膜抵抗が小さくなることによるシャント抑制によって、膜電位の伝播を抑制する。 | 抑制性神経細胞から放出されたGABAやグリシンは、シナプス後膜において[[GABA<sub>A</sub>]]及び/もしくは[[グリシン]]受容体の活性化を介してClイオン透過性を上昇させる。Cl平衡電位が静止膜電位より深い場合には過分極応答を引き起こす。Cl平衡電位が静止膜電位と近い場合においても、Clイオン透過性の亢進によって膜抵抗が小さくなることによるシャント抑制によって、膜電位の伝播を抑制する。 | ||
2013年4月2日 (火) 16:23時点における版
中枢神経系には興奮性神経細胞の他に多数の抑制性神経細胞が存在する。大脳皮質では約20%の神経細胞がGABAを伝達物質としてもつGABA作動性抑制性神経細胞である。大脳皮質の抑制性神経細胞の大多数は、局所回路において作用することから介在神経細胞(interneuron)とも呼ばれ、興奮性神経細胞からの出力を調整し、出力の同期性を制御したり、過剰興奮を防ぐなど重要な機能をもつ。大脳皮質における抑制性神経細胞は樹状突起上に棘突起が乏しい(aspiny)といった共通の特徴を有するものの、形態・機能・マーカータンパク質の発現などの点からは非常な多様性をもつ。例えば大脳皮質には、形態的には大型バスケット細胞、小型バスケット細胞、ネストバスケット細胞、シャンデリア細胞、紡錘細胞、ダブルブーケ細胞、マルチノッチ細胞などが存在する。シナプスを形成する部位からは、興奮性神経細胞上の樹状突起、細胞体、軸索部分にそれぞれ特化した抑制性神経細胞が存在し、その機能と密接に関連する。軸索に形成された抑制性シナプスは、興奮性神経細胞からの出力を強力に抑制し、シナプス前抑制と呼ばれる。遠位樹状突起に形成された抑制性シナプスは、近傍の樹状突起への興奮性入力を局所的に微調節する。抑制性神経細胞が発現するマーカータンパク質からはParvalbumin、Somatostatin、Calretinin、さらにCalretinin陽性細胞の中にはNeuropeptide YやVasoactive Intestinal Polypeptideなどを発現する抑制性神経細胞に分類される。 抑制性神経細胞から放出されたGABAやグリシンは、シナプス後膜において[[GABAA]]及び/もしくはグリシン受容体の活性化を介してClイオン透過性を上昇させる。Cl平衡電位が静止膜電位より深い場合には過分極応答を引き起こす。Cl平衡電位が静止膜電位と近い場合においても、Clイオン透過性の亢進によって膜抵抗が小さくなることによるシャント抑制によって、膜電位の伝播を抑制する。
GABA及びグリシン作動性神経細胞
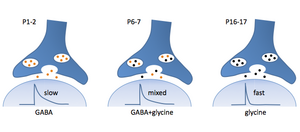
内側台形体核の抑制性神経細胞は外側上オリーブ核に投射するが、軸索終末部では抑制性神経伝達物質のスイッチングが生じる。すなわちP1-2ではGABAのみが放出されるが(左)、未熟期(P6-7)の共放出の時期(中)を経て、グリシンのみの放出を行うようになる(右)。
抑制性神経伝達物質にはGABA及びグリシンが有るが、中枢神経系においてはGABA作動性神経細胞が広範囲に存在しており、グリシン作動性神経細胞は主に脳幹部及び脊髄に存在している。またGABA及びグリシン共放出の形態も存在することが知られている[1])。また、聴覚中継路核の外側上オリーブ核(lateral superior olivary nucleus, LSO)における内側台形体核(medial nucleus of the trapezoid body, NMTB)からの抑制性入力において、単一神経終末部から放出される伝達物質が未熟期にはGABA優位であったものが、GABA及びグリシン同時放出の時期を経て、成熟期のグリシン優位の状態へと徐々に発達変化していくことも報告された[2]。このように共放出を含めた3つの抑制性伝達物質放出様式を持つ(図1)。
大脳皮質の抑制性神経細胞の産生および移動メカニズム
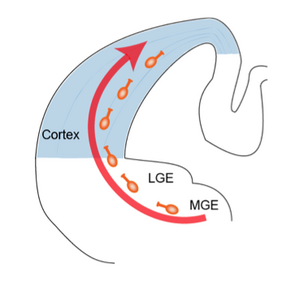
げっ歯類の大脳皮質抑制性神経細胞は終脳腹側の基底核原基(ganglionic eminence)で産生され、脳表に対して接線方向に移動し皮質に至る。
LGE: lateral ganglionic eminence, MGE: medial ganglionic eminence
げっ歯類の大脳皮質抑制性神経細胞はほぼ全てが終脳腹側の基底核原基で産生される[3]。基底核原基は大きく分けて内側部・尾側部・外側部から構成され、内側部では主にパルブアルブミン(parvalbumin, PV)陽性細胞とソマトスタチン(somatostatin, SOM)陽性細胞が、尾側部では主にカルレチニン(calretinin, CR)陽性細胞が産生され、それぞれ大脳皮質に移動する。外側部では主に嗅球の抑制性神経細胞が産生されることが判っているが、大脳皮質抑制性神経細胞の産生に対してどの程度貢献しているかは現在のところ不明である。内側部と尾側部で産生された抑制性神経細胞は脳表面に対して接線方向に移動して大脳皮質に進入した後に移動方向を変え皮質の各層に配置される(図2)。
一方、ヒトを含めた霊長類では大脳皮質の抑制性神経細胞のうち基底核原基で産生される割合は35%程度であり、残りの65%は終脳背側の脳室帯と脳室下帯で産生されることが判っている[4]。さらに前者は胎生初期に産生され一酸化窒素合成酵素(nitric oxide synthase, NOS)陽性、ニューロペプチドY(neuropeptide Y, NPY)陽性、SOM陽性細胞へ分化するのに対し、後者は胎生後期に産生されCR陽性細胞へ分化することが判っている。また、基底核原基で産生された細胞はげっ歯類と同様に脳表面に対して接線方向に移動し大脳皮質に進入するのに対し、脳室帯と脳室下帯で産生された細胞は脳表に向かって放射状に移動し、“inside-out”様式の配置を取ることが示唆されている。
GABA性入力による細胞膜電位の脱分極作用
幼若期、あるいは成熟後においても神経損傷等の病態時には、細胞内Clイオン濃度が比較的高い事が知られている。このため、Clイオンの平衡電位は静止膜電位よりも浅い状態にある。このような状態ではGABAA受容体の活性化により、Clイオンは細胞内から外へ流出する形となり、過分極応答ではなく、脱分極応答を示す事が知られている[5]。
関連項目
参考文献
- ↑
Keller, A.F., Coull, J.A., Chery, N., Poisbeau, P., & De Koninck, Y. (2001).
Region-specific developmental specialization of GABA-glycine cosynapses in laminas I-II of the rat spinal dorsal horn. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(20), 7871-80. [PubMed:11588160] [PMC] [WorldCat] - ↑
Nabekura, J., Katsurabayashi, S., Kakazu, Y., Shibata, S., Matsubara, A., Jinno, S., ..., & Ishibashi, H. (2004).
Developmental switch from GABA to glycine release in single central synaptic terminals. Nature neuroscience, 7(1), 17-23. [PubMed:14699415] [WorldCat] [DOI] - ↑
Wonders, C.P., & Anderson, S.A. (2006).
The origin and specification of cortical interneurons. Nature reviews. Neuroscience, 7(9), 687-96. [PubMed:16883309] [WorldCat] [DOI] - ↑
Petanjek, Z., Kostović, I., & Esclapez, M. (2009).
Primate-specific origins and migration of cortical GABAergic neurons. Frontiers in neuroanatomy, 3, 26. [PubMed:20011218] [PMC] [WorldCat] [DOI] - ↑
Kakazu, Y., Akaike, N., Komiyama, S., & Nabekura, J. (1999).
Regulation of intracellular chloride by cotransporters in developing lateral superior olive neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(8), 2843-51. [PubMed:10191302] [PMC] [WorldCat]
(執筆者:加藤剛、鍋島淳一 担当編集委員:柚崎通介)