(2人の利用者による、間の34版が非表示) 1行目:
1行目: <div align="right">
<div align="right">
<font size="+1">[http://researchmap.jp/read0180808 澁木 克栄]</font><br>
<font size="+1">[http://researchmap.jp/read0180808 澁木克栄 ]</font><br>
''新潟大学脳研究所''<br>
''新潟大学脳研究所''<br>
<font size="+1">中矢 直樹</font><br>
DOI [[XXXX]] /XXXX 原稿受付日:2013年12月2日 原稿完成日:2013年月日 <br>
''米国国立衛生研究所・眼研究所''<br>
DOI: <selfdoi /> 原稿受付日:2013年12月2日 原稿完成日:2014年11月2日<br>
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br>
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br>
</div>
</div>
英語名:nitric oxide 独:Stickstoffmonoxid 仏:monoxyde d'azote 略称:NO<br>
同義語:血管内皮細胞由来弛緩因子、EDRF、Nitric oxide
同義語:血管内皮細胞由来弛緩因子、EDRF
{{box|text= 一酸化窒素は分子量30の不安定な物質である。生体内ではシグナル伝達分子として働く。アルギニンから一酸化窒素合成酵素により合成され、グアニル酸シクラーゼを活性化することでcGMP産生を向上させる、タンパク質をニトロシル化、ニトロ化する、あるいは活性化酸素として機能するなど、幾つかの作用機序が知られている。生体における機能としては、シナプス可塑性の調節因子、脳血流量の調節因子、神経細胞死への関与などが挙げられる。NOが関与するシナプス可塑性としては[[小脳]]の[[長期抑圧]]、[[海馬]]の[[長期増強]]、[[大脳皮質]]の長期増強などがある。いずれの場合も、特定の膜に閉ざされたコンパートメントから、別の膜に閉ざされたコンパートメントに、NOのガス拡散特性によって情報を伝達しているという点に特徴がある。NOの放出部位はシナプス前部、後部、[[抑制性介在神経]]と多彩であり、NOはシナプスの可塑性に必須な因子というより、状況に応じて誘発を促進する調節因子であるという点が共通している。}}
{{box|text=
一酸化窒素(NO)は分子量30の無色透明なガスで、酸素に触れると直ちに酸化されて二酸化窒素となる。このような不安定な無機ガスは、近年まで生体とは全く無縁であると考えられていたが、血管内皮細胞由来の血管平滑筋弛緩因子(EDRF)として循環制御に重要な役割を果たすことが発見された。NOの物質としての特徴はガス状物質であり、細胞膜を透過して拡散しやすいこと、及び生体内で速やかに酸化され、半減期が1秒程度と短いことである。これらのユニークなNOの特性による情報伝達の発見は1998年のノーベル医学・生理学賞の受賞対象となった。
{{Chembox
| Verifiedfields = changed
| Watchedfields = changed
| verifiedrevid = 477001381
| ImageFile = Nitric-oxide-2D.png
| ImageFile_Ref = {{chemboximage|correct|??}}
| ImageSize = 121
| ImageName = Skeletal formula of nitric oxide with bond length
| ImageFileL1 = Nitric oxide.svg
| ImageNameL1 = Skeletal formula showing three lone pairs and one unpaired electron
| ImageFileR1 = Nitric-oxide-3D-vdW.png
| ImageFileR1_Ref = {{chemboximage|correct|??}}
| ImageNameR1 = Space-filling model of nitric oxide
| IUPACName = Nitric oxide
| SystematicName = Oxidonitrogen(•)<ref>{{cite web|title = Nitric Oxide (CHEBI:16480)|url = https://www.ebi.ac.uk/chebi/searchId.do?chebiId=16480|work = Chemical Entities of Biological Interest (ChEBI)|location = UK|publisher = European Bioinformatics Institute}}</ref> (additive)
| OtherNames = Nitrogen monoxide<br />
Nitrogen(II) oxide
|Section1={{Chembox Identifiers
| IUPHAR_ligand = 2509
| CASNo = 10102-43-9
| ChEMBL_Ref = {{ebicite|changed|EBI}}
| ChEMBL = 1200689
| CASNo_Ref = {{cascite|correct|CAS}}
| PubChem = 145068
| ChemSpiderID = 127983
| ChemSpiderID_Ref = {{chemspidercite|correct|chemspider}}
| UNII = 31C4KY9ESH
| UNII_Ref = {{fdacite|correct|FDA}}
| EINECS = 233-271-0
| UNNumber = 1660
| DrugBank_Ref = {{drugbankcite|correct|drugbank}}
| DrugBank = DB00435
| KEGG = D00074
| KEGG_Ref = {{keggcite|correct|kegg}}
| ChEBI_Ref = {{ebicite|correct|EBI}}
| ChEBI = 16480
| RTECS = QX0525000
| Gmelin = 451
| 3DMet = B00122
| SMILES = [N]=O
| StdInChI = 1S/NO/c1-2
| StdInChI_Ref = {{stdinchicite|correct|chemspider}}
| InChI = 1/NO/c1-2
| StdInChIKey = MWUXSHHQAYIFBG-UHFFFAOYSA-N
| StdInChIKey_Ref = {{stdinchicite|correct|chemspider}}
| InChIKey = MWUXSHHQAYIFBG-UHFFFAOYAI
}}
|Section2={{Chembox Properties
| N=1 | O=1
| Appearance = Colourless gas
| Density = 1.3402 g dm<sup>−3</sup>
| MeltingPtC = −164
| BoilingPtC = −152
| Solubility = 0.0098 g/100ml (0 °C) <br /> 0.0056 g/100ml (20 °C)
| RefractIndex = 1.0002697
}}
|Section3={{Chembox Structure
| MolShape = linear ([[point group]] C<sub>∞''v''</sub>)
}}
|Section5={{Chembox Thermochemistry
| DeltaHf = 91.29 kJ mol<sup>−1</sup>
| Entropy = 210.76 J K<sup>−1</sup> mol<sup>−1</sup>
}}
|Section6={{Chembox Pharmacology
| ATCCode_prefix = R07
| ATCCode_suffix = AX01
| AdminRoutes = [[Inhalation]]
| Bioavail = good
| Metabolism = via pulmonary capillary bed
| HalfLife = 2–6 seconds
}}
|Section7={{Chembox Hazards
| ExternalSDS = [http://avogadro.chem.iastate.edu/MSDS/nitric_oxide.pdf External MSDS]
| EUClass = {{Hazchem O}} {{Hazchem T}}
| RPhrases = {{R8}}, {{R23}}, {{R34}}, {{R44}}
| SPhrases = {{S1}}, {{S17}}, {{S23}}, {{S36/37/39}}, {{S45}}
| NFPA-H = 3
| NFPA-F = 0
| NFPA-R = 3
| NFPA-S = OX
| LC50 = 315 ppm (rabbit, 15 min)<br/>854 ppm (rat, 4 hr)<br/>320 ppm (mouse)<ref name=IDLH>{{IDLH|10102439|Nitric oxide}}</ref>
| LCLo = 2500 ppm (mouse, 12 min)<ref name=IDLH/>
}}
|Section8={{Chembox Related
| OtherFunction_label = [[nitrogen]] [[oxide]]s
| OtherFunction = [[Dinitrogen pentoxide]]<br />
[[Dinitrogen tetroxide]]<br />
[[Dinitrogen trioxide]]<br />
[[Nitrogen dioxide]]<br />
[[Nitrous oxide]]<br/>
[[Azanone|Nitroxyl]] (reduced form)<br/>
[[Hydroxylamine]] (hydrogenated form)
}}
}}
}}
==一酸化窒素とは==
== NOの生体内シグナル伝達経路 ==
一酸化窒素(NO)は分子量30の無色透明なガスで、[[wj:酸素|酸素]]に触れると直ちに[[wj:酸化|酸化]]されて[[wj:酸素|酸素]]二酸化窒素となる。このような不安定な無機ガスは、近年まで生体とは全く無縁であると考えられていたが、[[wj:血管内皮細胞|血管内皮細胞]]由来の血管平滑筋弛緩因子(EDRF)として[[wj:循環系|循環]]制御に重要な役割を果たすことが発見された。NOの物質としての特徴はガス状物質であり、細胞膜を透過して拡散しやすいこと、及び生体内で速やかに酸化され、[[wj:半減期|半減期]]が1秒程度と短いことである。これらのユニークなNOの特性による情報伝達の発見は1998年の[[wj:ノーベル医学・生理学賞|ノーベル医学・生理学賞]]の受賞対象となった。
NOは生体内では[[アルギニン]]から合成される。血管内皮型(eNOS)、神経型(nNOS)及び誘導型(iNOS)の3タイプの合成酵素がある <ref name=ref1><pubmed>18588525</pubmed></ref>。eNOSは [[カルシウム]]/カルモジュリンによって活性が制御され、 [[細胞膜]]に結合しやすい性質を持っている。nNOSも、カルシウム /カルモジュリンによって活性が制御されるが、主に細胞質に存在すると考えられてきた。しかし [[PSD95 ]]などの特定の膜蛋白に結合しやすいことが明らかにされた。iNOSは主に免疫系の細胞などで発現し、サイトカインなどによって酵素自体が誘導されることでNOの合成調節がなされる点が特徴である。NOの作用メカニズムは多様であるが、主要なものとしてグアニル酸シクラーゼを活性し、細胞内のcGMPレベルを上げることが挙げられる。さらに神経細胞でもNOは合成され、脳の様々な場所で情報伝達を担うことにより、非常に多彩な機能に関与している。従来研究されてきたNOの主要な脳機能としては、 [[シナプス ]]可塑性の調節因子、脳血流量の調節因子、神経細胞死への関与などが挙げられる。
==合成==
[[ファイル:NOS reaction.png|thumb|right|350px|'''図1. 一酸化窒素合成経路'''<br>Arg: アルギキン、NOHLA: Nω-ヒドロキシ-L-アルギニン、NADPH: ニコチンアミドアデニンジヌクレオチドリン酸。図中でオレンジ色で示されているのは酵素のヘム部位。Wikipediaより。]]
NOは生体内では[[一酸化窒素合成酵素]]により[[アルギニン]]から[[NADPH]]を[[wj:補酵素|補酵素]]として合成される(図1)。アルギニンは[[Nω-ヒドロキシ-L-アルギニン]]をへて、最終的にNOと[[シトルリン]]となる。
一酸化窒素合成酵素はヘムを含むタンパク質であり、[[神経型一酸化窒素合成酵素|神経型]](nNOS)、[[誘導型一酸化窒素合成酵素|誘導型]](iNOS)及び[[血管内皮型一酸化窒素合成酵素|血管内皮型]](eNOS)の3タイプがある(表)<ref name=ref1><pubmed>18588525</pubmed></ref>。
{| class="wikitable"
|+表. 一酸化窒素合成酵素ファミリー
| '''名称''' || '''遺伝子''' || '''発現'''||'''細胞局在'''||'''活性調節'''
|-
| '''神経型''' (nNOS) || [http://mouse.brain-map.org/experiment/show/71234633 NOS1] ||
*神経組織(中枢及び末梢)
*[[肺]]
*[[腎臓]]など
||細胞質。また[[PSD-95]]などと結合し、シナプスに集積する。||[[カルシウム]]/[[カルモジュリン]]
|-
| '''誘導型''' (iNOS) || [http://mouse.brain-map.org/experiment/show/69028647 NOS2]||
*[[免疫]]系
*心血管系
*肺など
| 細胞質可溶性、ホモ二量体として活性型
|[[サイトカイン]]などによる酵素発現の誘導。カルシウム非依存性
|-
| '''内皮型''' (eNOS) || [http://mouse.brain-map.org/experiment/show/75831750 NOS3] ||
*[[血管内皮細胞]]
*[[骨髄]]細胞
*[[血小板]]など
||[[細胞膜]]に結合しやすい性質を持っている。||カルシウム/カルモジュリン
|}
Wikipediaより改変。遺伝子名はAllen Brain Atlasへのリンク。
==作用機構==
NOは生体内分子(主にタンパク質)を種々の形で修飾してその活性を表す。タンパク内の[[wj:ヘム鉄|ヘム鉄]]、アミノ酸[[wj:システイン|システイン]]の[[wj:チオール|チオール]]基や[[wj:チロシン|チロシン]]残基などが結合相手となる。
===グアニル酸シクラーゼ===
NOは[[可溶性グアニル酸シクラーゼ]]を活性化し、細胞内の[[cGMP]]レベルを上げる。[[グアニル酸シクラーゼ]]の活性化は、NOが酵素の活性中心のヘム鉄に高い親和性を有する性質に依存している。生成されたcGMPは複数の経路を通じて下流へシグナルを伝達する。
#[[cGMP依存性タンパク質リン酸化酵素]]([[protein kinase G]]; [[PKG]])を活性化し、種々のターゲット分子の働きをリン酸化によって調節する。脳の[[シナプス可塑性]]の調節に関連しては、海馬で[[CaMKII]]<ref><pubmed>21255668</pubmed></ref>や[[RhoA]] <ref><pubmed>15694326</pubmed></ref>、[[Vasodilator-stimulated phosphoprotein]]([[VASP]])<ref><pubmed>24127602</pubmed></ref>などがPKGのターゲットであると報告されている。[[小脳]]においても[[G-substrate]]や[[IP3タイプI受容体|IP<sub>3</sub>タイプI受容体]]などがPKGによってリン酸化されることが知られている<ref><pubmed>22340725</pubmed></ref>。[[Protein kinase A]]と同様に、[[cAMP responsive element 結合因子]]([[CREB]])をリン酸化し、シナプス可塑性に関連したタンパク合成を調節することも報告されている。
#また、cGMPはcAMPと同様に[[イオンチャネル#HCNチャネルとCNGチャネル|環状ヌクレオチド依存性 (cyclic nucleotide-gated; CNG)イオンチャンネル]]を開口させる。これらのCNGチャンネルは特に[[視覚]]や[[嗅覚]]の受容に重要である<ref><pubmed>7946333</pubmed></ref> <ref><pubmed>17724338</pubmed></ref>。
#cGMPは、[[cAMP特異的ホスホジエステラーゼ]](PDE)の活性を抑制または増強させるため、一部のcGMPの作用は、これにより起こるとされる。上昇したcGMP はそれ自身、PDEによって速やかに分解され、その作用を消失する。
===タンパク質のニトロシル化===
[[ファイル:一酸化窒素2.png|thumb|350px|<b>図2. タンパク質ニトロシル化とその逆反応</b><br>
一酸化窒素合成酵素の活性化により、NOが合成されるとともに、一酸化窒素合成酵素自身もニトロシル化される。一酸化窒素からは遷移金属イオンにより触媒される経路'''(1と2)'''、チイルラジカル再結合'''(3と4)'''、一酸化窒素酸化によるN<sub>2</sub>O<sub>3</sub>産生経路'''(5と6)'''により、S−ニトロソ化グルタチオン (GSNO''')(1, 3, 5)'''あるいはニトロシル化タンパク質'''(2, 4, 6)'''が生成する。S−ニトロソ化グルタチオンはさらにニトロシル基転移反応によりタンパク質をニトロシル化する'''(7)'''。一方、NAD(P)H依存性酵素であるS−ニトロソ化グルタチオン還元酵素により分解される'''(8)'''。またはニトロシル基転移反応によりニトロシル化された一酸化窒素合成酵素やその他のタンパク質からもニトロシル基転移反応によりニトロシル化タンパク質が生成する'''(9)'''。ニトロシル化タンパク質はチオレドキシン還元酵素の働きにより、脱ニトロシル化される'''(10)'''。<br>
文献<ref name=ref23127359 />より改変、引用。]]
NOは、タンパク分子内に存在するシステインの-SH残基を[[ニトロシル化]]し、[[wj:ニトロシルチオール残基|ニトロシルチオール残基]]を形成する<ref name=ref23127359><pubmed>23127359</pubmed></ref> <ref><pubmed>15688001</pubmed></ref>。
Protein-Cys-SH + NO· → Protein- Cys-S-NO
タンパク質ニトロシル化の経路は、直接NOがタンパク質に作用する以外に、[[wj:グルタチオン|グルタチオン]]や一旦一酸化窒素合成酵素やその他のタンパク質に結合し、そこから転移される経路も存在する(図2)。
ニトロシル化されたタンパク質は、その活性が修飾され、これにより、いくつかの神経タンパク質の作用が変化することが知られている。シナプス膜関連タンパクでは[[NMDA型グルタミン酸受容体]], [[AMPA型グルタミン酸受容体]]及び[[シンタキシン]]を始めとして10種類以上がNOによりニトロシル化されることが知られている<ref><pubmed>2371916</pubmed></ref>。近年、タンパク質機能解析及び微量定量法の目覚ましい進歩により、生体内でニトロシル化を受けるタンパクの同定が進んでいるが、実験条件によっては、ニトロシル化の可逆性及び分子間転移性による不安定からくる誤差を十分考慮して、解析する必要がある。
===タンパク質のニトロ化===
また、NOは、種々の分子をニトロ化することが知られている。タンパク分子においては、ニトロ化は主としてチロシン残基において起こる。
NO· + O2·- → ONOO-
ONOO- + CO2 → NO2· + CO3·-
Protein-Tyr + NO2· → Protein-Tyr-NO2
ニトロ化は、後述されるように、NOの[[活性酸素窒素種]]としての反応により起こる不可逆的反応である<ref><pubmed>9202025</pubmed></ref> <ref><pubmed>15020765</pubmed></ref>。[[wj:DNA合成|DNA合成]]に重要な[[wj:リボヌクレオチドリダクターゼ|リボヌクレオチドリダクターゼ]]の[[wj:活性中心|活性中心]]に存在するチロシン残基のニトロ化が知られている<ref><pubmed>7520445</pubmed></ref>。比較的高濃度のNOにより検出され、NOによる細胞死の誘導やストレス経路の活性化に重要であるとされる。
===活性酸素窒素種としての作用===
NOは、比較的高濃度において活性酸素窒素種 (reactive oxygen and nitrogen spieces, RONS)として細胞に対してストレス応答を引き起こす。これには、DNAの傷害によるがん抑制遺伝子p53の誘導、[[小胞体ストレス]]、[[p38 MAPキナーゼ]]の活性化や[[ミトコンドリア]]の機能障害などが関係して[[神経細胞死]]の誘導につながる<ref><pubmed>20547235</pubmed></ref>。
==神経系における機能==
神経細胞で合成されたNOは、脳の様々な部位で情報伝達を担うことにより、非常に多彩な機能に関与している。主要な脳機能としては、[[シナプス可塑性]]の調節因子、[[脳血流量]]の調節因子、[[神経細胞死]]への関与などが挙げられる。
=== シナプス可塑性の調節物質===
== シナプス可塑性の調節物質としてのNO ==
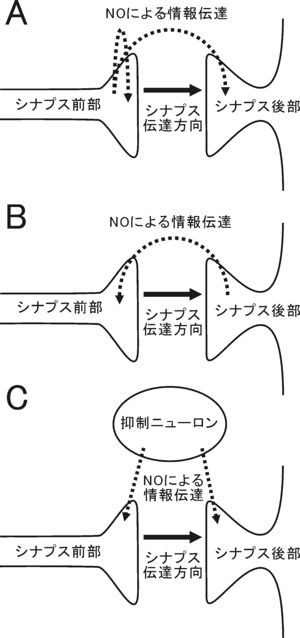
[[image:一酸化窒素(脳科学辞典).jpg|thumb|240px|'''図3.シナプス可塑性の調節因子としてのNO'''<br>シナプス前部から伝達物質と共に放出される場合(A)やシナプス後部からシナプス伝達の方向とは逆に放出される場合(B)や、シナプス近傍の抑制性のインターニューロンから放出される場合(C)など、様々なケースがある。]]
[[image:一酸化窒素(脳科学辞典).jpg|thumb|300px |'''図.シナプス可塑性の調節因子としてのNO '''<br>シナプス前部から伝達物質と共に放出される場合(A)やシナプス後部からシナプス伝達の方向とは逆に放出される場合(B)や、シナプス近傍の抑制性のインターニューロンから放出される場合(C)など、様々なケースがある。]]
NOの脳における重要な機能として[[シナプス]]可塑性の調節因子としての働きが挙げられる<ref name=ref2><pubmed>24198758</pubmed></ref>。NOが関与するシナプス可塑性としては[[小脳]]の[[長期抑圧]]、[[海馬]]の[[長期増強]]、[[大脳皮質]]の長期増強などがある。いずれの場合も、特定の膜に閉ざされたコンパートメントから、別の膜に閉ざされたコンパートメントに、NOのガス拡散特性によって情報を伝達しているという点に特徴がある(図3)。NOの放出部位はシナプス前部、後部、[[抑制性介在神経]]と多彩であり、NOはシナプスの可塑性に必須な因子というより、状況に応じて誘発を促進する調節因子であるという点が共通している。
NOの脳における重要な機能としてシナプス可塑性の調節因子としての働きが挙げられる <ref name=ref2><pubmed>24198758</pubmed></ref>。NOが関与するシナプス可塑性としては小脳の長期 [[抑圧 ]]、[[海馬]]の長期増強、 [[大脳皮質]]の長期増強などがある。いずれの場合も、特定の膜に閉ざされたコンパートメントから、別の膜に閉ざされたコンパートメントに、NOのガス拡散特性によって情報を伝達しているという点に特徴がある(図)。
====小脳長期抑圧現象====
小脳皮質からの唯一の出力細胞である[[プルキンエ細胞]]は、平行線維と登上線維からシナプス入力を受け。この二つが同期して起きたときに平行線維-プルキンエ細胞間シナプスが長期抑圧を起こす。小脳の長期抑圧は、ある種の運動学習の基礎メカニズムであると考えられている。小脳の長期抑圧は、シナプス後部であるプルキンエ細胞において生ずる。一方、平行線維を出す顆粒細胞はnNOSを多量に含み、NOは平行線維から放出されてプルキンエ細胞に、あるいは平行線維自身に作用すると考えられている。培養プルキンエ細胞を用た単純な実験系ではNOの関与なしに [[グルタミン酸]]応答の抑圧が起きるが、小脳長期抑圧を必要とする運動学習はNO依存性を示す、つまり標本による違いはあるものの、少なくとも個体レベルにおいて運動学習はNOによって促進的な修飾作用を受けると考えられる。
小脳皮質からの唯一の出力細胞である[[プルキンエ細胞]]は、[[平行線維]]と[[登上線維]]からシナプス入力を受け。この二つが同期して起きたときに平行線維-プルキンエ細胞間シナプスが長期[[抑圧]]を起こす。小脳の長期抑圧は、ある種の運動学習の基礎メカニズムであると考えられている。小脳の長期抑圧は、シナプス後部であるプルキンエ細胞において生ずる。一方、平行線維を出す[[顆粒細胞]]はnNOSを多量に含み、NOは平行線維から放出されてプルキンエ細胞に、あるいは平行線維自身に作用すると考えられている。培養プルキンエ細胞を用た単純な実験系ではNOの関与なしに[[グルタミン酸]]応答の抑圧が起きるが、小脳長期抑圧を必要とする運動学習はNO依存性を示す、つまり標本による違いはあるものの、少なくとも個体レベルにおいて[[運動学習]]はNOによって促進的な修飾作用を受けると考えられる。
====海馬長期増強現象====
海馬錘体細胞への入力線維を高頻度で刺激すると、シナプス後膜のNMDA型グルタミン酸受容体が活性化されてカルシウムが流入し、長期増強が起きる。長期増強には、シナプス後部のグルタミン酸受容体数が増加する型と、 [[シナプス前部]]からのグルタミン酸放出量が増大する型がある。[[シナプス前]]部でグルタミン酸の放出が起きるためには、カルシウム流入があったシナプス後部からシナプス前部へと逆行性に情報を伝達するメカニズムがあるのではないかと想定され、NOもそのような[[逆行性情報伝達]]物質の候補として考えられた。しかしNOが長期増強の誘導に関与するにしても実験温度や動物の週令、刺激強度や刺激パターンなど様々な実験条件が適切に設定された場合のみであることが判ってきた。即ちNOは長期増強の成立には必須ではないが、実験条件によっては長期増強を促進する調節物質の一つであると思われる。
[[海馬]][[錐体細胞]]への入力線維を高頻度で刺激すると、[[シナプス後膜]]の[[NMDA型グルタミン酸受容体]]が活性化されてカルシウムが流入し、長期増強が起きる。長期増強には、シナプス後部のグルタミン酸[[受容体]]数が増加する型と、[[シナプス前部]]からのグルタミン酸放出量が増大する型がある。[[シナプス前]]部でグルタミン酸の放出が起きるためには、カルシウム流入があったシナプス後部からシナプス前部へと逆行性に情報を伝達するメカニズムがあるのではないかと想定され、NOもそのような[[逆行性情報伝達]]物質の候補として考えられた。しかしNOが長期増強の誘導に関与するにしても実験温度や動物の週令、刺激強度や刺激パターンなど様々な実験条件が適切に設定された場合のみであることが判ってきた。即ちNOは長期増強の成立には必須ではないが、実験条件によっては長期増強を促進する調節物質の一つであると思われる。
====大脳皮質長期増強現象====
大脳皮質でも長期増強は起きる。この長期増強とNOとの関係には大脳皮質の層毎の違いがある。即ち大脳皮質のIV層を刺激するとII /III層及びV層の両方にLTPが起きるが、V層のLTPのみがNO合成酵素阻害剤によって有意に小さくなる。大脳皮質のNO合成酵素は主に深い層の小型のインターニューロンに局在し、これが活動する時にNOも放出される。
[[大脳皮質]]でも長期増強は起きる。この長期増強とNOとの関係には大脳皮質の層毎の違いがある。即ち大脳皮質のIV層を刺激するとII/III層及びV層の両方にLTPが起きるが、V層のLTPのみが一酸化窒素合成酵素阻害剤によって有意に小さくなる。大脳皮質のNO合成酵素は主に深い層の小型の[[介在神経細胞]]に局在し、これが活動する時にNOも放出される。
=== 脳血流量の調節===
以上、小脳、海馬、大脳皮質の例を挙げたが、NOの放出部位はシナプス前部、後部、 [[抑制性 ]]インターニューロンと多彩であり(図)、NOはシナプスの可塑性に必須な因子というより、状況に応じて誘発を促進する調節因子であるという点が共通している。
NOが血管内皮細胞由来弛緩因子という機能を有する以上、脳の血流量の調節も他の臓器と同様に関わる<ref name=ref3><pubmed>17659528</pubmed></ref>。また、血管内皮細胞以外にも、ある種の[[自律神経]]終末はNOを直接放出する機能を持ち、血流調節に関わっている。
脳に特徴的な血流調節として興味深いのは、脳活動によって局所の脳血流量が増大する現象で、神経細胞の少なくとも一部が一酸化窒素合成酵素を有する以上、局所血流量調節の少なくとも一部はNOを介すると思われる。しかし、それ以外の複数の血流調節因子の関与も想定されており、NOの役割は部分的である。
== 脳血流量の調節因子としてのNO==
NOが血管内皮細胞由来弛緩因子という機能を有する以上、脳の血流量の調節も他の臓器と同様に関わる<ref name=ref3><pubmed>17659528</pubmed></ref>。また、血管内皮細胞以外にも、ある種の自立[[神経終末]]はNOを直接放出する機能を持ち、血流調節に関わっている。脳に特徴的な血流調節として興味深いのは、脳活動によって局所の脳血流量が増大する現象で、神経細胞の少なくとも一部がNO合成酵素を有する以上、局所血流量調節の少なくとも一部はNOを介すると思われる。しかし、それ以外の複数の血流調節因子の関与も想定されており、NOの役割は部分的である。
=== 神経細胞死===
== 神経細胞死とNO ==
NOは[[wj:免疫系|免疫系]]の細胞においてiNOSから作られ、[[wj:細胞障害|細胞障害]]性を示す。従って脳に[[wj:炎症|炎症]]があるとき、免疫系の細胞が動員されて、神経細胞死に関わる。また、本来はシナプス可塑性や脳血流の調節因子として作り出されるNOが、[[脳虚血]]などの病態に伴って、細胞障害性を示すという場合もある。しかし、その一方でNOは低濃度で[[神経細胞保護作用]]を有するという知見もあり、どのような実験条件下でどのような評価法によりその効果を判定したかということに留意する必要がある<ref name=ref4><pubmed>17882254</pubmed></ref>。
NOは免疫系の細胞においてiNOSから作られ、細胞障害性を示す。従って脳に炎症があるとき、免疫系の細胞が動員されて、神経細胞死に関わる。また、本来はシナプス可塑性や脳血流の調節因子として作り出されるNOが、脳虚血などの病態に伴って、細胞障害性を示すという場合もある。しかし、その一方でNOは低濃度で神経細胞保護作用を有するという知見もあり、どのような実験条件下でどのような評価法によりその効果を判定したかということに留意する必要がある <ref name=ref4><pubmed>17882254</pubmed></ref>。
== 関連語 ==
== 関連語 ==
*[[一酸化窒素合成酵素]]
*[[NO合成酵素 ]]
*[[cGMP]]
*[[cGMP]]
*[[長期増強]]
*[[長期増強]]
澁木克栄 新潟大学脳研究所 XXXX /XXXX 原稿受付日:2013年12月2日 原稿完成日:2013年月日林 康紀 (独立行政法人理化学研究所 脳科学総合研究センター)
同義語:血管内皮細胞由来弛緩因子、EDRF、Nitric oxide
一酸化窒素(NO)は分子量30の無色透明なガスで、酸素に触れると直ちに酸化されて二酸化窒素となる。このような不安定な無機ガスは、近年まで生体とは全く無縁であると考えられていたが、血管内皮細胞由来の血管平滑筋弛緩因子(EDRF)として循環制御に重要な役割を果たすことが発見された。NOの物質としての特徴はガス状物質であり、細胞膜を透過して拡散しやすいこと、及び生体内で速やかに酸化され、半減期が1秒程度と短いことである。これらのユニークなNOの特性による情報伝達の発見は1998年のノーベル医学・生理学賞の受賞対象となった。
NOの生体内シグナル伝達経路 NOは生体内ではアルギニン から合成される。血管内皮型(eNOS)、神経型(nNOS)及び誘導型(iNOS)の3タイプの合成酵素がある[ 1] カルシウム /カルモジュリンによって活性が制御され、細胞膜 に結合しやすい性質を持っている。nNOSも、カルシウム/カルモジュリンによって活性が制御されるが、主に細胞質に存在すると考えられてきた。しかしPSD95 などの特定の膜蛋白に結合しやすいことが明らかにされた。iNOSは主に免疫系の細胞などで発現し、サイトカインなどによって酵素自体が誘導されることでNOの合成調節がなされる点が特徴である。NOの作用メカニズムは多様であるが、主要なものとしてグアニル酸シクラーゼを活性し、細胞内のcGMPレベルを上げることが挙げられる。さらに神経細胞でもNOは合成され、脳の様々な場所で情報伝達を担うことにより、非常に多彩な機能に関与している。従来研究されてきたNOの主要な脳機能としては、シナプス 可塑性の調節因子、脳血流量の調節因子、神経細胞死への関与などが挙げられる。
シナプス可塑性の調節物質としてのNO 図.シナプス可塑性の調節因子としてのNO NOの脳における重要な機能としてシナプス可塑性の調節因子としての働きが挙げられる[ 2] 抑圧 、海馬 の長期増強、大脳皮質 の長期増強などがある。いずれの場合も、特定の膜に閉ざされたコンパートメントから、別の膜に閉ざされたコンパートメントに、NOのガス拡散特性によって情報を伝達しているという点に特徴がある(図)。
小脳皮質からの唯一の出力細胞であるプルキンエ細胞 は、平行線維と登上線維からシナプス入力を受け。この二つが同期して起きたときに平行線維-プルキンエ細胞間シナプスが長期抑圧を起こす。小脳の長期抑圧は、ある種の運動学習の基礎メカニズムであると考えられている。小脳の長期抑圧は、シナプス後部であるプルキンエ細胞において生ずる。一方、平行線維を出す顆粒細胞はnNOSを多量に含み、NOは平行線維から放出されてプルキンエ細胞に、あるいは平行線維自身に作用すると考えられている。培養プルキンエ細胞を用た単純な実験系ではNOの関与なしにグルタミン酸 応答の抑圧が起きるが、小脳長期抑圧を必要とする運動学習はNO依存性を示す、つまり標本による違いはあるものの、少なくとも個体レベルにおいて運動学習はNOによって促進的な修飾作用を受けると考えられる。
海馬錘体細胞への入力線維を高頻度で刺激すると、シナプス後膜のNMDA型グルタミン酸受容体が活性化されてカルシウムが流入し、長期増強が起きる。長期増強には、シナプス後部のグルタミン酸受容体数が増加する型と、シナプス前部 からのグルタミン酸放出量が増大する型がある。シナプス前 部でグルタミン酸の放出が起きるためには、カルシウム流入があったシナプス後部からシナプス前部へと逆行性に情報を伝達するメカニズムがあるのではないかと想定され、NOもそのような逆行性情報伝達 物質の候補として考えられた。しかしNOが長期増強の誘導に関与するにしても実験温度や動物の週令、刺激強度や刺激パターンなど様々な実験条件が適切に設定された場合のみであることが判ってきた。即ちNOは長期増強の成立には必須ではないが、実験条件によっては長期増強を促進する調節物質の一つであると思われる。
大脳皮質でも長期増強は起きる。この長期増強とNOとの関係には大脳皮質の層毎の違いがある。即ち大脳皮質のIV層を刺激するとII/III層及びV層の両方にLTPが起きるが、V層のLTPのみがNO合成酵素阻害剤によって有意に小さくなる。大脳皮質のNO合成酵素は主に深い層の小型のインターニューロンに局在し、これが活動する時にNOも放出される。
以上、小脳、海馬、大脳皮質の例を挙げたが、NOの放出部位はシナプス前部、後部、抑制性 インターニューロンと多彩であり(図)、NOはシナプスの可塑性に必須な因子というより、状況に応じて誘発を促進する調節因子であるという点が共通している。
脳血流量の調節因子としてのNO NOが血管内皮細胞由来弛緩因子という機能を有する以上、脳の血流量の調節も他の臓器と同様に関わる[ 3] 神経終末 はNOを直接放出する機能を持ち、血流調節に関わっている。脳に特徴的な血流調節として興味深いのは、脳活動によって局所の脳血流量が増大する現象で、神経細胞の少なくとも一部がNO合成酵素を有する以上、局所血流量調節の少なくとも一部はNOを介すると思われる。しかし、それ以外の複数の血流調節因子の関与も想定されており、NOの役割は部分的である。
神経細胞死とNO NOは免疫系の細胞においてiNOSから作られ、細胞障害性を示す。従って脳に炎症があるとき、免疫系の細胞が動員されて、神経細胞死に関わる。また、本来はシナプス可塑性や脳血流の調節因子として作り出されるNOが、脳虚血などの病態に伴って、細胞障害性を示すという場合もある。しかし、その一方でNOは低濃度で神経細胞保護作用を有するという知見もあり、どのような実験条件下でどのような評価法によりその効果を判定したかということに留意する必要がある[ 4]
関連語 参考文献
↑
Garthwaite, J. (2008). The European journal of neuroscience , 27(11), 2783-802.
[PubMed:18588525 ]
[PMC ]
[WorldCat ]
[DOI ]
↑
Hardingham, N., Dachtler, J., & Fox, K. (2013). Frontiers in cellular neuroscience , 7, 190.
[PubMed:24198758 ]
[PMC ]
[WorldCat ]
[DOI ]
↑
Gordon, G.R., Mulligan, S.J., & MacVicar, B.A. (2007). Glia , 55(12), 1214-21.
[PubMed:17659528 ]
[WorldCat ]
[DOI ]
↑
Calabrese, V., Mancuso, C., Calvani, M., Rizzarelli, E., Butterfield, D.A., & Stella, A.M. (2007). Nature reviews. Neuroscience , 8(10), 766-75.
[PubMed:17882254 ]
[WorldCat ]
[DOI ]