「ミュラーグリア」の版間の差分
細編集の要約なし |
|||
| (2人の利用者による、間の8版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | <div align="right"> | ||
<font size="+1">須賀 晶子、[http://researchmap.jp/read0042632 | <font size="+1">須賀 晶子、[http://researchmap.jp/read0042632 高橋政代]</font><br> | ||
''独立行政法人理化学研究所 発生・再生科学総合研究センター''<br> | ''独立行政法人理化学研究所 発生・再生科学総合研究センター''<br> | ||
DOI XXXX/XXXX 原稿受付日:2012年9月27日 原稿完成日:2013年月日<br> | |||
担当編集委員:[http:// | 担当編集委員:[http://www.phy.med.kyoto-u.ac.jp/dw.html 渡辺 大](京都大学大学院 生命科学研究科認知情報学講座・医学研究科生体情報科学講座)<br> | ||
</div> | </div> | ||
| 9行目: | 9行目: | ||
同義語:ミュラー細胞 | 同義語:ミュラー細胞 | ||
{{box|text= ミュラーグリアは[[網膜]]内の主要な[[グリア細胞]] | {{box|text= ミュラーグリアは[[網膜]]内の主要な[[グリア細胞]]である。(編集 コメント:要約を御願い致します)}} | ||
== ミュラーグリアとは == | == ミュラーグリアとは == | ||
[[Image:Akikosuga fig 1.jpg|thumb|250px|'''図1.ミュラーグリアと網膜の神経細胞の位置関係''' | [[Image:Akikosuga fig 1.jpg|thumb|250px|'''図1.ミュラーグリアと網膜の神経細胞の位置関係'''<br>c:錐体細胞、r: 桿体細胞、H:水平細胞、A:アマクリン細胞、B:双極細胞、G:網膜神経節細胞、OLM:外境界膜、ILM:内境界膜、ONL:外顆粒層、OPL:外網状層、INL:内顆粒層、IPL:内網状層、GCL:網膜神経節細胞層 Webvision Glial Cells of the Retinaより]] | ||
ミュラーグリアは[[網膜]]内の主要な[[グリア細胞]]であり、放射状に延びる細胞体が網膜内のすべての[[神経細胞]] | ミュラーグリアは[[網膜]]内の主要な[[グリア細胞]]であり、放射状に延びる細胞体が網膜内のすべての[[神経細胞]]と接している(図1)。発生的には神経細胞と共通の[[網膜前駆細胞]]に由来する。(イントロを御願い致します) | ||
==発生 == | ==発生 == | ||
| 19行目: | 19行目: | ||
[[Image:Akikosuga fig 2.jpg|thumb|250px|'''図2.マウス網膜の神経細胞とミュラーグリアの発生''']] | [[Image:Akikosuga fig 2.jpg|thumb|250px|'''図2.マウス網膜の神経細胞とミュラーグリアの発生''']] | ||
網膜にはミュラーグリアのほかに[[アストロサイト]]、[[ミクログリア]]の3種類のグリア細胞が存在する。ミクログリアが[[ | 網膜にはミュラーグリアのほかに[[アストロサイト]]、[[ミクログリア]]の3種類のグリア細胞が存在する。ミクログリアが[[wikipedia:jp:血球|血球]]成分である[[wikipedia:jp:マクロファージ|マクロファージ]]由来と考えられており<ref><pubmed> 7047372 </pubmed></ref> 、アストロサイトは[[視神経]]を介して網膜内へ移動してくるのに対し<ref><pubmed> 3282180 </pubmed></ref>、ミュラーグリアは網膜神経細胞と共通の前駆細胞から作られる<ref><pubmed> 3600789 </pubmed></ref>。網膜内の各神経細胞とミュラーグリアが生み出される順番は、生物種にかかわらず網膜[[神経節細胞]]、[[水平細胞]]、[[錐体視細胞]]、[[アマクリン細胞]]、[[桿体視細胞]]、[[双極細胞]]、ミュラーグリアの順で大まかに共通している<ref><pubmed> 15036211 </pubmed></ref>(図2)。ミュラーグリアと網膜の前駆細胞はともに放射状に伸びた形をしているが、前駆細胞の核が網膜層内を往復運動しているのに対し<ref><pubmed> 17560964 </pubmed></ref>、ミュラーグリアの核は[[内顆粒層]]に位置する。ミュラーグリアの突起は[[強膜]]側では視細胞と密着結合して[[外境界膜]]を形成し、[[硝子体]]側ではアストロサイトとともに[[内境界膜]]を形成する。 | ||
==機能 == | ==機能 == | ||
ミュラーグリアは網膜内の全細胞の2%から5%を占める<ref><pubmed> 9786999</pubmed></ref>。他の[[中枢神経系]]におけるグリア細胞と同様に、成熟したミュラーグリアは網膜組織の[[ | ミュラーグリアは網膜内の全細胞の2%から5%を占める<ref><pubmed> 9786999</pubmed></ref>。他の[[中枢神経系]]におけるグリア細胞と同様に、成熟したミュラーグリアは網膜組織の[[wikipedia:jp:恒常性|恒常性]] 維持に働いており、特徴的な分子を発現していることが知られている<ref name="RER2006"><pubmed> 16839797 </pubmed></ref>。 | ||
=== 神経伝達物質のリサイクル === | === 神経伝達物質のリサイクル === | ||
網膜内の神経細胞から放出される[[グルタミン酸]]、[[γ-アミノ酪酸]]([[GABA]])はミュラーグリア内で[[ | 網膜内の神経細胞から放出される[[グルタミン酸]]、[[γ-アミノ酪酸]]([[GABA]])はミュラーグリア内で[[wikipedia:ja:グルタミン|グルタミン]]へと変換される<ref><pubmed> 19114072 </pubmed></ref>。グルタミン酸は[[グルタミン酸・アスパラギン酸輸送体]](GLAST)を介して細胞内に取り込まれ、[[グルタミン合成酵素]](Glutamine synthetase)によってグルタミンに変換された後にグルタミン輸送体を介して細胞外へ放出される<ref><pubmed> 8531222 </pubmed></ref>。一方GABAは[[GABA輸送体]](GAT-3)を介して細胞内に取り込まれた後に<ref><pubmed> 8915826 </pubmed></ref>[[GABAアミノ基転移酵素]](GABA-T)によってグルタミン酸へと変換され、細胞内に取り込まれたグルタミン酸と同じ経路をたどる。 | ||
=== 網膜組織内のカリウムイオン濃度の調節 === | === 網膜組織内のカリウムイオン濃度の調節 === | ||
神経活動によって細胞外へ放出された[[ | 神経活動によって細胞外へ放出された[[wikipedia:jp:カリウムイオン|カリウム]]イオンはミュラーグリアによって取り込まれた後に血液中、硝子体、網膜下腔へと放出される<ref name="Glia2000"><pubmed> 10594921 </pubmed></ref>。カリウムイオンの取り込みは主にミュラーグリアと[[内網状層]]・[[外網状層]]が接する位置に局在している[[カリウムチャネル]](Kir 2.1)が、放出はミュラーグリアと血管、硝子体、網膜下腔が接する位置に局在するKir 4.1が担っている。 | ||
=== 網膜組織内の水の量の調節 === | === 網膜組織内の水の量の調節 === | ||
細胞内での[[ | 細胞内での[[wikipedia:jp:酸化的リン酸化|酸化的リン酸化]]で生じる水分子や[[wikipedia:ja:グルコース|グルコース]]の取り込みに伴って流入する水分子はミュラーグリアで発現している水チャネル([[アクアポリン]])を介して血液中へと放出される<ref><pubmed> 18501660 </pubmed></ref>。 | ||
== グリオーシス == | == グリオーシス == | ||
[[ | [[wikipedia:jp:網膜剥離|網膜剥離]]などの機械的な損傷や[[wikipedia:jp:糖尿病網膜症|糖尿病網膜症]]、[[虚血]]などの傷害を受けた場合には、他の中枢神経でみられる反応性グリアと同様の変化がミュラーグリアでも見られる<ref name="RER2006" />。顕著な変化は[[中間径フィラメント]]である[[グリア線維性酸性タンパク質]](glial fibrillary acidic protein, GFAP)の発現が上昇すること<ref><pubmed> 14692684 </pubmed></ref>、カリウムイオンチャネルなどの特徴的な遺伝子の発現が低下することである<ref name="Glia2000" />。一方で、このような傷害条件下では活性化したミクログリアがミュラーグリアからの[[神経栄養因子]]分泌を促進するという報告もある<ref><pubmed> 12417648 </pubmed></ref>。ミュラーグリアの[[グリオーシス]]が網膜組織にさらに障害を与えるのか、逆に神経細胞の保護効果をもつのかははっきりしていないが、長期的には網膜組織の恒常性維持に必要な機能が低下することで[[神経細胞死]]につながると考えられている。 | ||
== ミュラーグリアからの網膜再生 == | == ミュラーグリアからの網膜再生 == | ||
網膜傷害時に見られるミュラーグリアの増殖と恒常性維持に重要な遺伝子発現の低下はグリオーシスの特徴の一つと考えられていたが、近年になってこれらの未[[分化]]化したミュラーグリアから網膜の神経細胞が[[再生]]されることが[[ゼブラフィッシュ]]<ref><pubmed> 17596452 </pubmed></ref>、[[ | 網膜傷害時に見られるミュラーグリアの増殖と恒常性維持に重要な遺伝子発現の低下はグリオーシスの特徴の一つと考えられていたが、近年になってこれらの未[[分化]]化したミュラーグリアから網膜の神経細胞が[[再生]]されることが[[ゼブラフィッシュ]]<ref><pubmed> 17596452 </pubmed></ref>、[[wikipedia:jp:ニワトリ|ニワトリ]]<ref><pubmed> 11224540 </pubmed></ref>、[[wikipedia:jp:ラット|ラット]]・[[wikipedia:jp:ハツカネズミ|マウス]]<ref><pubmed> 15353594 </pubmed></ref><ref><pubmed> 19033471 </pubmed></ref>で報告されている。この再生能力は動物種によって異なっており、[[wikipedia:jp:哺乳類|哺乳類]]では増殖するミュラーグリアが非常に少ないか、傷害条件によっては全く増殖しない<ref><pubmed> 20303826 </pubmed></ref><ref><pubmed> 21500284 </pubmed></ref>。しかしマウスやヒトのミュラーグリアも[[細胞培養|培養]]環境下では網膜の神経細胞に分化させられることから<ref><pubmed> 21732491 </pubmed></ref>、網膜の[[幹細胞]]・前駆細胞様になる可能性を持つと考えられている。 | ||
== 関連項目 == | == 関連項目 == | ||
*[[グリア細胞]] | *[[グリア細胞]] | ||
*[[ | *[[網膜神経回路]] | ||
*[[神経幹細胞]] | *[[神経幹細胞]] | ||
*[[神経前駆細胞]] | *[[神経前駆細胞]] | ||
*[[ニューロン新生]] | *[[ニューロン新生]] | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2014年3月4日 (火) 23:10時点における版
須賀 晶子、高橋政代
独立行政法人理化学研究所 発生・再生科学総合研究センター
DOI XXXX/XXXX 原稿受付日:2012年9月27日 原稿完成日:2013年月日
担当編集委員:渡辺 大(京都大学大学院 生命科学研究科認知情報学講座・医学研究科生体情報科学講座)
英:Müller glia 独:Müllerzelle 仏:Cellule de Müller
同義語:ミュラー細胞
ミュラーグリアとは
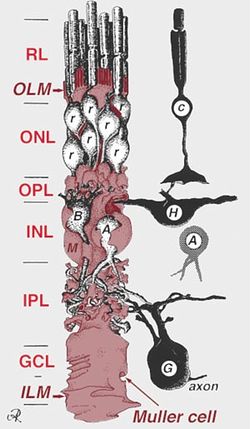
c:錐体細胞、r: 桿体細胞、H:水平細胞、A:アマクリン細胞、B:双極細胞、G:網膜神経節細胞、OLM:外境界膜、ILM:内境界膜、ONL:外顆粒層、OPL:外網状層、INL:内顆粒層、IPL:内網状層、GCL:網膜神経節細胞層 Webvision Glial Cells of the Retinaより
ミュラーグリアは網膜内の主要なグリア細胞であり、放射状に延びる細胞体が網膜内のすべての神経細胞と接している(図1)。発生的には神経細胞と共通の網膜前駆細胞に由来する。(イントロを御願い致します)
発生

網膜にはミュラーグリアのほかにアストロサイト、ミクログリアの3種類のグリア細胞が存在する。ミクログリアが血球成分であるマクロファージ由来と考えられており[1] 、アストロサイトは視神経を介して網膜内へ移動してくるのに対し[2]、ミュラーグリアは網膜神経細胞と共通の前駆細胞から作られる[3]。網膜内の各神経細胞とミュラーグリアが生み出される順番は、生物種にかかわらず網膜神経節細胞、水平細胞、錐体視細胞、アマクリン細胞、桿体視細胞、双極細胞、ミュラーグリアの順で大まかに共通している[4](図2)。ミュラーグリアと網膜の前駆細胞はともに放射状に伸びた形をしているが、前駆細胞の核が網膜層内を往復運動しているのに対し[5]、ミュラーグリアの核は内顆粒層に位置する。ミュラーグリアの突起は強膜側では視細胞と密着結合して外境界膜を形成し、硝子体側ではアストロサイトとともに内境界膜を形成する。
機能
ミュラーグリアは網膜内の全細胞の2%から5%を占める[6]。他の中枢神経系におけるグリア細胞と同様に、成熟したミュラーグリアは網膜組織の恒常性 維持に働いており、特徴的な分子を発現していることが知られている[7]。
神経伝達物質のリサイクル
網膜内の神経細胞から放出されるグルタミン酸、γ-アミノ酪酸(GABA)はミュラーグリア内でグルタミンへと変換される[8]。グルタミン酸はグルタミン酸・アスパラギン酸輸送体(GLAST)を介して細胞内に取り込まれ、グルタミン合成酵素(Glutamine synthetase)によってグルタミンに変換された後にグルタミン輸送体を介して細胞外へ放出される[9]。一方GABAはGABA輸送体(GAT-3)を介して細胞内に取り込まれた後に[10]GABAアミノ基転移酵素(GABA-T)によってグルタミン酸へと変換され、細胞内に取り込まれたグルタミン酸と同じ経路をたどる。
網膜組織内のカリウムイオン濃度の調節
神経活動によって細胞外へ放出されたカリウムイオンはミュラーグリアによって取り込まれた後に血液中、硝子体、網膜下腔へと放出される[11]。カリウムイオンの取り込みは主にミュラーグリアと内網状層・外網状層が接する位置に局在しているカリウムチャネル(Kir 2.1)が、放出はミュラーグリアと血管、硝子体、網膜下腔が接する位置に局在するKir 4.1が担っている。
網膜組織内の水の量の調節
細胞内での酸化的リン酸化で生じる水分子やグルコースの取り込みに伴って流入する水分子はミュラーグリアで発現している水チャネル(アクアポリン)を介して血液中へと放出される[12]。
グリオーシス
網膜剥離などの機械的な損傷や糖尿病網膜症、虚血などの傷害を受けた場合には、他の中枢神経でみられる反応性グリアと同様の変化がミュラーグリアでも見られる[7]。顕著な変化は中間径フィラメントであるグリア線維性酸性タンパク質(glial fibrillary acidic protein, GFAP)の発現が上昇すること[13]、カリウムイオンチャネルなどの特徴的な遺伝子の発現が低下することである[11]。一方で、このような傷害条件下では活性化したミクログリアがミュラーグリアからの神経栄養因子分泌を促進するという報告もある[14]。ミュラーグリアのグリオーシスが網膜組織にさらに障害を与えるのか、逆に神経細胞の保護効果をもつのかははっきりしていないが、長期的には網膜組織の恒常性維持に必要な機能が低下することで神経細胞死につながると考えられている。
ミュラーグリアからの網膜再生
網膜傷害時に見られるミュラーグリアの増殖と恒常性維持に重要な遺伝子発現の低下はグリオーシスの特徴の一つと考えられていたが、近年になってこれらの未分化化したミュラーグリアから網膜の神経細胞が再生されることがゼブラフィッシュ[15]、ニワトリ[16]、ラット・マウス[17][18]で報告されている。この再生能力は動物種によって異なっており、哺乳類では増殖するミュラーグリアが非常に少ないか、傷害条件によっては全く増殖しない[19][20]。しかしマウスやヒトのミュラーグリアも培養環境下では網膜の神経細胞に分化させられることから[21]、網膜の幹細胞・前駆細胞様になる可能性を持つと考えられている。
関連項目
参考文献
- ↑
Oehmichen, M. (1982).
Are resting and/or reactive microglia macrophages? Immunobiology, 161(3-4), 246-54. [PubMed:7047372] [WorldCat] [DOI] - ↑
Watanabe, T., & Raff, M.C. (1988).
Retinal astrocytes are immigrants from the optic nerve. Nature, 332(6167), 834-7. [PubMed:3282180] [WorldCat] [DOI] - ↑
Turner, D.L., & Cepko, C.L. (1987).
A common progenitor for neurons and glia persists in rat retina late in development. Nature, 328(6126), 131-6. [PubMed:3600789] [WorldCat] [DOI] - ↑
Hatakeyama, J., & Kageyama, R. (2004).
Retinal cell fate determination and bHLH factors. Seminars in cell & developmental biology, 15(1), 83-9. [PubMed:15036211] [WorldCat] [DOI] - ↑
Baye, L.M., & Link, B.A. (2008).
Nuclear migration during retinal development. Brain research, 1192, 29-36. [PubMed:17560964] [PMC] [WorldCat] [DOI] - ↑
Jeon, C.J., Strettoi, E., & Masland, R.H. (1998).
The major cell populations of the mouse retina. The Journal of neuroscience : the official journal of the Society for Neuroscience, 18(21), 8936-46. [PubMed:9786999] [PMC] [WorldCat] - ↑ 7.0 7.1
Bringmann, A., Pannicke, T., Grosche, J., Francke, M., Wiedemann, P., Skatchkov, S.N., ..., & Reichenbach, A. (2006).
Müller cells in the healthy and diseased retina. Progress in retinal and eye research, 25(4), 397-424. [PubMed:16839797] [WorldCat] [DOI] - ↑
Bringmann, A., Pannicke, T., Biedermann, B., Francke, M., Iandiev, I., Grosche, J., ..., & Reichenbach, A. (2008).
Role of retinal glial cells in neurotransmitter uptake and metabolism. Neurochemistry international, 54(3-4), 143-60. [PubMed:19114072] [WorldCat] [DOI] - ↑
Derouiche, A., & Rauen, T. (1995).
Coincidence of L-glutamate/L-aspartate transporter (GLAST) and glutamine synthetase (GS) immunoreactions in retinal glia: evidence for coupling of GLAST and GS in transmitter clearance. Journal of neuroscience research, 42(1), 131-43. [PubMed:8531222] [WorldCat] [DOI] - ↑
Johnson, J., Chen, T.K., Rickman, D.W., Evans, C., & Brecha, N.C. (1996).
Multiple gamma-Aminobutyric acid plasma membrane transporters (GAT-1, GAT-2, GAT-3) in the rat retina. The Journal of comparative neurology, 375(2), 212-24. [PubMed:8915826] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1
Bringmann, A., Francke, M., Pannicke, T., Biedermann, B., Kodal, H., Faude, F., ..., & Reichenbach, A. (2000).
Role of glial K(+) channels in ontogeny and gliosis: a hypothesis based upon studies on Müller cells. Glia, 29(1), 35-44. [PubMed:10594921] [WorldCat] - ↑
Verkman, A.S., Ruiz-Ederra, J., & Levin, M.H. (2008).
Functions of aquaporins in the eye. Progress in retinal and eye research, 27(4), 420-33. [PubMed:18501660] [PMC] [WorldCat] [DOI] - ↑
Lewis, G.P., & Fisher, S.K. (2003).
Up-regulation of glial fibrillary acidic protein in response to retinal injury: its potential role in glial remodeling and a comparison to vimentin expression. International review of cytology, 230, 263-90. [PubMed:14692684] [WorldCat] [DOI] - ↑
Harada, T., Harada, C., Kohsaka, S., Wada, E., Yoshida, K., Ohno, S., ..., & Wada, K. (2002).
Microglia-Müller glia cell interactions control neurotrophic factor production during light-induced retinal degeneration. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(21), 9228-36. [PubMed:12417648] [PMC] [WorldCat] - ↑
Bernardos, R.L., Barthel, L.K., Meyers, J.R., & Raymond, P.A. (2007).
Late-stage neuronal progenitors in the retina are radial Müller glia that function as retinal stem cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(26), 7028-40. [PubMed:17596452] [PMC] [WorldCat] [DOI] - ↑
Fischer, A.J., & Reh, T.A. (2001).
Müller glia are a potential source of neural regeneration in the postnatal chicken retina. Nature neuroscience, 4(3), 247-52. [PubMed:11224540] [WorldCat] [DOI] - ↑
Ooto, S., Akagi, T., Kageyama, R., Akita, J., Mandai, M., Honda, Y., & Takahashi, M. (2004).
Potential for neural regeneration after neurotoxic injury in the adult mammalian retina. Proceedings of the National Academy of Sciences of the United States of America, 101(37), 13654-9. [PubMed:15353594] [PMC] [WorldCat] [DOI] - ↑
Karl, M.O., Hayes, S., Nelson, B.R., Tan, K., Buckingham, B., & Reh, T.A. (2008).
Stimulation of neural regeneration in the mouse retina. Proceedings of the National Academy of Sciences of the United States of America, 105(49), 19508-13. [PubMed:19033471] [PMC] [WorldCat] [DOI] - ↑
Karl, M.O., & Reh, T.A. (2010).
Regenerative medicine for retinal diseases: activating endogenous repair mechanisms. Trends in molecular medicine, 16(4), 193-202. [PubMed:20303826] [PMC] [WorldCat] [DOI] - ↑
Joly, S., Pernet, V., Samardzija, M., & Grimm, C. (2011).
Pax6-positive Müller glia cells express cell cycle markers but do not proliferate after photoreceptor injury in the mouse retina. Glia, 59(7), 1033-46. [PubMed:21500284] [WorldCat] [DOI] - ↑
Giannelli, S.G., Demontis, G.C., Pertile, G., Rama, P., & Broccoli, V. (2011).
Adult human Müller glia cells are a highly efficient source of rod photoreceptors. Stem cells (Dayton, Ohio), 29(2), 344-56. [PubMed:21732491] [WorldCat] [DOI]