「自殺」の版間の差分
細編集の要約なし |
細 →遺伝学 |
||
| (3人の利用者による、間の17版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">柳 雅也、辻井 農亜、[http://researchmap.jp/oshirakawa 白川 治 ]</font><br> | <font size="+1">柳 雅也、辻井 農亜、[http://researchmap.jp/oshirakawa 白川 治 ]</font><br> | ||
''近畿大学医学部精神神経科学教室''<br> | ''近畿大学医学部精神神経科学教室''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2014年7月8日 原稿完成日:2014年月日<br> | ||
担当編集委員:[http://researchmap.jp/tadafumikato 加藤 忠史](独立行政法人理化学研究所 脳科学総合研究センター)<br> | 担当編集委員:[http://researchmap.jp/tadafumikato 加藤 忠史](独立行政法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
{{box|text= | |||
歴史や文化、思想や哲学、社会経済的状況、養育環境など、多様な心理社会的要因が相互に作用するという複雑さを自殺は有する。自殺に至る場合ストレスが引き金になることが多いことから、心理的要因がその誘因として重視される一方で、自殺の背景としては精神疾患の存在が重要とされる。しかし、自殺のリスクの高さと精神疾患の重症度は相関しないことも少なくなく、精神疾患に罹患しても、多くは自殺行動を起こすことはない。また、同じストレス状況下にあっても、ストレスに対する個々の反応は様々である。このように、同じような精神疾患やストレス負荷が背景にあったとしても、自殺行動を起こす人と回避する人に分かれる。その理由として、精神疾患の枠を超え、おかれた状況の違いだけでは説明できない個体が有する自殺への至りやすさ、すなわち遺伝負因や神経生化学的・内分泌学的変化に代表される生物学的な脆弱性が存在すると考えられる。 | |||
}} | |||
== 背景 == | |||
毎年全世界で約100万人が自殺により死亡していると推定されている。自殺企図の直前には精神医学的診断がつく場合が多く、心理学的剖検では、その90%以上がなんらかの[[精神障害]]を有するとされる。そのため、特定の[[精神疾患]]あるいは精神症状との関連から自殺の病態を捉え、治療的に介入する試みがこれまでにもなされてきた。ところが、実際には精神疾患に罹患したとしても自殺行動に至ることは決して多くはなく、また精神疾患の重症度と自殺のリスクの高さは必ずしも相関しないことが示されている。このことは、精神医学的診断から独立した、すなわち特定の精神疾患という枠組を越えた自殺に至る脆弱性の存在を示唆している。自殺を心理学的観点から捉えると、[[ストレス]]因を引き金とする思考・行動の病理といえるが、自殺には遺伝的要因が関与することが示されているように(次章参照)、自殺に至る脆弱性には生物学的背景が存在しうる。 | |||
== | == 遺伝学 == | ||
[[image:自殺1.png|thumb|350px|'''図1.自殺行動のストレスー素因モデル'''<br>(Mann JJ, 2003 9) より改変)]] | |||
== | {| class="wikitable" | ||
|+ 表.自殺に関する遺伝学的知見(文献2、4) | |||
|- | |||
| colspan="3" | * 養子研究(adoption studies):約6倍<br> * 双生児研究(twin studies):遺伝率 38~55% | |||
|- | |||
| colspan="2" | No. of Twins(%)Concordant for Suicidal Behavior | |||
| | |||
|- | |||
| style="text-align:center" | MZ | |||
| style="text-align:center" | DN | |||
| style="text-align:center" | P | |||
|- | |||
| style="text-align:center" | 40/172(23.0) | |||
| style="text-align:center" | 2/294(0.7) | |||
| style="text-align:center" | < 0.0001 | |||
|- | |||
| colspan="3" | * 家族研究(family studies):2~12倍<br>(約5倍、既遂>未遂、impulsive aggression) | |||
|} | |||
家族研究、双生児研究、養子研究により、自殺には遺伝的要因が関与することが示されている。これまでの研究から、自殺行動の致死性が高いほど、すなわち自殺念慮から自殺既遂へと致死性が高くなるほど、遺伝的要因も強くなることが示されている(1)。家族研究では自殺者および非自殺者の血縁者における自殺傾性を比較するが、対象や評価方法、解析方法等の問題はあるものの、自殺者の家族では対照者と比べて自殺行動をとる危険性が高くなると報告されている(2)。また、双生児研究では、自殺関連行動の一卵性双生児における一致率は、二卵性双生児のそれよりも有意に高い(24.1% vs 2.8%)ことがメタ解析で報告されている(3)。さらに養子研究では、自殺の遺伝負因を持つ養子は負因を持たない養子に比べて自殺率が高いと報告されている(4)。自殺行動の水準を、自殺念慮から致死的な自殺企図まで幅をもたせて設定すると、自殺行動の遺伝性(heritability)は30-55%と推測されており、それらは精神疾患の有無から独立した遺伝性として同定される(2)。 | |||
[[ | [[ヒト]]ゲノム上には多くの遺伝子多型が存在し、自殺行動に関わる遺伝的な背景に関与すると考えられている。これらの自殺への感受性を担う遺伝子多型は世代間で伝達され、自殺傾性の遺伝的要因となりうる。どの遺伝子多型が自殺行動への重要な遺伝要因であるか、個別の多型について自殺行動への関与を調べる遺伝子相関研究がこれまでに数多くおこなわれてきた。しかしながら、従来の遺伝子相関研究では一度に検討できる遺伝子多型数が限られていたことや、他の精神疾患同様、個々の多型が自殺に及ぼす影響は大きくないと考えられることもあり、これまでのところ自殺の遺伝要因と定義できる明確な遺伝子多型は同定されていない。近年、目覚ましい遺伝子工学の発展に伴い、ヒトがもつすべての遺伝子についての網羅的[[検索]]を可能にする全遺伝子相関研究genome-wide association study (GWAS) が利用可能となっていることから、その技術を自殺の遺伝子研究に用いる試みが現在始まっている(5,6,7)。一方では、こうした親から子へと直接的に伝わる遺伝的要因に加え、[[エピジェネティック]]な機構を通じて人生早期のライフイベント(過酷な養育環境など)が遺伝子発現に変化をもたらすことも、自殺に至る生物学的背景になると考えられている(8)。こういった自殺に至る素因を背景に、精神疾患への罹患がリスクを高め、心的負荷となるライフイベントへの暴露といった急性のストレスが引き金となり、その帰結として自殺行動が引き起こされるとする「ストレス-素因モデル」が提唱されている(図1)(9)。 | ||
== 神経心理学 == | |||
自殺企図者もしくは自殺既遂者における衝動性・攻撃性の亢進が報告されており、特に若年者の自殺との関連が指摘されている(10)。また、うつ病や境界性パーソナリティ障害などの精神疾患に罹患していたとしても、衝動性・攻撃性が高い個人はより自殺のリスクが高いことが示されているように、背景となる精神疾患に関わらず、衝動性・攻撃性の高さは自殺行動につながりやすい(10)。さらに、衝動性や攻撃性の表出と考えられる怒りや暴力が、自殺行動と相関することも報告されている(11)。 | |||
一方、自殺における認知行動的特性と関連する認知機能障害の存在が重視されている。刺激に対して適切な注意の方向修正ができない注意選択の障害(attention deficit)、別の解決策に思考が向かないといった問題解決(problem solving)や意志決定(decision making)に関する能力の障害は、認知の硬直性(cognitive rigidity)と捉えることができ、自殺との関連が認められる(12)。また、悲観・厭世観(pessimism)や絶望感(hopelessness)、神経症傾向(neuroticism)といった心理学的特性やパーソナリティ特性も注目されており、なかでも絶望感は自殺のリスクを高める要因として重要であるとされる(12)。また、絶望感や社会的孤立(social [[isolation]])に伴うようなこころの痛み(psychological pain)が自殺念慮を引き起こし、自殺行動に至らしめる危険因子であると指摘されている(11)。 | |||
== 脳画像所見 == | |||
磁気共鳴画像(magnetic resonance imaging, MRI)を用いた脳構造画像研究により、自殺企図歴のある患者群では、気分障害やパーソナリティ障害、統合失調症といった特定の精神疾患に関わらず、眼窩部[[前頭前野]]を中心とした脳体積が減少していることが報告されている(12)。また同じくMRIを用いた研究で、自殺企図歴のある群においては、脳の[[白質]]病変(white matter hyperintensitities)が多くみられることも報告されている(13)。一方、磁気共鳴機能画像法を用いた脳機能画像(functional magnetic resonance imaging, fMRI)研究では、前項で述べた自殺に特徴的な神経心理学的所見と脳機能との関連が眼窩部前頭前野を中心に報告されている。うつ病患者のうち自殺企図歴を有する群では、意思決定課題の遂行時に眼窩部前頭前野の反応が乏しいことが報告されているとともに、怒りに関する[[情動]]刺激の提示による同脳部位の賦活が大きいことが報告されている(12)。さらに健常における研究ではあるが、自殺の危険因子である社会的孤立を連想させる刺激提示によって、同脳部位が活性化されることが報告されており(14)、自殺行動に至る背景として眼窩部前頭前野が重要な脳部位であることが窺える。 | |||
== 神経生化学的・神経内分泌学的変化 == | |||
自殺の生物学的機序の解明は、自殺既遂者あるいは自殺企図者における神経生化学的・神経内[[分泌]]学的な変化を捉える試みに始まる。とくに自殺者死後脳における研究は、自殺既遂直後の脳を対象とするため、自殺傾性の重症度が最も高くかつ生物学的均一性も比較的高いと考えられる。そして、[[セロトニン]]、[[ノルアドレナリン]]、ドパミンなどの神経伝達系の変化、細胞内情報伝達系の変化、神経細胞の形態変化などを直接捉えることができるため、自殺の生物学的な病態の解明には不可欠である。自殺における脳内神経伝達系の異常として、主に[[セロトニン神経系]]の失調とノル[[アドレナリン]]神経系やHypothalamic-pituitary-adrenal (HPA)系の失調が示唆されており、前者は遺伝的な規定を強く受けるtrait-relatedな系であるのに対し、後者の二つはストレスに反応して変化するよりstate-dependentな特性を示す系とされている(15)。 | |||
=== | ===セロトニン神経系=== | ||
[[セロトニン神経]]系(Serotonergic system)は、主に延髄の[[縫線核]](raphe nucleus)を起始として[[前頭葉]]をはじめ脳のさまざまな領域に投射しており,その失調が、抑うつ気分などの気分変調や衝動性・攻撃性といった情動不安定性を含めた自殺関連行動の背景と考えられている。 | |||
自殺者死後脳における[[脳脊髄液]]の変化として、セロトニン神経系の機能低下についての報告が数多くみうけられる。自殺者死後脳の前頭前野においては、[[シナプス前部]]のセロトニントランスポーター(以下5HTT)の減少(16)や、[[シナプス]]後部のセロトニン1A(5HT1A)および2A(5HT2A)受容体の増加(17)が報告されているが、これらは前頭葉におけるセロトニン神経伝達の低下を示唆する所見とされる。これらの変化は前頭葉のなかでもとりわけ、行動抑制に関わる脳領域である腹側前頭前野(ventral prefrontal cortex)での報告が多い(18)。さらに、自殺者死後脳の脳幹において、セロトニンおよびその代謝産物である5-hydroxyindole acetic acid (5-HIAA)の低下が報告されている(19)。セロトニン合成酵素である[[トリプトファン水酸化酵素]]2(tryptophan hydroxylase isoform 2; TPH2)は中枢神経系で特異的に発現しているTPHのisoformであるが、うつ病自殺者の死後脳において、TPH2のタンパク及び[[mRNA]]レベルが縫線核で上昇していたとの報告もある(20, 21)。この変化は、自殺でのセロトニン神経系の機能低下に対する代償的変化である可能性が考えられる。 | |||
死後脳以外でも、自殺におけるセロトニン神経系の機能低下を示す所見は数多く報告されている。致死的な自殺企図歴をもつうつ病患者をはじめ、統合失調症やパーソナリティ障害における自殺企図者においても脳脊[[髄液]]中の5-HIAAの低下が認められ、また衝動性の高いものほどその低下が目立つことが明らかにされている(22)。これらのことにより、脳脊髄液中の5-HIAAの低下は、特定の精神疾患の枠を超えて自殺と関連する生物学的指標と考えられている。 | |||
===ノルアドレナリン神経系=== | |||
ノルアドレナリン神経系(Noradrenergic system)は、[[ストレス応答]]や絶望感などの心理学的特性に関与する系で、セロトニン神経系ほどではないが、その失調と自殺との関連が指摘されている。 | ノルアドレナリン神経系(Noradrenergic system)は、[[ストレス応答]]や絶望感などの心理学的特性に関与する系で、セロトニン神経系ほどではないが、その失調と自殺との関連が指摘されている。 | ||
自殺既遂者において、ノルアドレナリン神経系の起始核である[[青斑核]]([[locus coeruleus]] | 自殺既遂者において、ノルアドレナリン神経系の起始核である[[青斑核]]([[locus coeruleus]])の神経細胞数の減少と細胞密度の低下が報告されている(23)。同じく自殺既遂者の脳幹においてノルアドレナリンが低下しており、その二次的な変化とされるアドレナリンα2受容体(以下α2受容体)結合の増加が報告されている(24)。これらの所見は、脳幹におけるノルアドレナリンの枯渇を示唆する。一方、自殺既遂者の前頭前野では、ノルアドレナリンの上昇とα2受容体結合の低下が報告されているが(25)、これは皮質でのノルアドレナリン活性の亢進を示すと考えられる。しかし、前頭前野におけるα2およびそのサブタイプであるα2A受容体が増加しているとの報告も多数あり(26-30)、自殺既遂者の皮質においてみられるこのような相反した所見は、青斑核においてもノルアドレナリン生合成の律速酵素である[[チロシン水酸化酵素]](tyrosine hydroxylase; TH)の増加または減少として報告されている(9)。これらのことは、状態依存的にノルアドレナリン神経系が変化する可能性を示唆しており、当初みられたノルアドレナリンの活性亢進がやがては低活性に至るような過程が自殺にはあるのかもしれない。 | ||
===視床下部―下垂体―副腎系=== | |||
[[Hypothalamic-pituitary-adrenal axis]]; HPA system | [[Hypothalamic-pituitary-adrenal axis]]; HPA system | ||
[[HPA系]]は、生体の[[ストレス反応]]性を規定する主要なシステムである。生体がストレスにさらされると、[[視床下部]] | [[HPA系]]は、生体の[[ストレス反応]]性を規定する主要なシステムである。生体がストレスにさらされると、[[視床下部]]からのCRH(corticotropin-releasing hormone)分泌が増加し、下垂体前葉からのACTH(adrenocorticotrophic hormone)分泌および副腎皮質からの[[グルココルチコイド]]の分泌を促進する。分泌されたグルココルチコイドは、生理的レベルでは、視床下部、下垂体前葉に分布する[[グルココルチコイド受容体]]への結合を介して、CRHおよびACTHの生合成と放出を抑制している。また、視床下部のCRH産生ニューロンは、さらに上位に位置する[[海馬]]から[[抑制性]]の入力を受けており、生理的レベルのグルココルチコイドは、海馬によるHPA系への抑制を強化する。これらのネガティブ・フィードバック機構および[[扁桃体]]から視床下部への[[興奮性]]の入力などを通じて、HPA系は制御されている。HPA系の機能評価として、デキサメサゾン(dexamethasone; DEX)を用いたDEX抑制試験またはDEX/CRH抑制試験がある。DEXは外因性合成グルココルチコイドホルモンで、その投与によりネガティブ・フィードバックを介してACTH、グルココルチコイド放出を抑制する。 | ||
生体へのストレス負荷が持続するとグルココルチコイド分泌が上昇し、その上昇の持続によって、神経栄養因子であるBDNF(brain-derived neurotrophic factor)の減少、海馬での神経細胞の傷害や[[神経新生]]の抑制などが生じる(31)。海馬の傷害によりHPA系への抑制性の制御は減弱し、その結果HPA系の過活性がもたらされる。ストレス負荷と関連する自殺においても、HPA系の過活性を示唆する報告が多い。結果は必ずしも一致していないものの、うつ病や自殺ではDEXによるグルココルチコイドの抑制がかかりにくい(non-suppression)とされており、HPA系の過活性の存在が示唆されている。non-suppressionは将来の自殺既遂の予測因子ともされており、15年以上にわたるフォローアップ研究において、non-suppressorはsuppressorと比較して約14倍自殺のリスクが高まると報告されている(32)。またnon-suppressorの気分障害では、自殺のリスクが約4.5倍高まるとするメタ解析の報告もある(15)。その他にも、脳脊髄液におけるCRH濃度の上昇(33)、前頭葉におけるCRH[[結合親和性]]の低下(34)、下垂体と副腎の肥大(35)といったHPA系に関する変化が、うつ病の自殺者で報告されている。 | |||
== | == 参考文献 == | ||
<references /> | <references /> | ||
2014年7月8日 (火) 13:16時点における版
柳 雅也、辻井 農亜、白川 治
近畿大学医学部精神神経科学教室
DOI:10.14931/bsd.5373 原稿受付日:2014年7月8日 原稿完成日:2014年月日
担当編集委員:加藤 忠史(独立行政法人理化学研究所 脳科学総合研究センター)
歴史や文化、思想や哲学、社会経済的状況、養育環境など、多様な心理社会的要因が相互に作用するという複雑さを自殺は有する。自殺に至る場合ストレスが引き金になることが多いことから、心理的要因がその誘因として重視される一方で、自殺の背景としては精神疾患の存在が重要とされる。しかし、自殺のリスクの高さと精神疾患の重症度は相関しないことも少なくなく、精神疾患に罹患しても、多くは自殺行動を起こすことはない。また、同じストレス状況下にあっても、ストレスに対する個々の反応は様々である。このように、同じような精神疾患やストレス負荷が背景にあったとしても、自殺行動を起こす人と回避する人に分かれる。その理由として、精神疾患の枠を超え、おかれた状況の違いだけでは説明できない個体が有する自殺への至りやすさ、すなわち遺伝負因や神経生化学的・内分泌学的変化に代表される生物学的な脆弱性が存在すると考えられる。
背景
毎年全世界で約100万人が自殺により死亡していると推定されている。自殺企図の直前には精神医学的診断がつく場合が多く、心理学的剖検では、その90%以上がなんらかの精神障害を有するとされる。そのため、特定の精神疾患あるいは精神症状との関連から自殺の病態を捉え、治療的に介入する試みがこれまでにもなされてきた。ところが、実際には精神疾患に罹患したとしても自殺行動に至ることは決して多くはなく、また精神疾患の重症度と自殺のリスクの高さは必ずしも相関しないことが示されている。このことは、精神医学的診断から独立した、すなわち特定の精神疾患という枠組を越えた自殺に至る脆弱性の存在を示唆している。自殺を心理学的観点から捉えると、ストレス因を引き金とする思考・行動の病理といえるが、自殺には遺伝的要因が関与することが示されているように(次章参照)、自殺に至る脆弱性には生物学的背景が存在しうる。
遺伝学
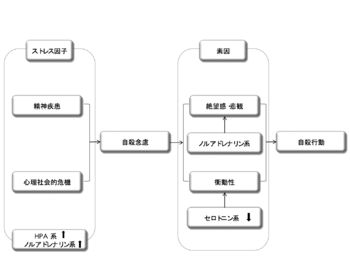
(Mann JJ, 2003 9) より改変)
| * 養子研究(adoption studies):約6倍 * 双生児研究(twin studies):遺伝率 38~55% | ||
| No. of Twins(%)Concordant for Suicidal Behavior | ||
| MZ | DN | P |
| 40/172(23.0) | 2/294(0.7) | < 0.0001 |
| * 家族研究(family studies):2~12倍 (約5倍、既遂>未遂、impulsive aggression) | ||
家族研究、双生児研究、養子研究により、自殺には遺伝的要因が関与することが示されている。これまでの研究から、自殺行動の致死性が高いほど、すなわち自殺念慮から自殺既遂へと致死性が高くなるほど、遺伝的要因も強くなることが示されている(1)。家族研究では自殺者および非自殺者の血縁者における自殺傾性を比較するが、対象や評価方法、解析方法等の問題はあるものの、自殺者の家族では対照者と比べて自殺行動をとる危険性が高くなると報告されている(2)。また、双生児研究では、自殺関連行動の一卵性双生児における一致率は、二卵性双生児のそれよりも有意に高い(24.1% vs 2.8%)ことがメタ解析で報告されている(3)。さらに養子研究では、自殺の遺伝負因を持つ養子は負因を持たない養子に比べて自殺率が高いと報告されている(4)。自殺行動の水準を、自殺念慮から致死的な自殺企図まで幅をもたせて設定すると、自殺行動の遺伝性(heritability)は30-55%と推測されており、それらは精神疾患の有無から独立した遺伝性として同定される(2)。
ヒトゲノム上には多くの遺伝子多型が存在し、自殺行動に関わる遺伝的な背景に関与すると考えられている。これらの自殺への感受性を担う遺伝子多型は世代間で伝達され、自殺傾性の遺伝的要因となりうる。どの遺伝子多型が自殺行動への重要な遺伝要因であるか、個別の多型について自殺行動への関与を調べる遺伝子相関研究がこれまでに数多くおこなわれてきた。しかしながら、従来の遺伝子相関研究では一度に検討できる遺伝子多型数が限られていたことや、他の精神疾患同様、個々の多型が自殺に及ぼす影響は大きくないと考えられることもあり、これまでのところ自殺の遺伝要因と定義できる明確な遺伝子多型は同定されていない。近年、目覚ましい遺伝子工学の発展に伴い、ヒトがもつすべての遺伝子についての網羅的検索を可能にする全遺伝子相関研究genome-wide association study (GWAS) が利用可能となっていることから、その技術を自殺の遺伝子研究に用いる試みが現在始まっている(5,6,7)。一方では、こうした親から子へと直接的に伝わる遺伝的要因に加え、エピジェネティックな機構を通じて人生早期のライフイベント(過酷な養育環境など)が遺伝子発現に変化をもたらすことも、自殺に至る生物学的背景になると考えられている(8)。こういった自殺に至る素因を背景に、精神疾患への罹患がリスクを高め、心的負荷となるライフイベントへの暴露といった急性のストレスが引き金となり、その帰結として自殺行動が引き起こされるとする「ストレス-素因モデル」が提唱されている(図1)(9)。
神経心理学
自殺企図者もしくは自殺既遂者における衝動性・攻撃性の亢進が報告されており、特に若年者の自殺との関連が指摘されている(10)。また、うつ病や境界性パーソナリティ障害などの精神疾患に罹患していたとしても、衝動性・攻撃性が高い個人はより自殺のリスクが高いことが示されているように、背景となる精神疾患に関わらず、衝動性・攻撃性の高さは自殺行動につながりやすい(10)。さらに、衝動性や攻撃性の表出と考えられる怒りや暴力が、自殺行動と相関することも報告されている(11)。
一方、自殺における認知行動的特性と関連する認知機能障害の存在が重視されている。刺激に対して適切な注意の方向修正ができない注意選択の障害(attention deficit)、別の解決策に思考が向かないといった問題解決(problem solving)や意志決定(decision making)に関する能力の障害は、認知の硬直性(cognitive rigidity)と捉えることができ、自殺との関連が認められる(12)。また、悲観・厭世観(pessimism)や絶望感(hopelessness)、神経症傾向(neuroticism)といった心理学的特性やパーソナリティ特性も注目されており、なかでも絶望感は自殺のリスクを高める要因として重要であるとされる(12)。また、絶望感や社会的孤立(social isolation)に伴うようなこころの痛み(psychological pain)が自殺念慮を引き起こし、自殺行動に至らしめる危険因子であると指摘されている(11)。
脳画像所見
磁気共鳴画像(magnetic resonance imaging, MRI)を用いた脳構造画像研究により、自殺企図歴のある患者群では、気分障害やパーソナリティ障害、統合失調症といった特定の精神疾患に関わらず、眼窩部前頭前野を中心とした脳体積が減少していることが報告されている(12)。また同じくMRIを用いた研究で、自殺企図歴のある群においては、脳の白質病変(white matter hyperintensitities)が多くみられることも報告されている(13)。一方、磁気共鳴機能画像法を用いた脳機能画像(functional magnetic resonance imaging, fMRI)研究では、前項で述べた自殺に特徴的な神経心理学的所見と脳機能との関連が眼窩部前頭前野を中心に報告されている。うつ病患者のうち自殺企図歴を有する群では、意思決定課題の遂行時に眼窩部前頭前野の反応が乏しいことが報告されているとともに、怒りに関する情動刺激の提示による同脳部位の賦活が大きいことが報告されている(12)。さらに健常における研究ではあるが、自殺の危険因子である社会的孤立を連想させる刺激提示によって、同脳部位が活性化されることが報告されており(14)、自殺行動に至る背景として眼窩部前頭前野が重要な脳部位であることが窺える。
神経生化学的・神経内分泌学的変化
自殺の生物学的機序の解明は、自殺既遂者あるいは自殺企図者における神経生化学的・神経内分泌学的な変化を捉える試みに始まる。とくに自殺者死後脳における研究は、自殺既遂直後の脳を対象とするため、自殺傾性の重症度が最も高くかつ生物学的均一性も比較的高いと考えられる。そして、セロトニン、ノルアドレナリン、ドパミンなどの神経伝達系の変化、細胞内情報伝達系の変化、神経細胞の形態変化などを直接捉えることができるため、自殺の生物学的な病態の解明には不可欠である。自殺における脳内神経伝達系の異常として、主にセロトニン神経系の失調とノルアドレナリン神経系やHypothalamic-pituitary-adrenal (HPA)系の失調が示唆されており、前者は遺伝的な規定を強く受けるtrait-relatedな系であるのに対し、後者の二つはストレスに反応して変化するよりstate-dependentな特性を示す系とされている(15)。
セロトニン神経系
セロトニン神経系(Serotonergic system)は、主に延髄の縫線核(raphe nucleus)を起始として前頭葉をはじめ脳のさまざまな領域に投射しており,その失調が、抑うつ気分などの気分変調や衝動性・攻撃性といった情動不安定性を含めた自殺関連行動の背景と考えられている。
自殺者死後脳における脳脊髄液の変化として、セロトニン神経系の機能低下についての報告が数多くみうけられる。自殺者死後脳の前頭前野においては、シナプス前部のセロトニントランスポーター(以下5HTT)の減少(16)や、シナプス後部のセロトニン1A(5HT1A)および2A(5HT2A)受容体の増加(17)が報告されているが、これらは前頭葉におけるセロトニン神経伝達の低下を示唆する所見とされる。これらの変化は前頭葉のなかでもとりわけ、行動抑制に関わる脳領域である腹側前頭前野(ventral prefrontal cortex)での報告が多い(18)。さらに、自殺者死後脳の脳幹において、セロトニンおよびその代謝産物である5-hydroxyindole acetic acid (5-HIAA)の低下が報告されている(19)。セロトニン合成酵素であるトリプトファン水酸化酵素2(tryptophan hydroxylase isoform 2; TPH2)は中枢神経系で特異的に発現しているTPHのisoformであるが、うつ病自殺者の死後脳において、TPH2のタンパク及びmRNAレベルが縫線核で上昇していたとの報告もある(20, 21)。この変化は、自殺でのセロトニン神経系の機能低下に対する代償的変化である可能性が考えられる。
死後脳以外でも、自殺におけるセロトニン神経系の機能低下を示す所見は数多く報告されている。致死的な自殺企図歴をもつうつ病患者をはじめ、統合失調症やパーソナリティ障害における自殺企図者においても脳脊髄液中の5-HIAAの低下が認められ、また衝動性の高いものほどその低下が目立つことが明らかにされている(22)。これらのことにより、脳脊髄液中の5-HIAAの低下は、特定の精神疾患の枠を超えて自殺と関連する生物学的指標と考えられている。
ノルアドレナリン神経系
ノルアドレナリン神経系(Noradrenergic system)は、ストレス応答や絶望感などの心理学的特性に関与する系で、セロトニン神経系ほどではないが、その失調と自殺との関連が指摘されている。
自殺既遂者において、ノルアドレナリン神経系の起始核である青斑核(locus coeruleus)の神経細胞数の減少と細胞密度の低下が報告されている(23)。同じく自殺既遂者の脳幹においてノルアドレナリンが低下しており、その二次的な変化とされるアドレナリンα2受容体(以下α2受容体)結合の増加が報告されている(24)。これらの所見は、脳幹におけるノルアドレナリンの枯渇を示唆する。一方、自殺既遂者の前頭前野では、ノルアドレナリンの上昇とα2受容体結合の低下が報告されているが(25)、これは皮質でのノルアドレナリン活性の亢進を示すと考えられる。しかし、前頭前野におけるα2およびそのサブタイプであるα2A受容体が増加しているとの報告も多数あり(26-30)、自殺既遂者の皮質においてみられるこのような相反した所見は、青斑核においてもノルアドレナリン生合成の律速酵素であるチロシン水酸化酵素(tyrosine hydroxylase; TH)の増加または減少として報告されている(9)。これらのことは、状態依存的にノルアドレナリン神経系が変化する可能性を示唆しており、当初みられたノルアドレナリンの活性亢進がやがては低活性に至るような過程が自殺にはあるのかもしれない。
視床下部―下垂体―副腎系
Hypothalamic-pituitary-adrenal axis; HPA system
HPA系は、生体のストレス反応性を規定する主要なシステムである。生体がストレスにさらされると、視床下部からのCRH(corticotropin-releasing hormone)分泌が増加し、下垂体前葉からのACTH(adrenocorticotrophic hormone)分泌および副腎皮質からのグルココルチコイドの分泌を促進する。分泌されたグルココルチコイドは、生理的レベルでは、視床下部、下垂体前葉に分布するグルココルチコイド受容体への結合を介して、CRHおよびACTHの生合成と放出を抑制している。また、視床下部のCRH産生ニューロンは、さらに上位に位置する海馬から抑制性の入力を受けており、生理的レベルのグルココルチコイドは、海馬によるHPA系への抑制を強化する。これらのネガティブ・フィードバック機構および扁桃体から視床下部への興奮性の入力などを通じて、HPA系は制御されている。HPA系の機能評価として、デキサメサゾン(dexamethasone; DEX)を用いたDEX抑制試験またはDEX/CRH抑制試験がある。DEXは外因性合成グルココルチコイドホルモンで、その投与によりネガティブ・フィードバックを介してACTH、グルココルチコイド放出を抑制する。
生体へのストレス負荷が持続するとグルココルチコイド分泌が上昇し、その上昇の持続によって、神経栄養因子であるBDNF(brain-derived neurotrophic factor)の減少、海馬での神経細胞の傷害や神経新生の抑制などが生じる(31)。海馬の傷害によりHPA系への抑制性の制御は減弱し、その結果HPA系の過活性がもたらされる。ストレス負荷と関連する自殺においても、HPA系の過活性を示唆する報告が多い。結果は必ずしも一致していないものの、うつ病や自殺ではDEXによるグルココルチコイドの抑制がかかりにくい(non-suppression)とされており、HPA系の過活性の存在が示唆されている。non-suppressionは将来の自殺既遂の予測因子ともされており、15年以上にわたるフォローアップ研究において、non-suppressorはsuppressorと比較して約14倍自殺のリスクが高まると報告されている(32)。またnon-suppressorの気分障害では、自殺のリスクが約4.5倍高まるとするメタ解析の報告もある(15)。その他にも、脳脊髄液におけるCRH濃度の上昇(33)、前頭葉におけるCRH結合親和性の低下(34)、下垂体と副腎の肥大(35)といったHPA系に関する変化が、うつ病の自殺者で報告されている。
参考文献