「カイニン酸型グルタミン酸受容体」の版間の差分
Etsukosuzuki (トーク | 投稿記録) 細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の12版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/esuzuki 鈴木 江津子]、[http://researchmap.jp/haruyukikamiya 神谷 温之]</font><br> | <font size="+1">[http://researchmap.jp/esuzuki 鈴木 江津子]、[http://researchmap.jp/haruyukikamiya 神谷 温之]</font><br> | ||
''北海道大学 医学研究科神経生物学分野''<br> | ''北海道大学 医学研究科神経生物学分野''<br> | ||
DOI:<selfdoi /> 原稿受付日:2013年7月30日 原稿完成日:2013年8月12日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi | 担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
| 67行目: | 67行目: | ||
{| class="wikitable" style="text-align:center" | {| class="wikitable" style="text-align:center" | ||
|+ 表2.Allen Brain Atlasでの分布 | |+ 表2.Allen Brain Atlasでの分布 | ||
|colspan="5" | サブユニット名 | |||
|- | |- | ||
| [http://mouse.brain-map.org/experiment/show/528 GluK1]|| [http://mouse.brain-map.org/experiment/show/69257719 GluK2] ||[http://mouse.brain-map.org/experiment/show/75749432 GluK3]||[http://mouse.brain-map.org/experiment/show/71307388 GluK4]||[http://mouse.brain-map.org/experiment/show/68911017 GluK5] | | [http://mouse.brain-map.org/experiment/show/528 GluK1]|| [http://mouse.brain-map.org/experiment/show/69257719 GluK2] ||[http://mouse.brain-map.org/experiment/show/75749432 GluK3]||[http://mouse.brain-map.org/experiment/show/71307388 GluK4]||[http://mouse.brain-map.org/experiment/show/68911017 GluK5] | ||
| 73行目: | 74行目: | ||
== 薬理学的特性== | == 薬理学的特性== | ||
==== アゴニスト ==== | ==== アゴニスト ==== | ||
[[カイニン酸]]は、海藻の[[wikipedia:ja:マクリ|マクリ]](Digenea simplex、別名:[[wikipedia:ja:カイニン草|カイニン草]])から分離された天然化合物であり、AMPA型グルタミン酸受容体およびカイニン酸受容体の[[アゴニスト]] | [[カイニン酸]]は、海藻の[[wikipedia:ja:マクリ|マクリ]](Digenea simplex、別名:[[wikipedia:ja:カイニン草|カイニン草]])から分離された天然化合物であり、AMPA型グルタミン酸受容体およびカイニン酸受容体の[[アゴニスト]]として作用する<ref name=ref2><pubmed> 18793656 </pubmed></ref>。カイニン酸と類似した構造を持つ天然化合物である[[ドウモイ酸]]は、カイニン酸よりも強くカイニン酸受容体を活性化する。また、カイニン酸受容体のサブユニット特異的アゴニストとしていくつかの薬剤が合成された。このうち、[[GluK1]]選択的アゴニストとして[[ATPA]]が広く用いられている。 | ||
==== アンタゴニスト ==== | ==== アンタゴニスト ==== | ||
薬理学的アプローチにより、選択性の高いサブユニット特異的アンタゴニストの開発が試みられてきた。GluK1選択的アンタゴニストとして、[[ | 薬理学的アプローチにより、選択性の高いサブユニット特異的アンタゴニストの開発が試みられてきた。GluK1選択的アンタゴニストとして、[[LY 382884]]が用いられてきたが、近年では、天然化合物である[[ウィラルジン]]の構造を基に合成された[[UBP310]]や[[ACET]]([[UBP316]])などのより特異性の高い薬剤が用いられている。UBPシリーズのアンタゴニストはGluK1に対して選択性があるが、UBP310は[[GluK3]]や[[GluK2]]/[[GluK5]]に対してもアンタゴニストとして作用することが報告されている。 | ||
== 生理的機能 == | == 生理的機能 == | ||
[[ファイル:Etsukosuzuki_Fig2.png|thumb|350px|'''図2.スライスパッチクランプ法を用いて記録した海馬CA3野苔状線維シナプスのAMPA型グルタミン酸受容体とカイニン酸受容体を介する二成分からなる興奮性シナプス後電流(EPSC)の例(未発表データ)'''<br>標準液中で記録したEPSCにはAMPA型グルタミン酸受容体を介する速い成分とカイニン酸受容体を介する遅い成分の両者が混在する。選択的なAMPA型グルタミン酸受容体アンタゴニスト(GYKI 53655、 30 | [[ファイル:Etsukosuzuki_Fig2.png|thumb|350px|'''図2.スライスパッチクランプ法を用いて記録した海馬CA3野苔状線維シナプスのAMPA型グルタミン酸受容体とカイニン酸受容体を介する二成分からなる興奮性シナプス後電流(EPSC)の例(未発表データ)'''<br>標準液中で記録したEPSCにはAMPA型グルタミン酸受容体を介する速い成分とカイニン酸受容体を介する遅い成分の両者が混在する。選択的なAMPA型グルタミン酸受容体アンタゴニスト(GYKI 53655、 30 μM)存在下で記録したカイニン酸受容体応答(赤トレース)を、標準液中で記録した波形(黒トレース)から減算し、AMPA型グルタミン酸受容体応答(青トレース)を抽出した。(GABA<sub>A</sub>受容体を介した応答が混入することを避けるため、塩化物イオンの平衡電位である-66.5 mVで応答を記録した。また、記録の最後にAMPA型グルタミン酸受容体およびカイニン酸受容体のアンタゴニストを投与すると応答がほぼ消失することから、この記録条件ではNMDA型グルタミン酸受容体の寄与は少ないと考えられる。)]] | ||
当初はAMPA型グルタミン酸受容体とカイニン酸受容体を区別するための選択的な薬剤が存在せず、中枢神経系におけるカイニン酸受容体の機能を研究することは難しかったが、[[wikipedia:GYKI53655| | 当初はAMPA型グルタミン酸受容体とカイニン酸受容体を区別するための選択的な薬剤が存在せず、中枢神経系におけるカイニン酸受容体の機能を研究することは難しかったが、[[wikipedia:GYKI53655|GYKI 53655]]などのAMPA型グルタミン酸受容体選択的なアンタゴニストの登場により、AMPA型グルタミン酸受容体を介した成分と分離することが可能となった<ref><pubmed> 7826635 </pubmed></ref>。 | ||
最初にカイニン酸受容体を介した興奮性シナプス後電流(EPSC)が薬理学的に分離されたのは、海馬CA3野の苔状線維シナプスであった<ref><pubmed> 9217159 </pubmed></ref>、<ref><pubmed> 9217158 </pubmed></ref>。カイニン酸受容体が介するシナプス応答は、海馬CA3野の同じ錐体細胞から得られるAMPA型グルタミン酸受容体を介するシナプス応答に比べてゆっくりとした時間経過を示す(図2)。カイニン酸受容体を介するシナプス応答のピーク振幅は、AMPA型グルタミン酸受容体を介するシナプス応答の~10 %程度と小さな割合だが、持続時間が長いため興奮性シナプス後電位(EPSP)の加重によるスパイク発生に寄与すると考えられている。また、[[GTP結合タンパク質]]を仲介する[[代謝型受容体]]の作用様式で、海馬CA1野の抑制性ニューロン終末からの[[GABA]]放出を抑制するという報告や<ref><pubmed> 9655508 </pubmed></ref>、[[遅い後過分極]](Slow after hyperpolarization: slow AHP)を抑制するという報告<ref><pubmed> 11931745 </pubmed></ref>もある。 | |||
カイニン酸受容体が[[シナプス前部]]に発現しており、[[神経伝達物質]]の放出を調節する作用を持つことが報告されている。[[シナプス前]] | カイニン酸受容体が[[シナプス前部]]に発現しており、[[神経伝達物質]]の放出を調節する作用を持つことが報告されている。[[シナプス前]]部でのカイニン酸受容体の機能的意義は、古くは海馬CA3野の遊離神経終末を用いた研究により示されてきた<ref><pubmed> 6287270 </pubmed></ref>。シナプス前部のカイニン酸受容体の作用の特徴として、投与するカイニン酸の濃度により双方向性に変化することが知られている。すなわち、低濃度のカイニン酸投与は神経伝達物質の放出を増大させるが、高濃度のカイニン酸投与は抑制することが海馬CA3野苔状線維シナプスなどで示されており、イオンチャンネル型のカイニン酸受容体がシナプス前部を[[脱分極]]させることで神経伝達物質放出を調節するというメカニズムが提唱されている<ref><pubmed> 10718745 </pubmed></ref>、<ref><pubmed> 11747895 </pubmed></ref>、<ref><pubmed> 11239159 </pubmed></ref>。 | ||
カイニン酸受容体を高密度に発現する海馬CA3野苔状線維シナプスでは、海馬の他のシナプスと違い、[[NMDA型グルタミン酸受容体]]の活性化を必要としないシナプス前性の[[長期増強]]が生じることから、カイニン酸受容体と海馬CA3野苔状線維シナプスの長期増強との関連が調べられている。[[ノックアウトマウス]] | カイニン酸受容体を高密度に発現する海馬CA3野苔状線維シナプスでは、海馬の他のシナプスと違い、[[NMDA型グルタミン酸受容体]]の活性化を必要としないシナプス前性の[[長期増強]]が生じることから、カイニン酸受容体と海馬CA3野苔状線維シナプスの長期増強との関連が調べられている。[[ノックアウトマウス]]を用いた研究では、GluK2をノックアウトすると海馬CA3野苔状線維シナプスの長期増強が抑制されるが、GluK1をノックアウトしても影響がない<ref><pubmed> 11182092 </pubmed></ref>。一方でGluK1のアンタゴニストを投与すると海馬CA3野苔状線維シナプスの[[長期増強]]が抑制されることが報告されており<ref><pubmed> 10580501 </pubmed></ref>、苔状線維長期増強に関与するカイニン酸受容体のサブユニットに関しては未だ議論の余地があるところである。 | ||
== 病態との関連 == | == 病態との関連 == | ||
==== てんかん ==== | ==== てんかん ==== | ||
[[wikipedia:ja:マウス|マウス]]ないし[[wikipedia:ja:ラット|ラット]]でのカイニン酸[[wikipedia:ja:腹腔|腹腔]]内投与は、発作性神経活動や[[wikipedia:ja:ヒト|ヒト]]の[[側頭葉てんかん]]で見られるような[[神経損傷]]パターンを引き起こすことから、実験的てんかんモデルとして広く用いられてきた。GluK2を欠損させたマウスでは、海馬CA3野錐体細胞のカイニン酸への感受性が低下しており、またカイニン酸投与を行ってもてんかん発作を生じない<ref><pubmed> 15509753 </pubmed></ref>。GluK1選択的アンタゴニストは、[[ムスカリン性アセチルコリン受容体]]アゴニストの[[wikipedia:ja:ピロカロピン|ピロカロピン]]投与や電気刺激によって引き起こされる海馬スライスでのてんかん様活動やin vivoでの発作性神経活動を抑える<ref><pubmed> 12080343 </pubmed></ref>。てんかん原生を獲得した海馬[[歯状回]]には異所性に苔状線維投射が生じるが、この異所性シナプスではカイニン酸受容体応答を生じるようになる<ref><pubmed> | [[wikipedia:ja:マウス|マウス]]ないし[[wikipedia:ja:ラット|ラット]]でのカイニン酸[[wikipedia:ja:腹腔|腹腔]]内投与は、発作性神経活動や[[wikipedia:ja:ヒト|ヒト]]の[[側頭葉てんかん]]で見られるような[[神経損傷]]パターンを引き起こすことから、実験的てんかんモデルとして広く用いられてきた。GluK2を欠損させたマウスでは、海馬CA3野錐体細胞のカイニン酸への感受性が低下しており、またカイニン酸投与を行ってもてんかん発作を生じない<ref><pubmed> 15509753 </pubmed></ref>。GluK1選択的アンタゴニストは、[[ムスカリン性アセチルコリン受容体]]アゴニストの[[wikipedia:ja:ピロカロピン|ピロカロピン]]投与や電気刺激によって引き起こされる海馬スライスでのてんかん様活動やin vivoでの発作性神経活動を抑える<ref><pubmed> 12080343 </pubmed></ref>。てんかん原生を獲得した海馬[[歯状回]]には異所性に苔状線維投射が生じるが、この異所性シナプスではカイニン酸受容体応答を生じるようになる<ref><pubmed> 16148230 </pubmed></ref>。 | ||
==== 慢性疼痛 ==== | ==== 慢性疼痛 ==== | ||
| 97行目: | 98行目: | ||
==== 片頭痛 ==== | ==== 片頭痛 ==== | ||
疼痛の研究は[[片頭痛]] | 疼痛の研究は[[片頭痛]]の[[動物モデル]]に適応されてきている<ref name=ref2 />。[[脳幹]][[三叉神経核]]尾側の神経細胞は、[[カプサイシン]]による[[髄膜]]への侵害刺激に反応して[[c-Fos]]が発現するが、[[スマトリプタン]]や[[ジヒドロエルゴタミン]]などの片頭痛に効果的な薬物の前処置によりc-Fosの発現は低下し、GluK1アンタゴニストも同様の効果を示すことが報告されている。 | ||
==関連項目== | ==関連項目== | ||
2015年9月2日 (水) 09:45時点における最新版
鈴木 江津子、神谷 温之
北海道大学 医学研究科神経生物学分野
DOI:10.14931/bsd.4040 原稿受付日:2013年7月30日 原稿完成日:2013年8月12日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:Kainate type glutamate receptor (kainate receptor) 英語略名:KAR
カイニン酸型グルタミン酸受容体(カイニン酸受容体)は、AMPA型グルタミン酸受容体、NMDA型グルタミン酸受容体に次ぐ第3のイオンチャンネル型グルタミン酸受容体である。AMPA型グルタミン酸受容体やNMDA型グルタミン酸受容体は中枢神経系の興奮性シナプスに広く分布するのに対し、カイニン酸受容体は海馬CA3野苔状線維シナプスなど特定のシナプスに局在する傾向がある。また、AMPA型グルタミン酸受容体やNMDA型グルタミン酸受容体は興奮性シナプス伝達に直接的に寄与するのに対し、カイニン酸受容体は神経細胞の興奮性やシナプス伝達の調節因子として機能することが多い。
構造
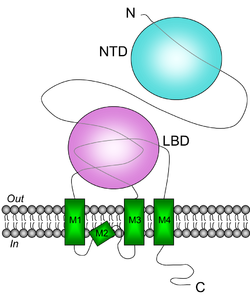
グルタミン酸はリガンド結合ドメインLBDに結合し、N末ドメインNTDはヘテロ4量体形成に関わる。([1]より改変)
カイニン酸受容体の分子構造は、他のイオンチャンネル型グルタミン酸受容体、中でも特にAMPA型グルタミン酸受容体と多くの共通点を有する[1]。アセチルコリン受容体、GABA受容体、グリシン受容体など他のイオンチャンネル型受容体が5つのサブユニットからなる5量体構造をとるのに対し、4量体構造の受容体チャンネルを構成すると考えられている。個々のサブユニットには4つの疎水性配列M1-4があり、そのうちM1、M3、M4は膜貫通ドメインを構成するが、M2は細胞膜を貫通せずヘアピンループ状に細胞内→細胞内へと折り返す[2]。また、N末ドメイン(N-terminal domain: NTD)を介したサブユニット間の相互作用を介してヘテロ4量体を構成すると考えられている[3]。リガンド結合ドメイン(ligand-binding domain: LBD)はM1よりN末とM3-M4間の2つの細胞外領域が関与する[4]。GluK1、GluK2がRNA編集によるイオン透過性の修飾を受け、これが発達依存的にコントロールされる点はAMPA型グルタミン酸受容体サブユニットGluA2と類似する。
サブユニット
GluK1-GluK5の5つのサブユニットが存在する。GluK1-GluK3の基本サブユニットと、高親和性サブユニットであるGluK4-GluK5の組み合わせで機能的な受容体が構成される。
カイニン酸受容体サブユニットは報告によりいくつかの呼称が併存し、それぞれの関連が分かりにくいなどの弊害が指摘されてきた。そこで、IUPHAR(The International Union of Basic and Clinical Pharmacology: 国際薬理学連合)の主導により呼称の統一が図られた。現在では、2009年に提案されたGluK1-GluK5の表記が広く用いられている[5]。これ以前は、GluR5-GluR7(GluK1-GluK3に相当)およびKA1-KA2(GluK4-GluK5に相当)という呼称が普及していた。以前の文献を参照する際には以下の新旧表記対照表を参照されたい。
| 分類 | サブユニット名 | ||||
| IUPHAR(現) | GluK1 | GluK2 | GluK3 | GluK4 | GluK5 |
| 遺伝子名 (HGNC) | GRIK1 | GRIK2 | GRIK3 | GRIK4 | GRIK5 |
| ラットcDNA(旧) | GluR5 | GluR6 | GluR7 | KA1 | KA2 |
| マウスcDNA | β2 | γ2 | |||
| ヒトcDNA | EAA3 | EAA4 | EAA5 | EAA1 | EAA2 |
([1]より改変)
修飾タンパク
他の神経伝達物質受容体タンパクと同じく、カイニン酸受容体も足場タンパクや副次的サブユニットとの相互作用により受容体輸送の制御を受けてシナプスやシナプス外に局在化し、また機能的修飾を受ける。カイニン酸受容体の局在と機能を制御する修飾タンパクとして初めて報告されたのが、興奮性シナプスのシナプス後肥厚の主要な構成タンパクであるPSD95(SAP90)である[6]。PSD95はGluK2と結合してクラスター形成を促し、脱感作を抑制する。その後、結合分子のスクリーニングから、いくつかの修飾タンパクが受容体輸送やチャンネルの性質を変化させることが報告されている。さらに、リン酸化、パルミトイル化、SUMO化などの翻訳後修飾もカイニン酸受容体の機能的多様性と特異的局在化に影響を与えることも見いだされている。
副次的サブユニットとして、Neto1、Neto2が同定されている。海馬CA3野苔状線維シナプスではNeto1はカイニン酸受容体の分布には影響しないが、カイニン酸受容体を介する遅い興奮性シナプス後電位の発生に必須であることが示されている[7]。
分布
カイニン酸受容体は中枢神経系に広く分布しているが、いくつかの脳領域で特に密に発現していることが報告されている。
海馬CA3野
錐体細胞にはGluK2、GluK4、GluK5が発現している。苔状線維にはGluK2とGluK3が発現している可能性が示唆されている。
抑制性ニューロン
海馬CA1野の抑制性ニューロンには、GluK1、GluK2とGluK5が発現している。
小脳
顆粒細胞では、GluK2とGluK5が、また培養した顆粒細胞にはGluK1とGluK2が見つかっている。プルキンエ細胞ではGluK1とGluK4が、また抑制性ニューロンにはGluK3が検出されている。
脊髄
| サブユニット名 | ||||
| GluK1 | GluK2 | GluK3 | GluK4 | GluK5 |
薬理学的特性
アゴニスト
カイニン酸は、海藻のマクリ(Digenea simplex、別名:カイニン草)から分離された天然化合物であり、AMPA型グルタミン酸受容体およびカイニン酸受容体のアゴニストとして作用する[8]。カイニン酸と類似した構造を持つ天然化合物であるドウモイ酸は、カイニン酸よりも強くカイニン酸受容体を活性化する。また、カイニン酸受容体のサブユニット特異的アゴニストとしていくつかの薬剤が合成された。このうち、GluK1選択的アゴニストとしてATPAが広く用いられている。
アンタゴニスト
薬理学的アプローチにより、選択性の高いサブユニット特異的アンタゴニストの開発が試みられてきた。GluK1選択的アンタゴニストとして、LY 382884が用いられてきたが、近年では、天然化合物であるウィラルジンの構造を基に合成されたUBP310やACET(UBP316)などのより特異性の高い薬剤が用いられている。UBPシリーズのアンタゴニストはGluK1に対して選択性があるが、UBP310はGluK3やGluK2/GluK5に対してもアンタゴニストとして作用することが報告されている。
生理的機能
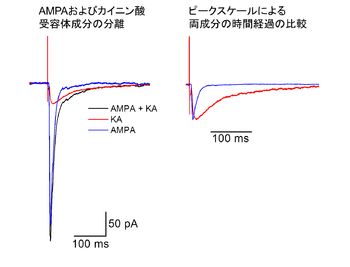
標準液中で記録したEPSCにはAMPA型グルタミン酸受容体を介する速い成分とカイニン酸受容体を介する遅い成分の両者が混在する。選択的なAMPA型グルタミン酸受容体アンタゴニスト(GYKI 53655、 30 μM)存在下で記録したカイニン酸受容体応答(赤トレース)を、標準液中で記録した波形(黒トレース)から減算し、AMPA型グルタミン酸受容体応答(青トレース)を抽出した。(GABAA受容体を介した応答が混入することを避けるため、塩化物イオンの平衡電位である-66.5 mVで応答を記録した。また、記録の最後にAMPA型グルタミン酸受容体およびカイニン酸受容体のアンタゴニストを投与すると応答がほぼ消失することから、この記録条件ではNMDA型グルタミン酸受容体の寄与は少ないと考えられる。)
当初はAMPA型グルタミン酸受容体とカイニン酸受容体を区別するための選択的な薬剤が存在せず、中枢神経系におけるカイニン酸受容体の機能を研究することは難しかったが、GYKI 53655などのAMPA型グルタミン酸受容体選択的なアンタゴニストの登場により、AMPA型グルタミン酸受容体を介した成分と分離することが可能となった[9]。
最初にカイニン酸受容体を介した興奮性シナプス後電流(EPSC)が薬理学的に分離されたのは、海馬CA3野の苔状線維シナプスであった[10]、[11]。カイニン酸受容体が介するシナプス応答は、海馬CA3野の同じ錐体細胞から得られるAMPA型グルタミン酸受容体を介するシナプス応答に比べてゆっくりとした時間経過を示す(図2)。カイニン酸受容体を介するシナプス応答のピーク振幅は、AMPA型グルタミン酸受容体を介するシナプス応答の~10 %程度と小さな割合だが、持続時間が長いため興奮性シナプス後電位(EPSP)の加重によるスパイク発生に寄与すると考えられている。また、GTP結合タンパク質を仲介する代謝型受容体の作用様式で、海馬CA1野の抑制性ニューロン終末からのGABA放出を抑制するという報告や[12]、遅い後過分極(Slow after hyperpolarization: slow AHP)を抑制するという報告[13]もある。
カイニン酸受容体がシナプス前部に発現しており、神経伝達物質の放出を調節する作用を持つことが報告されている。シナプス前部でのカイニン酸受容体の機能的意義は、古くは海馬CA3野の遊離神経終末を用いた研究により示されてきた[14]。シナプス前部のカイニン酸受容体の作用の特徴として、投与するカイニン酸の濃度により双方向性に変化することが知られている。すなわち、低濃度のカイニン酸投与は神経伝達物質の放出を増大させるが、高濃度のカイニン酸投与は抑制することが海馬CA3野苔状線維シナプスなどで示されており、イオンチャンネル型のカイニン酸受容体がシナプス前部を脱分極させることで神経伝達物質放出を調節するというメカニズムが提唱されている[15]、[16]、[17]。
カイニン酸受容体を高密度に発現する海馬CA3野苔状線維シナプスでは、海馬の他のシナプスと違い、NMDA型グルタミン酸受容体の活性化を必要としないシナプス前性の長期増強が生じることから、カイニン酸受容体と海馬CA3野苔状線維シナプスの長期増強との関連が調べられている。ノックアウトマウスを用いた研究では、GluK2をノックアウトすると海馬CA3野苔状線維シナプスの長期増強が抑制されるが、GluK1をノックアウトしても影響がない[18]。一方でGluK1のアンタゴニストを投与すると海馬CA3野苔状線維シナプスの長期増強が抑制されることが報告されており[19]、苔状線維長期増強に関与するカイニン酸受容体のサブユニットに関しては未だ議論の余地があるところである。
病態との関連
てんかん
マウスないしラットでのカイニン酸腹腔内投与は、発作性神経活動やヒトの側頭葉てんかんで見られるような神経損傷パターンを引き起こすことから、実験的てんかんモデルとして広く用いられてきた。GluK2を欠損させたマウスでは、海馬CA3野錐体細胞のカイニン酸への感受性が低下しており、またカイニン酸投与を行ってもてんかん発作を生じない[20]。GluK1選択的アンタゴニストは、ムスカリン性アセチルコリン受容体アゴニストのピロカロピン投与や電気刺激によって引き起こされる海馬スライスでのてんかん様活動やin vivoでの発作性神経活動を抑える[21]。てんかん原生を獲得した海馬歯状回には異所性に苔状線維投射が生じるが、この異所性シナプスではカイニン酸受容体応答を生じるようになる[22]。
慢性疼痛
カイニン酸受容体は脊髄の痛覚伝達路に選択的に発現し、その局在の特異性に基づいて痛覚制御のターゲットとして注目を集め、多くの生理学的な研究が行われてきた[23]。感覚神経の後根神経節では低濃度のカイニン酸によって脱分極が引き起こされる。また、その神経終末部のカイニン酸受容体が活性化すると、シナプス前部からの神経伝達物質の放出が抑制される。炎症性また神経障害性の慢性疼痛に対して、GluK1を含むカイニン酸受容体の抑制は鎮痛効果を示すことが報告されている。
片頭痛
疼痛の研究は片頭痛の動物モデルに適応されてきている[8]。脳幹三叉神経核尾側の神経細胞は、カプサイシンによる髄膜への侵害刺激に反応してc-Fosが発現するが、スマトリプタンやジヒドロエルゴタミンなどの片頭痛に効果的な薬物の前処置によりc-Fosの発現は低下し、GluK1アンタゴニストも同様の効果を示すことが報告されている。
関連項目
参考文献
- ↑ 1.0 1.1 1.2
Contractor, A., Mulle, C., & Swanson, G.T. (2011).
Kainate receptors coming of age: milestones of two decades of research. Trends in neurosciences, 34(3), 154-63. [PubMed:21256604] [PMC] [WorldCat] [DOI] - ↑
Wo, Z.G., & Oswald, R.E. (1994).
Transmembrane topology of two kainate receptor subunits revealed by N-glycosylation. Proceedings of the National Academy of Sciences of the United States of America, 91(15), 7154-8. [PubMed:8041762] [PMC] [WorldCat] [DOI] - ↑
Ayalon, G., & Stern-Bach, Y. (2001).
Functional assembly of AMPA and kainate receptors is mediated by several discrete protein-protein interactions. Neuron, 31(1), 103-13. [PubMed:11498054] [WorldCat] [DOI] - ↑
Mayer, M.L. (2005).
Crystal structures of the GluR5 and GluR6 ligand binding cores: molecular mechanisms underlying kainate receptor selectivity. Neuron, 45(4), 539-52. [PubMed:15721240] [WorldCat] [DOI] - ↑
Collingridge, G.L., Olsen, R.W., Peters, J., & Spedding, M. (2009).
A nomenclature for ligand-gated ion channels. Neuropharmacology, 56(1), 2-5. [PubMed:18655795] [PMC] [WorldCat] [DOI] - ↑
Garcia, E.P., Mehta, S., Blair, L.A., Wells, D.G., Shang, J., Fukushima, T., ..., & Marshall, J. (1998).
SAP90 binds and clusters kainate receptors causing incomplete desensitization. Neuron, 21(4), 727-39. [PubMed:9808460] [WorldCat] [DOI] - ↑
Straub, C., Hunt, D.L., Yamasaki, M., Kim, K.S., Watanabe, M., Castillo, P.E., & Tomita, S. (2011).
Distinct functions of kainate receptors in the brain are determined by the auxiliary subunit Neto1. Nature neuroscience, 14(7), 866-73. [PubMed:21623363] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1
Jane, D.E., Lodge, D., & Collingridge, G.L. (2009).
Kainate receptors: pharmacology, function and therapeutic potential. Neuropharmacology, 56(1), 90-113. [PubMed:18793656] [WorldCat] [DOI] - ↑
Paternain, A.V., Morales, M., & Lerma, J. (1995).
Selective antagonism of AMPA receptors unmasks kainate receptor-mediated responses in hippocampal neurons. Neuron, 14(1), 185-9. [PubMed:7826635] [WorldCat] [DOI] - ↑
Castillo, P.E., Malenka, R.C., & Nicoll, R.A. (1997).
Kainate receptors mediate a slow postsynaptic current in hippocampal CA3 neurons. Nature, 388(6638), 182-6. [PubMed:9217159] [WorldCat] [DOI] - ↑
Vignes, M., & Collingridge, G.L. (1997).
The synaptic activation of kainate receptors. Nature, 388(6638), 179-82. [PubMed:9217158] [WorldCat] [DOI] - ↑
Rodríguez-Moreno, A., & Lerma, J. (1998).
Kainate receptor modulation of GABA release involves a metabotropic function. Neuron, 20(6), 1211-8. [PubMed:9655508] [WorldCat] [DOI] - ↑
Melyan, Z., Wheal, H.V., & Lancaster, B. (2002).
Metabotropic-mediated kainate receptor regulation of IsAHP and excitability in pyramidal cells. Neuron, 34(1), 107-14. [PubMed:11931745] [WorldCat] [DOI] - ↑
Ferkany, J.W., Zaczek, R., & Coyle, J.T. (1982).
Kainic acid stimulates excitatory amino acid neurotransmitter release at presynaptic receptors. Nature, 298(5876), 757-9. [PubMed:6287270] [WorldCat] [DOI] - ↑
Kamiya, H., & Ozawa, S. (2000).
Kainate receptor-mediated presynaptic inhibition at the mouse hippocampal mossy fibre synapse. The Journal of physiology, 523 Pt 3, 653-65. [PubMed:10718745] [PMC] [WorldCat] [DOI] - ↑
Lauri, S.E., Delany, C., J Clarke, V.R., Bortolotto, Z.A., Ornstein, P.L., T R Isaac, J., & Collingridge, G.L. (2001).
Synaptic activation of a presynaptic kainate receptor facilitates AMPA receptor-mediated synaptic transmission at hippocampal mossy fibre synapses. Neuropharmacology, 41(8), 907-15. [PubMed:11747895] [WorldCat] [DOI] - ↑
Schmitz, D., Mellor, J., & Nicoll, R.A. (2001).
Presynaptic kainate receptor mediation of frequency facilitation at hippocampal mossy fiber synapses. Science (New York, N.Y.), 291(5510), 1972-6. [PubMed:11239159] [WorldCat] [DOI] - ↑
Contractor, A., Swanson, G., & Heinemann, S.F. (2001).
Kainate receptors are involved in short- and long-term plasticity at mossy fiber synapses in the hippocampus. Neuron, 29(1), 209-16. [PubMed:11182092] [WorldCat] [DOI] - ↑
Bortolotto, Z.A., Clarke, V.R., Delany, C.M., Parry, M.C., Smolders, I., Vignes, M., ..., & Collingridge, G.L. (1999).
Kainate receptors are involved in synaptic plasticity. Nature, 402(6759), 297-301. [PubMed:10580501] [WorldCat] [DOI] - ↑
Fisahn, A., Contractor, A., Traub, R.D., Buhl, E.H., Heinemann, S.F., & McBain, C.J. (2004).
Distinct roles for the kainate receptor subunits GluR5 and GluR6 in kainate-induced hippocampal gamma oscillations. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(43), 9658-68. [PubMed:15509753] [PMC] [WorldCat] [DOI] - ↑
Smolders, I., Bortolotto, Z.A., Clarke, V.R., Warre, R., Khan, G.M., O'Neill, M.J., ..., & Michotte, Y. (2002).
Antagonists of GLU(K5)-containing kainate receptors prevent pilocarpine-induced limbic seizures. Nature neuroscience, 5(8), 796-804. [PubMed:12080343] [WorldCat] [DOI] - ↑
Epsztein, J., Represa, A., Jorquera, I., Ben-Ari, Y., & Crépel, V. (2005).
Recurrent mossy fibers establish aberrant kainate receptor-operated synapses on granule cells from epileptic rats. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(36), 8229-39. [PubMed:16148230] [PMC] [WorldCat] [DOI] - ↑
Bhangoo, S.K., & Swanson, G.T. (2013).
Kainate receptor signaling in pain pathways. Molecular pharmacology, 83(2), 307-15. [PubMed:23095167] [PMC] [WorldCat] [DOI]