「S100タンパク質」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (4人の利用者による、間の14版が非表示) | |||
| 1行目: | 1行目: | ||
{{Pfam_box | {{Pfam_box | ||
| Symbol = S_100 | | Symbol = S_100 | ||
| 43行目: | 36行目: | ||
{{PDB3|2psr}} :6-46 {{PDB3|3psr}}A:6-46 | {{PDB3|2psr}} :6-46 {{PDB3|3psr}}A:6-46 | ||
}} | }} | ||
S100 蛋白質は、[[wikipedia:JA:EF-hand|EF-hand]]型[[カルシウム]]結合性ドメイン(loop-helix-loop)をもつ分子量が8~14kD程度の低分子量蛋白質群である。B.W. Mooreにより、1965年にウシ脳から分離された。現在までに20種類以上のサブファミリーが同定されている。S100という名称は「中性硫酸アンモニウムに完全に(100%)溶ける(Soluble)」という特性に由来している。分類として、現在のところS100A1~S100A18、S100B、S100P、S100Z、Calbindin D<sub>9k</sub> (S100G)、Profilaggrin、Trychohyalin、Repetinに分類される。S100Bは特に[[脳]]での発現が高いことで知られている。[[wikipedia:JA:哺乳類|哺乳類]]の[[中枢神経]]系では、[[グリア細胞]]の一種である[[アストロサイト]]に選択的に発現する。末梢神経系ではグリア細胞の[[シュワン細胞]]に発現する。S100蛋白質群の機能は、カルシウムバッファー以外にも多岐にまたがると考えられており、未解明な部分が多い。またS100蛋白質は細胞内のシグナル伝達のみならず、細胞外にも分泌される事が知られており、実際に[[wikipedia:JA:血漿|血漿]]や[[脳脊髄液]]からも検出される。培養細胞系では、細胞外のS100Bは神経細胞の生存にかかわる[[栄養因子]]として働くことが提唱されている。 | |||
S100 | |||
== 構造 == | == 構造 == | ||
S100蛋白質群は、モノマーとして二つのEF-hand型カルシウム結合ドメインを有する。この二つのカルシウム結合ドメインは、其々構造とカルシウム結合能が異なる。C端末側の12アミノ酸残基からなるリンカーループは[[カルモジュリン]]および[[トロポニン]]-C様のカルシウム結合を持ち、解離定数K<sub>d</sub>は10-50n程度であるとされている。一方、N端末側の14アミノ酸残基からなる疑似正準的なEF-handリンカーループはK<sub>d</sub>=200-500µM程度の比較的弱いカルシウム結合能を持つ。ほとんどのS100蛋白質は生体内では二つの同一ポリペプチドが非共有結合で結合されている二量体として存在する。 | |||
== サブタイプ == | ==サブタイプ== | ||
分類として、現在のところS100A1~S100A18、S100B、S100P、S100Z、Calbindin D9k (S100G)、Profilaggrin、Trychohyalin、Repetinに分類される... | |||
== 分布 == | == 分布 == | ||
S100蛋白質は、その種類により生体内での局在がある。例えばS100A1は[[wikipedia:JA:平滑筋|平滑筋]]の[[wikipedia:JA:細胞質|細胞質]]にある一方、100A2は平滑筋の[[wikipedia:JA:核内|核内]]に存在する。S100Pは[[wikipedia:JA:胎盤|胎盤]]の発現が高い。S100Bは脳での発現が顕著に認められ、中でもグリア細胞の一種であるアストロサイトに選択的に発現する。S100Bはアストロサイトにより分泌され、細胞外空間や血流に分散する。脳ダメージおよび炎症にて、血清中S100B濃度は高くなり、S100Bの血清濃度で神経疾患の一次的な診断材料となる。血清中S100B濃度は、[[てんかん]]および[[統合失調症]]患者では高くなる。また、S100B濃度の上昇は[[血液脳関門]]の損傷をも示唆し、診断ツールとしての有用性が広く認められている。 | |||
== 機能 == | == 機能 == | ||
S100蛋白質群の機能は、カルシウムホメオスタシス、蛋白質の[[リン酸化]]、細胞成長、細胞運動性、[[wikipedia:JA:細胞周期|細胞周期]]調節、[[wikipedia:JA:翻訳|翻訳]]、[[wikipedia:JA:細胞分化|細胞分化]]、細胞生存など、多様であると提案されている。また、様々な疾患に関係するとされており、[[wikipedia:JA:乳がん|乳がん]]や[[wikipedia:JA:メラノーマ|メラノーマ]]を含む様々の癌細胞に発現する。また、S100蛋白質は、[[wikipedia:JA:炎症|炎症]]マーカーとしても利用される。機能としては、[[p53]]や[[Tau蛋白質]]のリン酸化の阻害や、[[蛋白質リン酸化酵素]]活性の抑制が知られている。 | |||
S100Bは、[[神経突起]]および[[軸索]] | S100Bは、[[神経突起]]および[[軸索]]成長、メラノーマ癌細胞増殖、[[プロテインキナーゼ-C]]依存的なリン酸化、[[微小管]]の重合に関与しているとされている。また、培養細胞を使用した実験では、神経細胞生存に重要であるという報告もある一方、S100Bノックアウト動物の神経回路形成に重篤な欠損がないことから、栄養因子としての機能は限定的であるという可能性も否めない。細胞外空間でのS100Bの標的として、[[終末糖化産物受容体]](RAGE)が知られている。マウスを使用した実験で、S100Bの分泌は神経活動依存的に起こり、脳波活動に影響をもたらすことが報告されている。 | ||
== 参考文献 == | == 参考文献 == | ||
Wikipedia entry: [http://en.wikipedia.org/wiki/S-100_protein S100 protein], [http://en.wikipedia.org/wiki/S100B S100B] | |||
Santamaria-Kisiel L, Rintala-Dempsey AC, Shaw G. Calcium-dependent and -independent interactions of the S100 protein family. Biochem. J. 396:201-214 (2006) Donato R. Intracellular and extracellular roles of S100 proteins. Microscopy Res. Tech. 60:540-551 (2003). | |||
Sorci G, Bianchi R, Riuzzi F, Tubaro C, Arcuri C, Giambanco I, Donato R. S100B Protein, a damage-associated molecular pattern protein in the brain and heart, and beyond. Cardiovascular Psychiatry and Neurology. doi: 10.1155/2010/656481 | |||
(執筆者:平瀬肇 担当編集委員:柚崎通介) | |||
2012年3月5日 (月) 22:52時点における版
| S-100/ICaBP type calcium binding domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
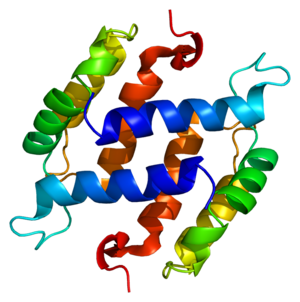 Structure of the S100B protein. Based on PyMOL rendering of PDB 1b4c. | |||||||||
| Identifiers | |||||||||
| Symbol | S_100 | ||||||||
| Pfam | PF01023 | ||||||||
| InterPro | IPR013787 | ||||||||
| PROSITE | PDOC00275 | ||||||||
| SCOP | 1cnp | ||||||||
| SUPERFAMILY | 1cnp | ||||||||
| |||||||||
S100 蛋白質は、EF-hand型カルシウム結合性ドメイン(loop-helix-loop)をもつ分子量が8~14kD程度の低分子量蛋白質群である。B.W. Mooreにより、1965年にウシ脳から分離された。現在までに20種類以上のサブファミリーが同定されている。S100という名称は「中性硫酸アンモニウムに完全に(100%)溶ける(Soluble)」という特性に由来している。分類として、現在のところS100A1~S100A18、S100B、S100P、S100Z、Calbindin D9k (S100G)、Profilaggrin、Trychohyalin、Repetinに分類される。S100Bは特に脳での発現が高いことで知られている。哺乳類の中枢神経系では、グリア細胞の一種であるアストロサイトに選択的に発現する。末梢神経系ではグリア細胞のシュワン細胞に発現する。S100蛋白質群の機能は、カルシウムバッファー以外にも多岐にまたがると考えられており、未解明な部分が多い。またS100蛋白質は細胞内のシグナル伝達のみならず、細胞外にも分泌される事が知られており、実際に血漿や脳脊髄液からも検出される。培養細胞系では、細胞外のS100Bは神経細胞の生存にかかわる栄養因子として働くことが提唱されている。
構造
S100蛋白質群は、モノマーとして二つのEF-hand型カルシウム結合ドメインを有する。この二つのカルシウム結合ドメインは、其々構造とカルシウム結合能が異なる。C端末側の12アミノ酸残基からなるリンカーループはカルモジュリンおよびトロポニン-C様のカルシウム結合を持ち、解離定数Kdは10-50n程度であるとされている。一方、N端末側の14アミノ酸残基からなる疑似正準的なEF-handリンカーループはKd=200-500µM程度の比較的弱いカルシウム結合能を持つ。ほとんどのS100蛋白質は生体内では二つの同一ポリペプチドが非共有結合で結合されている二量体として存在する。
サブタイプ
分類として、現在のところS100A1~S100A18、S100B、S100P、S100Z、Calbindin D9k (S100G)、Profilaggrin、Trychohyalin、Repetinに分類される...
分布
S100蛋白質は、その種類により生体内での局在がある。例えばS100A1は平滑筋の細胞質にある一方、100A2は平滑筋の核内に存在する。S100Pは胎盤の発現が高い。S100Bは脳での発現が顕著に認められ、中でもグリア細胞の一種であるアストロサイトに選択的に発現する。S100Bはアストロサイトにより分泌され、細胞外空間や血流に分散する。脳ダメージおよび炎症にて、血清中S100B濃度は高くなり、S100Bの血清濃度で神経疾患の一次的な診断材料となる。血清中S100B濃度は、てんかんおよび統合失調症患者では高くなる。また、S100B濃度の上昇は血液脳関門の損傷をも示唆し、診断ツールとしての有用性が広く認められている。
機能
S100蛋白質群の機能は、カルシウムホメオスタシス、蛋白質のリン酸化、細胞成長、細胞運動性、細胞周期調節、翻訳、細胞分化、細胞生存など、多様であると提案されている。また、様々な疾患に関係するとされており、乳がんやメラノーマを含む様々の癌細胞に発現する。また、S100蛋白質は、炎症マーカーとしても利用される。機能としては、p53やTau蛋白質のリン酸化の阻害や、蛋白質リン酸化酵素活性の抑制が知られている。
S100Bは、神経突起および軸索成長、メラノーマ癌細胞増殖、プロテインキナーゼ-C依存的なリン酸化、微小管の重合に関与しているとされている。また、培養細胞を使用した実験では、神経細胞生存に重要であるという報告もある一方、S100Bノックアウト動物の神経回路形成に重篤な欠損がないことから、栄養因子としての機能は限定的であるという可能性も否めない。細胞外空間でのS100Bの標的として、終末糖化産物受容体(RAGE)が知られている。マウスを使用した実験で、S100Bの分泌は神経活動依存的に起こり、脳波活動に影響をもたらすことが報告されている。
参考文献
Wikipedia entry: S100 protein, S100B
Santamaria-Kisiel L, Rintala-Dempsey AC, Shaw G. Calcium-dependent and -independent interactions of the S100 protein family. Biochem. J. 396:201-214 (2006) Donato R. Intracellular and extracellular roles of S100 proteins. Microscopy Res. Tech. 60:540-551 (2003).
Sorci G, Bianchi R, Riuzzi F, Tubaro C, Arcuri C, Giambanco I, Donato R. S100B Protein, a damage-associated molecular pattern protein in the brain and heart, and beyond. Cardiovascular Psychiatry and Neurology. doi: 10.1155/2010/656481
(執筆者:平瀬肇 担当編集委員:柚崎通介)