微小管
佐藤 啓介、寺田 純雄
東京医科歯科大学 医歯薬学総合研究科 神経機能形態学分野
DOI:10.14931/bsd.4389 原稿受付日:2013年10月31日 原稿完成日:2014年4月28日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名:microtubule 独:Mikrotubulus 仏:microtubule
微小管は、真核生物における主要な細胞骨格の一つである。チュブリンのヘテロダイマーを基本構成単位とする中空の円筒状線維で、外径は約25 nm。重合と脱重合を繰り返す非常に動的な構造物で、細胞の形態維持や変化、細胞分裂、細胞内物質輸送、鞭毛や繊毛の運動等の多様な細胞機能に重要な役割を果たしている。さまざまなタンパク質と結合したり、翻訳後修飾を受けたりすることにより、その構造や動態が調節され、多様な機能を発揮する。
構造

2種のチュブリンサブユニット、すなわちα-チュブリンとβ-チュブリンそれぞれ1分子ずつからなるヘテロダイマーが基本構成単位である。サブユニットが縦方向に連結しているダイマーを考えると、同種のサブユニット間で横方向に円を描くように、異種のサブユニット間で縦方向に直鎖状に結合することにより、円筒形を形成する。縦方向の直鎖はプロトフィラメントと呼ばれ、通常細胞内では1本の円筒は13本のプロトフィラメントからなり、外径は約25nmである。
チュブリンの横方向の結合は一定のずれを持っているため、円筒内では同種のサブユニットが螺旋状に並ぶことになる。13本のプロトフィラメントからなる微小管の場合、この螺旋を1周すると異種のサブユニットに行き着く。この境目はseamと呼ばれ、微小管上にseam lineとして観察される[1]。
動態
重合と脱重合
微小管のプロトフィラメントはαβヘテロダイマーが決まった方向性を持って重合してできているため、微小管は極性を持つ。βサブユニットが位置している末端の方が重合・脱重合の速度が大きく、プラス端と呼ばれる。反対側はマイナス端である。チュブリンはGTP結合型またはGDP結合型をとるGTPaseであり、βサブユニットに結合しているGTPは微小管に組み込まれるとじきに加水分解されGDPとなる。GDP結合型の末端は、GTP結合型の末端と比べて脱重合しやすい(チュブリン濃度が高くても脱重合してしまう)ため、微小管末端のチュブリンがGTP結合型かGDP結合型かは微小管の動態に重要である[2]。
微小管のプラス端は常に伸長と退縮を繰り返しており、伸長から短縮への相の変化をcatastrophe、短縮から伸長への変化をrescueという。この性質は動的不安定性(dynamic instability)と呼ばれ、微小管動態の重要な特徴である[3]。動的不安定性のおかげで、例えば細胞分裂時に染色体を微小管の先端で捉えることが可能になる。このように微小管の動態制御は生命現象に非常に重要であるため、catastropheとrescueは多くの微小管結合タンパク質により調節されている[4]。試験管内ではマイナス端も動的不安定性を示すが、細胞内では結合タンパク質により安定化されている[5]。
また、プラス端での重合とマイナス端での脱重合の速度が釣り合った場合、見かけ上繊維の長さが変わらずに微小管がプラス端方向に移動する。この状態をトレッドミリング (treadmilling)という。
微小管の新規形成
試験管内ではチュブリンを高濃度にすることにより、核となる微小管の無いところから重合が起こるが、細胞内のチュブリン濃度は低くそのような重合は起こらない。そこで、細胞内には微小管形成中心(microtubule organizing center; MTOC)という重合核が存在する。多くの細胞では中心体(centrosome)がMTOCとして働き、細胞の微小管ネットワークの中心となっている。繊毛や鞭毛では基底小体がMTOCとして働いている。
MTOCで直接的に微小管の重合開始を担うのはγ-チュブリンである[6]。γ-チュブリンは、γ-TuSCというタンパク質複合体を形成して機能する。酵母などではこれが実際の微小管重合核となる。一方、哺乳類を含む多くの真核生物では、γ-TuSCにさらに多くのタンパク質が加わったγ-TuRCを形成する。MTOC以外にも微小管の重合開始点が存在することが知られており、多くの場合、中心体と同様γ-チュブリンが重合開始を担っていると考えられている[7]。
翻訳後修飾
微小管はいくつか特徴的な翻訳後修飾を受ける。これらの修飾は、結合タンパク質やモータータンパク質の微小管に対する結合能を変化させるなどして、微小管の機能や安定性、構造に大きな影響を及ぼす[8]。
C末端の脱チロシン化および再チロシン化
α-チュブリンのC末端のチロシンは除去と付加を繰り返し受けている。神経系でみられるチロシンが除去された状態で起こる脱グルタミン酸(Δ2 チュブリンを生成する)は再チロシン化ができず不可逆的である。
グリシン化とグルタミン酸化
重合した状態のチュブリンのC末端付近に存在する複数のグルタミン酸残基はグリシンもしくはグルタミン酸の付加を受ける。グリシンやグルタミン酸は次々と付加されていき、ポリグリシンもしくはポリグルタミン酸の側鎖となる。
アセチル化
アセチル化は主に安定化した微小管に見出される。しかし、アセチル化により微小管構造が安定化されるわけではない。α-チュブリンのLys40が主要なアセチル化部位と考えられているが、他のアセチル化部位も同定されている。
結合タンパク質
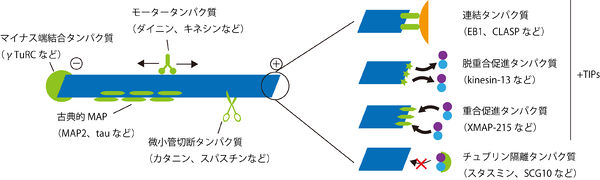
これまでに数多くの微小管に結合するタンパク質が発見されており、その機能は多岐にわたっている(図参照)。
古典的MAP(Microtubule Associating Protein)もしくは構造的MAPに属するタウやMAP2は微小管を安定化させることにより動態を変化させる[9][10]。なおMAP1A/Bの軽鎖サブユニットLC3はオートファゴソーム膜に局在する(オートファジーの項目参照)。
微小管のプラス端に結合するものは+TIPsと総称される[11]。+TIPsには、重合を促進するもの(例:XMAP215)、重合を阻害するもの(例:CLASP)、脱重合を促進するもの(例:キネシン-13)、膜や細胞骨格など他の構造と微小管との連結をするもの(例:EB1)等がある。
マイナス端に結合するタンパク質には、γ-チュブリンの他にnineinやNezha/Patroninなどがあり、脱重合を防いだり重合開始点を特定の部位に局在化したりしている[12][13]。
カタニンやスパスチンのように微小管を切断する微小管結合タンパク質もある[14]。
スタスミンやSCG10は重合していないチュブリンダイマーと結合し隔離することにより、微小管の脱重合を促進する[15]。
キネシンスーパーファミリー(Kinesin superfamily proteins: KIFs)は保存されたcore domainを持ち、ATPを消費して構造変化を起こす微小管結合タンパク質の一群である。その多くは微小管上をプラス端に向かって移動するモーターとして機能するが、前出したキネシン-13のように、微小管の脱重合を促進する働きを持つものも存在する。 ATPの水解サイクルにおいて、自身の構造変化に伴い、結合相手の微小管にもいわばアロステリックな構造変化を来すので、その構造変化の大小に応じてモーターとして機能したり、脱重合を促進したりすると考えることができる。詳しくはキネシンの項目を参照されたい。
ダイニン(Dynein)も同様にATPを消費するタンパク質複合体で、こちらはもっぱらモータータンパク質として働く。小胞輸送など細胞内での物質輸送や有糸分裂などに働く細胞質ダイニン1(cytoplasmic dynein 1)、鞭毛・繊毛内の逆行輸送に働く細胞質ダイニン2(cytoplasmic dynein 2)、そして繊毛や鞭毛の運動に関わる軸糸ダイニン(axonemal dynein)に分けられる。詳しくはダイニンの項目を参照されたい。
機能
微小管が形成する繊維は長くて硬いため、細胞の形を決める重要な因子となる他、以下に概説するように、細胞内物質輸送、有糸分裂、鞭毛や繊毛の運動において重要な役割を果たしている。
神経細胞内物質輸送
極性を持つ微小管線維をレールとして、積荷と結合したモータータンパク質が方向性を持って移動することにより、物質輸送が行われる。積荷はタンパク質、核酸、脂質(小胞やオルガネラ)など多岐に渡る。特に、神経細胞は特に長い突起を持っており、その中の物質の移動はモータータンパク質による微小管に沿った輸送に大きく依存している。突起内には微小管が密に配列され構造を保つ役割を担うと同時に、モータータンパク質を介して突起の先端にその形態変化・維持に必要な物質を輸送している。微小管の脱重合は突起の伸長を阻害し、後退を引き起こす。神経細胞内で行われる輸送の詳しい説明は 軸索輸送、小胞輸送等の項目を参照されたい。
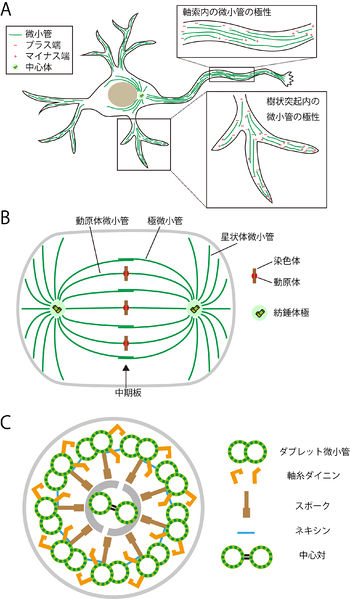
軸索と樹状突起における微小管
軸索内に存在する微小管は向きが揃っており、プラス端は先端に存在する[16](図A、拡大図上)。これは、プラス端に向かって動く微小管モーターであるキネシンによって、非常に長い突起の先端に効率よく物質を運ぶために有利だと考えられる。
伸長している軸索の細胞体に近い方に存在する微小管は安定で寿命が長く、脱チロシン化かつアセチル化されたチュブリンで構成されている。先端部に行くほど微小管はより動的で、チロシン化されているがアセチル化を受けていないチュブリンに富んでいる[17]。特に成長円錐(growth cone)では微小管は非常に動的で形態も複雑である[18]。
樹状突起では、近位部では異なる向きの微小管が混在し、総体としてみると極性の無い状態になっている。一方、遠位部では先端にプラス端を向けた極性を持っている[19](図A、拡大図下)。ショウジョウバエのニューロンでは、樹状突起の分岐点に存在するゴルジ体(Golgi outpostと呼ばれる)から微小管が伸長し、樹状突起の形態形成に重要な役割を果たしていることが明らかになっている[20]。哺乳類のニューロンにおいても樹状突起の分岐点にGolgi outpostが見つかっているが、そこから微小管の伸長が起こるかは検討されていない[21]。また、以前は樹状突起の棘突起(spine)には微小管は存在しないと考えられていたが、近年の研究で棘突起内に非常に動的な微小管が存在することが明らかになり、棘突起形成に関与していることが示されている。
前述したように、軸索と樹状突起では結合タンパク質の分布が異なり、例えばタウは軸索に、MAP2は樹状突起にほぼ特異的に存在している[22]。また、MAP1Aが成熟したニューロンに発現し、樹状突起に多く存在する一方で、MAP1Bは発生初期の段階で高発現し、伸長中の軸索、特に成長円錐に集積している[23]。これらのMAPsは、微小管の安定化や他のタンパク質との結合を調節することにより、微小管の機能を制御していると考えられる。
チュブリンの軸索輸送
発生過程における伸展途中の場合や傷害を受けて再生中など、特別な場合を除き、成熟した脊椎動物神経細胞の軸索にはタンパク質の合成を担う小胞体とリボソームが存在しないため、突起の先端で微小管が重合するためには、細胞体で新規に合成したチュブリンを先端まで運ぶ必要がある。チュブリンは一日当たりの移動速度が数mm以下の遅い軸索輸送で運ばれることが知られている。輸送の際は、チュブリンはサブユニットもしくは小さい重合体(オリゴマー)の状態でキネシンによって運ばれるとする説が有力であるが、異論も存在する[24][25]。輸送の速度がキネシンの移動速度と比べて遥かに遅いのは、チュブリンがモータータンパク質に結合したり解離したりしながら、軸索の先端に運ばれていくからであると推測されているが、その詳しいメカニズムは不明な点が多い。
また、細胞体の中心体から伸びる微小管がカタニンによって切断され、軸索へ運ばれる現象も観察されている。
有糸分裂
有糸分裂における染色体の配置や分離において、微小管と微小管結合タンパク質は中心的な役割を果たす。ステージごとの微小管の動態や働きを以下に述べる。
- 前中期
- 核膜の崩壊と核ラミナの消失が起こり、紡錘体極から伸びた微小管が動原体を介して染色体を補足する(動原体微小管)。紡錘体極から伸びる微小管には、動原体と結合せずに反対側の極からの微小管と逆並行に相互作用し、後期における紡錘体極の移動に関わるもの(極微小管)や、細胞表層に達して紡錘体と細胞分裂の軸の向きを合わせるのに働いているもの(星状体微小管)がある。
- 後期
- 後期促進複合体(anaphase promoting complex: APC)の活性化により、複製された染色体をつないでいたコヒーシンが分解され、染色体が紡錘体極に向かって引っ張られる。この染色体の移動は、動原体微小管がプラス端から短縮することにより行われる。さらに、双極性のキネシン-5が極微小管の重なり合った部分で働くことで、紡錘体極の間隔が広げられる。
- 終期
- 染色体が完全に分離し、核膜の再生と染色体の脱凝縮が起こる。収縮環が形成され、分裂溝ができ始める。逆並行に重なった極微小管はmidzoneに密集して存在し、分裂溝の陥入に必要な脂質膜を小胞輸送により供給するのに寄与している。
- 細胞質分裂
- 分裂溝の陥入が進行し、最終的にくびり切られる。間期微小管が再生する。
鞭毛・繊毛
細胞表面に存在する繊毛や鞭毛、一次繊毛の内部には微小管が通っており、軸糸を形成している。繊毛や鞭毛の軸糸は、2本のシングレット微小管(中心対小管)からなる中心対と、中心対を囲むように配置された9つのダブレット微小管からなる(図C)。各々のダブレット微小管は13本のプロトフィラメントからなるA管と10本のプロトフィラメントからなるB管でできている。中心対小管どうしは中心架橋で結ばれており、ダブレット微小管はネキシンという構造でお互いに架橋されている。一次繊毛の軸糸には中心対が存在しない。
ダブレット微小管には細胞質ダイニンとは異なるダイニン(軸糸ダイニン)が結合している。隣接するダブレット微小管の間を軸糸ダイニンが移動することによって生じる微小管の「滑り」が繊毛や鞭毛の波打ち運動を起こしていると考えられる[26]。
軸糸の微小管は基底小体を核として形成される。基底小体は中心小体と構造・機能的によく似ており、一次繊毛の基底小体は中心小体が基底小体に変化して形成される[27]。
疾患との関連
チュブリンの変異が原因となって起こる病気が多数報告されており、その症状は脳の発達や神経系の形態に異常を来すものがほとんどである[28]。
チュブリン遺伝子異常
TUBA1Aの変異では小頭症や滑脳症が引き起こされる。TUBB2Bの変異では小頭症や多小脳回症の報告がある。
脳梁や小脳の形成不全がTUBA1AとTUBB2Bの変異によって引き起こされる。
TUBB3は先天性外眼筋線維症(CFEOM3)の原因遺伝子として同定されている一方、CFEOM3の症状を呈さずに脳回の形成異常を引き起こす変異も見つかっている。
これまで同定されているチュブリンの変異の多くは、ヌクレオチドとの結合部位、長軸方向・側方向のチュブリン同士の結合部位、微小管結合タンパク質やモータータンパク質との結合部位などに見出されている[29]。
微小管結合タンパク質の異常
微小管結合や関連するタンパク質をコードする遺伝子が病気の原因遺伝子として同定された報告も多い[30]。
例えばダイニンに結合してその活性を制御するLIS1やLIS1結合タンパク質Doublecortinをコードする遺伝子が滑脳症の原因遺伝子として、また多くの中心体タンパク質をコードする遺伝子が小頭症の原因遺伝子として同定されている。
タウの異常な凝集はアルツハイマー型認知症や前頭側頭葉変性症などの神経変性疾患で観察され、タウオパチー(tauopathy)と総称されている。
関連項目
参考文献
- ↑
Kikkawa, M., Ishikawa, T., Nakata, T., Wakabayashi, T., & Hirokawa, N. (1994).
Direct visualization of the microtubule lattice seam both in vitro and in vivo. The Journal of cell biology, 127(6 Pt 2), 1965-71. [PubMed:7806574] [PMC] [WorldCat] [DOI] - ↑
Desai, A., & Mitchison, T.J. (1997).
Microtubule polymerization dynamics. Annual review of cell and developmental biology, 13, 83-117. [PubMed:9442869] [WorldCat] [DOI] - ↑
Mitchison, T., & Kirschner, M. (1984).
Dynamic instability of microtubule growth. Nature, 312(5991), 237-42. [PubMed:6504138] [WorldCat] [DOI] - ↑
van der Vaart, B., Akhmanova, A., & Straube, A. (2009).
Regulation of microtubule dynamic instability. Biochemical Society transactions, 37(Pt 5), 1007-13. [PubMed:19754441] [WorldCat] [DOI] - ↑
Akhmanova, A., & Steinmetz, M.O. (2008).
Tracking the ends: a dynamic protein network controls the fate of microtubule tips. Nature reviews. Molecular cell biology, 9(4), 309-22. [PubMed:18322465] [WorldCat] [DOI] - ↑
Kollman, J.M., Merdes, A., Mourey, L., & Agard, D.A. (2011).
Microtubule nucleation by γ-tubulin complexes. Nature reviews. Molecular cell biology, 12(11), 709-21. [PubMed:21993292] [WorldCat] [DOI] - ↑
Lüders, J., & Stearns, T. (2007).
Microtubule-organizing centres: a re-evaluation. Nature reviews. Molecular cell biology, 8(2), 161-7. [PubMed:17245416] [WorldCat] [DOI] - ↑
Janke, C., & Bulinski, J.C. (2011).
Post-translational regulation of the microtubule cytoskeleton: mechanisms and functions. Nature reviews. Molecular cell biology, 12(12), 773-86. [PubMed:22086369] [WorldCat] [DOI] - ↑
Halpain, S., & Dehmelt, L. (2006).
The MAP1 family of microtubule-associated proteins. Genome biology, 7(6), 224. [PubMed:16938900] [PMC] [WorldCat] [DOI] - ↑
Dehmelt, L., & Halpain, S. (2005).
The MAP2/Tau family of microtubule-associated proteins. Genome biology, 6(1), 204. [PubMed:15642108] [PMC] [WorldCat] [DOI] - ↑
Akhmanova, A., & Hoogenraad, C.C. (2005).
Microtubule plus-end-tracking proteins: mechanisms and functions. Current opinion in cell biology, 17(1), 47-54. [PubMed:15661518] [WorldCat] [DOI] - ↑
Tanaka, N., Meng, W., Nagae, S., & Takeichi, M. (2012).
Nezha/CAMSAP3 and CAMSAP2 cooperate in epithelial-specific organization of noncentrosomal microtubules. Proceedings of the National Academy of Sciences of the United States of America, 109(49), 20029-34. [PubMed:23169647] [PMC] [WorldCat] [DOI] - ↑
Goodwin, S.S., & Vale, R.D. (2010).
Patronin regulates the microtubule network by protecting microtubule minus ends. Cell, 143(2), 263-74. [PubMed:20946984] [PMC] [WorldCat] [DOI] - ↑
Roll-Mecak, A., & McNally, F.J. (2010).
Microtubule-severing enzymes. Current opinion in cell biology, 22(1), 96-103. [PubMed:19963362] [PMC] [WorldCat] [DOI] - ↑
Curmi, P.A., Gavet, O., Charbaut, E., Ozon, S., Lachkar-Colmerauer, S., Manceau, V., ..., & Sobel, A. (1999).
Stathmin and its phosphoprotein family: general properties, biochemical and functional interaction with tubulin. Cell structure and function, 24(5), 345-57. [PubMed:15216892] [WorldCat] [DOI] - ↑
Poulain, F.E., & Sobel, A. (2010).
The microtubule network and neuronal morphogenesis: Dynamic and coordinated orchestration through multiple players. Molecular and cellular neurosciences, 43(1), 15-32. [PubMed:19660553] [WorldCat] [DOI] - ↑
Janke, C., & Kneussel, M. (2010).
Tubulin post-translational modifications: encoding functions on the neuronal microtubule cytoskeleton. Trends in neurosciences, 33(8), 362-72. [PubMed:20541813] [WorldCat] [DOI] - ↑
Conde, C., & Cáceres, A. (2009).
Microtubule assembly, organization and dynamics in axons and dendrites. Nature reviews. Neuroscience, 10(5), 319-32. [PubMed:19377501] [WorldCat] [DOI] - ↑
Poulain, F.E., & Sobel, A. (2010).
The microtubule network and neuronal morphogenesis: Dynamic and coordinated orchestration through multiple players. Molecular and cellular neurosciences, 43(1), 15-32. [PubMed:19660553] [WorldCat] [DOI] - ↑
Ori-McKenney, K.M., Jan, L.Y., & Jan, Y.N. (2012).
Golgi outposts shape dendrite morphology by functioning as sites of acentrosomal microtubule nucleation in neurons. Neuron, 76(5), 921-30. [PubMed:23217741] [PMC] [WorldCat] [DOI] - ↑
Horton, A.C., Rácz, B., Monson, E.E., Lin, A.L., Weinberg, R.J., & Ehlers, M.D. (2005).
Polarized secretory trafficking directs cargo for asymmetric dendrite growth and morphogenesis. Neuron, 48(5), 757-71. [PubMed:16337914] [WorldCat] [DOI] - ↑
Dehmelt, L., & Halpain, S. (2005).
The MAP2/Tau family of microtubule-associated proteins. Genome biology, 6(1), 204. [PubMed:15642108] [PMC] [WorldCat] [DOI] - ↑
Halpain, S., & Dehmelt, L. (2006).
The MAP1 family of microtubule-associated proteins. Genome biology, 7(6), 224. [PubMed:16938900] [PMC] [WorldCat] [DOI] - ↑
Terada, S., Kinjo, M., & Hirokawa, N. (2000).
Oligomeric tubulin in large transporting complex is transported via kinesin in squid giant axons. Cell, 103(1), 141-55. [PubMed:11051554] [WorldCat] [DOI] - ↑
Shah, J.V., & Cleveland, D.W. (2002).
Slow axonal transport: fast motors in the slow lane. Current opinion in cell biology, 14(1), 58-62. [PubMed:11792545] [WorldCat] [DOI] - ↑
Lindemann, C.B., & Lesich, K.A. (2010).
Flagellar and ciliary beating: the proven and the possible. Journal of cell science, 123(Pt 4), 519-28. [PubMed:20145000] [WorldCat] [DOI] - ↑
Kobayashi, T., & Dynlacht, B.D. (2011).
Regulating the transition from centriole to basal body. The Journal of cell biology, 193(3), 435-44. [PubMed:21536747] [PMC] [WorldCat] [DOI] - ↑
Jaglin, X.H., & Chelly, J. (2009).
Tubulin-related cortical dysgeneses: microtubule dysfunction underlying neuronal migration defects. Trends in genetics : TIG, 25(12), 555-66. [PubMed:19864038] [WorldCat] [DOI] - ↑
Tischfield, M.A., Cederquist, G.Y., Gupta, M.L., & Engle, E.C. (2011).
Phenotypic spectrum of the tubulin-related disorders and functional implications of disease-causing mutations. Current opinion in genetics & development, 21(3), 286-94. [PubMed:21292473] [PMC] [WorldCat] [DOI] - ↑
Manzini, M.C., & Walsh, C.A. (2011).
What disorders of cortical development tell us about the cortex: one plus one does not always make two. Current opinion in genetics & development, 21(3), 333-9. [PubMed:21288712] [PMC] [WorldCat] [DOI]