「ガイドポスト細胞」の版間の差分
細編集の要約なし |
Takahikokawasaki (トーク | 投稿記録) 細 執筆中 |
||
| (3人の利用者による、間の20版が非表示) | |||
| 1行目: | 1行目: | ||
ガイドポスト細胞 | |||
英:guidepost | 英:guidepost cells | ||
同義語:道しるべ細胞、道標細胞、guidepost neurons、landmark cells | |||
ガイドポスト細胞とは、神経細胞の軸索伸長や移動の手助けとなる構造を提供する細胞のこと。 | |||
ガイドポスト細胞とは、神経細胞の軸索伸長や細胞移動をガイドする働きを持った細胞の総称である。典型的なガイドポスト細胞の場合、対象となる神経細胞の軸索伸長経路や移動経路上に前もって分布して、後からやってくる神経細胞や神経軸索の正常な移動をうながす。未成熟な神経細胞やグリア細胞を含むさまざまなタイプの細胞がガイドポスト細胞として機能する場合がある。各ガイドポスト細胞がどのような分子メカニズムを用いて神経細胞をガイドするかについては不明な場合が多いが、少なくとも一部のガイドポスト細胞は作用を及ぼす神経細胞との間に一過性の物理的接触をともなうことが報告されている。ガイドポスト細胞の多くは、神経回路の成熟にともなって細胞死したり、異なるタイプの細胞に分化したりしてしまう。 | |||
== | == ガイドポスト細胞の定義 == | ||
明確な定義はないが、以下のような特性を示す細胞をガイドポスト細胞と表現することが多い<ref name=ref6><pubmed> 17752851 </pubmed></ref>。 | |||
# | # ガイドする神経細胞の軸索投射経路や移動経路上に前もって分布する。 | ||
# | # ガイドする神経細胞や神経軸索と接触(または隣接)することで、細胞や軸索に対して移動の促進や停止、方向転換などのガイダンス作用を及ぼす。一過性のシナプス形成や物理的接触が確認されている場合もあるが、両者の隣接が観察された程度にとどまる場合もある。 | ||
# | # その細胞が欠失したり、その細胞が持つガイダンス機能が阻害されたりすると、対象となる神経細胞の軸索投射や細胞移動に異常が生じる。 | ||
# ガイドする神経細胞の最終的な軸索投射ターゲットではない。 | # ガイドする神経細胞の最終的な軸索投射ターゲットではない。 | ||
また、ガイドポスト細胞は何らかの特異的な分子マーカーを発現することが多く、それらの分子マーカーがガイドポスト細胞を発見する契機となったケースもある。 | |||
神経回路が作られる過程では、さまざまな細胞が「ガイドポスト細胞的」な役割を担っている。例えば、発生期の神経管の腹側正中部に形成されるシグナルセンターとして有名な[[フロアプレート]]は、脊髄の交連性ニューロンに対するガイドポスト細胞と考えることも可能である。しかし、フロアプレートの細胞はintermediate targetsと表現されることはあっても<ref><pubmed> 19300445 </pubmed></ref>、ガイドポスト細胞と表現されることはほとんどない。それゆえ、ガイドポスト細胞という表現を用いる時には、その細胞の特性だけでなく、慣習的な使用例にも注意が必要である。 | |||
== ガイドポスト細胞の発見 == | |||
[[image:ガイドポスト細胞_fig_1.png|400px|thumb|right|'''図1 バッタ胚の付属肢の模式図。左側が付属肢の先端。ガイドポスト細胞をピンク色で、Ti1神経細胞とその軸索を緑色で示した。胚の発生ステージは、孵化を100%として%で表記される。(A)正常な発生;31%ステージ胚では、Ti1が軸索を伸ばしはじめる。Fe1、Tr1、Cx1細胞は付属肢の特定の場所に飛び石状に分布する。35%ステージ胚では、Ti1の軸索がFe1、Tr1、Cx1細胞を経由して中枢神経系へ投射する。(B)Cx1細胞を除去した場合;放射線の照射でCx1細胞を除去しておくと、Ti1の神経軸索は正常な経路を伸長することが出来ず、枝分かれしたり迷走したりしてしまう<ref name=ref5 />。''']] | |||
ガイドポスト細胞としての特性を持った細胞は、トノサマバッタの付属肢を用いた研究で最初に報告された(図1)<ref name=ref6 />。発生中のバッタ胚の付属肢では、先端にTi1と呼ばれる感覚神経細胞が生じる。このTi1神経細胞は組織の中に最初に神経軸索を伸ばすパイオニアニューロンで、大きな屈曲を含む特定の経路を経由して中枢へと軸索を投射する<ref><pubmed> 1264194 </pubmed></ref>。この特徴的な軸索経路には、Ti1の軸索が伸長する前に、いくつかの抗体で選択的に識別される特殊な細胞が飛び石状に分布する。これらの細胞はそれぞれFe1、Tr1、Cx1と名付けられている。Ti1の軸索は点在するこれらの細胞と接触しつつ伸長し、最終的に中枢神経系へと投射する。放射線を照射してCx1細胞を取り除くと、Ti1の軸索は正常な経路を伸長できずに迷走してしまうことから、Cx1細胞はTi1の正常な軸索投射に必要であることが示された<ref name=ref5><pubmed> 6866090 </pubmed></ref>。これらの細胞は、軸索が伸長するための道しるべ(ガイドポスト)のように働くことから、ガイドポスト細胞という表現が用いられるようになった<ref name=ref6 />。 | |||
== 哺乳類におけるガイドポスト細胞 == | |||
哺乳類においても、神経回路が形成される過程でさまざまなガイドポスト細胞が働くことが知られている。以下に代表的な例を紹介する。 | |||
=== | === corridor cells === | ||
[[image:ガイドポスト細胞_fig_3.png|400px|thumb|right|'''図2 マウス胚の大脳皮質、基底核原基、視床を含んだ脳断面の模式図。上が背側、左が側方。LGEとLGEに由来するcorridor cellsなどの組織をピンク色で、MGEとMGEに由来する組織を水色で、大脳皮質へ投射する視床の神経細胞とその軸索を緑色で示した。(A)正常な発生;胎生12日目胚では、LGEに由来するcorridor cellsがMGEの特定の領域へ侵入して帯状に配列する。胎生15日目胚では、視床の神経軸索がcorridor cellsの配列に沿ってMGEを通過し、大脳皮質へと伸長する。(B)Mash-1を欠失したマウス胚;corridor cellsの配列がMGEに形成されず、視床の軸索はMGEを通過することが出来ない<ref name=ref4 />。''']] | |||
corridor cellsは、大脳皮質へ投射する背側視床(dorsal thalamus)の神経軸索が、途中の内側基底核原基(MGE: medial ganglionic eminence)を通過するための足場を提供するガイドポスト細胞である(図2)。MGEの中に視床の軸索が通過するための回廊(corridor)のように配列することから名付けられた。corridor cellsは外側基底核原基(LGE: lateral ganglionic eminence)に由来するGABA作動性の神経細胞である<ref name=ref4><pubmed> 16615895 </pubmed></ref>。 | |||
背側視床から大脳皮質へ投射する神経軸索は、途中のMGEを通過する際に特定の経路を伸長する。この経路には、視床の軸索が伸長する前に、近傍のLGEで生まれたcorridor cellsが移動してきて帯状に配列する。視床の軸索は軸索の束(内包:internal capsule)を作りながらcorridor cellsの配列に沿ってMGEを通過する<ref name=ref4 />。 | |||
= | 転写因子のMash1を欠失したマウス胚では、corridor cellsが消失し、視床の軸索はMGEを正常に通り抜けることができない。Mash1を欠失したマウス胚の脳組織片に正常なマウス胚のLGEを移植して培養すると、corridor cellsの配列が回復するとともに、視床の軸索がMGEを通り抜けるようになる。これらの結果は、corridor cellsの配列は視床軸索がMGEを通過するために必要かつ十分な要素であることを示している<ref name=ref4 />。また、corridor cellsは膜分子の[[ニューレグリン]]−1を発現し、視床の軸索はニューレグリン−1の受容体膜分子であるErbB4を発現する。ニューレグリン−1やErbB4を欠失したマウス胚では、corridor cellsの配列に大きな異常が認められないにもかかわらず、背側視床から皮質への軸索投射に大きな異常が生じることから、corridor cellsによる視床軸索のガイドにはニューレグリン−1とErbB4によるシグナルが関与している可能性が高い<ref name=ref4 />。 | ||
=== lot cells(lot細胞) === | |||
[[image:ガイドポスト細胞_fig_4.png|400px|thumb|right|'''図3 マウス胚の終脳を側面から見た模式図。脳の先端が左側。lot細胞をピンク色で、嗅球の投射神経細胞とその神経軸索を緑色で示した。(A)正常な発生;胎生12日目胚では、lot細胞が終脳の表層に弧を描くように帯状に分布する。胎生14日目胚では、帯状のlot細胞群の上を嗅球の神経軸索が伸長する。(B)lot細胞を除去した場合;破線で囲った領域のlot細胞を薬剤で除去すると、嗅球の神経軸索はlot細胞が失われた領域に侵入しなくなる。''']] | |||
lot細胞は発生期の終脳表層に帯状に配列し、嗅球の投射神経細胞の軸索伸長をガイドするガイドポスト細胞である(図3)<ref><pubmed> 12486929 </pubmed></ref>。lot細胞はmGluR1を認識するモノクローナル抗体による染色パターンを手掛かりとして、マウス初期胚の終脳で見つかった<ref name=ref1><pubmed> 9742149 </pubmed></ref><ref><pubmed> 22539416 </pubmed></ref>。lot細胞は終脳の背側領域で早い時期に誕生し終脳表層を接線方向へ移動する<ref><pubmed> 10908621 </pubmed></ref><ref name=ref2><pubmed> 16439477 </pubmed></ref><ref><pubmed> 18434520 </pubmed></ref>。このような発生様式に加えて、lot細胞は[[カハールレチウス細胞]]に特有なp73を発現することなどから、近年ではlot細胞をカハールレチウス細胞のサブグループに分類する考えもある<ref name=ref3><pubmed> 24403153 </pubmed></ref>。 | |||
嗅球の投射神経細胞は終脳表層の特定の領域に弧を描くように軸索を伸ばして軸索の束を作る。この軸索束が形成される領域には、軸索よりも先にlot細胞群が帯状に配列する。lot細胞の配列と嗅球の軸索伸長は、マウス胚から終脳だけを取り出して培養しても再現することが出来る<ref><pubmed> 8821172 </pubmed></ref>。薬剤を用いてlot細胞を部分的に除去した終脳を培養すると、嗅球の軸索はlot細胞が失われた領域に侵入しなくなる<ref name=ref1 />。また、Netrin-1/DCCシグナルを欠失したマウス胚ではlot細胞の配列が部分的に失われるが、このlot細胞を欠く領域には嗅球の軸索が侵入しない<ref name=ref2 />。さらに、転写因子のLhx2を欠失したマウス胚では、lot細胞の分布パターンと嗅球から終脳への軸索投射が大きく乱れる。正常なマウス胚の嗅球とLhx2を欠失したマウス胚の終脳を組み合わせて培養しても嗅球から終脳への軸索伸長は異常なままだが、Lhx2を欠失したマウス胚の嗅球と正常なマウス胚の終脳を組み合わせて培養すると、嗅球の軸索はlot細胞が配列した終脳の正しい場所を伸長する<ref><pubmed> 17329426 </pubmed></ref>。転写因子のNeurog1とNeurog2の両者を欠失したマウス胚では、lot細胞の数がいちじるしく現象し、嗅球から終脳への軸索投射も失われる<ref name=ref3 />。これらの結果は、lot細胞の配列が嗅球から終脳への正常な軸索投射に必要であることを示している。 | |||
=== glial sling === | |||
glial slingは発生期の終脳背側の正中部に分布し、大脳皮質の左右をつなぐ交連性神経細胞の軸索が正中部を通過するのをサポートするガイドポスト細胞である。 | |||
=== 視交叉のガイドポスト細胞 === | |||
左右の視神経軸索は間脳の腹側表層で交差して視交叉(chiasma)を形成する。視交叉が形成される領域には、視神経軸索よりも先に、膜分子のCD44を発現する神経細胞が逆V字を描くように配列し、視神経軸索の交差をうながす。CD44陽性細胞を欠失させると、視神経軸索は視交叉の入り口で停止してしまい、脳の反対側へ投射することができなくなる<ref><pubmed> 7514428 </pubmed></ref><ref><pubmed> 7541558 </pubmed></ref>。CD44陽性細胞に加えて、視交叉での視神経軸索のガイダンスには、Ephrin B2を発現する特殊なradial glia細胞も関与する。<ref><pubmed> 7751940 </pubmed></ref>。 | |||
・subplate neurons([[サブプレート]]):大脳皮質へ投射する視床の軸索は、皮質の深層に位置するサブプレートに到達した後、皮質の発生が進むまでの間、軸索の伸長を停止してサブプレート内に留まる(waiting period)。この視床の軸索停止にサブプレートの細胞が関与している。皮質が成熟すると、サブプレートの細胞は細胞死を引き起こして消失し、視床の軸索は皮質内へと投射する。 | |||
Ghosh et al., 1990; Ghosh and Shatz, 1992, 1993 | |||
・海馬におけるカハールレチウス細胞とGABA作動性神経細胞: | |||
==関連項目== | ==関連項目== | ||
*[[パイオニアニューロン]] | *[[パイオニアニューロン]] | ||
*[[ニューレグリン]] | *[[ニューレグリン]] | ||
*[[サブプレート]] | *[[サブプレート]] | ||
*[[ | *[[フロアプレート]] | ||
*[[カハールレチウス細胞]] | *[[カハールレチウス細胞]] | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2016年1月29日 (金) 16:05時点における版
ガイドポスト細胞
英:guidepost cells 同義語:道しるべ細胞、道標細胞、guidepost neurons、landmark cells
ガイドポスト細胞とは、神経細胞の軸索伸長や移動の手助けとなる構造を提供する細胞のこと。
ガイドポスト細胞とは、神経細胞の軸索伸長や細胞移動をガイドする働きを持った細胞の総称である。典型的なガイドポスト細胞の場合、対象となる神経細胞の軸索伸長経路や移動経路上に前もって分布して、後からやってくる神経細胞や神経軸索の正常な移動をうながす。未成熟な神経細胞やグリア細胞を含むさまざまなタイプの細胞がガイドポスト細胞として機能する場合がある。各ガイドポスト細胞がどのような分子メカニズムを用いて神経細胞をガイドするかについては不明な場合が多いが、少なくとも一部のガイドポスト細胞は作用を及ぼす神経細胞との間に一過性の物理的接触をともなうことが報告されている。ガイドポスト細胞の多くは、神経回路の成熟にともなって細胞死したり、異なるタイプの細胞に分化したりしてしまう。
ガイドポスト細胞の定義
明確な定義はないが、以下のような特性を示す細胞をガイドポスト細胞と表現することが多い[1]。
- ガイドする神経細胞の軸索投射経路や移動経路上に前もって分布する。
- ガイドする神経細胞や神経軸索と接触(または隣接)することで、細胞や軸索に対して移動の促進や停止、方向転換などのガイダンス作用を及ぼす。一過性のシナプス形成や物理的接触が確認されている場合もあるが、両者の隣接が観察された程度にとどまる場合もある。
- その細胞が欠失したり、その細胞が持つガイダンス機能が阻害されたりすると、対象となる神経細胞の軸索投射や細胞移動に異常が生じる。
- ガイドする神経細胞の最終的な軸索投射ターゲットではない。
また、ガイドポスト細胞は何らかの特異的な分子マーカーを発現することが多く、それらの分子マーカーがガイドポスト細胞を発見する契機となったケースもある。
神経回路が作られる過程では、さまざまな細胞が「ガイドポスト細胞的」な役割を担っている。例えば、発生期の神経管の腹側正中部に形成されるシグナルセンターとして有名なフロアプレートは、脊髄の交連性ニューロンに対するガイドポスト細胞と考えることも可能である。しかし、フロアプレートの細胞はintermediate targetsと表現されることはあっても[2]、ガイドポスト細胞と表現されることはほとんどない。それゆえ、ガイドポスト細胞という表現を用いる時には、その細胞の特性だけでなく、慣習的な使用例にも注意が必要である。
ガイドポスト細胞の発見
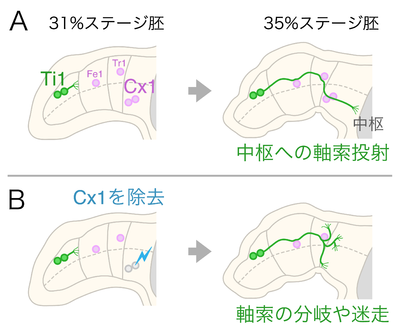
ガイドポスト細胞としての特性を持った細胞は、トノサマバッタの付属肢を用いた研究で最初に報告された(図1)[1]。発生中のバッタ胚の付属肢では、先端にTi1と呼ばれる感覚神経細胞が生じる。このTi1神経細胞は組織の中に最初に神経軸索を伸ばすパイオニアニューロンで、大きな屈曲を含む特定の経路を経由して中枢へと軸索を投射する[4]。この特徴的な軸索経路には、Ti1の軸索が伸長する前に、いくつかの抗体で選択的に識別される特殊な細胞が飛び石状に分布する。これらの細胞はそれぞれFe1、Tr1、Cx1と名付けられている。Ti1の軸索は点在するこれらの細胞と接触しつつ伸長し、最終的に中枢神経系へと投射する。放射線を照射してCx1細胞を取り除くと、Ti1の軸索は正常な経路を伸長できずに迷走してしまうことから、Cx1細胞はTi1の正常な軸索投射に必要であることが示された[3]。これらの細胞は、軸索が伸長するための道しるべ(ガイドポスト)のように働くことから、ガイドポスト細胞という表現が用いられるようになった[1]。
哺乳類におけるガイドポスト細胞
哺乳類においても、神経回路が形成される過程でさまざまなガイドポスト細胞が働くことが知られている。以下に代表的な例を紹介する。
corridor cells
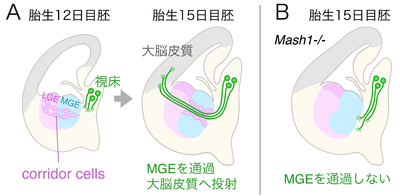
corridor cellsは、大脳皮質へ投射する背側視床(dorsal thalamus)の神経軸索が、途中の内側基底核原基(MGE: medial ganglionic eminence)を通過するための足場を提供するガイドポスト細胞である(図2)。MGEの中に視床の軸索が通過するための回廊(corridor)のように配列することから名付けられた。corridor cellsは外側基底核原基(LGE: lateral ganglionic eminence)に由来するGABA作動性の神経細胞である[5]。 背側視床から大脳皮質へ投射する神経軸索は、途中のMGEを通過する際に特定の経路を伸長する。この経路には、視床の軸索が伸長する前に、近傍のLGEで生まれたcorridor cellsが移動してきて帯状に配列する。視床の軸索は軸索の束(内包:internal capsule)を作りながらcorridor cellsの配列に沿ってMGEを通過する[5]。
転写因子のMash1を欠失したマウス胚では、corridor cellsが消失し、視床の軸索はMGEを正常に通り抜けることができない。Mash1を欠失したマウス胚の脳組織片に正常なマウス胚のLGEを移植して培養すると、corridor cellsの配列が回復するとともに、視床の軸索がMGEを通り抜けるようになる。これらの結果は、corridor cellsの配列は視床軸索がMGEを通過するために必要かつ十分な要素であることを示している[5]。また、corridor cellsは膜分子のニューレグリン−1を発現し、視床の軸索はニューレグリン−1の受容体膜分子であるErbB4を発現する。ニューレグリン−1やErbB4を欠失したマウス胚では、corridor cellsの配列に大きな異常が認められないにもかかわらず、背側視床から皮質への軸索投射に大きな異常が生じることから、corridor cellsによる視床軸索のガイドにはニューレグリン−1とErbB4によるシグナルが関与している可能性が高い[5]。
lot cells(lot細胞)
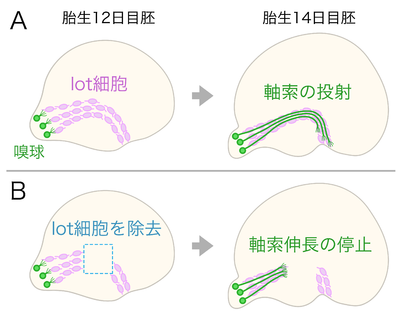
lot細胞は発生期の終脳表層に帯状に配列し、嗅球の投射神経細胞の軸索伸長をガイドするガイドポスト細胞である(図3)[6]。lot細胞はmGluR1を認識するモノクローナル抗体による染色パターンを手掛かりとして、マウス初期胚の終脳で見つかった[7][8]。lot細胞は終脳の背側領域で早い時期に誕生し終脳表層を接線方向へ移動する[9][10][11]。このような発生様式に加えて、lot細胞はカハールレチウス細胞に特有なp73を発現することなどから、近年ではlot細胞をカハールレチウス細胞のサブグループに分類する考えもある[12]。
嗅球の投射神経細胞は終脳表層の特定の領域に弧を描くように軸索を伸ばして軸索の束を作る。この軸索束が形成される領域には、軸索よりも先にlot細胞群が帯状に配列する。lot細胞の配列と嗅球の軸索伸長は、マウス胚から終脳だけを取り出して培養しても再現することが出来る[13]。薬剤を用いてlot細胞を部分的に除去した終脳を培養すると、嗅球の軸索はlot細胞が失われた領域に侵入しなくなる[7]。また、Netrin-1/DCCシグナルを欠失したマウス胚ではlot細胞の配列が部分的に失われるが、このlot細胞を欠く領域には嗅球の軸索が侵入しない[10]。さらに、転写因子のLhx2を欠失したマウス胚では、lot細胞の分布パターンと嗅球から終脳への軸索投射が大きく乱れる。正常なマウス胚の嗅球とLhx2を欠失したマウス胚の終脳を組み合わせて培養しても嗅球から終脳への軸索伸長は異常なままだが、Lhx2を欠失したマウス胚の嗅球と正常なマウス胚の終脳を組み合わせて培養すると、嗅球の軸索はlot細胞が配列した終脳の正しい場所を伸長する[14]。転写因子のNeurog1とNeurog2の両者を欠失したマウス胚では、lot細胞の数がいちじるしく現象し、嗅球から終脳への軸索投射も失われる[12]。これらの結果は、lot細胞の配列が嗅球から終脳への正常な軸索投射に必要であることを示している。
glial sling
glial slingは発生期の終脳背側の正中部に分布し、大脳皮質の左右をつなぐ交連性神経細胞の軸索が正中部を通過するのをサポートするガイドポスト細胞である。
視交叉のガイドポスト細胞
左右の視神経軸索は間脳の腹側表層で交差して視交叉(chiasma)を形成する。視交叉が形成される領域には、視神経軸索よりも先に、膜分子のCD44を発現する神経細胞が逆V字を描くように配列し、視神経軸索の交差をうながす。CD44陽性細胞を欠失させると、視神経軸索は視交叉の入り口で停止してしまい、脳の反対側へ投射することができなくなる[15][16]。CD44陽性細胞に加えて、視交叉での視神経軸索のガイダンスには、Ephrin B2を発現する特殊なradial glia細胞も関与する。[17]。
・subplate neurons(サブプレート):大脳皮質へ投射する視床の軸索は、皮質の深層に位置するサブプレートに到達した後、皮質の発生が進むまでの間、軸索の伸長を停止してサブプレート内に留まる(waiting period)。この視床の軸索停止にサブプレートの細胞が関与している。皮質が成熟すると、サブプレートの細胞は細胞死を引き起こして消失し、視床の軸索は皮質内へと投射する。
Ghosh et al., 1990; Ghosh and Shatz, 1992, 1993
・海馬におけるカハールレチウス細胞とGABA作動性神経細胞:
関連項目
参考文献
- ↑ 1.0 1.1 1.2
Bentley, D., & Keshishian, H. (1982).
Pathfinding by peripheral pioneer neurons in grasshoppers. Science (New York, N.Y.), 218(4577), 1082-8. [PubMed:17752851] [WorldCat] [DOI] - ↑
Chao, D.L., Ma, L., & Shen, K. (2009).
Transient cell-cell interactions in neural circuit formation. Nature reviews. Neuroscience, 10(4), 262-71. [PubMed:19300445] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1
Bentley, D., & Caudy, M. (1983).
Pioneer axons lose directed growth after selective killing of guidepost cells. Nature, 304(5921), 62-5. [PubMed:6866090] [WorldCat] [DOI] - ↑
Bate, C.M. (1976).
Pioneer neurones in an insect embryo. Nature, 260(5546), 54-6. [PubMed:1264194] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 5.3 5.4
López-Bendito, G., Cautinat, A., Sánchez, J.A., Bielle, F., Flames, N., Garratt, A.N., ..., & Garel, S. (2006).
Tangential neuronal migration controls axon guidance: a role for neuregulin-1 in thalamocortical axon navigation. Cell, 125(1), 127-42. [PubMed:16615895] [PMC] [WorldCat] [DOI] - ↑
Kawasaki, T., & Hirata, T. (2002).
[Development and migration of lot cell, the guidepost neuron of the lateral olfactory tract]. Tanpakushitsu kakusan koso. Protein, nucleic acid, enzyme, 47(15), 1989-93. [PubMed:12486929] [WorldCat] - ↑ 7.0 7.1
Sato, Y., Hirata, T., Ogawa, M., & Fujisawa, H. (1998).
Requirement for early-generated neurons recognized by monoclonal antibody lot1 in the formation of lateral olfactory tract. The Journal of neuroscience : the official journal of the Society for Neuroscience, 18(19), 7800-10. [PubMed:9742149] [PMC] [WorldCat] - ↑
Hirata, T., Kumada, T., Kawasaki, T., Furukawa, T., Aiba, A., Conquet, F., ..., & Fukuda, A. (2012).
Guidepost neurons for the lateral olfactory tract: expression of metabotropic glutamate receptor 1 and innervation by glutamatergic olfactory bulb axons. Developmental neurobiology, 72(12), 1559-76. [PubMed:22539416] [WorldCat] [DOI] - ↑
Tomioka, N., Osumi, N., Sato, Y., Inoue, T., Nakamura, S., Fujisawa, H., & Hirata, T. (2000).
Neocortical origin and tangential migration of guidepost neurons in the lateral olfactory tract. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(15), 5802-12. [PubMed:10908621] [PMC] [WorldCat] - ↑ 10.0 10.1
Kawasaki, T., Ito, K., & Hirata, T. (2006).
Netrin 1 regulates ventral tangential migration of guidepost neurons in the lateral olfactory tract. Development (Cambridge, England), 133(5), 845-53. [PubMed:16439477] [WorldCat] [DOI] - ↑
Ito, K., Kawasaki, T., Takashima, S., Matsuda, I., Aiba, A., & Hirata, T. (2008).
Semaphorin 3F confines ventral tangential migration of lateral olfactory tract neurons onto the telencephalon surface. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(17), 4414-22. [PubMed:18434520] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1
Dixit, R., Wilkinson, G., Cancino, G.I., Shaker, T., Adnani, L., Li, S., ..., & Schuurmans, C. (2014).
Neurog1 and Neurog2 control two waves of neuronal differentiation in the piriform cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 34(2), 539-53. [PubMed:24403153] [PMC] [WorldCat] [DOI] - ↑
Sugisaki, N., Hirata, T., Naruse, I., Kawakami, A., Kitsukawa, T., & Fujisawa, H. (1996).
Positional cues that are strictly localized in the telencephalon induce preferential growth of mitral cell axons. Journal of neurobiology, 29(2), 127-37. [PubMed:8821172] [WorldCat] [DOI] - ↑
Saha, B., Hari, P., Huilgol, D., & Tole, S. (2007).
Dual role for LIM-homeodomain gene Lhx2 in the formation of the lateral olfactory tract. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(9), 2290-7. [PubMed:17329426] [PMC] [WorldCat] [DOI] - ↑
Sretavan, D.W., Feng, L., Puré, E., & Reichardt, L.F. (1994).
Embryonic neurons of the developing optic chiasm express L1 and CD44, cell surface molecules with opposing effects on retinal axon growth. Neuron, 12(5), 957-75. [PubMed:7514428] [PMC] [WorldCat] [DOI] - ↑
Sretavan, D.W., Puré, E., Siegel, M.W., & Reichardt, L.F. (1995).
Disruption of retinal axon ingrowth by ablation of embryonic mouse optic chiasm neurons. Science (New York, N.Y.), 269(5220), 98-101. [PubMed:7541558] [WorldCat] [DOI] - ↑
Marcus, R.C., Blazeski, R., Godement, P., & Mason, C.A. (1995).
Retinal axon divergence in the optic chiasm: uncrossed axons diverge from crossed axons within a midline glial specialization. The Journal of neuroscience : the official journal of the Society for Neuroscience, 15(5 Pt 2), 3716-29. [PubMed:7751940] [WorldCat]