ガイドポスト細胞
川崎 能彦
国立遺伝学研究所
DOI:10.14931/bsd.3848 原稿受付日:2016年2月2日 原稿完成日:2019年8月26日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
英:guidepost cells 独:Wegweiserzelle
同義語:道しるべ細胞、道標細胞、guidepost neurons、landmark cells
ガイドポスト細胞とは、神経細胞の軸索伸長や細胞移動をガイドする働きを持った細胞の総称である。典型的なガイドポスト細胞の場合、ガイドする神経細胞の軸索伸長経路や移動経路上に前もって分布して、後からやってくる神経細胞や神経軸索の正常な移動をうながす。未成熟な神経細胞やグリア細胞を含むさまざまなタイプの細胞がガイドポスト細胞として機能する場合がある。各ガイドポスト細胞がどのような分子メカニズムを用いて神経細胞をガイドするかについては不明な場合が多いが、少なくとも一部のガイドポスト細胞は作用を及ぼす神経細胞との間に一過性の物理的接触をともなうことが報告されている。ガイドポスト細胞の多くは、神経回路の成熟にともなって細胞死したり、異なるタイプの細胞に分化したりしてしまう。
定義
ガイドポスト細胞は、神経細胞の軸索伸長や移動の手助けとなる構造を提供する細胞である。明確な定義はないが、以下のような特性を示す細胞をガイドポスト細胞と表現することが多い[1]。
- ガイドする神経細胞の軸索伸長経路や移動経路上に前もって分布する。
- ガイドする神経細胞や神経軸索と接触(または隣接)することで、細胞や軸索に対して移動の促進や停止、方向転換などの作用を引き起こす。ガイドする神経細胞との間に一過性のシナプス形成や物理的接触が確認されている場合もあるが、両者の隣接が観察された程度にとどまる場合もある。
- その細胞が欠失したり、その細胞が持つガイダンス機能が阻害されたりすると、ガイドする神経細胞の軸索投射や細胞移動に異常が生じる。
- ガイドする神経細胞の最終的な軸索投射ターゲットではない。
ガイドポスト細胞は何らかの特異的な分子マーカーを発現することがあり、それら分子マーカーの局在性がガイドポスト細胞発見の契機となったケースもある。
神経回路が作られる過程では、さまざまな細胞が「ガイドポスト細胞的」な役割を担っている。例えば、発生期の神経管の腹側正中部に形成されるシグナルセンターとして有名な底板(フロアプレート)は、脊髄の交連性神経細胞に対するガイドポスト細胞と考えることも可能である。しかし、フロアプレートの細胞はintermediate targetsと表現されることはあっても[2]、ガイドポスト細胞と表現されることはほとんどない。このように、ガイドポスト細胞という表現を用いる時には、その細胞の特性だけでなく、慣習的な使用例にも注意が必要である。
発見
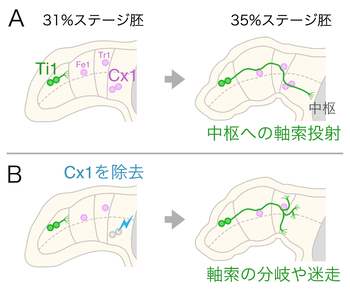
左が付属肢の先端。ガイドポスト細胞をピンク色で、Ti1神経細胞とその軸索を緑色で示した。バッタ胚は、孵化を100%として%で発生ステージが表記される。
(A)正常な発生;31%ステージ胚では、Ti1が軸索を伸ばしはじめる。ガイドポスト細胞のFe1、Tr1、Cx1は付属肢の特定の場所に飛び石状に分布する。35%ステージ胚になると、Ti1の軸索はガイドポスト細胞を経由して中枢神経系へ投射する。
(B)Cx1細胞を除去した場合;短波長の強い光を局所的に照射してCx1細胞を取り除いておくと、Ti1の神経軸索は正常な経路を伸長することが出来ず、枝分かれしたり迷走したりしてしまう[3]。
ガイドポスト細胞としての特性を持った細胞は、トノサマバッタの付属肢を用いた研究で最初に報告された(図1)[1]。発生中のバッタ胚の付属肢では、先端にTi1と呼ばれる感覚神経細胞が生じる。このTi1神経細胞は組織の中に最初に神経軸索を伸ばすパイオニアニューロンで、大きな屈曲を含む特定の経路を経由して中枢へと軸索を投射する[4]。この特徴的な軸索経路には、Ti1の軸索が伸長する前に、いくつかの抗体で選択的に識別される特殊な細胞が飛び石状に分布する。これらの細胞はそれぞれFe1、Tr1、Cx1と名付けられている。
Ti1の軸索は点在するこれらの細胞に次々と接触しつつ伸長し、最終的に正中領域の中枢神経系へと投射する。短波長の強い光を照射してCx1細胞を取り除いておくと、Ti1の軸索は正常な経路を伸長せずに付属肢の中を迷走してしまうことから、Cx1細胞はTi1の正常な軸索投射に必要であることが示された[3]。これらの細胞は、まるで軸索が伸長するための道しるべ(ガイドポスト)のように働くことから、ガイドポスト細胞という表現が用いられるようになった[1]。
哺乳類の神経系におけるガイドポスト細胞
哺乳類においても、神経回路が形成される過程でさまざまなガイドポスト細胞が働くことが知られている。以下にガイドポスト細胞が関与する神経回路形成について代表的な例を紹介する。
視床皮質投射経路
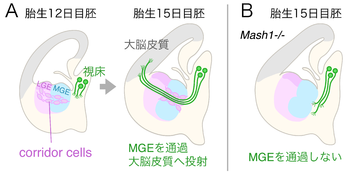
上が背側、左が側方。外側基底核原基とcorridor cellsなどの外側基底核原基に由来する組織をピンク色で、内側基底核原基と内側基底核原基に由来する組織を水色で、大脳皮質へ投射する視床の神経細胞とその軸索を緑色で示した。
(A)正常な発生;胎生12日目胚では、外側基底核原基に由来するcorridor cellsが内側基底核原基の特定の領域へ侵入して帯状に配列する。胎生15日目胚になると、視床の神経軸索がcorridor cellsの配列に沿って内側基底核原基を通過し、大脳皮質へと伸長する。
(B)Mash-1を欠失したマウス胚;corridor cellsの配列が内側基底核原基に形成されず、視床の軸索は内側基底核原基を通過することが出来ない[5]。
大脳皮質へ投射する背側視床(dorsal thalamus)の神経軸索が、途中の内側基底核原基(MGE: medial ganglionic eminence)を通過する際に、corridor cellsと呼ばれるガイドポスト細胞が関与する(図2)。
内側基底核原基の中に視床の軸索が通過するための回廊(corridor)のように配列することから名付けられた[5]。corridor cellsは外側基底核原基(LGE: lateral ganglionic eminence)に由来するGABA作動性の神経細胞である[5]。背側視床から大脳皮質へ投射する視床皮質路(thalamocortical projection)の神経軸索は、途中の内側基底核原基を通過する際に特定の経路を伸長する。この経路には、視床の軸索が侵入する前に、近傍の外側基底核原基で生まれたcorridor cellsが移動してきて帯状に配列する。視床の軸索は軸索の束(内包:internal capsule)を作りながらcorridor cellsの配列に沿って内側基底核原基を通過する[5][6]。
転写因子のMash1を欠失したマウス胚では、corridor cellsが消失し、視床の軸索は内側基底核原基を正常に通り抜けることができない。Mash1を欠失したマウス胚の脳組織片に正常なマウス胚の外側基底核原基を移植して培養すると、corridor cellsの配列が回復するとともに、視床の軸索が内側基底核原基を通り抜けるようになる。これらの結果は、corridor cellsが内包を形成する視床軸索のガイドポスト細胞であり、corridor cellsの配列が視床軸索の内側基底核原基の通過に必要な要素であることを示している[5]。
corridor cellsは膜分子のニューレグリン-1を発現し、視床の軸索はニューレグリン-1の受容体膜分子であるErbB4を発現する。ニューレグリン-1やErbB4を欠失したマウス胚では、corridor cellsの配列に大きな異常が認められないにもかかわらず、背側視床から皮質への軸索投射に大きな異常が生じることから、corridor cellsによる視床軸索のガイドにはニューレグリン-1/ErbB4シグナルが関与している可能性が高い[5]。
嗅球軸索
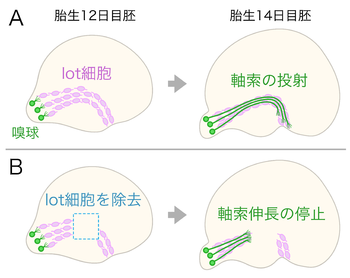
lot細胞をピンク色で、嗅球の投射神経細胞とその軸索を緑色で示した。
(A)正常な発生;胎生12日目胚では、lot細胞が終脳の表層に弧を描くように帯状に分布する。胎生14日目胚になると、lot細胞の配列の上を嗅球の神経軸索が伸長する。
(B)lot細胞を除去した場合;破線で囲った領域のlot細胞を薬剤で除去しておくと、嗅球の神経軸索はlot細胞が失われた領域に侵入しなくなる[7]。
嗅球の投射神経細胞が終脳表層に軸索を伸長する際に、足場として機能するガイドポスト細胞がlot細胞(lot cells)である(図3)[8]。
lot細胞は代謝活性型グルタミン酸受容体1 (mGluR1)を認識するモノクローナル抗体による染色パターンを手掛かりとして、マウス初期胚の終脳で見つかった[7][9]。lot細胞は終脳の背側領域で早い時期に誕生し終脳表層を腹側接線方向へ移動する[10][11][12]。このような発生様式に加えて、lot細胞はカハールレチウス細胞に特有なp73を発現することや、細胞運命を追跡した研究などから、近年ではlot細胞をカハールレチウス細胞のサブグループとする考えもある[13][14]。嗅球の投射神経細胞は終脳表層の特定の領域に弧を描くように軸索を伸長する。この経路には、嗅球の軸索が伸長するよりも前にlot細胞が移動してきて帯状に配列する。嗅球の軸索は軸索の束(外側嗅索:lateral olfactory tract)を作りながらlot細胞の配列に沿って終脳表層を伸長する[7]。
lot細胞の配列と嗅球軸索による軸索束の形成は、マウス胚から終脳を取り出して培養しても再現することが出来る[15][7]。その際、薬剤を用いてlot細胞を部分的に除去した終脳を培養すると、嗅球の軸索はlot細胞が失われた領域に侵入しなくなる[7]。また、軸索ガイダンスシグナルとして有名なネトリン-1/DCCシグナルを欠失したマウス胚ではlot細胞の配列が部分的に失われるが、このlot細胞を欠く領域には嗅球の軸索が侵入しない[11]。同様に、転写因子のLhx2を欠失したマウス胚では、lot細胞の分布パターンと嗅球から終脳への軸索投射が大きく乱れる。正常なマウス胚の嗅球とLhx2を欠失したマウス胚の終脳を組み合わせて培養しても嗅球から終脳への軸索伸長は異常なままだが、Lhx2を欠失したマウス胚の嗅球と正常なマウス胚の終脳を組み合わせて培養すると、嗅球の軸索はlot細胞が配列した終脳の正しい場所を伸長する[16]。転写因子のNeurog1とNeurog2を両方欠失したマウス胚では、lot細胞の数が著しく減少するとともに、嗅球から終脳への軸索投射も失われる[13]。これらの結果は、lot細胞が外側嗅索を形成する嗅球軸索のガイドポスト細胞であり、lot細胞の配列が嗅球から終脳への正常な軸索投射に必要であることを示している。
脳梁
大脳皮質の左右をつなぐ交連性神経細胞の軸索は、終脳背側正中部の特定の領域を軸索の束(脳梁:corpus callosum)を形成しながら通過する。脳梁ができる領域には、交連性神経細胞の軸索が通過するよりも前に、近隣の大脳皮質の脳室下帯(subventricular zone)で生じた神経細胞が正中部を左右に貫くように帯状に配列してglial slingと呼ばれる構造を形成する。その後、交連性神経細胞の軸索はglial slingに沿って脳の正中部を通過し、反対側の大脳皮質へと投射する[17]。glial slingの構造は生後しばらくすると消失する。
転写因子のNfiaを欠失したマウス胚では、glial slingを形成するはずの神経細胞が終脳背側正中領域ではなく中隔野(septum)へと異所的に移動してしまうため、正常なglial slingが形成されず、脳梁も形成されない[18]。この結果は、glial slingを形成する神経細胞が脳梁を形成する交連性神経細胞のガイドポスト細胞である可能性を強く示唆している。
視交叉
左右の網膜から伸び出した視神経軸索は、間脳の腹側表層の特定の領域で交差して視交叉(chiasma)を形成する。マウス胚を用いた研究から、視交叉の形成にはCD44陽性細胞と、放射状グリア細胞の2種類の細胞がガイドポスト細胞として関与する可能性が報告されている。
視交叉が形成される領域には、視神経軸索が伸びてくる前に、膜分子のCD44を発現する神経細胞が逆V字を描くように配列する。抗体反応を利用してCD44陽性細胞を欠失させたマウス胚では、視神経軸索は視交叉で交差する前に停止してしまい、脳の反対側へと伸長することができなくなる。これらの結果は、CD44陽性細胞は視神経軸索が視交叉で交差することをサポートするガイドポスト細胞である可能性を強く示唆している[19][20]。
マウスの視神経軸索の一部は視交叉で交差せずに同側の脳へと投射する。これら同側の脳へと投射する視神経軸索は受容体型膜分子であるEphB1を発現するが、間脳の視交叉近傍の放射状グリア細胞(radial glia cells)は視交叉の形成時期に一過的にEphB1のリガンド分子であるEphrin-B2を発現する。それゆえEprin-B2/EphB1シグナルを受けた視神経軸索が視交叉の手前で反転して同側の脳へと投射するようガイドされている可能性がある。実際にEphB1を欠失したマウス胚では同側の脳へと投射する視神経軸索の量が減少することから、視交叉近傍の放射状グリア細胞は一部の視神経軸索に対して視交叉を交差しないように働きかけるガイドポスト細胞である可能性が高い[21][22]。
大脳皮質へ投射する視床軸索
大脳皮質が形成される過程で皮質板(cortical plate)の深層側に位置するサブプレート(subplate)には、発生の早い時期に誕生する神経細胞が一過的に分布する。これらサブプレートの神経細胞は視床から伸長してきた神経軸索に対して、皮質板への投射を一時的に待機(waiting period)させるように働くことが報告されている。
前述したように、大脳皮質へ投射する視床の神経軸索はcorridor cells にガイドされて内側基底核原基を通過する(図2)[5]。その後、視床の軸索は大脳皮質の深層に位置するサブプレートに到達するが、軸索の最終的なターゲットである皮質板が成熟するまでは、皮質板には投射せずにサブプレート内に留まる[6]。サブプレートの神経細胞を除去すると、視床の軸索は本来の投射先以外の皮質領域へと投射してしまうなど、正常な投射ができなくなることから[23][24]、サブプレートの神経細胞は、視床の軸索が正常な皮質領域へと投射するよう導くガイドポスト細胞だと考えることができる。
関連項目
参考文献
- ↑ 1.0 1.1 1.2
Bentley, D., & Keshishian, H. (1982).
Pathfinding by peripheral pioneer neurons in grasshoppers. Science (New York, N.Y.), 218(4577), 1082-8. [PubMed:17752851] [WorldCat] [DOI] - ↑
Chao, D.L., Ma, L., & Shen, K. (2009).
Transient cell-cell interactions in neural circuit formation. Nature reviews. Neuroscience, 10(4), 262-71. [PubMed:19300445] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1
Bentley, D., & Caudy, M. (1983).
Pioneer axons lose directed growth after selective killing of guidepost cells. Nature, 304(5921), 62-5. [PubMed:6866090] [WorldCat] [DOI] - ↑
Bate, C.M. (1976).
Pioneer neurones in an insect embryo. Nature, 260(5546), 54-6. [PubMed:1264194] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 5.3 5.4 5.5 5.6
López-Bendito, G., Cautinat, A., Sánchez, J.A., Bielle, F., Flames, N., Garratt, A.N., ..., & Garel, S. (2006).
Tangential neuronal migration controls axon guidance: a role for neuregulin-1 in thalamocortical axon navigation. Cell, 125(1), 127-42. [PubMed:16615895] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1
Garel, S., & López-Bendito, G. (2014).
Inputs from the thalamocortical system on axon pathfinding mechanisms. Current opinion in neurobiology, 27, 143-50. [PubMed:24742382] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2 7.3 7.4
Sato, Y., Hirata, T., Ogawa, M., & Fujisawa, H. (1998).
Requirement for early-generated neurons recognized by monoclonal antibody lot1 in the formation of lateral olfactory tract. The Journal of neuroscience : the official journal of the Society for Neuroscience, 18(19), 7800-10. [PubMed:9742149] [PMC] [WorldCat] - ↑
Kawasaki, T., & Hirata, T. (2002).
[Development and migration of lot cell, the guidepost neuron of the lateral olfactory tract]. Tanpakushitsu kakusan koso. Protein, nucleic acid, enzyme, 47(15), 1989-93. [PubMed:12486929] [WorldCat] - ↑
Hirata, T., Kumada, T., Kawasaki, T., Furukawa, T., Aiba, A., Conquet, F., ..., & Fukuda, A. (2012).
Guidepost neurons for the lateral olfactory tract: expression of metabotropic glutamate receptor 1 and innervation by glutamatergic olfactory bulb axons. Developmental neurobiology, 72(12), 1559-76. [PubMed:22539416] [WorldCat] [DOI] - ↑
Tomioka, N., Osumi, N., Sato, Y., Inoue, T., Nakamura, S., Fujisawa, H., & Hirata, T. (2000).
Neocortical origin and tangential migration of guidepost neurons in the lateral olfactory tract. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(15), 5802-12. [PubMed:10908621] [PMC] [WorldCat] - ↑ 11.0 11.1
Kawasaki, T., Ito, K., & Hirata, T. (2006).
Netrin 1 regulates ventral tangential migration of guidepost neurons in the lateral olfactory tract. Development (Cambridge, England), 133(5), 845-53. [PubMed:16439477] [WorldCat] [DOI] - ↑
Ito, K., Kawasaki, T., Takashima, S., Matsuda, I., Aiba, A., & Hirata, T. (2008).
Semaphorin 3F confines ventral tangential migration of lateral olfactory tract neurons onto the telencephalon surface. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(17), 4414-22. [PubMed:18434520] [PMC] [WorldCat] [DOI] - ↑ 13.0 13.1
Dixit, R., Wilkinson, G., Cancino, G.I., Shaker, T., Adnani, L., Li, S., ..., & Schuurmans, C. (2014).
Neurog1 and Neurog2 control two waves of neuronal differentiation in the piriform cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 34(2), 539-53. [PubMed:24403153] [PMC] [WorldCat] [DOI] - ↑
de Frutos, C.A., Bouvier, G., Arai, Y., Thion, M.S., Lokmane, L., Keita, M., ..., & Garel, S. (2016).
Reallocation of Olfactory Cajal-Retzius Cells Shapes Neocortex Architecture. Neuron, 92(2), 435-448. [PubMed:27693257] [WorldCat] [DOI] - ↑
Sugisaki, N., Hirata, T., Naruse, I., Kawakami, A., Kitsukawa, T., & Fujisawa, H. (1996).
Positional cues that are strictly localized in the telencephalon induce preferential growth of mitral cell axons. Journal of neurobiology, 29(2), 127-37. [PubMed:8821172] [WorldCat] [DOI] - ↑
Saha, B., Hari, P., Huilgol, D., & Tole, S. (2007).
Dual role for LIM-homeodomain gene Lhx2 in the formation of the lateral olfactory tract. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(9), 2290-7. [PubMed:17329426] [PMC] [WorldCat] [DOI] - ↑
Shu, T., Li, Y., Keller, A., & Richards, L.J. (2003).
The glial sling is a migratory population of developing neurons. Development (Cambridge, England), 130(13), 2929-37. [PubMed:12756176] [PMC] [WorldCat] [DOI] - ↑
Shu, T., Butz, K.G., Plachez, C., Gronostajski, R.M., & Richards, L.J. (2003).
Abnormal development of forebrain midline glia and commissural projections in Nfia knock-out mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(1), 203-12. [PubMed:12514217] [PMC] [WorldCat] - ↑
Sretavan, D.W., Feng, L., Puré, E., & Reichardt, L.F. (1994).
Embryonic neurons of the developing optic chiasm express L1 and CD44, cell surface molecules with opposing effects on retinal axon growth. Neuron, 12(5), 957-75. [PubMed:7514428] [PMC] [WorldCat] [DOI] - ↑
Sretavan, D.W., Puré, E., Siegel, M.W., & Reichardt, L.F. (1995).
Disruption of retinal axon ingrowth by ablation of embryonic mouse optic chiasm neurons. Science (New York, N.Y.), 269(5220), 98-101. [PubMed:7541558] [WorldCat] [DOI] - ↑
Marcus, R.C., Blazeski, R., Godement, P., & Mason, C.A. (1995).
Retinal axon divergence in the optic chiasm: uncrossed axons diverge from crossed axons within a midline glial specialization. The Journal of neuroscience : the official journal of the Society for Neuroscience, 15(5 Pt 2), 3716-29. [PubMed:7751940] [WorldCat] - ↑
Williams, S.E., Mann, F., Erskine, L., Sakurai, T., Wei, S., Rossi, D.J., ..., & Henkemeyer, M. (2003).
Ephrin-B2 and EphB1 mediate retinal axon divergence at the optic chiasm. Neuron, 39(6), 919-35. [PubMed:12971893] [WorldCat] [DOI] - ↑
Ghosh, A., Antonini, A., McConnell, S.K., & Shatz, C.J. (1990).
Requirement for subplate neurons in the formation of thalamocortical connections. Nature, 347(6289), 179-81. [PubMed:2395469] [WorldCat] [DOI] - ↑
Ghosh, A., & Shatz, C.J. (1993).
A role for subplate neurons in the patterning of connections from thalamus to neocortex. Development (Cambridge, England), 117(3), 1031-47. [PubMed:8325233] [WorldCat]