「多系統萎縮症」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (2人の利用者による、間の6版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/read0113019 西澤 正豊]</font><br> | <font size="+1">[http://researchmap.jp/read0113019 西澤 正豊]</font><br> | ||
''新潟大学 脳研究所 ''<br> | ''新潟大学 脳研究所 ''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2016年1月30日 原稿完成日:2016年月日<br> | ||
担当編集委員:[http://researchmap.jp/read0141446 漆谷 真] | 担当編集委員:[http://researchmap.jp/read0141446 漆谷 真](京都大学 大学院医学研究科)<br> | ||
</div> | </div> | ||
| 13行目: | 13行目: | ||
[[小脳]]あるいはその連絡線維の変性を呈する疾患の総称である[[脊髄小脳変性症]]のうち、遺伝性がなく、かつ病変が[[大脳基底核]]、[[自律神経系]]をなどにも及ぶ病型を指す。脊髄小脳変性症の孤発例の約3分の2を占める。 | [[小脳]]あるいはその連絡線維の変性を呈する疾患の総称である[[脊髄小脳変性症]]のうち、遺伝性がなく、かつ病変が[[大脳基底核]]、[[自律神経系]]をなどにも及ぶ病型を指す。脊髄小脳変性症の孤発例の約3分の2を占める。 | ||
従来、小脳系の変性を主体とする病型は、[[オリーブ橋小脳萎縮症]](olivopontoserebellar atrophy:OPCA)、大脳基底核系を主体とする病型は、[[線条体黒質変性症]](striatonigral | 従来、小脳系の変性を主体とする病型は、[[オリーブ橋小脳萎縮症]](olivopontoserebellar atrophy:OPCA)、大脳基底核系を主体とする病型は、[[線条体黒質変性症]](striatonigral degeneration:SND)、自律神経系を主体とする病型は、[[Shy-Drager症候群]](Shy-Drager syndrome:SDS)とも呼ばれてきた。オリーブ橋小脳萎縮症は[[w:Joseph Jules Dejerine|Dejerine]]とAndré-Thomasによる1900年の報告に始まるが<ref>'''J. J. Dejerine, A. Thomas'''<br>L'átrophie olivo-ponto-cérébelleuse.<br>In: ''Nouvelle iconographie de la Salpêtrière''. 1900, 13, S. 330.</ref>、[[オリーブ小脳系]]を超えた病変も認められていた。1964年にAdamsが提唱した線条体黒質変性症においても、[[黒質]][[線条体]]だけでなく、オリーブ小脳系の変性を伴うと記載されていた<ref><pubmed> 14219099</pubmed></ref>。Shy-Drager症候群はShyとDragerにより1960年に報告されたが<ref><pubmed> 14446364 </pubmed></ref>、1967年のSchwarzによる4剖検例では、自律神経系を超えた変性が認められていた<ref><pubmed> 6018044 </pubmed></ref>。こうした経緯から、GrahamとOppenheimerは1969年、病変分布の共通性から、オリーブ橋小脳萎縮症、線条体黒質変性症、Shy-Drager症候群を包括する多系統委縮症という名称を提案した<ref><pubmed>5774131</pubmed></ref>。高橋によるShy-Drager症候群のわが国初の詳細な剖検報告(1969年)<ref>'''高橋昭, 高城晋, 山本耕平ほか'''<br>Shy-Drager症候群. オリーブ橋小脳萎縮症との関連<br>''臨床神経学'' 9: 121-129, 1969</ref>でも、Shy-Drager症候群とオリーブ橋小脳萎縮症病変の共通性が指摘されている。 | ||
==症候== | ==症候== | ||
40~60歳に、多くは[[小脳性運動失調]]から発症し、次第に自律神経症状や[[錐体外路症状]]、[[錐体路症状]]を伴う病型を[[MSA-C]]と呼ぶ。新潟大学の剖検例では、MSA-Cに[[パーキンソニズム]]を伴うのは74%であった。また、[[尿失禁]]や[[排尿困難]]、[[起立性低血圧]]や[[失神]]、男性では[[陰萎]]などの自律神経症状が発現する中央値は発症から2.5年であり、2.5年より早期から自律神経障害が出現すると、その後の進行が速かった。 | 40~60歳に、多くは[[小脳性運動失調]]から発症し、次第に自律神経症状や[[錐体外路症状]]、[[錐体路症状]]を伴う病型を[[MSA-C]]と呼ぶ。新潟大学の剖検例では、MSA-Cに[[パーキンソニズム]]を伴うのは74%であった。また、[[尿失禁]]や[[排尿困難]]、[[起立性低血圧]]や[[失神]]、男性では[[陰萎]]などの自律神経症状が発現する中央値は発症から2.5年であり、2.5年より早期から自律神経障害が出現すると、その後の進行が速かった。 | ||
多くはパーキンソン症状から発症し、次第に自律神経症状を伴う病型を[[MSA-P]]と呼ぶ。小脳性運動失調症状はパーキンソン症状にマスクされやすく、MSA-Pが小脳性運動失調を伴う頻度は、新潟大学の検討では44%であった。MSA-Pの初期には、パーキンソン病との鑑別が困難な症例もある。パーキンソン病に比べて、[[レボドパ]]補充療法の効果が乏しく、進行が速く、症状の左右差や[[静止時振戦]]がまれであることが特徴とされるが、MSA-Pでもパーキンソン症状の左右差が明らかな例や、典型的な静止時振戦を示す例、レボドパも無効ではなく、改善を示す例がある。進行期になると、多系統萎縮症でも[[大脳皮質]]の著明な萎縮や、進行性の認知障害が認められる。 | |||
多系統萎縮症の全経過は約9年で、[[wj::誤嚥性肺炎|誤嚥性肺炎]]や[[wj::敗血症|敗血症]]などの[[wj::感染症|感染症]]が死因となることが多いが、夜間の[[突然死]]も重要である。通常の低音のいびきとは異なる高調の喉頭喘鳴は、[[声帯外転麻痺]]を示唆する症候とされ、声帯外転麻痺による気道閉塞が突然死の原因と考えられてきた。しかし、麻酔薬により[[睡眠]]状態を再現して喉頭内視鏡検査を行うと、気道狭窄が生じている部位は[[wj:声帯|声帯]]に限らず、[[wj:被裂部|被裂部]]、[[wj::喉頭蓋|喉頭蓋]]、[[wj::舌根部|舌根部]]、[[wj::軟口蓋|軟口蓋]]など広範囲に及び、また吸気時に喉頭蓋が気管に引き込まれ、気道を閉塞する[[wikipedia:floppy epiglottis|floppy epiglottis]]と呼ばれる病態も合併することが明らかになった。MSAの睡眠呼吸障害に対する治療法として、マスクを用いた[[持続陽圧換気]](continuous positive airway pressure: CPAP)を不用意に行うと、floppy epiglottisでは気道狭窄が悪化する[[恐れ]]があり、注意を要する。 | 多系統萎縮症の全経過は約9年で、[[wj::誤嚥性肺炎|誤嚥性肺炎]]や[[wj::敗血症|敗血症]]などの[[wj::感染症|感染症]]が死因となることが多いが、夜間の[[突然死]]も重要である。通常の低音のいびきとは異なる高調の喉頭喘鳴は、[[声帯外転麻痺]]を示唆する症候とされ、声帯外転麻痺による気道閉塞が突然死の原因と考えられてきた。しかし、麻酔薬により[[睡眠]]状態を再現して喉頭内視鏡検査を行うと、気道狭窄が生じている部位は[[wj:声帯|声帯]]に限らず、[[wj:被裂部|被裂部]]、[[wj::喉頭蓋|喉頭蓋]]、[[wj::舌根部|舌根部]]、[[wj::軟口蓋|軟口蓋]]など広範囲に及び、また吸気時に喉頭蓋が気管に引き込まれ、気道を閉塞する[[wikipedia:floppy epiglottis|floppy epiglottis]]と呼ばれる病態も合併することが明らかになった。MSAの睡眠呼吸障害に対する治療法として、マスクを用いた[[持続陽圧換気]](continuous positive airway pressure: CPAP)を不用意に行うと、floppy epiglottisでは気道狭窄が悪化する[[恐れ]]があり、注意を要する。 | ||
多系統萎縮症の睡眠呼吸障害に対して、CPAP装着や気管切開などを行っても、突然死を防げない症例が存在する。[[中枢性無呼吸]]や致死性[[wj:不整脈|不整脈]]などが原因と考えられ、気管切開による人工呼吸管理が必要になる。 | 多系統萎縮症の睡眠呼吸障害に対して、CPAP装着や気管切開などを行っても、突然死を防げない症例が存在する。[[中枢性無呼吸]]や致死性[[wj::不整脈|不整脈]]などが原因と考えられ、気管切開による人工呼吸管理が必要になる。 | ||
== 診断 == | == 診断 == | ||
診断には、1999年に発表されたGilmanらによるconsensus | 診断には、1999年に発表されたGilmanらによるconsensus statementが広く用いられてきた。これによると、多系統萎縮症は診断の確かさによりdefinite、probable、possibleの3群に分類され、さらにオリーブ橋小脳萎縮症も線条体黒質変性症もいずれは自律神経症状を合併することからShy-Drager症候群を除外して、小脳症状と自律神経障害を呈して従来のオリーブ橋小脳萎縮症に相当する多系統萎縮症をMSA-C、[[パーキンソン症]]状と自律神経障害を呈して従来の線条体黒質変性症に相当する多系統萎縮症をMSA-Pとして、多系統萎縮症を臨床的に2分した。2008年には、改訂版が発表され、probableとpossibleの主な分岐点は、自律神経症状の程度により規定された。排尿障害では[[尿失禁]]、男性では[[勃起障害]]が重視され、起立性低血圧では、起立後3分以内に収縮期血圧が30 mmHg以上,あるいは拡張期血圧が15 mmHg以上低下する場合をprobableとする基準値が定められた(表1)。 | ||
これに対してわが国では、[[MSA-A]]としてShy-Drager症候群を残そうとする立場もある。新潟大学脳研究所で、病理学的に診断が確定された多系統萎縮症の臨床像を検討すると、MCA-C、MSA-Pのいずれも22%は、初発症状が自律神経障害であった。Shy-Drager症候群とされてきた症例は、早期から著明な自律神経障害で発症し、次第に小脳性運動失調やパーキンソン症状を伴うが、Shy-Drager症候群に特異的な自律神経障害は指摘できない。また「premotor MSA」(発症早期に自律神経障害が前景に立ち、他の系統変性による症候がまだ目立たない段階で、たまたま病理学的[[検索]]が行われた症例)では、オリーブ橋小脳系と線条体黒質系の変性は軽微であるのに対し、脳幹の自律神経諸核には既にglial cytoplasmic inclusionを認めている。また、Shy-Drager症候群と[[進行性自律神経機能不全症]](progressive autonomic failure:PAF)との鑑別も、初期には困難である。こうした知見を総合すると、Shy-Drager症候群を独立した疾患とすることは現時点では難しいと考えられる。 | これに対してわが国では、[[MSA-A]]としてShy-Drager症候群を残そうとする立場もある。新潟大学脳研究所で、病理学的に診断が確定された多系統萎縮症の臨床像を検討すると、MCA-C、MSA-Pのいずれも22%は、初発症状が自律神経障害であった。Shy-Drager症候群とされてきた症例は、早期から著明な自律神経障害で発症し、次第に小脳性運動失調やパーキンソン症状を伴うが、Shy-Drager症候群に特異的な自律神経障害は指摘できない。また「premotor MSA」(発症早期に自律神経障害が前景に立ち、他の系統変性による症候がまだ目立たない段階で、たまたま病理学的[[検索]]が行われた症例)では、オリーブ橋小脳系と線条体黒質系の変性は軽微であるのに対し、脳幹の自律神経諸核には既にglial cytoplasmic inclusionを認めている。また、Shy-Drager症候群と[[進行性自律神経機能不全症]](progressive autonomic failure:PAF)との鑑別も、初期には困難である。こうした知見を総合すると、Shy-Drager症候群を独立した疾患とすることは現時点では難しいと考えられる。 | ||
MSA-CとMSA-Pの頻度には、著明な人種差がある。わが国ではMSA-Cが全体の7、8割、MSA-Pが2、3割を占めるが、欧米ではこの頻度が逆転している。MSA-CとMSA-Pは臨床診断であるが、病理学的に診断が確定されたdefinite 多系統萎縮症についても、Wenningらが検討した欧州ではMSA- | MSA-CとMSA-Pの頻度には、著明な人種差がある。わが国ではMSA-Cが全体の7、8割、MSA-Pが2、3割を占めるが、欧米ではこの頻度が逆転している。MSA-CとMSA-Pは臨床診断であるが、病理学的に診断が確定されたdefinite 多系統萎縮症についても、Wenningらが検討した欧州ではMSA-Pが8割を占め、一方、新潟大学の多系統萎縮症連続剖検例では、MSA-Cが3分の2を占めた。 | ||
{| class="wikitable" | {| class="wikitable" | ||
|+ 表1.多系統萎縮症診断基準改訂版<ref | |+ 表1.多系統萎縮症診断基準改訂版<ref><pubmed>18725592</pubmed></ref> | ||
|- | |- | ||
|'''従来通り、definite, probable, possibleに分類し、さらにMSA-PとMSA-Cに分類する。''' | |'''従来通り、definite, probable, possibleに分類し、さらにMSA-PとMSA-Cに分類する。''' | ||
#Definite MSA<br> | #Definite MSA<br> 病理学的に,中枢神経に広範に、多数のα-synuclein陽性glial cytoplasmic inclusion(GCI)を認め、線条体黒質系またはオリーブ橋小脳系の変性所見を伴う。 | ||
#Probable MSA<br> 孤発性で進行性の成人発症(30歳以降)の変性疾患で、自律神経障害(尿失禁([[wj:膀胱|膀胱]]からの尿排出をコントロールできない、男性では勃起障害)、または起立後3分以内に少なくとも収縮期血圧が30 mmHg,拡張期血圧が15 mmHg低下する起立性低血圧)に加え、レボドパ反応性の乏しいパーキンソニズム(動作緩慢に、筋強剛、振戦、または[[姿勢反射]]障害を伴う)、または小脳症候群([[歩行失調]]に、小脳性[[構音障害]]、四肢失調、または小脳性[[眼球運動障害]]を伴う)を呈する。 | #Probable MSA<br> 孤発性で進行性の成人発症(30歳以降)の変性疾患で、自律神経障害(尿失禁([[wj:膀胱|膀胱]]からの尿排出をコントロールできない、男性では勃起障害)、または起立後3分以内に少なくとも収縮期血圧が30 mmHg,拡張期血圧が15 mmHg低下する起立性低血圧)に加え、レボドパ反応性の乏しいパーキンソニズム(動作緩慢に、筋強剛、振戦、または[[姿勢反射]]障害を伴う)、または小脳症候群([[歩行失調]]に、小脳性[[構音障害]]、四肢失調、または小脳性[[眼球運動障害]]を伴う)を呈する。 | ||
#Possible MSA<br> 孤発性で進行性の成人発症(30歳以降)の変性疾患で、パーキンソニズム、または小脳症候群を呈し、加えて自律神経障害を示唆する所見(他の原因では説明できない[[尿意促迫]]、[[頻尿]]、[[残尿]]、男性では[[勃起不全]]、またはprobable MSAの規準を満たさないレベルの起立性低血圧)を少なくとも一つ認め、さらに以下の表で少なくとも一つの所見を満たすもの。<br> | #Possible MSA<br> 孤発性で進行性の成人発症(30歳以降)の変性疾患で、パーキンソニズム、または小脳症候群を呈し、加えて自律神経障害を示唆する所見(他の原因では説明できない[[尿意促迫]]、[[頻尿]]、[[残尿]]、男性では[[勃起不全]]、またはprobable MSAの規準を満たさないレベルの起立性低血圧)を少なくとも一つ認め、さらに以下の表で少なくとも一つの所見を満たすもの。<br> | ||
| 41行目: | 41行目: | ||
(2) Possible MSA-P<br> 急速進行性のパーキンソニズム、レボドパ反応性が乏しいこと、運動症状出現3年以内の姿勢反射障害、 | (2) Possible MSA-P<br> 急速進行性のパーキンソニズム、レボドパ反応性が乏しいこと、運動症状出現3年以内の姿勢反射障害、 | ||
歩行失調・小脳性構音障害・四肢失調・または<br> 小脳性眼球運動障害、運動症状出現5年以内の嚥下障害、 | 歩行失調・小脳性構音障害・四肢失調・または<br> 小脳性眼球運動障害、運動症状出現5年以内の嚥下障害、 | ||
MRIにおける[[被殻]]・[[中小脳脚]]・[[橋]]・または小脳の萎縮、[[陽電子断層撮像法#脳機能計測|FDG-PET]]における被殻・脳幹・または小脳の低代謝。<br> | |||
(3) Possible MSA-C<br> パーキンソニズム(動作緩慢と筋強剛)、MRIにおける被殻・中小脳脚・または橋の萎縮、FDG- | (3) Possible MSA-C<br> パーキンソニズム(動作緩慢と筋強剛)、MRIにおける被殻・中小脳脚・または橋の萎縮、FDG-PETにおける被殻の低代謝、SPECTまたはPETにおける<br> 黒質線条体[[ドーパミン]]作動性ニューロンの節前性脱神経 。 | ||
|- | |- | ||
|'''多系統萎縮症の診断を支持するred flag所見<br>''' | |'''多系統萎縮症の診断を支持するred flag所見<br>''' | ||
| 58行目: | 58行目: | ||
多系統萎縮症の補助診断には[[MRI]]が有用である。MSA-Cでは、小脳、[[中小脳脚]]、[[脳幹]]の進行性萎縮とともに、橋底部に十字状の高信号(hot cross bun sign:橋十字サイン)が、MSA-Pでは、被殻の進行性萎縮とグリオーシス、鉄の沈着により、被殻後外側部に線状の高信号(putaminal slit sign)が認められる(図1)。 | 多系統萎縮症の補助診断には[[MRI]]が有用である。MSA-Cでは、小脳、[[中小脳脚]]、[[脳幹]]の進行性萎縮とともに、橋底部に十字状の高信号(hot cross bun sign:橋十字サイン)が、MSA-Pでは、被殻の進行性萎縮とグリオーシス、鉄の沈着により、被殻後外側部に線状の高信号(putaminal slit sign)が認められる(図1)。 | ||
[[MIBG心筋シンチグラフィー]]では、MSA-Pの初期には取り込みの低下は認められないので、パーキンソン病との鑑別に役立つ。[[脳脊髄液]] | [[MIBG心筋シンチグラフィー]]では、MSA-Pの初期には取り込みの低下は認められないので、パーキンソン病との鑑別に役立つ。[[脳脊髄液]]中のα-シヌクレインは多系統萎縮症では低下する。glial cytoplasmic inclusionに結合するリガンドを利用した[[PET]]検査も開発中である。 | ||
==治療== | ==治療== | ||
| 70行目: | 70行目: | ||
MSA-Cでは小脳皮質、[[橋]]小脳系、および[[下オリーブ核]]に強い変性と神経細胞脱落、[[グリオーシス]]が認められる。一方、MSA-Pでは[[被殻]]、黒質の変性が高度であり、特に被殻の後外側部は神経細胞脱落が強く、褐色調の色素沈着がみられる。Shy-Drager症候群とされた剖検例では、[[脊髄]][[中間外側核]]、[[迷走神経]]背側核、[[交感神経節]]などの自律神経諸核の変性が強い。 | MSA-Cでは小脳皮質、[[橋]]小脳系、および[[下オリーブ核]]に強い変性と神経細胞脱落、[[グリオーシス]]が認められる。一方、MSA-Pでは[[被殻]]、黒質の変性が高度であり、特に被殻の後外側部は神経細胞脱落が強く、褐色調の色素沈着がみられる。Shy-Drager症候群とされた剖検例では、[[脊髄]][[中間外側核]]、[[迷走神経]]背側核、[[交感神経節]]などの自律神経諸核の変性が強い。 | ||
(<u>編集部コメント:もし組織画像などお持ちでしたらお願いいたします?</u>) | |||
多系統萎縮症に共通する疾患特異的バイオマーカーとして、脳幹の[[オリゴデンドロサイト]]や神経細胞の細胞質内に特徴的な封入体([[glial cytoplasmic inclusion]]:[[GCI]]、[[neuronal cytoplasmic inclusion]]:[[NCI]])が見出され、多系統萎縮症は疾患単位として確立された。さらに、glial cytoplasmic inclusion、neuronal cytoplasmic inclusionの主な構成成分は、リン酸化された[[α-シヌクレイン]]であることが明らかにされた。α-シヌクレインは、もともとオリゴデンドロサイトには発現していない。多系統萎縮症では病的[[グリア細胞]]がα-シヌクレインを産生するという可能性よりも、神経細胞が産生したα-シヌクレインが細胞間を伝搬してグリアに取り込まれるという「[[プリオン]]様のタンパク伝搬仮説」が現在は有力である。パーキンソン病の特徴である[[レヴィー小体]]の主な構成成分もリン酸化α-シヌクレインであるが、同じシヌクレイノパチーである多系統萎縮症とパーキンソン病がどこで分岐するかは未解明である。α-シヌクレイン遺伝子の点変異は家族性パーキンソン病の原因とはなるが、多系統萎縮症の表現型は示さない。α-シヌクレイン遺伝子のduplication、あるいはtriplicationによるまれな家族性パーキンソン病では、レヴィー小体とglial cytoplasmic inclusionがともに認められることから、遺伝子量の増大はglial cytoplasmic inclusion形成の原因の一つと考えられる。 | 多系統萎縮症に共通する疾患特異的バイオマーカーとして、脳幹の[[オリゴデンドロサイト]]や神経細胞の細胞質内に特徴的な封入体([[glial cytoplasmic inclusion]]:[[GCI]]、[[neuronal cytoplasmic inclusion]]:[[NCI]])が見出され、多系統萎縮症は疾患単位として確立された。さらに、glial cytoplasmic inclusion、neuronal cytoplasmic inclusionの主な構成成分は、リン酸化された[[α-シヌクレイン]]であることが明らかにされた。α-シヌクレインは、もともとオリゴデンドロサイトには発現していない。多系統萎縮症では病的[[グリア細胞]]がα-シヌクレインを産生するという可能性よりも、神経細胞が産生したα-シヌクレインが細胞間を伝搬してグリアに取り込まれるという「[[プリオン]]様のタンパク伝搬仮説」が現在は有力である。パーキンソン病の特徴である[[レヴィー小体]]の主な構成成分もリン酸化α-シヌクレインであるが、同じシヌクレイノパチーである多系統萎縮症とパーキンソン病がどこで分岐するかは未解明である。α-シヌクレイン遺伝子の点変異は家族性パーキンソン病の原因とはなるが、多系統萎縮症の表現型は示さない。α-シヌクレイン遺伝子のduplication、あるいはtriplicationによるまれな家族性パーキンソン病では、レヴィー小体とglial cytoplasmic inclusionがともに認められることから、遺伝子量の増大はglial cytoplasmic inclusion形成の原因の一つと考えられる。 | ||
== 病態生理 == | == 病態生理 == | ||
ごくまれではあるが、多系統萎縮症には家族発症例があり(<u>編集部コメント:脊髄小脳変性症のうち遺伝性がないものとの定義と矛盾?</u>)、これらの解析から辻らにより[[COQ2]]([[コエンザイムQ10]]合成酵素)遺伝子に変異が同定された。変異が2つあれば発症者となり、変異が1つでは発症リスクを高めることになる。日本人のみに認められるV393A変異は多系統萎縮症の約9%に見出され(健常者では約3%)、ホモ変異例では脳内のコエンザイムQ10量が減少していた。 | |||
(<u>編集部コメント:ほとんどの場合は病態がわからないということでしょうか?</u>) | |||
==関連項目== | ==関連項目== | ||
| 84行目: | 86行目: | ||
==参考文献== | ==参考文献== | ||
<references/> | <references/> | ||
2016年2月6日 (土) 15:22時点における版
英語名:Multiple system atrophy 独:Multisystematrophie 仏:atrophies multisystématisées
英語略:MSA
多系統萎縮症とは、小脳系、大脳基底核系、自律神経系の3系統を中心とし、錐体路にも及ぶ多系統が変性する神経変性疾患である。小脳性運動失調から発症し、次第に自律神経症状や錐体外路症状、錐体路症状を伴う病型をMSA-C、パーキンソン症状から発症し、次第に自律神経症状を伴う病型をMSA-Pと呼ぶ。全経過は約9年で、誤嚥性肺炎や敗血症などの感染症が死因となることが多いが、夜間の突然死も重要である。根治的治療法は確立されておらず、対症療法が主体となる。病理学的にはオリゴデンドログリアや神経細胞の細胞質内に特徴的な封入体が観察され、その主な構成成分はリン酸化されたα-シヌクレインである。
概念
小脳あるいはその連絡線維の変性を呈する疾患の総称である脊髄小脳変性症のうち、遺伝性がなく、かつ病変が大脳基底核、自律神経系をなどにも及ぶ病型を指す。脊髄小脳変性症の孤発例の約3分の2を占める。
従来、小脳系の変性を主体とする病型は、オリーブ橋小脳萎縮症(olivopontoserebellar atrophy:OPCA)、大脳基底核系を主体とする病型は、線条体黒質変性症(striatonigral degeneration:SND)、自律神経系を主体とする病型は、Shy-Drager症候群(Shy-Drager syndrome:SDS)とも呼ばれてきた。オリーブ橋小脳萎縮症はDejerineとAndré-Thomasによる1900年の報告に始まるが[1]、オリーブ小脳系を超えた病変も認められていた。1964年にAdamsが提唱した線条体黒質変性症においても、黒質線条体だけでなく、オリーブ小脳系の変性を伴うと記載されていた[2]。Shy-Drager症候群はShyとDragerにより1960年に報告されたが[3]、1967年のSchwarzによる4剖検例では、自律神経系を超えた変性が認められていた[4]。こうした経緯から、GrahamとOppenheimerは1969年、病変分布の共通性から、オリーブ橋小脳萎縮症、線条体黒質変性症、Shy-Drager症候群を包括する多系統委縮症という名称を提案した[5]。高橋によるShy-Drager症候群のわが国初の詳細な剖検報告(1969年)[6]でも、Shy-Drager症候群とオリーブ橋小脳萎縮症病変の共通性が指摘されている。
症候
40~60歳に、多くは小脳性運動失調から発症し、次第に自律神経症状や錐体外路症状、錐体路症状を伴う病型をMSA-Cと呼ぶ。新潟大学の剖検例では、MSA-Cにパーキンソニズムを伴うのは74%であった。また、尿失禁や排尿困難、起立性低血圧や失神、男性では陰萎などの自律神経症状が発現する中央値は発症から2.5年であり、2.5年より早期から自律神経障害が出現すると、その後の進行が速かった。
多くはパーキンソン症状から発症し、次第に自律神経症状を伴う病型をMSA-Pと呼ぶ。小脳性運動失調症状はパーキンソン症状にマスクされやすく、MSA-Pが小脳性運動失調を伴う頻度は、新潟大学の検討では44%であった。MSA-Pの初期には、パーキンソン病との鑑別が困難な症例もある。パーキンソン病に比べて、レボドパ補充療法の効果が乏しく、進行が速く、症状の左右差や静止時振戦がまれであることが特徴とされるが、MSA-Pでもパーキンソン症状の左右差が明らかな例や、典型的な静止時振戦を示す例、レボドパも無効ではなく、改善を示す例がある。進行期になると、多系統萎縮症でも大脳皮質の著明な萎縮や、進行性の認知障害が認められる。
多系統萎縮症の全経過は約9年で、誤嚥性肺炎や敗血症などの感染症が死因となることが多いが、夜間の突然死も重要である。通常の低音のいびきとは異なる高調の喉頭喘鳴は、声帯外転麻痺を示唆する症候とされ、声帯外転麻痺による気道閉塞が突然死の原因と考えられてきた。しかし、麻酔薬により睡眠状態を再現して喉頭内視鏡検査を行うと、気道狭窄が生じている部位は声帯に限らず、被裂部、喉頭蓋、舌根部、軟口蓋など広範囲に及び、また吸気時に喉頭蓋が気管に引き込まれ、気道を閉塞するfloppy epiglottisと呼ばれる病態も合併することが明らかになった。MSAの睡眠呼吸障害に対する治療法として、マスクを用いた持続陽圧換気(continuous positive airway pressure: CPAP)を不用意に行うと、floppy epiglottisでは気道狭窄が悪化する恐れがあり、注意を要する。
多系統萎縮症の睡眠呼吸障害に対して、CPAP装着や気管切開などを行っても、突然死を防げない症例が存在する。中枢性無呼吸や致死性不整脈などが原因と考えられ、気管切開による人工呼吸管理が必要になる。
診断
診断には、1999年に発表されたGilmanらによるconsensus statementが広く用いられてきた。これによると、多系統萎縮症は診断の確かさによりdefinite、probable、possibleの3群に分類され、さらにオリーブ橋小脳萎縮症も線条体黒質変性症もいずれは自律神経症状を合併することからShy-Drager症候群を除外して、小脳症状と自律神経障害を呈して従来のオリーブ橋小脳萎縮症に相当する多系統萎縮症をMSA-C、パーキンソン症状と自律神経障害を呈して従来の線条体黒質変性症に相当する多系統萎縮症をMSA-Pとして、多系統萎縮症を臨床的に2分した。2008年には、改訂版が発表され、probableとpossibleの主な分岐点は、自律神経症状の程度により規定された。排尿障害では尿失禁、男性では勃起障害が重視され、起立性低血圧では、起立後3分以内に収縮期血圧が30 mmHg以上,あるいは拡張期血圧が15 mmHg以上低下する場合をprobableとする基準値が定められた(表1)。
これに対してわが国では、MSA-AとしてShy-Drager症候群を残そうとする立場もある。新潟大学脳研究所で、病理学的に診断が確定された多系統萎縮症の臨床像を検討すると、MCA-C、MSA-Pのいずれも22%は、初発症状が自律神経障害であった。Shy-Drager症候群とされてきた症例は、早期から著明な自律神経障害で発症し、次第に小脳性運動失調やパーキンソン症状を伴うが、Shy-Drager症候群に特異的な自律神経障害は指摘できない。また「premotor MSA」(発症早期に自律神経障害が前景に立ち、他の系統変性による症候がまだ目立たない段階で、たまたま病理学的検索が行われた症例)では、オリーブ橋小脳系と線条体黒質系の変性は軽微であるのに対し、脳幹の自律神経諸核には既にglial cytoplasmic inclusionを認めている。また、Shy-Drager症候群と進行性自律神経機能不全症(progressive autonomic failure:PAF)との鑑別も、初期には困難である。こうした知見を総合すると、Shy-Drager症候群を独立した疾患とすることは現時点では難しいと考えられる。
MSA-CとMSA-Pの頻度には、著明な人種差がある。わが国ではMSA-Cが全体の7、8割、MSA-Pが2、3割を占めるが、欧米ではこの頻度が逆転している。MSA-CとMSA-Pは臨床診断であるが、病理学的に診断が確定されたdefinite 多系統萎縮症についても、Wenningらが検討した欧州ではMSA-Pが8割を占め、一方、新潟大学の多系統萎縮症連続剖検例では、MSA-Cが3分の2を占めた。
従来通り、definite, probable, possibleに分類し、さらにMSA-PとMSA-Cに分類する。
(1) Possible MSA-P またはMSA-C |
| 多系統萎縮症の診断を支持するred flag所見 口部顔面ジストニア、頸部前屈、カンプトコルミア(脊柱の高度の前屈)and/or Pisa症候群(脊柱の高度の側屈)、手または足の拘縮、吸気時のため息、高度の発声困難、高度の構音障害、いびきの出現または増悪、手足の冷感、病的笑いまたは病的泣き、jerkyなミオクローヌス様の姿勢振戦または動作性振戦。 |
| 多系統萎縮症の診断を支持しない所見 典型的丸薬丸め様の静止時振戦、臨床的に有意な末梢神経障害、薬剤誘発性でない幻覚、75歳以上の発症、失調症やパーキンソニズムの家族歴、認知症(DSM-IVによる)、多発性硬化症を示唆する大脳白質病変。 |
補助診断法
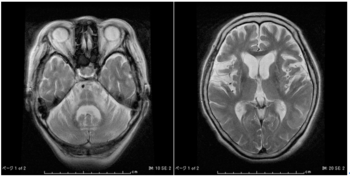
図左:MSA-Cにおける橋十字サインと橋、小脳の萎縮
図右:MSA-Pにおける線条体後外側部の線状高信号(スリットサイン)
多系統萎縮症の補助診断にはMRIが有用である。MSA-Cでは、小脳、中小脳脚、脳幹の進行性萎縮とともに、橋底部に十字状の高信号(hot cross bun sign:橋十字サイン)が、MSA-Pでは、被殻の進行性萎縮とグリオーシス、鉄の沈着により、被殻後外側部に線状の高信号(putaminal slit sign)が認められる(図1)。
MIBG心筋シンチグラフィーでは、MSA-Pの初期には取り込みの低下は認められないので、パーキンソン病との鑑別に役立つ。脳脊髄液中のα-シヌクレインは多系統萎縮症では低下する。glial cytoplasmic inclusionに結合するリガンドを利用したPET検査も開発中である。
治療
根治的治療法は確立されておらず、対症療法が主体となる。わが国では、thyrotropin releasing hormone(TRH)の点滴とその誘導体(タルチレリン)の経口投与が、小脳性運動失調に対して唯一保険適用となっているが、その効果は限定的である。起立性低血圧や排尿障害などの自律神経症状には、対症療法を行う。多くの薬剤について、小脳性運動失調症に対する有効性が検証されているが、確実に効果が実証されたものはない。
多系統萎縮症では、経過中に気道や尿路の感染症を繰り返して、全身状態が悪化することが多い。口腔ケアを徹底して、誤嚥による気道感染を予防することが重要である。
脊髄小脳変性症と多系統萎縮症は厚生労働省の指定難病制度の対象疾患であり、さらに介護保健法における「特定疾病」に指定されている。制度上Shy-Drager症候群を拡大して多系統萎縮症として独立させたために、脊髄小脳変性症には皮質性小脳萎縮症と遺伝性脊髄小脳変性症が残された形となっている。また、MSA-Pはパーキンソン病と診断されている場合が少なからずあり、難病対策制度上の分類には、再度整理が必要である。
病理所見
MSA-Cでは小脳皮質、橋小脳系、および下オリーブ核に強い変性と神経細胞脱落、グリオーシスが認められる。一方、MSA-Pでは被殻、黒質の変性が高度であり、特に被殻の後外側部は神経細胞脱落が強く、褐色調の色素沈着がみられる。Shy-Drager症候群とされた剖検例では、脊髄中間外側核、迷走神経背側核、交感神経節などの自律神経諸核の変性が強い。
(編集部コメント:もし組織画像などお持ちでしたらお願いいたします?)
多系統萎縮症に共通する疾患特異的バイオマーカーとして、脳幹のオリゴデンドロサイトや神経細胞の細胞質内に特徴的な封入体(glial cytoplasmic inclusion:GCI、neuronal cytoplasmic inclusion:NCI)が見出され、多系統萎縮症は疾患単位として確立された。さらに、glial cytoplasmic inclusion、neuronal cytoplasmic inclusionの主な構成成分は、リン酸化されたα-シヌクレインであることが明らかにされた。α-シヌクレインは、もともとオリゴデンドロサイトには発現していない。多系統萎縮症では病的グリア細胞がα-シヌクレインを産生するという可能性よりも、神経細胞が産生したα-シヌクレインが細胞間を伝搬してグリアに取り込まれるという「プリオン様のタンパク伝搬仮説」が現在は有力である。パーキンソン病の特徴であるレヴィー小体の主な構成成分もリン酸化α-シヌクレインであるが、同じシヌクレイノパチーである多系統萎縮症とパーキンソン病がどこで分岐するかは未解明である。α-シヌクレイン遺伝子の点変異は家族性パーキンソン病の原因とはなるが、多系統萎縮症の表現型は示さない。α-シヌクレイン遺伝子のduplication、あるいはtriplicationによるまれな家族性パーキンソン病では、レヴィー小体とglial cytoplasmic inclusionがともに認められることから、遺伝子量の増大はglial cytoplasmic inclusion形成の原因の一つと考えられる。
病態生理
ごくまれではあるが、多系統萎縮症には家族発症例があり(編集部コメント:脊髄小脳変性症のうち遺伝性がないものとの定義と矛盾?)、これらの解析から辻らによりCOQ2(コエンザイムQ10合成酵素)遺伝子に変異が同定された。変異が2つあれば発症者となり、変異が1つでは発症リスクを高めることになる。日本人のみに認められるV393A変異は多系統萎縮症の約9%に見出され(健常者では約3%)、ホモ変異例では脳内のコエンザイムQ10量が減少していた。
(編集部コメント:ほとんどの場合は病態がわからないということでしょうか?)
関連項目
参考文献
- ↑ J. J. Dejerine, A. Thomas
L'átrophie olivo-ponto-cérébelleuse.
In: Nouvelle iconographie de la Salpêtrière. 1900, 13, S. 330. - ↑
ADAMS, R.D., VANBOGAERT, L., & VANDEREECKEN, H. (1964).
STRIATO-NIGRAL DEGENERATION. Journal of neuropathology and experimental neurology, 23, 584-608. [PubMed:14219099] [WorldCat] - ↑
SHY, G.M., & DRAGER, G.A. (1960).
A neurological syndrome associated with orthostatic hypotension: a clinical-pathologic study. Archives of neurology, 2, 511-27. [PubMed:14446364] [WorldCat] [DOI] - ↑
Schwarz, G.A. (1967).
The orthostatic hypotension syndrome of Shy-Drager. A clinicopathologic report. Archives of neurology, 16(2), 123-39. [PubMed:6018044] [WorldCat] [DOI] - ↑
Graham, J.G., & Oppenheimer, D.R. (1969).
Orthostatic hypotension and nicotine sensitivity in a case of multiple system atrophy. Journal of neurology, neurosurgery, and psychiatry, 32(1), 28-34. [PubMed:5774131] [PMC] [WorldCat] [DOI] - ↑ 高橋昭, 高城晋, 山本耕平ほか
Shy-Drager症候群. オリーブ橋小脳萎縮症との関連
臨床神経学 9: 121-129, 1969 - ↑
Gilman, S., Wenning, G.K., Low, P.A., Brooks, D.J., Mathias, C.J., Trojanowski, J.Q., ..., & Vidailhet, M. (2008).
Second consensus statement on the diagnosis of multiple system atrophy. Neurology, 71(9), 670-6. [PubMed:18725592] [PMC] [WorldCat] [DOI]