「ドレブリン」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (2人の利用者による、間の12版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | <div align="right"> | ||
<font size="+1">[ | <font size="+1">[http://researchmap.jp/7000016212 小金澤 紀子]、[http://researchmap.jp/read0058514 白尾 智明]</font><br> | ||
''群馬大学大学院医学系研究科神経薬理学''<br> | ''群馬大学大学院医学系研究科神経薬理学''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2016年8月15日 原稿完成日:2016年月日<br> | ||
担当編集委員:[http://researchmap.jp/ | 担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](国立研究開発法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
{{box|text= | |||
ドレブリンはアクチン結合タンパク質として知られ、そのアイソフォームには主にドレブリンEとドレブリンAがある。ドレブリンEは胎児期及び幼若期に主に発現し、成熟期にはドレブリンAが神経細胞特異的に発現する。ドレブリンEは突起伸展や軸索成長に影響を及ぼし、ドレブリンAはシナプス後部に集積し樹状突起スパインの形成を促進する機能がある。また、ドレブリンAはシナプス可塑性にも関与することが知られている。 | |||
}} | |||
==イントロダクション== | |||
ドレブリンは脳の発達に依存して発現量が変化するタンパク質として1985年にニワトリ脳から精製された(Shirao and Obata, 1985)アクチン結合タンパク質である。 | |||
ニワトリ胚では神経組織以外にも発現しているが、孵化後には神経組織に多量に発現しており(Shirao and Obata, 1986)、また、[[免疫]]電顕により神経細胞樹状突起に特異的に存在することが示され(Shirao et al., 1987)、1988年に発生過程で調節される脳タンパク(Developmentally REgulated BRain proteIN)という意味で、ドレブリン(drebrin)と命名された(Shirao et al., 1988)。同年、ドレブリンcDNAの配列が決定され、その結果、ニワトリのドレブリンには幼若型のドレブリンE1、ドレブリンE2と成熟型のドレブリンA(このアイソフォームは神経細胞特異的)の三種類のアイソフォームがあることが明らかになった(Kojima et al., 1988)。[[哺乳類]]においては[[ラット]]脳での研究が最初に行われ、ドレブリンは種を越えて保存されていること、また、ラットでは胎児型ドレブリンが一種類(ドレブリンE)しか存在しないことが示された(Shirao et al., 1989)。1993年には[[ヒト]]のcDNAのクローニングが報告されている(Toda et al., 1993)。 | |||
==構造== | |||
[[image:1ドレブリン.png|thumb|350px|'''図1.'''<br>ADF-H:ADFホモロジードメイン<br>AR1:アクチン結合領域1<br>AR2:アクチン結合領域2<br>In 2:In 2(ドレブリンA特異的配列)<br>P:プロリンリッチ領域]] | |||
ドレブリンはN末端に[[ADF]]-ホモロジードメインを持つ分子で、[[コフィリン]]やツインフィリンとスーパーファミリーを作っていると考えることができる。ドレブリンは大きく分けると、幼若型(ドレブリンE)と成熟型(ドレブリンA)の二種類に分かれる。ドレブリンのアイソフォームは単一遺伝子から選択的スプライシングにより生成されるため(Kojima et al., 1993)、アミノ酸配列はほぼ同一であるが、ドレブリンAのみがins2配列を持つ(図1)。 | |||
[[ | |||
ドレブリンが結合するタンパク質としては種々のものが報告されているが、一番の特徴はアクチン線維に結合してアクチン線維の構造を変化させることである。原子間力顕微鏡を用いた観察によると、ドレブリンの結合していないアクチン線維は36nmピッチのらせん構造を持つのに対し、ドレブリンAの結合したアクチン線維は40nmピッチのらせん構造を持つ(Sharma et al., 2011)。 | |||
==サブファミリー== | |||
ドレブリンE(幼若型アイソフォーム) | |||
ドレブリンA(成熟型アイソフォーム、神経特異的) | |||
==発現== | ==発現== | ||
===組織分布=== | ===組織分布=== | ||
ドレブリンEは非神経細胞にも発現しているが、すべての細胞に発現しているわけではない。一方、ドレブリンAは神経細胞特異的に発現する。[[げっ歯類]]脳においては胎児期および生後10日ほどまでは、ドレブリンEの発現が多い。ドレブリンAは[[海馬]]においては生後5日程度から見られるが、通常、生後10日ほどからその発現量が多くなる | ドレブリンEは非神経細胞にも発現しているが、すべての細胞に発現しているわけではない。一方、ドレブリンAは神経細胞特異的に発現する。[[げっ歯類]]脳においては胎児期および生後10日ほどまでは、ドレブリンEの発現が多い。ドレブリンAは[[海馬]]においては生後5日程度から見られるが、通常、生後10日ほどからその発現量が多くなる(Aoki et al., 2005)。 | ||
===細胞内分布=== | ===細胞内分布=== | ||
ドレブリンEは移動中神経細胞の細胞体や[[軸索]]の[[成長円錐]]に多く集積している。一方、ドレブリンAは樹状突起スパインに多く集積している。 | |||
==機能== | ==機能== | ||
アクチン結合タンパク質であるドレブリンは、F-アクチンの物理的性質を変化させることにより、他のアクチン結合タンパク質がアクチンフィラメントに結合するのを防ぐことでF- | アクチン結合タンパク質であるドレブリンは、F-アクチンの物理的性質を変化させることにより、他のアクチン結合タンパク質がアクチンフィラメントに結合するのを防ぐことでF-アクチンの安定性を変化させる。たとえば、ドレブリンはトロポミオシンのF-アクチン結合を阻害するが、ゲルゾリンのF-アクチン結合は阻害しない。したがって、ゲルゾリンはドレブリンの結合したアクチンを切断することができる(Ishikawa et al., 1994)。逆に、トロポミオシンはゲルゾリンのF-アクチン結合を阻害するので、F-アクチンの断裂はおきにくい。また、ドレブリンはアクチン-ミオシン相互作用を抑制するので一度できた突起は退縮しにくくなる。したがって、ドレブリンがクラスターし始めたフィロポディアは退縮せずに安定したスパインへと形態変化すると考えられる。 | ||
===神経細胞の発達とドレブリン=== | |||
ドレブリンEは成長円錐に多量存在し、突起伸展や軸索成長に影響を及ぼしている(Toda et al., 1999; Mizui et al., 2009)。成熟に伴いドレブリンEは消失し、代わりにドレブリンAが出現する。ドレブリンAは[[シナプス]]後部に集積し、樹状突起スパインの形成を促進する(後述)。スパイン形成時にドレブリンの機能を介在するドレブリン結合タンパク質、スパイカーも同定されている(Yamazaki et al., 2014)。 | |||
===シナプス成熟とドレブリン=== | |||
成熟した神経細胞の樹状突起スパインは[[シナプス後肥厚部]](Postsynaptic densities, PSDs)を含んでいるが、ドレブリンAの発現は[[PSD-95]]の集積を促進し、樹状突起スパインの形成に重要な役割を果たしていることが示されている(Takahashi et al., 2003)。また、ドレブリンAの過剰発現によりスパイン形態が変化する(Hayashi and Shirao, 1999)ことが知られているが、未熟な海馬神経細胞に過剰発現させると巨大なフィロポディア様の突起が形成され、そこにはドレブリンAの集積量に相関してF-アクチンと[[PSD]]-95が集積する(Mizui et al., 2005)。このことから、ドレブリンAはスパイン形成に必要な材料を集積する機能を持っているが、その量は適度でなければならないことが示唆されている。 | |||
=== | ===シナプス可塑性とドレブリン=== | ||
[[image:2ドレブリン.png|thumb|350px|'''図2.''']] | |||
ドレブリンAのスパインへの局在は神経活動依存的に変化し、シナプス可塑性に伴い一過性に樹状突起スパインから樹状突起シャフトへと移動することが分かっている。これはNMDA受容体を介した[[CA2|Ca2]]+の流入により引き起こされ、加えて、ミオシンIIによる調整を受けていることも示唆されている(Mizui et al., 2014)。この一過性の移動はスパインが形態的変化を起こすために重要な役割を果たしていると考えられている(図2)。 | |||
また、ドレブリンAはLTPの形成に重要でありドレブリンEではその役割を補完できない、つまり、ドレブリンのアイソフォーム変換はLTPが形成されるようになるために重要であることが示唆されている(Kojima et al., 2016)。 | |||
===認知障害とドレブリン=== | |||
[[アルツハイマー病]]ではシナプス機能不全が起きていると考えられているが、アルツハイマー病死後脳の海馬ではドレブリンの広範囲な消失が認められている(Harigaya et al., 1996)。さらに、軽度のアルツハイマー病患者や[[軽度認知障害]]患者の死後脳においても海馬でドレブリンの減少が見られた(Counts et al., 2006; Counts et al., 2012)。In vitro系においても、アルツハイマー病の発症に関与していると考えられる[[Aβ]]オリゴマーによりドレブリンの減少が惹起されることが確認されている(Lacor et al., 2007)。なお、このAβオリゴマーによるドレブリンの樹状突起スパインからの消失は、[[ヒストン脱アセチル化酵素]]を阻害すると起こらない(Ishizuka et al., 2014)。 | |||
[[モデル動物]]を使った研究においては、ドレブリンがアルツハイマー病の発病機序に関与することも分かっており(Calon et al., 2004)、例えばドレブリンAはアルツハイマー病モデル[[動物]]において活動依存性NMDA受容体輸送に重要な役割を果たすと考えられている(Lee and Aoki, 2012)。 | |||
[[ | |||
またアルツハイマー病だけでなく、[[ダウン症候群]]の死後脳でもドレブリンが顕著に減少しているという報告がある(Shim and Lubec, 2002)。 | |||
=== | ===がん細胞とドレブリン=== | ||
がん細胞は正常細胞の細胞間結合を破壊し、運動性や形態を変化させる。ドレブリンはもともとこれらの機能に関与していることから、発がん過程においてもその役割が調べられており、近年、様々ながん細胞においてドレブリンの発現が認められている。例えば、2005年には[[皮膚]]がんにおいてドレブリンの発現が認められた(Peitsch et al., 2005)。また興味深いことに、転移性のがん細胞にはドレブリンが異常に発現している(Lin et al., 2014)。もっと最近では、ドレブリンがプログラニューリンを活性化し、膀胱がんを惹起することも報告されている(Xu et al., 2015)。ドレブリンが腫瘍の発現に関与するのか等まだ不明な点は多いが、特に転移性の腫瘍ではドレブリンの機能異常が見られることから、ドレブリンはがんのバイオマーカーとして用いることができるのかもしれない。 | |||
==関連語== | ==関連語== | ||
2016年8月16日 (火) 22:44時点における版
小金澤 紀子、白尾 智明
群馬大学大学院医学系研究科神経薬理学
DOI:10.14931/bsd.7254 原稿受付日:2016年8月15日 原稿完成日:2016年月日
担当編集委員:林 康紀(国立研究開発法人理化学研究所 脳科学総合研究センター)
ドレブリンはアクチン結合タンパク質として知られ、そのアイソフォームには主にドレブリンEとドレブリンAがある。ドレブリンEは胎児期及び幼若期に主に発現し、成熟期にはドレブリンAが神経細胞特異的に発現する。ドレブリンEは突起伸展や軸索成長に影響を及ぼし、ドレブリンAはシナプス後部に集積し樹状突起スパインの形成を促進する機能がある。また、ドレブリンAはシナプス可塑性にも関与することが知られている。
イントロダクション
ドレブリンは脳の発達に依存して発現量が変化するタンパク質として1985年にニワトリ脳から精製された(Shirao and Obata, 1985)アクチン結合タンパク質である。
ニワトリ胚では神経組織以外にも発現しているが、孵化後には神経組織に多量に発現しており(Shirao and Obata, 1986)、また、免疫電顕により神経細胞樹状突起に特異的に存在することが示され(Shirao et al., 1987)、1988年に発生過程で調節される脳タンパク(Developmentally REgulated BRain proteIN)という意味で、ドレブリン(drebrin)と命名された(Shirao et al., 1988)。同年、ドレブリンcDNAの配列が決定され、その結果、ニワトリのドレブリンには幼若型のドレブリンE1、ドレブリンE2と成熟型のドレブリンA(このアイソフォームは神経細胞特異的)の三種類のアイソフォームがあることが明らかになった(Kojima et al., 1988)。哺乳類においてはラット脳での研究が最初に行われ、ドレブリンは種を越えて保存されていること、また、ラットでは胎児型ドレブリンが一種類(ドレブリンE)しか存在しないことが示された(Shirao et al., 1989)。1993年にはヒトのcDNAのクローニングが報告されている(Toda et al., 1993)。
構造
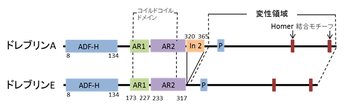
ADF-H:ADFホモロジードメイン
AR1:アクチン結合領域1
AR2:アクチン結合領域2
In 2:In 2(ドレブリンA特異的配列)
P:プロリンリッチ領域
ドレブリンはN末端にADF-ホモロジードメインを持つ分子で、コフィリンやツインフィリンとスーパーファミリーを作っていると考えることができる。ドレブリンは大きく分けると、幼若型(ドレブリンE)と成熟型(ドレブリンA)の二種類に分かれる。ドレブリンのアイソフォームは単一遺伝子から選択的スプライシングにより生成されるため(Kojima et al., 1993)、アミノ酸配列はほぼ同一であるが、ドレブリンAのみがins2配列を持つ(図1)。
ドレブリンが結合するタンパク質としては種々のものが報告されているが、一番の特徴はアクチン線維に結合してアクチン線維の構造を変化させることである。原子間力顕微鏡を用いた観察によると、ドレブリンの結合していないアクチン線維は36nmピッチのらせん構造を持つのに対し、ドレブリンAの結合したアクチン線維は40nmピッチのらせん構造を持つ(Sharma et al., 2011)。
サブファミリー
ドレブリンE(幼若型アイソフォーム)
ドレブリンA(成熟型アイソフォーム、神経特異的)
発現
組織分布
ドレブリンEは非神経細胞にも発現しているが、すべての細胞に発現しているわけではない。一方、ドレブリンAは神経細胞特異的に発現する。げっ歯類脳においては胎児期および生後10日ほどまでは、ドレブリンEの発現が多い。ドレブリンAは海馬においては生後5日程度から見られるが、通常、生後10日ほどからその発現量が多くなる(Aoki et al., 2005)。
細胞内分布
ドレブリンEは移動中神経細胞の細胞体や軸索の成長円錐に多く集積している。一方、ドレブリンAは樹状突起スパインに多く集積している。
機能
アクチン結合タンパク質であるドレブリンは、F-アクチンの物理的性質を変化させることにより、他のアクチン結合タンパク質がアクチンフィラメントに結合するのを防ぐことでF-アクチンの安定性を変化させる。たとえば、ドレブリンはトロポミオシンのF-アクチン結合を阻害するが、ゲルゾリンのF-アクチン結合は阻害しない。したがって、ゲルゾリンはドレブリンの結合したアクチンを切断することができる(Ishikawa et al., 1994)。逆に、トロポミオシンはゲルゾリンのF-アクチン結合を阻害するので、F-アクチンの断裂はおきにくい。また、ドレブリンはアクチン-ミオシン相互作用を抑制するので一度できた突起は退縮しにくくなる。したがって、ドレブリンがクラスターし始めたフィロポディアは退縮せずに安定したスパインへと形態変化すると考えられる。
神経細胞の発達とドレブリン
ドレブリンEは成長円錐に多量存在し、突起伸展や軸索成長に影響を及ぼしている(Toda et al., 1999; Mizui et al., 2009)。成熟に伴いドレブリンEは消失し、代わりにドレブリンAが出現する。ドレブリンAはシナプス後部に集積し、樹状突起スパインの形成を促進する(後述)。スパイン形成時にドレブリンの機能を介在するドレブリン結合タンパク質、スパイカーも同定されている(Yamazaki et al., 2014)。
シナプス成熟とドレブリン
成熟した神経細胞の樹状突起スパインはシナプス後肥厚部(Postsynaptic densities, PSDs)を含んでいるが、ドレブリンAの発現はPSD-95の集積を促進し、樹状突起スパインの形成に重要な役割を果たしていることが示されている(Takahashi et al., 2003)。また、ドレブリンAの過剰発現によりスパイン形態が変化する(Hayashi and Shirao, 1999)ことが知られているが、未熟な海馬神経細胞に過剰発現させると巨大なフィロポディア様の突起が形成され、そこにはドレブリンAの集積量に相関してF-アクチンとPSD-95が集積する(Mizui et al., 2005)。このことから、ドレブリンAはスパイン形成に必要な材料を集積する機能を持っているが、その量は適度でなければならないことが示唆されている。
シナプス可塑性とドレブリン
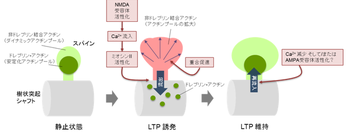
ドレブリンAのスパインへの局在は神経活動依存的に変化し、シナプス可塑性に伴い一過性に樹状突起スパインから樹状突起シャフトへと移動することが分かっている。これはNMDA受容体を介したCa2+の流入により引き起こされ、加えて、ミオシンIIによる調整を受けていることも示唆されている(Mizui et al., 2014)。この一過性の移動はスパインが形態的変化を起こすために重要な役割を果たしていると考えられている(図2)。
また、ドレブリンAはLTPの形成に重要でありドレブリンEではその役割を補完できない、つまり、ドレブリンのアイソフォーム変換はLTPが形成されるようになるために重要であることが示唆されている(Kojima et al., 2016)。
認知障害とドレブリン
アルツハイマー病ではシナプス機能不全が起きていると考えられているが、アルツハイマー病死後脳の海馬ではドレブリンの広範囲な消失が認められている(Harigaya et al., 1996)。さらに、軽度のアルツハイマー病患者や軽度認知障害患者の死後脳においても海馬でドレブリンの減少が見られた(Counts et al., 2006; Counts et al., 2012)。In vitro系においても、アルツハイマー病の発症に関与していると考えられるAβオリゴマーによりドレブリンの減少が惹起されることが確認されている(Lacor et al., 2007)。なお、このAβオリゴマーによるドレブリンの樹状突起スパインからの消失は、ヒストン脱アセチル化酵素を阻害すると起こらない(Ishizuka et al., 2014)。
モデル動物を使った研究においては、ドレブリンがアルツハイマー病の発病機序に関与することも分かっており(Calon et al., 2004)、例えばドレブリンAはアルツハイマー病モデル動物において活動依存性NMDA受容体輸送に重要な役割を果たすと考えられている(Lee and Aoki, 2012)。
またアルツハイマー病だけでなく、ダウン症候群の死後脳でもドレブリンが顕著に減少しているという報告がある(Shim and Lubec, 2002)。
がん細胞とドレブリン
がん細胞は正常細胞の細胞間結合を破壊し、運動性や形態を変化させる。ドレブリンはもともとこれらの機能に関与していることから、発がん過程においてもその役割が調べられており、近年、様々ながん細胞においてドレブリンの発現が認められている。例えば、2005年には皮膚がんにおいてドレブリンの発現が認められた(Peitsch et al., 2005)。また興味深いことに、転移性のがん細胞にはドレブリンが異常に発現している(Lin et al., 2014)。もっと最近では、ドレブリンがプログラニューリンを活性化し、膀胱がんを惹起することも報告されている(Xu et al., 2015)。ドレブリンが腫瘍の発現に関与するのか等まだ不明な点は多いが、特に転移性の腫瘍ではドレブリンの機能異常が見られることから、ドレブリンはがんのバイオマーカーとして用いることができるのかもしれない。