「NeuN」の版間の差分
細編集の要約なし |
細 →構造 |
||
| 16行目: | 16行目: | ||
== 構造 == | == 構造 == | ||
[[ファイル:NeuN1.jpg|サムネイル|300px|右|'''図1. マウスのNeuN/Rbfox3の遺伝子構造'''<ref name=Maxeiner><pubmed>24150744</pubmed>より改変。<br>エクソンは数字付きの四角で示されている。太線EはNeuNのエピトープ、太線RRMはRNA結合部位、太線NLSは核移行シグナル部位を示している。ATGはexon5の翻訳開始部位、STOPはexon15の2つの停止部位を表している。マウスでは5種類以上のスプライスバリアントが生成されることが報告されている<ref name=kim><pubmed>19713214</pubmed></ref> <ref name=Maxeiner><pubmed>24150744</pubmed> <ref name=duan><pubmed>25680637</pubmed></ref>。]] | [[ファイル:NeuN1.jpg|サムネイル|300px|右|'''図1. マウスのNeuN/Rbfox3の遺伝子構造'''<ref name=Maxeiner><pubmed>24150744</pubmed></ref>より改変。<br>エクソンは数字付きの四角で示されている。太線EはNeuNのエピトープ、太線RRMはRNA結合部位、太線NLSは核移行シグナル部位を示している。ATGはexon5の翻訳開始部位、STOPはexon15の2つの停止部位を表している。マウスでは5種類以上のスプライスバリアントが生成されることが報告されている<ref name=kim><pubmed>19713214</pubmed></ref> <ref name=Maxeiner><pubmed>24150744</pubmed> <ref name=duan><pubmed>25680637</pubmed></ref>。]] | ||
[[ウェスタンブロッティング]]では46kDaと48kDaの分子量を示す。NeuN/Rbfox3は[[feminizing locus on Xファミリー|Fox(feminizing locus on X)ファミリー]]に属する分子で、[[RNA]]認識モチーフであるRRM型RNA結合ドメインが分子の中心に1つある<ref name=duan><pubmed>25680637</pubmed></ref>。 | [[ウェスタンブロッティング]]では46kDaと48kDaの分子量を示す。NeuN/Rbfox3は[[feminizing locus on Xファミリー|Fox(feminizing locus on X)ファミリー]]に属する分子で、[[RNA]]認識モチーフであるRRM型RNA結合ドメインが分子の中心に1つある<ref name=duan><pubmed>25680637</pubmed></ref>。 | ||
2016年9月13日 (火) 23:30時点における版
石 龍徳
東京医科大学組織・神経解剖学分野
DOI:10.14931/bsd.6876 原稿受付日:2016年2月8日 原稿完成日:2016年9月13日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英語名:neuronal nuclei
同義語:Feminizing locus on X 3, FOX3, Rbfox3
NeuNは、マウス脳の細胞核を抗原として作製されたモノクローナル抗体の抗原分子の名称ある。NeuN抗体は細胞分裂終了後のニューロンと反応するが、グリアとは反応しない。現在、ニューロンのマーカー抗体として発生学、神経科学などの分野で広く用いられている。2009年になって、NeuN抗体の抗原分子は、組織特異的スプライシング調節因子のRbfox3であることが判明した。
NeuNとは
1992年Mullenらは、ニューロン分化の調節に重要な分子を同定する目的で、オキナワハツカネズミ(Mus caroli)脳の細胞核をマウス(ハツカネズミ、Mus musculus BALB/c系統)に免疫してモノクローナル抗体を作製した。その結果、細胞分裂終了後のニューロンの核に特異的に反応する抗体(mAb A60)を得て、その抗原をNeuN(neuronal nuclei)と命名した[1]。NeuN抗体はニューロンのマーカーとして長年用いられてきたが、その抗原分子の性質は17年間不明なままであった。NeuNの正体は、2009年にKimら(Kawamotoのグループ)によって組織特異的スプライシング調節因子のRNA-binding Fox3 (Rbfox3)であることが明らかになった[2]。この項ではNeuN/Rbfox3と記述する。
構造
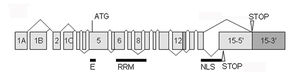
エクソンは数字付きの四角で示されている。太線EはNeuNのエピトープ、太線RRMはRNA結合部位、太線NLSは核移行シグナル部位を示している。ATGはexon5の翻訳開始部位、STOPはexon15の2つの停止部位を表している。マウスでは5種類以上のスプライスバリアントが生成されることが報告されている[2] 引用エラー:
<ref> タグに対応する </ref> タグが不足しています。ウェスタンブロッティングでは46kDaと48kDaの分子量を示す。NeuN/Rbfox3はFox(feminizing locus on X)ファミリーに属する分子で、RNA認識モチーフであるRRM型RNA結合ドメインが分子の中心に1つある[4]。
NeuN/Rbfox3 mRNAは、選択的スプライシングによって、スプライスバリアントを生じることが報告されている(図1)。プライスバリアントの正確な数は不明だが、マウスでは5種類以上あることが報告されている[2] 引用エラー: <ref> タグに対応する </ref> タグが不足しています。選択的スプライシングによってNeuN/Rbfox3の働きを自己調節するようなドミナントネガティブのバリアントを作ることが知られている[5]。
サブファミリー
NeuN/Rbfox3の属するRbfoxファミリーには、Rbfox1(別名:Fox1, A2BP1)、Rbfox2(別名:Fox2, Rbm9, Fxh),Rbfox3(別名:NeuN, Fox3, D11Bwg0517e)の3つのサブタイプがある。それぞれの分子の組織発現は異なっている。NeuN/Rbfox3は、マウスでは選択的スプライシングによって、5種類以上のスプライスバリアントが産生される[2] 引用エラー: <ref> タグに対応する </ref> タグが不足しています。
発現
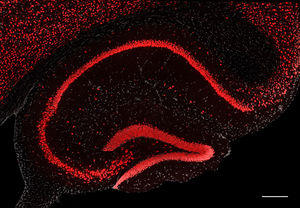
灰色はDAPIによる核染色。スケールバーは200 μm。
Rbfoxファミリーの3つのサブタイプの発現パターンは異なっている。Rbfox1は、ニューロン、骨格筋、心臓に、Rbfox2はニューロン、筋、卵巣、胚全体、ヒト胚の大腸や卵巣由来の細胞に、Rbfox3は細胞分裂終了後のニューロンに発現している[4] [6]。また、マウス胚性腫瘍細胞のP19細胞では、NeuNは検出されないが、レチノイン酸を作用させて神経誘導するとNeuNを発現するようになる[2]。
NeuN/Rbfox3は核では正染色質(euchoromatin)に強く発現しており(図2)、異染色質(heterochromatin)にはほとんど発現していない。また、発現は弱いが核だけでなく細胞質にも発現している。
核には46kDaと48kDa分子が同量発現しているが、細胞質では48kDa分子が多く発現している[7]。NeuN/Rbfox3は、アストロサイト、オリゴデンドロサイト、ミクログリア、シュワン細胞、増殖中の神経前駆細胞などには発現していない。その発現が細胞分裂終了後のニューロンに限られているので、発生期のニューロン分化マーカーや病理学的なマーカーとして有用である[4][8]。ほとんどのニューロンに発現しているが、つぎに挙げるニューロンでは例外的にが発現していない:小脳のプルキンエ細胞、下オリーブ核のニューロン、網膜の内/外顆粒層のニューロン、脊髄のγ運動ニューロン、交感神経節のニューロン、発生期大脳皮質のCajal-Retzius細胞[6]。In vitroの培養細胞では、GFAP陽性細胞がNeuNを発現することがあるので注意を要する[9]。
機能
NeuN/Rbfox3の属するRbfoxファミリー分子は、組織特異的選択的スプライシング調節因子である。RNA認識モチーフであるRRM型RNA結合ドメインが分子の中心に1つあり、RNA penta(hexa)nucleotide (U)GCAUGと結合する[2][4][6]。例えばNumbの選択的スプライシングを調節することにより、ニューロンの分化を促進する[10]。また、直接pri-miRNAに結合しpri-miRNAのプロセシングを調節している[11]。NeuN/Rbfox3欠損マウスでは、けいれん発作に対する感受性が上昇し、不安行動が減少することが報告されている[12]。
疾患との関わり
NeuNは神経細胞腫、神経節細胞腫、 髄芽腫に発現している[8][13]。マウスやラットの脳虚血モデルではNeuN/Rbfox3発現の低下が報告されているが、機能低下によるものか細胞死によるものかが不明確な場合が多い[14] [15] [4]。Rbfox3の遺伝子欠損がローランドてんかん患者で見つかっている[16]。
関連項目
参考文献
- ↑
Mullen, R.J., Buck, C.R., & Smith, A.M. (1992).
NeuN, a neuronal specific nuclear protein in vertebrates. Development (Cambridge, England), 116(1), 201-11. [PubMed:1483388] [WorldCat] - ↑ 2.0 2.1 2.2 2.3 2.4 2.5
Kim, K.K., Adelstein, R.S., & Kawamoto, S. (2009).
Identification of neuronal nuclei (NeuN) as Fox-3, a new member of the Fox-1 gene family of splicing factors. The Journal of biological chemistry, 284(45), 31052-61. [PubMed:19713214] [PMC] [WorldCat] [DOI] - ↑
Maxeiner, S., Glassmann, A., Kao, H.T., & Schilling, K. (2014).
The molecular basis of the specificity and cross-reactivity of the NeuN epitope of the neuron-specific splicing regulator, Rbfox3. Histochemistry and cell biology, 141(1), 43-55. [PubMed:24150744] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2 4.3 4.4
Duan, W., Zhang, Y.P., Hou, Z., Huang, C., Zhu, H., Zhang, C.Q., & Yin, Q. (2016).
Novel Insights into NeuN: from Neuronal Marker to Splicing Regulator. Molecular neurobiology, 53(3), 1637-1647. [PubMed:25680637] [WorldCat] [DOI] - ↑
Damianov, A., & Black, D.L. (2010).
Autoregulation of Fox protein expression to produce dominant negative splicing factors. RNA (New York, N.Y.), 16(2), 405-16. [PubMed:20042473] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2
Gusel'nikova, V.V., & Korzhevskiy, D.E. (2015).
NeuN As a Neuronal Nuclear Antigen and Neuron Differentiation Marker. Acta naturae, 7(2), 42-7. [PubMed:26085943] [PMC] [WorldCat] - ↑
Lind, D., Franken, S., Kappler, J., Jankowski, J., & Schilling, K. (2005).
Characterization of the neuronal marker NeuN as a multiply phosphorylated antigen with discrete subcellular localization. Journal of neuroscience research, 79(3), 295-302. [PubMed:15605376] [WorldCat] [DOI] - ↑ 8.0 8.1
Wolf, H.K., Buslei, R., Schmidt-Kastner, R., Schmidt-Kastner, P.K., Pietsch, T., Wiestler, O.D., & Blümcke, I. (1996).
NeuN: a useful neuronal marker for diagnostic histopathology. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society, 44(10), 1167-71. [PubMed:8813082] [WorldCat] [DOI] - ↑
Darlington, P.J., Goldman, J.S., Cui, Q.L., Antel, J.P., & Kennedy, T.E. (2008).
Widespread immunoreactivity for neuronal nuclei in cultured human and rodent astrocytes. Journal of neurochemistry, 104(5), 1201-9. [PubMed:17995928] [WorldCat] [DOI] - ↑
Kim, K.K., Nam, J., Mukouyama, Y.S., & Kawamoto, S. (2013).
Rbfox3-regulated alternative splicing of Numb promotes neuronal differentiation during development. The Journal of cell biology, 200(4), 443-58. [PubMed:23420872] [PMC] [WorldCat] [DOI] - ↑
Kim, K.K., Yang, Y., Zhu, J., Adelstein, R.S., & Kawamoto, S. (2014).
Rbfox3 controls the biogenesis of a subset of microRNAs. Nature structural & molecular biology, 21(10), 901-10. [PubMed:25240799] [PMC] [WorldCat] [DOI] - ↑
Wang, H.Y., Hsieh, P.F., Huang, D.F., Chin, P.S., Chou, C.H., Tung, C.C., ..., & Huang, H.S. (2015).
RBFOX3/NeuN is Required for Hippocampal Circuit Balance and Function. Scientific reports, 5, 17383. [PubMed:26619789] [PMC] [WorldCat] [DOI] - ↑
Soylemezoglu, F., Onder, S., Tezel, G.G., & Berker, M. (2003).
Neuronal nuclear antigen (NeuN): a new tool in the diagnosis of central neurocytoma. Pathology, research and practice, 199(7), 463-8. [PubMed:14521262] [WorldCat] [DOI] - ↑
Davoli, M.A., Fourtounis, J., Tam, J., Xanthoudakis, S., Nicholson, D., Robertson, G.S., ..., & Xu, D. (2002).
Immunohistochemical and biochemical assessment of caspase-3 activation and DNA fragmentation following transient focal ischemia in the rat. Neuroscience, 115(1), 125-36. [PubMed:12401327] [WorldCat] [DOI] - ↑
Unal-Cevik, I., Kilinç, M., Gürsoy-Ozdemir, Y., Gurer, G., & Dalkara, T. (2004).
Loss of NeuN immunoreactivity after cerebral ischemia does not indicate neuronal cell loss: a cautionary note. Brain research, 1015(1-2), 169-74. [PubMed:15223381] [WorldCat] [DOI] - ↑
Lal, D., Reinthaler, E.M., Altmüller, J., Toliat, M.R., Thiele, H., Nürnberg, P., ..., & Neubauer, B.A. (2013).
RBFOX1 and RBFOX3 mutations in rolandic epilepsy. PloS one, 8(9), e73323. [PubMed:24039908] [PMC] [WorldCat] [DOI]