「神経幹細胞」の版間の差分
細編集の要約なし |
Kenichimizutani (トーク | 投稿記録) 細編集の要約なし |
||
| (他の1人の利用者による、間の1版が非表示) | |||
| 11行目: | 11行目: | ||
== 神経幹細胞とは == | == 神経幹細胞とは == | ||
[[ファイル: Fig.2b.pdf|300px|thumb|right|'''図1. 神経幹細胞の自己複製能と多分化能'''<br>神経幹細胞は自己複製能と多分化能を併せもった未分化な細胞である。]] | [[ファイル: Fig.2b.pdf|300px|thumb|right|'''図1. 神経幹細胞の自己複製能と多分化能'''<br><u>神経幹細胞は自己複製能と多分化能を併せもった未分化な細胞である。</u>]] | ||
神経幹細胞は、[[自己複製能]]と[[多分化能]]を併せもった、未分化な細胞である。[[胎生期]]の脳では、神経幹細胞が先ずは盛んに増殖することで自らの数を指数関数的に増やし、次いで、[[非対称分裂]]によって[[神経細胞]]を生み出す<ref name=ref1><pubmed> 11689956</pubmed></ref>。また、胎生後期や生後の脳では、[[アストロサイト]]や[[オリゴデンドロサイト]]を生み出すことが知られている。すなわち、神経幹細胞は、中枢神経系を構成する主要な細胞型であるニューロン、アストロサイト、およびオリゴデンドロサイトの供給源となる細胞である(''' | 神経幹細胞は、[[自己複製能]]と[[多分化能]]を併せもった、未分化な細胞である。[[胎生期]]の脳では、神経幹細胞が先ずは盛んに増殖することで自らの数を指数関数的に増やし、次いで、[[非対称分裂]]によって[[神経細胞]]を生み出す<ref name=ref1><pubmed> 11689956</pubmed></ref>。また、胎生後期や生後の脳では、[[アストロサイト]]や[[オリゴデンドロサイト]]を生み出すことが知られている。すなわち、神経幹細胞は、中枢神経系を構成する主要な細胞型であるニューロン、アストロサイト、およびオリゴデンドロサイトの供給源となる細胞である('''図1''')。 | ||
神経幹細胞の自己複製と多分化能は[[bHLH型転写因子]]によって制御されていると考えられており、自己複製はNotch-Hesシグナルが主要な役割を担う<ref name=ref2><pubmed> 11937492</pubmed></ref>一方で、神経細胞の分化を制御するAscl1、[[アストロサイト]]の分化を制御する[[Hes1]]、[[オリゴデンドロサイト]]の分化を制御する[[Olig2]]という3種類のbHLH型転写因子が中心となって分化を調節する。最近の研究で、神経幹細胞が自己複製する状態では、これらの転写因子の発現が振動している状態である一方で、分化に向かう際には、単一の分化運命決定因子が持続的に発現する状態であることが明らかになっている<ref name=ref3><pubmed> 12399594</pubmed></ref><ref name=ref4><pubmed> 24179156</pubmed></ref>。 | 神経幹細胞の自己複製と多分化能は[[bHLH型転写因子]]によって制御されていると考えられており、自己複製はNotch-Hesシグナルが主要な役割を担う<ref name=ref2><pubmed> 11937492</pubmed></ref>一方で、神経細胞の分化を制御するAscl1、[[アストロサイト]]の分化を制御する[[Hes1]]、[[オリゴデンドロサイト]]の分化を制御する[[Olig2]]という3種類のbHLH型転写因子が中心となって分化を調節する。最近の研究で、神経幹細胞が自己複製する状態では、これらの転写因子の発現が振動している状態である一方で、分化に向かう際には、単一の分化運命決定因子が持続的に発現する状態であることが明らかになっている<ref name=ref3><pubmed> 12399594</pubmed></ref><ref name=ref4><pubmed> 24179156</pubmed></ref>。 | ||
==神経幹細胞の分化制御機構モデル== | ==神経幹細胞の分化制御機構モデル== | ||
[[ファイル: Fig.2a.pdf|500px|thumb|right|''' | [[ファイル: Fig.2a.pdf|500px|thumb|right|'''図2. 大脳皮質発生過程における神経幹細胞の分化制御機構モデル'''<br><u>神経幹細胞は比較的均一な細胞集団であると考えられているが、きわめて多種多様な細胞を生み出すことが可能である。この分子機構を解明するために、数多くの研究者が二つの仮説を中心に様々な研究を、これまで展開してきた。</u>]] | ||
それでは、比較的均一な集団である神経幹細胞は、どのようにして脳を構成する多種多様な細胞を生み出すことができるのであろうか?神経幹細胞が多様な分化細胞を生み出す分子機構を解く上で、二つの仮説が存在し、いずれの説が正しいか、あるいは、両者のいかなる使い分けがあるかについては今後の研究が必要と考えられている('''図2''')。 | それでは、比較的均一な集団である神経幹細胞は、どのようにして脳を構成する多種多様な細胞を生み出すことができるのであろうか?神経幹細胞が多様な分化細胞を生み出す分子機構を解く上で、二つの仮説が存在し、いずれの説が正しいか、あるいは、両者のいかなる使い分けがあるかについては今後の研究が必要と考えられている('''図2''')。 | ||
| 38行目: | 38行目: | ||
最近の研究では、大脳皮質発生初期の神経幹細胞に発現する転写因子Fezlを欠損した[[マウス]]は、深層の神経細胞の分化が阻止されているにも係らず、後期に誕生する上層の神経細胞は正常なタイミングで分化すること、神経幹細胞の未分化性を一過的に促進した細胞は、深層の神経細胞を生み出すことなしに、正しい時期に上層の神経細胞を生み出すことが可能であることが明らかにされている<ref name=ref18><pubmed>15750183</pubmed></ref>。 | 最近の研究では、大脳皮質発生初期の神経幹細胞に発現する転写因子Fezlを欠損した[[マウス]]は、深層の神経細胞の分化が阻止されているにも係らず、後期に誕生する上層の神経細胞は正常なタイミングで分化すること、神経幹細胞の未分化性を一過的に促進した細胞は、深層の神経細胞を生み出すことなしに、正しい時期に上層の神経細胞を生み出すことが可能であることが明らかにされている<ref name=ref18><pubmed>15750183</pubmed></ref>。 | ||
さらには、脳室帯に位置する神経幹細胞は、より未分化性の高い幹細胞集団と比較的分化に傾いた幹細胞集団が不均一に存在しており、これが[[Notch]]シグナルの強弱で区別されている<ref name=ref19><pubmed>17721509</pubmed></ref>ことが見出されている。また、深層の神経細胞で発現する転写因子Fezlと上層の神経細胞で発現する転写因子[[Cux2]]が脳室帯の異なる神経幹細胞で発現する可能性も示されている<ref name=ref20><pubmed>22879516</pubmed></ref>が、これと相反する報告も認められている<ref name=ref21><pubmed>24314728</pubmed></ref>。一方で、分化した神経細胞でさえも環境に応じて適切に性質が変化する現象が観察されていることから<ref name=ref22><pubmed>26880563</pubmed></ref> | さらには、脳室帯に位置する神経幹細胞は、より未分化性の高い幹細胞集団と比較的分化に傾いた幹細胞集団が不均一に存在しており、これが[[Notch]]シグナルの強弱で区別されている<ref name=ref19><pubmed>17721509</pubmed></ref>ことが見出されている。また、深層の神経細胞で発現する転写因子Fezlと上層の神経細胞で発現する転写因子[[Cux2]]が脳室帯の異なる神経幹細胞で発現する可能性も示されている<ref name=ref20><pubmed>22879516</pubmed></ref>が、これと相反する報告も認められている<ref name=ref21><pubmed>24314728</pubmed></ref>。一方で、分化した神経細胞でさえも環境に応じて適切に性質が変化する現象が観察されていることから<ref name=ref22><pubmed>26880563</pubmed></ref>、神経幹細胞の不均一性を司る分子機構は未だ不明な点が多いのが現状である。 | ||
== 胎生期の神経幹細胞と成体の神経幹細胞 == | == 胎生期の神経幹細胞と成体の神経幹細胞 == | ||
2018年12月23日 (日) 14:29時点における版
水谷健一
神戸学院大学大学院 薬学研究科 幹細胞生物学研究室
DOI:10.14931/bsd.2101 原稿受付日:2017年4月6日 原稿完成日:2017年4月17日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
英語名:neural stem cell 独:neuronale Stammzelle 仏:cellule neuronale souche
神経幹細胞は、自己複製能と多分化能を併せもった、神経系の未分化な組織幹細胞である(図1)。中枢神経系はきわめて多種多様な細胞から構成されているが、比較的均質な神経幹細胞が分化することで、様々な細胞型が生み出される。この神経幹細胞の分化制御機構については、数多くの研究者が二つの仮説(図2)を中心に研究を展開してきた歴史的な経緯がある。また、成体脳の神経幹細胞における神経新生が近年注目されているが、胎生期の神経幹細胞がどのようにして成体の神経幹細胞として維持されるのか、その細胞系譜については依然として未解明の現象が数多く残されている。ここでは、大脳皮質の神経幹細胞について概説する。
神経幹細胞とは
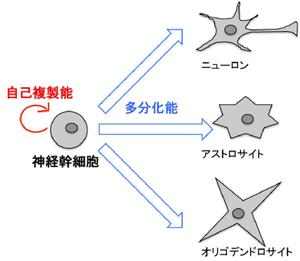
神経幹細胞は自己複製能と多分化能を併せもった未分化な細胞である。
神経幹細胞は、自己複製能と多分化能を併せもった、未分化な細胞である。胎生期の脳では、神経幹細胞が先ずは盛んに増殖することで自らの数を指数関数的に増やし、次いで、非対称分裂によって神経細胞を生み出す[1]。また、胎生後期や生後の脳では、アストロサイトやオリゴデンドロサイトを生み出すことが知られている。すなわち、神経幹細胞は、中枢神経系を構成する主要な細胞型であるニューロン、アストロサイト、およびオリゴデンドロサイトの供給源となる細胞である(図1)。
神経幹細胞の自己複製と多分化能はbHLH型転写因子によって制御されていると考えられており、自己複製はNotch-Hesシグナルが主要な役割を担う[2]一方で、神経細胞の分化を制御するAscl1、アストロサイトの分化を制御するHes1、オリゴデンドロサイトの分化を制御するOlig2という3種類のbHLH型転写因子が中心となって分化を調節する。最近の研究で、神経幹細胞が自己複製する状態では、これらの転写因子の発現が振動している状態である一方で、分化に向かう際には、単一の分化運命決定因子が持続的に発現する状態であることが明らかになっている[3][4]。
神経幹細胞の分化制御機構モデル
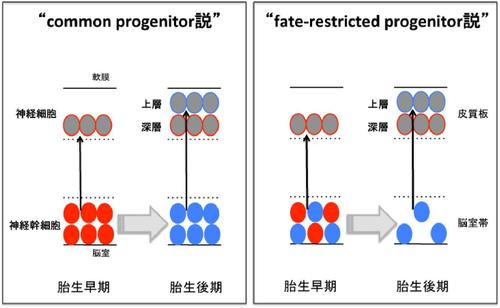
神経幹細胞は比較的均一な細胞集団であると考えられているが、きわめて多種多様な細胞を生み出すことが可能である。この分子機構を解明するために、数多くの研究者が二つの仮説を中心に様々な研究を、これまで展開してきた。
それでは、比較的均一な集団である神経幹細胞は、どのようにして脳を構成する多種多様な細胞を生み出すことができるのであろうか?神経幹細胞が多様な分化細胞を生み出す分子機構を解く上で、二つの仮説が存在し、いずれの説が正しいか、あるいは、両者のいかなる使い分けがあるかについては今後の研究が必要と考えられている(図2)。
Common progenitor説
一つは“common progenitor説”であり、中枢神経系を構成する全ての細胞が、共通の神経幹細胞から生み出されるという考え方である。
大脳皮質では、組織を構成する神経細胞のうち、終脳背側の脳室帯を発生起源とするグルタミン酸作動性の神経細胞は、共通の神経幹細胞が非対称分裂を繰り返す過程で、経時的に発現する転写因子が切り替わり、この結果、神経幹細胞が時間と共に変化すると考えられてきた。これは、発生期のマウス中枢神経系では、ドナーの神経幹細胞を異なる誕生日の脳室帯に移植すると、誕生日の早い神経幹細胞は多様な分化能を示すが、誕生日の遅い神経幹細胞は分化能力が制限されるという知見に基づいている[5]。
実際、大脳皮質発生初期に分化する深層の神経細胞の運命決定は、より誕生日の早いCajal-Retzius細胞への分化を転写因子FoxG1が抑制する一方で[6]、転写因子Fezlが促進することが確認されている[7]。こうした神経幹細胞の時間依存的な性質の変化は、細胞周期の調節が中心的な役割を果たすとの仮説が提唱されてきたが[8]、最近の研究で、細胞周期を止めても幹細胞の時間が進行することが見出されている[9]。
一方、ショウジョウバエ胚中枢神経系では、“common progenitor説”を支持する数多くの重要な知見を見出している。ショウジョウバエ胚中枢神経系では、まず一層の神経上皮からneuroblast (NB)とよばれる神経幹細胞様の細胞が生じ、NBは神経幹細胞様に非対称に分裂し、自己複製とganglion mother cell (GMC)とよばれる小さな神経前駆細胞の産生を繰り返す。GMCは、通常1回だけ分裂して2つの最終分化した神経細胞あるいはグリア細胞を生み出すが、順次、生み出されるGMCは生まれた順番に応じて、NBからそれぞれ異なる個性を与えられる。このとき、NBはHunchback、Krüppel、Pdm、Castor、Grainyheadという5種類の転写因子のセットを順次発現し、その発現を分裂とカップルして切り替えていくことで[10][11][12]、共通の神経幹細胞様の細胞が時間と共に性質を変化する結果として、多様な細胞を生み出すことが可能となる。
しかしながら、脊椎動物においては、特定の神経幹細胞や前駆細胞を個体内で同定することは極めて困難であり、この過程を司る分子メカニズムを追求するには数多くの障壁が存在している。
Fate−restricted progenitor説
もう一つの概念が“fate-restricted progenitor説”であり、発生期の早い時期から異なる細胞系譜の神経幹細胞が混在し、各々が固有の細胞型を生み出すという考え方である。
実際、神経幹細胞が不均一な細胞集団であることは古くから指摘されてきた[13]。たとえば、増殖因子に対する応答性[14]、形態[15]、細胞周期の長さ[16]、など神経幹細胞の不均一性を示唆する様々な報告が認められる。また、発生初期の神経上皮細胞でさえも、多数の異なる細胞集団が観察され、異なるコンピテンスを示す幹細胞型が分取可能であることが示されている[17]。
最近の研究では、大脳皮質発生初期の神経幹細胞に発現する転写因子Fezlを欠損したマウスは、深層の神経細胞の分化が阻止されているにも係らず、後期に誕生する上層の神経細胞は正常なタイミングで分化すること、神経幹細胞の未分化性を一過的に促進した細胞は、深層の神経細胞を生み出すことなしに、正しい時期に上層の神経細胞を生み出すことが可能であることが明らかにされている[18]。
さらには、脳室帯に位置する神経幹細胞は、より未分化性の高い幹細胞集団と比較的分化に傾いた幹細胞集団が不均一に存在しており、これがNotchシグナルの強弱で区別されている[19]ことが見出されている。また、深層の神経細胞で発現する転写因子Fezlと上層の神経細胞で発現する転写因子Cux2が脳室帯の異なる神経幹細胞で発現する可能性も示されている[20]が、これと相反する報告も認められている[21]。一方で、分化した神経細胞でさえも環境に応じて適切に性質が変化する現象が観察されていることから[22]、神経幹細胞の不均一性を司る分子機構は未だ不明な点が多いのが現状である。
胎生期の神経幹細胞と成体の神経幹細胞
齧歯類の成体脳では海馬歯状回や嗅球において、神経細胞を供給し続けていることが知られている。すなわち、脳の発生に寄与した胎生期の神経幹細胞の一部の集団は、成体でも限られた領域において成体神経幹細胞として保持されることで一生に渡って神経細胞を産生し[23]、高次機能の発現に重要な役割を果たすと考えられているが、このような成体神経幹細胞がどのようにして長期間維持できるのかについては未解明の問題として残されていた。最近、成体神経幹細胞の分裂頻度を低く保つ責任因子がp57であることが同定されており[24]、神経幹細胞の分裂できる回数には上限があって、長期間保つためにはp57による細胞周期の制御が決定的な役割を担うことが示唆されている。
今後、脳室帯に局在する神経幹細胞の時間依存的な特性の変化や細胞系譜の多様性を司る分子機構がさらに明確化されることで、成体神経幹細胞による神経新生の分子機構や、これらが破綻することによって生じる様々な疾患との関連性が解明されることが期待される。
関連項目
参考文献
- ↑
Temple, S. (2001).
The development of neural stem cells. Nature, 414(6859), 112-7. [PubMed:11689956] [WorldCat] [DOI] - ↑
Hitoshi, S., Alexson, T., Tropepe, V., Donoviel, D., Elia, A.J., Nye, J.S., ..., & van der Kooy, D. (2002).
Notch pathway molecules are essential for the maintenance, but not the generation, of mammalian neural stem cells. Genes & development, 16(7), 846-58. [PubMed:11937492] [PMC] [WorldCat] [DOI] - ↑
Hirata, H., Yoshiura, S., Ohtsuka, T., Bessho, Y., Harada, T., Yoshikawa, K., & Kageyama, R. (2002).
Oscillatory expression of the bHLH factor Hes1 regulated by a negative feedback loop. Science (New York, N.Y.), 298(5594), 840-3. [PubMed:12399594] [WorldCat] [DOI] - ↑
Imayoshi, I., Isomura, A., Harima, Y., Kawaguchi, K., Kori, H., Miyachi, H., ..., & Kageyama, R. (2013).
Oscillatory control of factors determining multipotency and fate in mouse neural progenitors. Science (New York, N.Y.), 342(6163), 1203-8. [PubMed:24179156] [WorldCat] [DOI] - ↑
Desai, A.R., & McConnell, S.K. (2000).
Progressive restriction in fate potential by neural progenitors during cerebral cortical development. Development (Cambridge, England), 127(13), 2863-72. [PubMed:10851131] [WorldCat] - ↑
Hanashima, C., Li, S.C., Shen, L., Lai, E., & Fishell, G. (2004).
Foxg1 suppresses early cortical cell fate. Science (New York, N.Y.), 303(5654), 56-9. [PubMed:14704420] [WorldCat] [DOI] - ↑
Molyneaux, B.J., Arlotta, P., Hirata, T., Hibi, M., & Macklis, J.D. (2005).
Fezl is required for the birth and specification of corticospinal motor neurons. Neuron, 47(6), 817-31. [PubMed:16157277] [WorldCat] [DOI] - ↑
McConnell, S.K., & Kaznowski, C.E. (1991).
Cell cycle dependence of laminar determination in developing neocortex. Science (New York, N.Y.), 254(5029), 282-5. [PubMed:1925583] [WorldCat] [DOI] - ↑
Okamoto, M., Miyata, T., Konno, D., Ueda, H.R., Kasukawa, T., Hashimoto, M., ..., & Kawaguchi, A. (2016).
Cell-cycle-independent transitions in temporal identity of mammalian neural progenitor cells. Nature communications, 7, 11349. [PubMed:27094546] [PMC] [WorldCat] [DOI] - ↑
Isshiki, T., Pearson, B., Holbrook, S., & Doe, C.Q. (2001).
Drosophila neuroblasts sequentially express transcription factors which specify the temporal identity of their neuronal progeny. Cell, 106(4), 511-21. [PubMed:11525736] [WorldCat] [DOI] - ↑
Kambadur, R., Koizumi, K., Stivers, C., Nagle, J., Poole, S.J., & Odenwald, W.F. (1998).
Regulation of POU genes by castor and hunchback establishes layered compartments in the Drosophila CNS. Genes & development, 12(2), 246-60. [PubMed:9436984] [PMC] [WorldCat] [DOI] - ↑
Pearson, B.J., & Doe, C.Q. (2003).
Regulation of neuroblast competence in Drosophila. Nature, 425(6958), 624-8. [PubMed:14534589] [WorldCat] [DOI] - ↑
Walsh, C., & Cepko, C.L. (1993).
Clonal dispersion in proliferative layers of developing cerebral cortex. Nature, 362(6421), 632-5. [PubMed:8464513] [WorldCat] [DOI] - ↑
Martens, D.J., Tropepe, V., & van Der Kooy, D. (2000).
Separate proliferation kinetics of fibroblast growth factor-responsive and epidermal growth factor-responsive neural stem cells within the embryonic forebrain germinal zone. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(3), 1085-95. [PubMed:10648714] [PMC] [WorldCat] - ↑
Gal, J.S., Morozov, Y.M., Ayoub, A.E., Chatterjee, M., Rakic, P., & Haydar, T.F. (2006).
Molecular and morphological heterogeneity of neural precursors in the mouse neocortical proliferative zones. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(3), 1045-56. [PubMed:16421324] [PMC] [WorldCat] [DOI] - ↑
Malatesta, P., Hartfuss, E., & Götz, M. (2000).
Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage. Development (Cambridge, England), 127(24), 5253-63. [PubMed:11076748] [WorldCat] - ↑
Maric, D., Maric, I., Chang, Y.H., & Barker, J.L. (2003).
Prospective cell sorting of embryonic rat neural stem cells and neuronal and glial progenitors reveals selective effects of basic fibroblast growth factor and epidermal growth factor on self-renewal and differentiation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(1), 240-51. [PubMed:12514221] [PMC] [WorldCat] - ↑
Mizutani, K., & Saito, T. (2005).
Progenitors resume generating neurons after temporary inhibition of neurogenesis by Notch activation in the mammalian cerebral cortex. Development (Cambridge, England), 132(6), 1295-304. [PubMed:15750183] [WorldCat] [DOI] - ↑
Mizutani, K., Yoon, K., Dang, L., Tokunaga, A., & Gaiano, N. (2007).
Differential Notch signalling distinguishes neural stem cells from intermediate progenitors. Nature, 449(7160), 351-5. [PubMed:17721509] [WorldCat] [DOI] - ↑
Franco, S.J., Gil-Sanz, C., Martinez-Garay, I., Espinosa, A., Harkins-Perry, S.R., Ramos, C., & Müller, U. (2012).
Fate-restricted neural progenitors in the mammalian cerebral cortex. Science (New York, N.Y.), 337(6095), 746-9. [PubMed:22879516] [PMC] [WorldCat] [DOI] - ↑
Guo, C., Eckler, M.J., McKenna, W.L., McKinsey, G.L., Rubenstein, J.L., & Chen, B. (2013).
Fezf2 expression identifies a multipotent progenitor for neocortical projection neurons, astrocytes, and oligodendrocytes. Neuron, 80(5), 1167-74. [PubMed:24314728] [PMC] [WorldCat] [DOI] - ↑
Oishi, K., Nakagawa, N., Tachikawa, K., Sasaki, S., Aramaki, M., Hirano, S., ..., & Nakajima, K. (2016).
Identity of neocortical layer 4 neurons is specified through correct positioning into the cortex. eLife, 5. [PubMed:26880563] [PMC] [WorldCat] [DOI] - ↑
ALTMAN, J. (1962).
Are new neurons formed in the brains of adult mammals? Science (New York, N.Y.), 135(3509), 1127-8. [PubMed:13860748] [WorldCat] [DOI] - ↑
Furutachi, S., Miya, H., Watanabe, T., Kawai, H., Yamasaki, N., Harada, Y., ..., & Gotoh, Y. (2015).
Slowly dividing neural progenitors are an embryonic origin of adult neural stem cells. Nature neuroscience, 18(5), 657-65. [PubMed:25821910] [WorldCat] [DOI]