「閾値」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の5版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:Threshold | |||
[[ファイル:閾値_図1.jpg|thumb|250xpx|図1:閾値の概念図<br> ある入力値を境にして出力が変化するとき、その値を閾値と呼ぶ。この場合、入力=5が閾値。]] | |||
閾値は、ある現象を引き起こすのに必要な入力や刺激の大きさを表す値である(図1)。[[wikipedia:JA:非線形|非線形]]な応答を示す現象については、多くの場合で閾値を定義できるため、[[wikipedia:JA:生物学|生物学]]・[[wikipedia:JA:化学|化学]]・[[wikipedia:JA:物理学|物理学]]の分野で広く使われる概念である。 | |||
[[ファイル:閾値_図1.jpg|thumb|250xpx| | 神経科学の分野においては、[[活動電位]]の発生に必要な刺激強度、動物に特定の応答を引き起こす感覚刺激の強度についての閾値が知られている。その他に、[[シナプス可塑性]]誘導に必要な電気刺激の強度、細胞内[[Ca<sup>2+</sup>]]濃度上昇の大きさなどについても、閾値という言葉が用いられる。閾値の一般的な意味から、特定の値を境にして現象が起こるか否かが決まると思われがちであるが、生命現象で観察される閾値は状況によって変化することが多い。 | ||
==活動電位の閾値== | ==活動電位の閾値== | ||
[[ファイル:閾値_図2.jpg|thumb|250xpx| | [[ファイル:閾値_図2.jpg|thumb|250xpx|図2:活動電位の閾値<br> 閾値を越える脱分極が生じたときのみ、活動電位(赤)が発生する。]] | ||
[[神経細胞]]を[[脱分極]]させる刺激(シナプス入力または電気刺激)が入力すると、開状態になる[[ナトリウムチャネル|電位依存性Na<sup>+</sup>チャネル]]の数が増加する。そして、細胞内へのNa<sup>+</sup>流入がさらなる脱分極を引き起こし、それがさらに多くのNa<sup>+</sup>チャネルを開状態にする。この[[wikipedia:JA:ポジティブフィードバック|ポジティブフィードバック]]によって、活動電位が全か無かの法則に従って発生する。つまり、電位依存性Na<sup>+</sup>チャネルのポジティブフィードバックを駆動するのに必要な脱分極の大きさが、活動電位発生の際に観察される閾値([[閾膜電位]] | [[神経細胞]]を[[脱分極]]させる刺激(シナプス入力または電気刺激)が入力すると、開状態になる[[ナトリウムチャネル|電位依存性Na<sup>+</sup>チャネル]]の数が増加する。そして、細胞内へのNa<sup>+</sup>流入がさらなる脱分極を引き起こし、それがさらに多くのNa<sup>+</sup>チャネルを開状態にする。この[[wikipedia:JA:ポジティブフィードバック|ポジティブフィードバック]]によって、活動電位が全か無かの法則に従って発生する。つまり、電位依存性Na<sup>+</sup>チャネルのポジティブフィードバックを駆動するのに必要な脱分極の大きさが、活動電位発生の際に観察される閾値([[閾膜電位]])である(図2)。より厳密には、脱分極を引き起こすNa<sup>+</sup>流入と、[[過分極]]を引き起こすK<sup>+</sup>流出およびCl<sup>-</sup>流入とがつり合う電位が、閾膜電位である。そして、その均衡がNa<sup>+</sup>流入に傾くと活動電位が発生する<ref>''' Dale Purves, George J. Augustine, David Fitzpatrick, William C. Hall, Anthony-Samuel LaMantia, James O. McNamara, and Leonard E. White'''<br> Neuroscience, Fourth Edition, Chapter 3<br> ''SINAUER'' : 2008</ref>。 | ||
活動電位発生と電位依存性Na<sup>+</sup>チャネルが引き起こすポジティブフィードバックとの関連性から、活動電位発生の閾値=電位依存性Na<sup>+</sup>チャネルが開く閾値と誤解されることがある。しかし、電位依存性Na<sup>+</sup>チャネルが開くこと自体には閾値はなく、[[膜電位]]に応じて開状態をとる確率が変化するだけである<ref>'''Bertil Hille'''<br>Ion Channels of Excitable Membranes, Third Edition, Chapter 3 and 19<br>''SINAUER'' : 2001</ref>。そして、不活性化状態にある電位依存性Na<sup>+</sup>チャネルの割合や、Na<sup>+</sup>電流に拮抗する電流の大きさに応じて、ポジティブフィードバックの駆動に必要な脱分極の大きさまたはそれを引き起こす刺激の強さが変化する。例えば、活動電位発生直後の相対不応期には不活性化状態のNa<sup>+</sup>チャネルが多く、またNa<sup>+</sup>の細胞内流入に拮抗するK<sup>+</sup>の流出が増加しているために、閾値が大きくなる<ref>'''本郷利憲、廣重力、豊田順一'''<br> | 活動電位発生と電位依存性Na<sup>+</sup>チャネルが引き起こすポジティブフィードバックとの関連性から、活動電位発生の閾値=電位依存性Na<sup>+</sup>チャネルが開く閾値と誤解されることがある。しかし、電位依存性Na<sup>+</sup>チャネルが開くこと自体には閾値はなく、[[膜電位]]に応じて開状態をとる確率が変化するだけである<ref>'''Bertil Hille'''<br>Ion Channels of Excitable Membranes, Third Edition, Chapter 3 and 19<br>''SINAUER'' : 2001</ref>。そして、不活性化状態にある電位依存性Na<sup>+</sup>チャネルの割合や、Na<sup>+</sup>電流に拮抗する電流の大きさに応じて、ポジティブフィードバックの駆動に必要な脱分極の大きさまたはそれを引き起こす刺激の強さが変化する。例えば、活動電位発生直後の相対不応期には不活性化状態のNa<sup>+</sup>チャネルが多く、またNa<sup>+</sup>の細胞内流入に拮抗するK<sup>+</sup>の流出が増加しているために、閾値が大きくなる<ref>'''本郷利憲、廣重力、豊田順一'''<br>標準生理学、第7版、第2章<br>''医学書院'' : 2009</ref>。 | ||
==感覚応答の閾値== | ==感覚応答の閾値== | ||
| 30行目: | 19行目: | ||
==樹状突起応答の閾値== | ==樹状突起応答の閾値== | ||
神経細胞は[[樹状突起]] | 神経細胞は[[樹状突起]](dendrite)で受ける興奮性シナプス入力と、[[抑制性シナプス]]入力を[[細胞体]]で統合し、活動電位という出力へと変換すると考えられてきた。しかし近年、[[大脳皮質]]5層[[錐体細胞]]および[[海馬]][[CA1]]錐体細胞で、[[樹状突起]]の比較的近い部位の[[興奮性シナプス]]が一定数以上同時に活性化すると、各々による脱分極の[[線形和]]を越えた脱分極が起こり、それが細胞体に伝わることが報告された<ref><pubmed> 10749211 </pubmed></ref>。シナプス入力を[[樹状突起]]で統合して細胞体へ伝えるこの現象は[[dendritic spike]]と呼ばれ、細胞レベルでの情報処理に重要な役割を果たすと考えられている。活動電位と同様に、[[非線形]]な脱分極を引き起こすのに必要な脱分極の大きさが閾値と呼ばれている。 | ||
==シナプス可塑性誘導の閾値== | ==シナプス可塑性誘導の閾値== | ||
[[ファイル:閾値_図3.jpg|thumb|250xpx| | [[ファイル:閾値_図3.jpg|thumb|250xpx|図3:シナプス可塑性の閾値<br> 500 msの脱分極パルスを0分に与えると、その後GABAに対する電流応答(上段)の増大が持続する(下段、赤)。一方、100 ms以下の脱分極パルスでは電流応答の増大が起こらない。(Kitagawa et al., 2009より転載。)]] | ||
[[シナプス可塑性]]は、[[シナプス]]の活動状況等により情報伝達効率が変化する現象で、[[学習]]・[[記憶]] | [[シナプス可塑性]]は、[[シナプス]]の活動状況等により情報伝達効率が変化する現象で、[[学習]]・[[記憶]]の基盤と考えられている。[[シナプス可塑性]]を誘導するような刺激の頻度や強度、あるいはそのような刺激が引き起こす細胞内Ca<sup>2+</sup>濃度上昇の大きさが、[[シナプス可塑性]]誘導の閾値である。閾値以上の刺激は、[[細胞内情報伝達系]]の[[フィードバック]]反応を誘導して安定状態を変化させたり、[[シナプス後肥厚]]に存在する[[受容体]]や[[足場蛋白質]]の変化を促し、[[シナプス]]の機能変化を安定化・長期化する(図3)。<br> | ||
[[シナプス可塑性]]誘導に関わるポジティブフィードバック反応として、[[カルシウムカルモジュリン依存性蛋白質キナーゼ|Ca<sup>2+</sup>/CaM依存性プロテインキナーゼII]](CaMKII)の自己[[リン酸化]]反応や、[[プロテインキナーゼC]](PKC)-[[分裂促進因子活性化蛋白質キナーゼ|MAPキナーゼ]](MAPK)経路に見られるような多数の酵素反応を介したポジティブフィードバック反応が知られている。これらのポジティブフィードバック反応は、多数の酵素反応を含むシグナル伝達系により制御されるため、その閾値がどのように調節されるのかを直観的に理解することが難しい。この問題を克服する手段として、コンピュータモデルによるシミュレーションが用いられ、細胞生物学実験による実証を経て、[[シナプス可塑性]]の閾値制御メカニズムについての理解が進んでいる<ref><pubmed> 17553426 </pubmed></ref><ref><pubmed> 19536203 </pubmed></ref>。<br> | |||
[[シナプス可塑性]]誘導の閾値は、様々な状況に応じて変化する。例えば、[[シナプス]]の活動履歴や、近隣の[[シナプス]]での可塑性により閾値が上下することが分かっている<ref><pubmed> 1346729 </pubmed></ref><ref><pubmed> 18097401</pubmed></ref>。このような[[シナプス可塑性]]誘導の閾値変化は、学習しやすさと関係し、また神経回路形成過程にもかかわると考えられている。 | |||
==参考文献== | |||
<references /> | |||
(執筆者:長崎信博、平野丈夫 担当編集委員:林康紀) | |||
2012年4月5日 (木) 16:00時点における版
英語名:Threshold
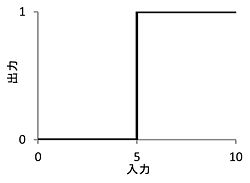
ある入力値を境にして出力が変化するとき、その値を閾値と呼ぶ。この場合、入力=5が閾値。
閾値は、ある現象を引き起こすのに必要な入力や刺激の大きさを表す値である(図1)。非線形な応答を示す現象については、多くの場合で閾値を定義できるため、生物学・化学・物理学の分野で広く使われる概念である。 神経科学の分野においては、活動電位の発生に必要な刺激強度、動物に特定の応答を引き起こす感覚刺激の強度についての閾値が知られている。その他に、シナプス可塑性誘導に必要な電気刺激の強度、細胞内[[Ca2+]]濃度上昇の大きさなどについても、閾値という言葉が用いられる。閾値の一般的な意味から、特定の値を境にして現象が起こるか否かが決まると思われがちであるが、生命現象で観察される閾値は状況によって変化することが多い。
活動電位の閾値
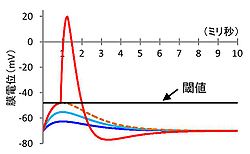
閾値を越える脱分極が生じたときのみ、活動電位(赤)が発生する。
神経細胞を脱分極させる刺激(シナプス入力または電気刺激)が入力すると、開状態になる電位依存性Na+チャネルの数が増加する。そして、細胞内へのNa+流入がさらなる脱分極を引き起こし、それがさらに多くのNa+チャネルを開状態にする。このポジティブフィードバックによって、活動電位が全か無かの法則に従って発生する。つまり、電位依存性Na+チャネルのポジティブフィードバックを駆動するのに必要な脱分極の大きさが、活動電位発生の際に観察される閾値(閾膜電位)である(図2)。より厳密には、脱分極を引き起こすNa+流入と、過分極を引き起こすK+流出およびCl-流入とがつり合う電位が、閾膜電位である。そして、その均衡がNa+流入に傾くと活動電位が発生する[1]。
活動電位発生と電位依存性Na+チャネルが引き起こすポジティブフィードバックとの関連性から、活動電位発生の閾値=電位依存性Na+チャネルが開く閾値と誤解されることがある。しかし、電位依存性Na+チャネルが開くこと自体には閾値はなく、膜電位に応じて開状態をとる確率が変化するだけである[2]。そして、不活性化状態にある電位依存性Na+チャネルの割合や、Na+電流に拮抗する電流の大きさに応じて、ポジティブフィードバックの駆動に必要な脱分極の大きさまたはそれを引き起こす刺激の強さが変化する。例えば、活動電位発生直後の相対不応期には不活性化状態のNa+チャネルが多く、またNa+の細胞内流入に拮抗するK+の流出が増加しているために、閾値が大きくなる[3]。
感覚応答の閾値
動物個体では、感覚器官の応答を引き起こす刺激の強度が閾値と呼ばれる。例えば、視覚応答に必要な光の強度に閾値がある。網膜の光受容細胞には桿体と錐体の2種類がある。桿体は色を識別できないが、微弱な光を検出できる。一方、錐体は異なる波長の光に応答する複数のタイプがあるため色を識別できるが、弱い光を検出できない。このように、網膜における光応答には2種類の閾値があり、桿体のほうが錐体よりも応答の閾値が低くなっている[4]。動物は、各感覚系において様々な閾値現象を組み合わせて用いることで、外環境を適切に認識し、その変化に対応している。
樹状突起応答の閾値
神経細胞は樹状突起(dendrite)で受ける興奮性シナプス入力と、抑制性シナプス入力を細胞体で統合し、活動電位という出力へと変換すると考えられてきた。しかし近年、大脳皮質5層錐体細胞および海馬CA1錐体細胞で、樹状突起の比較的近い部位の興奮性シナプスが一定数以上同時に活性化すると、各々による脱分極の線形和を越えた脱分極が起こり、それが細胞体に伝わることが報告された[5]。シナプス入力を樹状突起で統合して細胞体へ伝えるこの現象はdendritic spikeと呼ばれ、細胞レベルでの情報処理に重要な役割を果たすと考えられている。活動電位と同様に、非線形な脱分極を引き起こすのに必要な脱分極の大きさが閾値と呼ばれている。
シナプス可塑性誘導の閾値
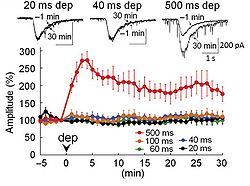
500 msの脱分極パルスを0分に与えると、その後GABAに対する電流応答(上段)の増大が持続する(下段、赤)。一方、100 ms以下の脱分極パルスでは電流応答の増大が起こらない。(Kitagawa et al., 2009より転載。)
シナプス可塑性は、シナプスの活動状況等により情報伝達効率が変化する現象で、学習・記憶の基盤と考えられている。シナプス可塑性を誘導するような刺激の頻度や強度、あるいはそのような刺激が引き起こす細胞内Ca2+濃度上昇の大きさが、シナプス可塑性誘導の閾値である。閾値以上の刺激は、細胞内情報伝達系のフィードバック反応を誘導して安定状態を変化させたり、シナプス後肥厚に存在する受容体や足場蛋白質の変化を促し、シナプスの機能変化を安定化・長期化する(図3)。
シナプス可塑性誘導に関わるポジティブフィードバック反応として、Ca2+/CaM依存性プロテインキナーゼII(CaMKII)の自己リン酸化反応や、プロテインキナーゼC(PKC)-MAPキナーゼ(MAPK)経路に見られるような多数の酵素反応を介したポジティブフィードバック反応が知られている。これらのポジティブフィードバック反応は、多数の酵素反応を含むシグナル伝達系により制御されるため、その閾値がどのように調節されるのかを直観的に理解することが難しい。この問題を克服する手段として、コンピュータモデルによるシミュレーションが用いられ、細胞生物学実験による実証を経て、シナプス可塑性の閾値制御メカニズムについての理解が進んでいる[6][7]。
シナプス可塑性誘導の閾値は、様々な状況に応じて変化する。例えば、シナプスの活動履歴や、近隣のシナプスでの可塑性により閾値が上下することが分かっている[8][9]。このようなシナプス可塑性誘導の閾値変化は、学習しやすさと関係し、また神経回路形成過程にもかかわると考えられている。
参考文献
- ↑ Dale Purves, George J. Augustine, David Fitzpatrick, William C. Hall, Anthony-Samuel LaMantia, James O. McNamara, and Leonard E. White
Neuroscience, Fourth Edition, Chapter 3
SINAUER : 2008 - ↑ Bertil Hille
Ion Channels of Excitable Membranes, Third Edition, Chapter 3 and 19
SINAUER : 2001 - ↑ 本郷利憲、廣重力、豊田順一
標準生理学、第7版、第2章
医学書院 : 2009 - ↑ Dale Purves, George J. Augustine, David Fitzpatrick, William C. Hall, Anthony-Samuel LaMantia, James O. McNamara, and Leonard E. White
Neuroscience, Fourth Edition, Chapter 11
SINAUER : 2008 - ↑
Schiller, J., Major, G., Koester, H.J., & Schiller, Y. (2000).
NMDA spikes in basal dendrites of cortical pyramidal neurons. Nature, 404(6775), 285-9. [PubMed:10749211] [WorldCat] [DOI] - ↑
Tanaka, K., Khiroug, L., Santamaria, F., Doi, T., Ogasawara, H., Ellis-Davies, G.C., ..., & Augustine, G.J. (2007).
Ca2+ requirements for cerebellar long-term synaptic depression: role for a postsynaptic leaky integrator. Neuron, 54(5), 787-800. [PubMed:17553426] [WorldCat] [DOI] - ↑
Kitagawa, Y., Hirano, T., & Kawaguchi, S.Y. (2009).
Prediction and validation of a mechanism to control the threshold for inhibitory synaptic plasticity. Molecular systems biology, 5, 280. [PubMed:19536203] [PMC] [WorldCat] [DOI] - ↑
Huang, Y.Y., Colino, A., Selig, D.K., & Malenka, R.C. (1992).
The influence of prior synaptic activity on the induction of long-term potentiation. Science (New York, N.Y.), 255(5045), 730-3. [PubMed:1346729] [WorldCat] [DOI] - ↑
Harvey, C.D., & Svoboda, K. (2007).
Locally dynamic synaptic learning rules in pyramidal neuron dendrites. Nature, 450(7173), 1195-200. [PubMed:18097401] [PMC] [WorldCat] [DOI]
(執筆者:長崎信博、平野丈夫 担当編集委員:林康紀)