「依存症」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (4人の利用者による、間の22版が非表示) | |||
| 1行目: | 1行目: | ||
依存症とは、精神に作用する[[wikipedia:JA:化学物質|化学物質]]の摂取や、ある種の快感や高揚感を伴う行為を繰り返し行った結果、それらの刺激を求める耐えがたい欲求が生じ、その刺激を追い求める行為が優勢となり、その刺激がないと不快な精神的・身体的症状を生じる、精神的・身体的・行動的状態のことである。依存症は、(1)物質依存、(2)行為・過程依存、(3)ある特定の人物に依存する関係依存、に大別される。物質依存には、[[wikipedia:JA:薬物依存|薬物依存]]、[[wikipedia:JA:ニコチン依存|ニコチン依存]]、[[wikipedia:JA:食物依存|食物依存]]などがある。行為・過程依存には、[[wikipedia:JA:買い物依存|買い物依存]]、[[wikipedia:JA:ギャンブル依存|ギャンブル依存]]、[[wikipedia:JA:セックス依存|セックス依存]]、最近では、携帯電話・ゲーム機、インターネット、テレビゲームへの依存などがある。関係依存には、共依存(人に必要とされることに依存)などがある。 | |||
特に物質依存は依存性物質を心身に重大な障害や苦痛を引き起こすほどに使用し、それらの物質に対する耐性や離脱などの問題が生じている精神疾患であり、深刻な社会問題となっている。依存性物質には違法薬物のみでなく[[wikipedia:JA:アルコール|アルコール]]など私たちの日常生活に身近な物質も含まれる。依存性物質の種類としては、中枢神経系抑制薬(アルコール、[[モルヒネ]]、[[睡眠薬]]など)、中枢神経系興奮薬([[メタンフェタミン]]などの[[覚せい剤]]、[[コカイン]]など)あるいは精神異常発現薬([[大麻]]、[[LSD]] など)などがあり、薬理作用の異なる種々の物質が依存を誘発する。 | |||
== 診断基準 == | == 診断基準 == | ||
| 41行目: | 20行目: | ||
=== DSM-IV === | === DSM-IV === | ||
DSM-IVの診断基準においては物質関連障害が物質使用障害と物質誘発性障害から構成され、物質使用障害は物質依存と物質乱用から構成される。物質依存は臨床的に重大な障害や苦痛を引き起こす物質使用の不適応的な様式で、以下の3つ(またはそれ以上)が、同じ12ヶ月の期間内のどこかで起こることによって示される。 | |||
#耐性、以下のいずれかによって定義されるもの:<br>A. 酩酊または希望の効果を得るために、著しく増大した量の物質が必要<br>B. 物質の同じ量の持続使用により、著しく効果が減弱 | #耐性、以下のいずれかによって定義されるもの:<br>A. 酩酊または希望の効果を得るために、著しく増大した量の物質が必要<br>B. 物質の同じ量の持続使用により、著しく効果が減弱 | ||
| 53行目: | 32行目: | ||
== 疫学 == | == 疫学 == | ||
平成20年の[[ | 平成20年の[[wikipedia:JA:厚生労働省|厚生労働省]]の患者調査によるとアルコール依存症の推計患者数は13100人(総患者数44000人)とされているが、一方で日本の一般人口1億2000万人における調査では約80万人がアルコール依存症であるとされており<ref>'''尾崎米厚、松下幸生、白坂知信、廣 尚典、樋口 進'''<br>わが国の成人飲酒行動およびアルコール症に関する全国調査<br>''日本アルコール・薬物医学会雑'':2005, 40(5), 455–70</ref>、治療を受けていないアルコール依存症罹患者が多く存在するという点においても大きな問題があると言える。平成19年の[[wikipedia:JA:警察庁|警察庁]]、厚生労働省、[[wikipedia:JA:海上保安庁|海上保安庁]]の調査によると、国内の薬物事犯検挙人数は、覚せい剤12211名、麻薬・抗精神薬が542名、[[アヘン]]が47名、大麻が2375名と報告されている。 | ||
== 依存症の脳内メカニズム == | == 依存症の脳内メカニズム == | ||
| 61行目: | 40行目: | ||
=== 依存性物質と報酬系 === | === 依存性物質と報酬系 === | ||
依存性物質は[[シナプス伝達]]に影響を与える特異的な標的、たとえば[[モノアミントランスポーター]]、[[オピオイド受容体]]、[[カンナビノイド受容体]]、[[ | 依存性物質は[[シナプス伝達]]に影響を与える特異的な標的、たとえば[[モノアミントランスポーター]]、[[オピオイド受容体]]、[[カンナビノイド受容体]]、[[セロトニン受容体]]、[[NMDA型グルタミン酸受容体]]、[[GABA受容体]]、[[ニコチン性アセチルコリン受容体]]、[[アデノシン受容体]]などに作用する(図1)。これらの作用が次の標的分子へ作用するといった連鎖の結果、最終的に快情動(報酬効果)を発現させる。依存性薬物が共通に作用する部位として[[腹側被蓋野]]の[[ドーパミン神経細胞]]から[[辺縁系]]、特に[[側坐核]]に投射する神経回路がある<ref><pubmed>9768834</pubmed></ref><ref><pubmed>11252991</pubmed></ref><ref><pubmed>15102958</pubmed></ref>。快情動を伴う体験をするときに、中脳の腹側被蓋野から前脳の側坐核へむかってのびているドーパミン神経細胞がドーパミンを放出し、ドーパミンを受け取った側坐核のニューロンで反応が起きることによって快情動が生じる。通常ドーパミン神経細胞は[[抑制性ニューロン]]によって働きが抑えられているが、依存性物質が抑制性ニューロンの働きを抑えることなどによって、ドーパミン神経細胞から[[ドーパミン]]が大量に放出される。依存症では、その快情動の再体験を求めて依存性物質の使用と快情動の体験が繰り返されることで、依存性物質の使用が強化される。 | ||
また、側坐核にはモルヒネや[[ヘロイン]] | また、側坐核にはモルヒネや[[ヘロイン]]などの麻薬の受容体が存在することから、依存性物質の報酬効果にはドーパミン系に加えて[[オピオイド]]系も重要である<ref><pubmed>1346804</pubmed></ref>。オピオイド受容体以外にも依存性物質の標的分子は側坐核や腹側被蓋野に投射する神経細胞に多数存在する。 | ||
近年では[[分界条床核]]、[[扁桃体]][[中心核]]、[[側坐核]] | 近年では[[分界条床核]]、[[扁桃体]][[中心核]]、[[側坐核]]内側移行帯などの[[拡張扁桃体]]と呼ばれる辺縁系の脳部位が、依存性物質の報酬に関わっていることも知られている。[[前頭前野皮質]]に投射する神経回路は薬物誘発性の薬物再摂取に関与し、依存性物質に対する渇望感において重要な役割を担っていると考えられる。 | ||
=== 依存症におけるGIRKチャネルと報酬系の関連 === | === 依存症におけるGIRKチャネルと報酬系の関連 === | ||
[[ | [[G蛋白質活性型内向き整流性カリウムチャネル]](G protein-activated inwardly rectifying potassium channel: GIRKチャネル)は依存性物質のシグナル伝達において重要な役割を果たしている。様々な[[G<sub>i/o</sub>蛋白質共役型受容体]]に[[神経伝達物質]]が作用することによって[[G<sub>i/o</sub>蛋白質]]が活性化され、G蛋白質αサブユニットから遊離したG蛋白質βγサブユニットがGIRKチャネルを直接開口する<ref><pubmed>10997585</pubmed></ref><ref><pubmed>17168757</pubmed></ref>。また、エタノールはGIRKチャネルを直接開口することも見出されている<ref name="ref8"><pubmed>10570486</pubmed></ref><ref><pubmed>10570485</pubmed></ref>。GIRKチャネルの開口によって細胞膜は[[過分極]]化し、神経細胞の興奮性を調節する。[[wikipedia:JA:哺乳類|哺乳類]]において4つのGIRKチャネルサブユニットが知られている<ref><pubmed>8355805</pubmed></ref><ref><pubmed>7877685</pubmed></ref><ref><pubmed>7499385</pubmed></ref>。GIRK2サブユニットに1つのアミノ酸変異(カリウムイオンだけでなくナトリウムイオンも透過させ、G蛋白質制御も消失している)を持つウィーバーミュータントマウスでは、[[小脳顆粒細胞]]や[[黒質]]ドーパミン神経細胞、[[橋核]]神経細胞における[[神経細胞死]]が生じており、モルヒネおよびエタノールによる鎮痛が減弱している<ref name="ref8" /><ref><pubmed>12354627</pubmed></ref>。したがって、GIRKチャネルがモルヒネやエタノールの鎮痛効果において決定的な役割を果たすと考えられる。さらに、GIRKチャネル欠損マウスでは、コカインの自己投与が消失することも示されている<ref><pubmed>12637950</pubmed></ref>。また、開腹手術の患者を対象にした研究では、GIRK2サブユニットのA1032G多型がA/Aタイプの場合、脳内のGIRK2サブユニットのメッセンジャーRNA量が減少することによって、GIRKサブユニット蛋白質量も減少して、オピオイド感受性が低下するために、術後の疼痛に対して必要なオピオイド投与回数が増加している可能性が示唆されている<ref><pubmed>19756153</pubmed></ref>。 | ||
=== 各依存性物質の脳神経画像研究 === | === 各依存性物質の脳神経画像研究 === | ||
[[ポジトロンCT]](positron emission tomography: | [[ポジトロンCT]](positron emission tomography: PET)を用いた脳画像研究の発展に伴い、ヒト脳内の[[受容体]]、[[トランスポーター]]などを定量評価することが可能になり、依存症の病態が解明されつつある<ref>'''橋本謙二(著)、福居顯二(編)'''<br>III章 物質依存の神経生物学的基盤 物質依存の神経画像(脳とこころのプライマリケア(8)依存)<br>''株式会社シナジー''、2011</ref>。近年の依存症の脳神経画像研究の成果を以下に示す。 | ||
==== アルコール ==== | ==== アルコール ==== | ||
オピオイド受容体の[[ | オピオイド受容体の[[μサブタイプ]]は、アルコールによる報酬、耐性、離脱に関連している。近年のPET研究によると、アルコール依存症患者の脳内腹側線条体におけるμオピオイド受容体が増加しており、その増加はアルコールの渇望感と関連することが報告されている<ref><pubmed>15630073</pubmed></ref>。また断酒中のアルコール依存症患者における[[前帯状皮質]]のオピオイド受容体と渇望感との相関も認められている<ref><pubmed>19595579</pubmed></ref>。断酒中のアルコール依存症患者の線条体におけるドーパミン合成能やドーパミン[[D<sub>2</sub>・D<sub>3</sub>受容体]]結合能とアルコールに対する渇望が相関している<ref><pubmed>16055774</pubmed></ref>。断酒中のアルコール依存患者において腹側線条体の[[セロトニン受容体1B]]受容体(5-HT<sub>1B</sub>)の結合能が上昇していることも報告されている<ref><pubmed>20172504</pubmed></ref>。 | ||
==== | ==== 覚せい剤 ==== | ||
覚せい剤は主に脳内ドーパミン神経終末に作用し、シナプス間隙におけるドーパミン量を増加させることによって薬理作用を出現させる。覚せい剤の使用は長期にわたり脳内ドーパミン神経終末に障害を及ぼすことが脳神経画像研究から明らかになっている。たとえば、覚せい剤乱用者では、大脳基底核におけるドーパミンD<sub>2</sub>受容体が減少しており、ドーパミンD<sub>2</sub>受容体と[[眼窩前頭皮質]]における局所糖代謝率が関連して<ref><pubmed>11729018</pubmed></ref>、薬物依存症患者の線条体におけるドーパミンD<sub>2</sub>・D<sub>3</sub>受容体利用率が健常者より低下しており、この低下が患者の衝動性と負の相関関係にあることが報告されている<ref><pubmed>19940168</pubmed></ref> | |||
また、覚せい剤はセロトニン神経系にも作用する。PET研究により、覚せい剤使用経験者の脳内[[セロトニントランスポーター]](5-hydroxytryptamine transporter: 5-HTT)の密度が健常者よりも低下していること、その低下が彼らの攻撃性の強さと相関していることが報告されている<ref><pubmed>16389202</pubmed></ref>。 | |||
また断薬後も数年の間は脳内活性型[[ミクログリア]]の密度が健常者よりも上昇しており、このことが神経障害の継続に関連している可能性も示されている<ref><pubmed>18509037</pubmed></ref>。 | また断薬後も数年の間は脳内活性型[[ミクログリア]]の密度が健常者よりも上昇しており、このことが神経障害の継続に関連している可能性も示されている<ref><pubmed>18509037</pubmed></ref>。 | ||
| 91行目: | 68行目: | ||
==== 合成麻薬MDMA ==== | ==== 合成麻薬MDMA ==== | ||
脳画像研究では、 | 脳画像研究では、[[MDMA]]を使用した者において脳の多くの領域で5-HTTの減少が認められ、断薬によってその減少は回復すると報告されている<ref><pubmed>16847678</pubmed></ref>。 | ||
==== ニコチン ==== | ==== ニコチン ==== | ||
PET研究によると、喫煙によって脳内線条体におけるドーパミン放出が増加することがニコチン依存の形成にかかわると考えられている<ref><pubmed>15979645</pubmed></ref>。喫煙依存者で喫煙による側坐核におけるドーパミン放出が[[ドーパミントランスポーター]](DAT)、[[ | PET研究によると、喫煙によって脳内線条体におけるドーパミン放出が増加することがニコチン依存の形成にかかわると考えられている<ref><pubmed>15979645</pubmed></ref>。喫煙依存者で喫煙による側坐核におけるドーパミン放出が[[ドーパミントランスポーター]](DAT)、[[ドーパミンD<sub>4</sub>受容体]]、catechol O-methyl transferase(COMT)と関連することも報告されている<ref><pubmed>16818870</pubmed></ref>。 | ||
==== ヘロイン ==== | ==== ヘロイン ==== | ||
| 103行目: | 80行目: | ||
==== 大麻 ==== | ==== 大麻 ==== | ||
[[fMRI]]を用いた研究<ref><pubmed>19656642</pubmed></ref> | [[fMRI]]を用いた研究<ref><pubmed>19656642</pubmed></ref>では、慢性的で重度の大麻使用者は感情を表す顔(幸せあるいは恐怖)をマスクした状況でも前頭葉や辺縁系が変化していた。この結果は、大麻使用者は提示される刺激が意識処理より下の段階にある時でさえ、情動処理が異なっており、感情に関する情報処理が異なる可能性が強調されている。 | ||
==== ギャンブル ==== | ==== ギャンブル ==== | ||
[[wikipedia:JA:ギャンブル|ギャンブル]]依存ではセロトニンの機能異常、尿中、血中、髄液中の[[ノルアドレナリン]]代謝産物レベルが上昇していることや[[αアドレナリン受容体]][[拮抗薬]]に対する成長ホルモン反応が増大していることからノルアドレナリン機能異常、髄液中のドーパミンレベルの低下およびドーパミン代謝産物レベルの上昇が見られることからドーパミンの代謝回転の上昇が報告されている<ref><pubmed>12635538</pubmed></ref>。 | |||
ギャンブルに関する刺激と感情(悲しみ、幸福感)に関する刺激を提示してfMRIによる脳神経画像をギャンブル依存者と健常人を比較すると、ギャンブル依存の人は情動・モチベーションに反応が生じる際の脳活動と情動やモチベーションの自己報告との相関の強さがより顕著であり、ギャンブルへの衝動性の主観的評価と[[内側前頭前野皮質]]の活動との負の相関、[[中側頭回]]および[[側頭極]]の活動との正の相関を示した<ref><pubmed>21811809</pubmed></ref>。 | ギャンブルに関する刺激と感情(悲しみ、幸福感)に関する刺激を提示してfMRIによる脳神経画像をギャンブル依存者と健常人を比較すると、ギャンブル依存の人は情動・モチベーションに反応が生じる際の脳活動と情動やモチベーションの自己報告との相関の強さがより顕著であり、ギャンブルへの衝動性の主観的評価と[[内側前頭前野皮質]]の活動との負の相関、[[中側頭回]]および[[側頭極]]の活動との正の相関を示した<ref><pubmed>21811809</pubmed></ref>。 | ||
| 115行目: | 92行目: | ||
=== 薬物療法 === | === 薬物療法 === | ||
依存症の主症状である精神依存の治療において、患者―治療者間の信頼関係の構築、個人あるいは集団による精神療法、地域での支援(自助グループ等)が中心であり、薬物療法は補助療法としてこれらの治療法と組み合わせることが効果的である。依存性物質誘発症状の治療は依存性物質ごとに、急性期[[ | 依存症の主症状である精神依存の治療において、患者―治療者間の信頼関係の構築、個人あるいは集団による精神療法、地域での支援(自助グループ等)が中心であり、薬物療法は補助療法としてこれらの治療法と組み合わせることが効果的である。依存性物質誘発症状の治療は依存性物質ごとに、急性期[[wikipedia:JA:解毒|解毒]]、離脱期の治療、精神依存の治療、関連精神障害の治療の段階がある<ref>''' 池田和隆(著)、福居顯二(編)'''<br>VIII章 予防と治療 薬物療法(脳とこころのプライマリケア(8)依存)<br>''株式会社シナジー''、2011</ref>。 | ||
==== アルコール ==== | ==== アルコール ==== | ||
急性期解毒にはアルコール排泄の促進のために[[ | 急性期解毒にはアルコール排泄の促進のために[[wikipedia:JA:利尿薬|利尿薬]]が用いられる。アルコール依存では身体依存が強いため、離脱期には[[wikipedia:JA:ベンゾジアゼピン|ベンゾジアゼピン]]系薬物なども有効である。精神依存については[[wikipedia:JA:抗酒薬|抗酒薬]]によって飲酒による不快感を惹起させる方法が用いられる。また、[[wikipedia:JA:ビタミン|ビタミン]]欠乏による器質性脳障害に対してビタミン製剤の補給も重要となる。 | ||
==== ベンゾジアゼピン系薬物 ==== | ==== ベンゾジアゼピン系薬物 ==== | ||
[[ | [[γ-アミノ酪酸]](γ-aminobutyric acid: GABA)受容体を活性化するベンゾジアゼピン系薬物の場合、急性期解毒に対しては拮抗薬が用いられ、離脱期には主として長期作用型のベンゾジアゼピン系薬物が用いられる<ref>'''鈴木勇一、井澤志名野、村崎光邦(著)、和田 清(編)'''<br>ベンゾジアゼピン系薬物の臨床用量依存について(精神医学レビュー34、薬物依存)<br>''ライフ・サイエンス''、2000;74–79</ref>。 | ||
==== オピオイド ==== | ==== オピオイド ==== | ||
| 139行目: | 116行目: | ||
==== ニコチン ==== | ==== ニコチン ==== | ||
離脱期と精神依存の治療では、[[ | 離脱期と精神依存の治療では、[[wikipedia:JA:ニコチンガム|ニコチンガム]]、[[wikipedia:JA:ニコチンパッチ|ニコチンパッチ]]などのニコチン製剤や[[wikipedia:JA:バレニクリン|バレニクリン]]が用いられる。 | ||
==== 大麻 ==== | ==== 大麻 ==== | ||
特異的な薬物療法はなく、急性期の精神病症状は薬物治療なしで経過観察が基本であるが、強い[[恐怖感]]、[[ | 特異的な薬物療法はなく、急性期の精神病症状は薬物治療なしで経過観察が基本であるが、強い[[恐怖感]]、[[wikipedia:JA:発汗|発汗]]、[[wikipedia:JA:動悸|動悸]]などの顕著な[[自律神経症状]]が認められる場合は、ジアゼパムなどの穏和精神安定薬を投与する。[[誇大妄想]]などの[[幻覚]]・[[妄想]]や[[躁性]]の興奮を伴うときはハロペリドールなどの抗精神病薬を投与する。精神病症状が遷延化する場合は抗精神病薬の少量長期(1年以上)投与が有効である。 | ||
==== ギャンブル ==== | ==== ギャンブル ==== | ||
ギャンブルなど、物質以外への依存については薬物療法が確立していない。海外では[[選択的セロトニン再取り込み阻害薬]] | ギャンブルなど、物質以外への依存については薬物療法が確立していない。海外では[[選択的セロトニン再取り込み阻害薬]](selective serotonin reuptake inhibitor: SSRI)の使用報告が多い。[[イミプラミン]]、[[リチウム]]、[[バルプロ酸]]などの併用も報告されている。 | ||
=== 心理社会的治療 === | === 心理社会的治療 === | ||
| 153行目: | 130行目: | ||
==== 認知行動療法 ==== | ==== 認知行動療法 ==== | ||
行動・情緒・認知的な問題を治療の標的として、学習理論をはじめとする行動科学の諸理論や行動変容の諸技法を用いて、不適応な反応を軽減するとともに、適応的な反応を学習させていく治療法である。[[認知行動療法]]は依存性物質の種類を超えて有効性のエビデンスが最も多く提示されている<ref>'''森田展彰(著)、福居顯二(編)'''<br> | 行動・情緒・認知的な問題を治療の標的として、学習理論をはじめとする行動科学の諸理論や行動変容の諸技法を用いて、不適応な反応を軽減するとともに、適応的な反応を学習させていく治療法である。[[認知行動療法]]は依存性物質の種類を超えて有効性のエビデンスが最も多く提示されている<ref>'''森田展彰(著)、福居顯二(編)'''<br>VIII章 予防と治療 認知行動療法(脳とこころのプライマリケア(8)依存)<br>''株式会社シナジー''、2011</ref>。依存症に対する認知行動療法の主な手法は以下のとおりである。 | ||
#再発防止法<br> Marlattら<ref>'''GA Marlatt, JR Gordon'''<br>Relapse prevention: Maintenance Strategies in the Treatment of Addictive Behaviors. <br>''Guilford Press, London'', 1985</ref>がBanduraの社会的学習理論をもとに、物質依存者がいったん物質使用から離れた後に、再発する過程を防ぐことに焦点を当てた認知行動療法として開発した。薬物使用につながる認知行動パターンを「きっかけ・危険な状況→認知・対処スキル→行動→結果」という枠組みで明確化し、「行動」を変えるための方法を検討する技法である。 | #再発防止法<br> Marlattら<ref>'''GA Marlatt, JR Gordon'''<br>Relapse prevention: Maintenance Strategies in the Treatment of Addictive Behaviors. <br>''Guilford Press, London'', 1985</ref>がBanduraの社会的学習理論をもとに、物質依存者がいったん物質使用から離れた後に、再発する過程を防ぐことに焦点を当てた認知行動療法として開発した。薬物使用につながる認知行動パターンを「きっかけ・危険な状況→認知・対処スキル→行動→結果」という枠組みで明確化し、「行動」を変えるための方法を検討する技法である。 | ||
# | #認知療法<br> [[うつ病]]などに用いられてきた認知療法モデルを依存症にあてはめて、非機能的な認知の同定と認知の修正を中心とする技法である<ref>'''AT Beck, FD Wright, CF Newman, BS Liese'''<br>Cognitive Therapy of Substance Abuse.<br>''Guilford Press, London'', 1993</ref>。 | ||
#動機づけ面接<br> | #動機づけ面接<br> 「底つき」(依存症に対して自分が無力で、自分の力ではどうにもならない状況となっ<br>ていることを認めている状態)を待たず、依存症者それぞれの動機づけのレベルに合わせ、共感的な対話を通じて動機を強化し、行動変容を促す技法である<ref>'''GJ Connors, DM Donovan, CC DiClemente'''<br>Substance Abuse Treatment and the Stages of Change: Selecting and Planning Interventions.<br>''Guilford Press, New York'', 2001</ref><ref>'''WR Miller, SP Rollnick'''<br>Motivational Interviewing. Preparing People for Change, 2nd ed<br>''Guilford Press, New York'', 2002</ref>。 | ||
#随伴性マネージメント<br>[[オペラント条件付け]](ある環境下における行動がもたらす結果に基づいて、行動が再強化され、維持されること)の手法を用いて、薬物を再使用すれば罰則を受けることおよび断薬や治療遵守ができていれば[[報酬]]を得られることを明確に示す枠づけをおこない、行動変容を促す方法である。 | #随伴性マネージメント<br>[[オペラント条件付け]](ある環境下における行動がもたらす結果に基づいて、行動が再強化され、維持されること)の手法を用いて、薬物を再使用すれば罰則を受けることおよび断薬や治療遵守ができていれば[[報酬]]を得られることを明確に示す枠づけをおこない、行動変容を促す方法である。 | ||
#コミュニティ再強化法<br> 随伴性マネージメントの方法を地域社会サービスに結び付けたもの。たとえば、報酬として家族や仲間との社会活動や娯楽活動、職探し訓練を提示する。 | #コミュニティ再強化法<br> 随伴性マネージメントの方法を地域社会サービスに結び付けたもの。たとえば、報酬として家族や仲間との社会活動や娯楽活動、職探し訓練を提示する。 | ||
| 163行目: | 140行目: | ||
==== 自助グループ ==== | ==== 自助グループ ==== | ||
自助グループ(あるいは相互援助グループ)とは、当事者集団の一種であり、何らかの問題や病気を抱えた人たちが集まって、共通の課題について経験を分かち合い情報を共有して、より良い問題解決や病気の克服を目指すという方法である。しかしながら、AA(Alcoholics Anonymous)やNA(Narcotics Anonymous)および断酒会等の自助グループは、単なる当事者集団を超えて、独自の構造と回復の原理を持つ、治療的な回復志向集団である<ref>'''猪野亜朗、広藤秀雄、長 徹二(著)、福居顯二(編)'''<br> | 自助グループ(あるいは相互援助グループ)とは、当事者集団の一種であり、何らかの問題や病気を抱えた人たちが集まって、共通の課題について経験を分かち合い情報を共有して、より良い問題解決や病気の克服を目指すという方法である。しかしながら、AA(Alcoholics Anonymous)やNA(Narcotics Anonymous)および断酒会等の自助グループは、単なる当事者集団を超えて、独自の構造と回復の原理を持つ、治療的な回復志向集団である<ref>'''猪野亜朗、広藤秀雄、長 徹二(著)、福居顯二(編)'''<br>VIII章 予防と治療 相互援助(自助)グループと治療共同体(脳とこころのプライマリケア(8)依存)<br>''株式会社シナジー''、2011</ref>。 | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
<br> (執筆者:菅谷 渚、池田和隆 担当編集委員:加藤忠史) | |||
2012年4月9日 (月) 21:29時点における版
依存症とは、精神に作用する化学物質の摂取や、ある種の快感や高揚感を伴う行為を繰り返し行った結果、それらの刺激を求める耐えがたい欲求が生じ、その刺激を追い求める行為が優勢となり、その刺激がないと不快な精神的・身体的症状を生じる、精神的・身体的・行動的状態のことである。依存症は、(1)物質依存、(2)行為・過程依存、(3)ある特定の人物に依存する関係依存、に大別される。物質依存には、薬物依存、ニコチン依存、食物依存などがある。行為・過程依存には、買い物依存、ギャンブル依存、セックス依存、最近では、携帯電話・ゲーム機、インターネット、テレビゲームへの依存などがある。関係依存には、共依存(人に必要とされることに依存)などがある。
特に物質依存は依存性物質を心身に重大な障害や苦痛を引き起こすほどに使用し、それらの物質に対する耐性や離脱などの問題が生じている精神疾患であり、深刻な社会問題となっている。依存性物質には違法薬物のみでなくアルコールなど私たちの日常生活に身近な物質も含まれる。依存性物質の種類としては、中枢神経系抑制薬(アルコール、モルヒネ、睡眠薬など)、中枢神経系興奮薬(メタンフェタミンなどの覚せい剤、コカインなど)あるいは精神異常発現薬(大麻、LSD など)などがあり、薬理作用の異なる種々の物質が依存を誘発する。
診断基準
ICD-10
ICD-10の診断基準において依存症は「精神作用物質使用による精神および行動の障害」の分類の一つである依存症候群として扱われている。診断基準は
のうち3項目以上が過去1年間に同時に存在することである。
DSM-IV
DSM-IVの診断基準においては物質関連障害が物質使用障害と物質誘発性障害から構成され、物質使用障害は物質依存と物質乱用から構成される。物質依存は臨床的に重大な障害や苦痛を引き起こす物質使用の不適応的な様式で、以下の3つ(またはそれ以上)が、同じ12ヶ月の期間内のどこかで起こることによって示される。
- 耐性、以下のいずれかによって定義されるもの:
A. 酩酊または希望の効果を得るために、著しく増大した量の物質が必要
B. 物質の同じ量の持続使用により、著しく効果が減弱 - 離脱、以下のいずれかによって定義されるもの
A. その物質に特徴的な離脱症候群がある
B. 離脱症状を軽減したり回避したりするために、同じ物質(または密接に関連した物質)を摂取する - その物質をはじめのつもりよりも大量に、またはより長い期間、しばしば使用する
- 物質を中止、または制限しようとする持続的な欲求または努力の不成功のあること
- その物質を得るために必要な活動(例:多くの医者を訪れる、長距離の運転をするなど)、物質使用(例:立て続けに喫煙など)、または、その作用からの回復などに費やされる時間の大きいこと
- 物質の使用のために重要な社会的、職業的または娯楽的活動を放棄、または減少させていること
- 精神的または身体的問題が、その物質によって持続的、または反復的に起こり、悪化しているらしいことを知っているにもかかわらず、物質使用を続ける。
疫学
平成20年の厚生労働省の患者調査によるとアルコール依存症の推計患者数は13100人(総患者数44000人)とされているが、一方で日本の一般人口1億2000万人における調査では約80万人がアルコール依存症であるとされており[1]、治療を受けていないアルコール依存症罹患者が多く存在するという点においても大きな問題があると言える。平成19年の警察庁、厚生労働省、海上保安庁の調査によると、国内の薬物事犯検挙人数は、覚せい剤12211名、麻薬・抗精神薬が542名、アヘンが47名、大麻が2375名と報告されている。
依存症の脳内メカニズム
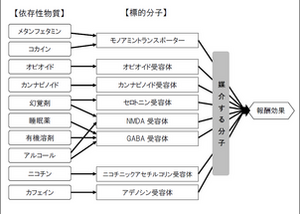
依存性物質と報酬系
依存性物質はシナプス伝達に影響を与える特異的な標的、たとえばモノアミントランスポーター、オピオイド受容体、カンナビノイド受容体、セロトニン受容体、NMDA型グルタミン酸受容体、GABA受容体、ニコチン性アセチルコリン受容体、アデノシン受容体などに作用する(図1)。これらの作用が次の標的分子へ作用するといった連鎖の結果、最終的に快情動(報酬効果)を発現させる。依存性薬物が共通に作用する部位として腹側被蓋野のドーパミン神経細胞から辺縁系、特に側坐核に投射する神経回路がある[2][3][4]。快情動を伴う体験をするときに、中脳の腹側被蓋野から前脳の側坐核へむかってのびているドーパミン神経細胞がドーパミンを放出し、ドーパミンを受け取った側坐核のニューロンで反応が起きることによって快情動が生じる。通常ドーパミン神経細胞は抑制性ニューロンによって働きが抑えられているが、依存性物質が抑制性ニューロンの働きを抑えることなどによって、ドーパミン神経細胞からドーパミンが大量に放出される。依存症では、その快情動の再体験を求めて依存性物質の使用と快情動の体験が繰り返されることで、依存性物質の使用が強化される。
また、側坐核にはモルヒネやヘロインなどの麻薬の受容体が存在することから、依存性物質の報酬効果にはドーパミン系に加えてオピオイド系も重要である[5]。オピオイド受容体以外にも依存性物質の標的分子は側坐核や腹側被蓋野に投射する神経細胞に多数存在する。
近年では分界条床核、扁桃体中心核、側坐核内側移行帯などの拡張扁桃体と呼ばれる辺縁系の脳部位が、依存性物質の報酬に関わっていることも知られている。前頭前野皮質に投射する神経回路は薬物誘発性の薬物再摂取に関与し、依存性物質に対する渇望感において重要な役割を担っていると考えられる。
依存症におけるGIRKチャネルと報酬系の関連
G蛋白質活性型内向き整流性カリウムチャネル(G protein-activated inwardly rectifying potassium channel: GIRKチャネル)は依存性物質のシグナル伝達において重要な役割を果たしている。様々な[[Gi/o蛋白質共役型受容体]]に神経伝達物質が作用することによって[[Gi/o蛋白質]]が活性化され、G蛋白質αサブユニットから遊離したG蛋白質βγサブユニットがGIRKチャネルを直接開口する[6][7]。また、エタノールはGIRKチャネルを直接開口することも見出されている[8][9]。GIRKチャネルの開口によって細胞膜は過分極化し、神経細胞の興奮性を調節する。哺乳類において4つのGIRKチャネルサブユニットが知られている[10][11][12]。GIRK2サブユニットに1つのアミノ酸変異(カリウムイオンだけでなくナトリウムイオンも透過させ、G蛋白質制御も消失している)を持つウィーバーミュータントマウスでは、小脳顆粒細胞や黒質ドーパミン神経細胞、橋核神経細胞における神経細胞死が生じており、モルヒネおよびエタノールによる鎮痛が減弱している[8][13]。したがって、GIRKチャネルがモルヒネやエタノールの鎮痛効果において決定的な役割を果たすと考えられる。さらに、GIRKチャネル欠損マウスでは、コカインの自己投与が消失することも示されている[14]。また、開腹手術の患者を対象にした研究では、GIRK2サブユニットのA1032G多型がA/Aタイプの場合、脳内のGIRK2サブユニットのメッセンジャーRNA量が減少することによって、GIRKサブユニット蛋白質量も減少して、オピオイド感受性が低下するために、術後の疼痛に対して必要なオピオイド投与回数が増加している可能性が示唆されている[15]。
各依存性物質の脳神経画像研究
ポジトロンCT(positron emission tomography: PET)を用いた脳画像研究の発展に伴い、ヒト脳内の受容体、トランスポーターなどを定量評価することが可能になり、依存症の病態が解明されつつある[16]。近年の依存症の脳神経画像研究の成果を以下に示す。
アルコール
オピオイド受容体のμサブタイプは、アルコールによる報酬、耐性、離脱に関連している。近年のPET研究によると、アルコール依存症患者の脳内腹側線条体におけるμオピオイド受容体が増加しており、その増加はアルコールの渇望感と関連することが報告されている[17]。また断酒中のアルコール依存症患者における前帯状皮質のオピオイド受容体と渇望感との相関も認められている[18]。断酒中のアルコール依存症患者の線条体におけるドーパミン合成能やドーパミン[[D2・D3受容体]]結合能とアルコールに対する渇望が相関している[19]。断酒中のアルコール依存患者において腹側線条体のセロトニン受容体1B受容体(5-HT1B)の結合能が上昇していることも報告されている[20]。
覚せい剤
覚せい剤は主に脳内ドーパミン神経終末に作用し、シナプス間隙におけるドーパミン量を増加させることによって薬理作用を出現させる。覚せい剤の使用は長期にわたり脳内ドーパミン神経終末に障害を及ぼすことが脳神経画像研究から明らかになっている。たとえば、覚せい剤乱用者では、大脳基底核におけるドーパミンD2受容体が減少しており、ドーパミンD2受容体と眼窩前頭皮質における局所糖代謝率が関連して[21]、薬物依存症患者の線条体におけるドーパミンD2・D3受容体利用率が健常者より低下しており、この低下が患者の衝動性と負の相関関係にあることが報告されている[22]
また、覚せい剤はセロトニン神経系にも作用する。PET研究により、覚せい剤使用経験者の脳内セロトニントランスポーター(5-hydroxytryptamine transporter: 5-HTT)の密度が健常者よりも低下していること、その低下が彼らの攻撃性の強さと相関していることが報告されている[23]。
また断薬後も数年の間は脳内活性型ミクログリアの密度が健常者よりも上昇しており、このことが神経障害の継続に関連している可能性も示されている[24]。
合成麻薬MDMA
脳画像研究では、MDMAを使用した者において脳の多くの領域で5-HTTの減少が認められ、断薬によってその減少は回復すると報告されている[25]。
ニコチン
PET研究によると、喫煙によって脳内線条体におけるドーパミン放出が増加することがニコチン依存の形成にかかわると考えられている[26]。喫煙依存者で喫煙による側坐核におけるドーパミン放出がドーパミントランスポーター(DAT)、[[ドーパミンD4受容体]]、catechol O-methyl transferase(COMT)と関連することも報告されている[27]。
ヘロイン
最近のPET研究において、ヘロイン依存症患者の線条体のドーパミンD2/3受容体結合と前シナプスのドーパミン放出を測定したところ、ドーパミンD2/3受容体結合と前シナプスのドーパミン放出ともに低下していることが報告されている[28]。
大麻
fMRIを用いた研究[29]では、慢性的で重度の大麻使用者は感情を表す顔(幸せあるいは恐怖)をマスクした状況でも前頭葉や辺縁系が変化していた。この結果は、大麻使用者は提示される刺激が意識処理より下の段階にある時でさえ、情動処理が異なっており、感情に関する情報処理が異なる可能性が強調されている。
ギャンブル
ギャンブル依存ではセロトニンの機能異常、尿中、血中、髄液中のノルアドレナリン代謝産物レベルが上昇していることやαアドレナリン受容体拮抗薬に対する成長ホルモン反応が増大していることからノルアドレナリン機能異常、髄液中のドーパミンレベルの低下およびドーパミン代謝産物レベルの上昇が見られることからドーパミンの代謝回転の上昇が報告されている[30]。
ギャンブルに関する刺激と感情(悲しみ、幸福感)に関する刺激を提示してfMRIによる脳神経画像をギャンブル依存者と健常人を比較すると、ギャンブル依存の人は情動・モチベーションに反応が生じる際の脳活動と情動やモチベーションの自己報告との相関の強さがより顕著であり、ギャンブルへの衝動性の主観的評価と内側前頭前野皮質の活動との負の相関、中側頭回および側頭極の活動との正の相関を示した[31]。
治療
薬物療法
依存症の主症状である精神依存の治療において、患者―治療者間の信頼関係の構築、個人あるいは集団による精神療法、地域での支援(自助グループ等)が中心であり、薬物療法は補助療法としてこれらの治療法と組み合わせることが効果的である。依存性物質誘発症状の治療は依存性物質ごとに、急性期解毒、離脱期の治療、精神依存の治療、関連精神障害の治療の段階がある[32]。
アルコール
急性期解毒にはアルコール排泄の促進のために利尿薬が用いられる。アルコール依存では身体依存が強いため、離脱期にはベンゾジアゼピン系薬物なども有効である。精神依存については抗酒薬によって飲酒による不快感を惹起させる方法が用いられる。また、ビタミン欠乏による器質性脳障害に対してビタミン製剤の補給も重要となる。
ベンゾジアゼピン系薬物
γ-アミノ酪酸(γ-aminobutyric acid: GABA)受容体を活性化するベンゾジアゼピン系薬物の場合、急性期解毒に対しては拮抗薬が用いられ、離脱期には主として長期作用型のベンゾジアゼピン系薬物が用いられる[33]。
オピオイド
急性解毒にはオピオイド受容体の拮抗薬が用いられ、離脱期には主にオピオイドが用いられる[34]。
中枢神経刺激薬
基礎研究によって様々な薬物治療の候補が挙がっているものの、治療法が確立しているとは言えないのが現状である。急性および遷延性の精神病症状を引き起こしている場合は、ハロペリドールやリスペリドンなどの抗精神病薬による治療が必要となる。
有機溶剤
精神病症状には抗精神病薬が用いられる。
ニコチン
離脱期と精神依存の治療では、ニコチンガム、ニコチンパッチなどのニコチン製剤やバレニクリンが用いられる。
大麻
特異的な薬物療法はなく、急性期の精神病症状は薬物治療なしで経過観察が基本であるが、強い恐怖感、発汗、動悸などの顕著な自律神経症状が認められる場合は、ジアゼパムなどの穏和精神安定薬を投与する。誇大妄想などの幻覚・妄想や躁性の興奮を伴うときはハロペリドールなどの抗精神病薬を投与する。精神病症状が遷延化する場合は抗精神病薬の少量長期(1年以上)投与が有効である。
ギャンブル
ギャンブルなど、物質以外への依存については薬物療法が確立していない。海外では選択的セロトニン再取り込み阻害薬(selective serotonin reuptake inhibitor: SSRI)の使用報告が多い。イミプラミン、リチウム、バルプロ酸などの併用も報告されている。
心理社会的治療
認知行動療法
行動・情緒・認知的な問題を治療の標的として、学習理論をはじめとする行動科学の諸理論や行動変容の諸技法を用いて、不適応な反応を軽減するとともに、適応的な反応を学習させていく治療法である。認知行動療法は依存性物質の種類を超えて有効性のエビデンスが最も多く提示されている[35]。依存症に対する認知行動療法の主な手法は以下のとおりである。
- 再発防止法
Marlattら[36]がBanduraの社会的学習理論をもとに、物質依存者がいったん物質使用から離れた後に、再発する過程を防ぐことに焦点を当てた認知行動療法として開発した。薬物使用につながる認知行動パターンを「きっかけ・危険な状況→認知・対処スキル→行動→結果」という枠組みで明確化し、「行動」を変えるための方法を検討する技法である。 - 認知療法
うつ病などに用いられてきた認知療法モデルを依存症にあてはめて、非機能的な認知の同定と認知の修正を中心とする技法である[37]。 - 動機づけ面接
「底つき」(依存症に対して自分が無力で、自分の力ではどうにもならない状況となっ
ていることを認めている状態)を待たず、依存症者それぞれの動機づけのレベルに合わせ、共感的な対話を通じて動機を強化し、行動変容を促す技法である[38][39]。 - 随伴性マネージメント
オペラント条件付け(ある環境下における行動がもたらす結果に基づいて、行動が再強化され、維持されること)の手法を用いて、薬物を再使用すれば罰則を受けることおよび断薬や治療遵守ができていれば報酬を得られることを明確に示す枠づけをおこない、行動変容を促す方法である。 - コミュニティ再強化法
随伴性マネージメントの方法を地域社会サービスに結び付けたもの。たとえば、報酬として家族や仲間との社会活動や娯楽活動、職探し訓練を提示する。
自助グループ
自助グループ(あるいは相互援助グループ)とは、当事者集団の一種であり、何らかの問題や病気を抱えた人たちが集まって、共通の課題について経験を分かち合い情報を共有して、より良い問題解決や病気の克服を目指すという方法である。しかしながら、AA(Alcoholics Anonymous)やNA(Narcotics Anonymous)および断酒会等の自助グループは、単なる当事者集団を超えて、独自の構造と回復の原理を持つ、治療的な回復志向集団である[40]。
参考文献
- ↑ 尾崎米厚、松下幸生、白坂知信、廣 尚典、樋口 進
わが国の成人飲酒行動およびアルコール症に関する全国調査
日本アルコール・薬物医学会雑:2005, 40(5), 455–70 - ↑
Koob, G.F., Sanna, P.P., & Bloom, F.E. (1998).
Neuroscience of addiction. Neuron, 21(3), 467-76. [PubMed:9768834] [WorldCat] [DOI] - ↑
Nestler, E.J. (2001).
Molecular basis of long-term plasticity underlying addiction. Nature reviews. Neuroscience, 2(2), 119-28. [PubMed:11252991] [WorldCat] [DOI] - ↑
Mizoguchi, H., Yamada, K., Mizuno, M., Mizuno, T., Nitta, A., Noda, Y., & Nabeshima, T. (2004).
Regulations of methamphetamine reward by extracellular signal-regulated kinase 1/2/ets-like gene-1 signaling pathway via the activation of dopamine receptors. Molecular pharmacology, 65(5), 1293-301. [PubMed:15102958] [WorldCat] [DOI] - ↑
Johnson, S.W., & North, R.A. (1992).
Opioids excite dopamine neurons by hyperpolarization of local interneurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 12(2), 483-8. [PubMed:1346804] [WorldCat] - ↑
Ikeda, K., Kobayashi, T., Kumanishi, T., Niki, H., & Yano, R. (2000).
Involvement of G-protein-activated inwardly rectifying K (GIRK) channels in opioid-induced analgesia. Neuroscience research, 38(1), 113-6. [PubMed:10997585] [WorldCat] [DOI] - ↑
Kobayashi, T., & Ikeda, K. (2006).
G protein-activated inwardly rectifying potassium channels as potential therapeutic targets. Current pharmaceutical design, 12(34), 4513-23. [PubMed:17168757] [WorldCat] [DOI] - ↑ 8.0 8.1
Kobayashi, T., Ikeda, K., Kojima, H., Niki, H., Yano, R., Yoshioka, T., & Kumanishi, T. (1999).
Ethanol opens G-protein-activated inwardly rectifying K+ channels. Nature neuroscience, 2(12), 1091-7. [PubMed:10570486] [WorldCat] [DOI] - ↑
Lewohl, J.M., Wilson, W.R., Mayfield, R.D., Brozowski, S.J., Morrisett, R.A., & Harris, R.A. (1999).
G-protein-coupled inwardly rectifying potassium channels are targets of alcohol action. Nature neuroscience, 2(12), 1084-90. [PubMed:10570485] [WorldCat] [DOI] - ↑
Kubo, Y., Reuveny, E., Slesinger, P.A., Jan, Y.N., & Jan, L.Y. (1993).
Primary structure and functional expression of a rat G-protein-coupled muscarinic potassium channel. Nature, 364(6440), 802-6. [PubMed:8355805] [WorldCat] [DOI] - ↑
Krapivinsky, G., Gordon, E.A., Wickman, K., Velimirović, B., Krapivinsky, L., & Clapham, D.E. (1995).
The G-protein-gated atrial K+ channel IKACh is a heteromultimer of two inwardly rectifying K(+)-channel proteins. Nature, 374(6518), 135-41. [PubMed:7877685] [WorldCat] [DOI] - ↑
Lesage, F., Guillemare, E., Fink, M., Duprat, F., Heurteaux, C., Fosset, M., ..., & Lazdunski, M. (1995).
Molecular properties of neuronal G-protein-activated inwardly rectifying K+ channels. The Journal of biological chemistry, 270(48), 28660-7. [PubMed:7499385] [WorldCat] [DOI] - ↑
Ikeda, K., Kobayashi, T., Kumanishi, T., Yano, R., Sora, I., & Niki, H. (2002).
Molecular mechanisms of analgesia induced by opioids and ethanol: is the GIRK channel one of the keys? Neuroscience research, 44(2), 121-131. [PubMed:12354627] [WorldCat] [DOI] - ↑
Morgan, A.D., Carroll, M.E., Loth, A.K., Stoffel, M., & Wickman, K. (2003).
Decreased cocaine self-administration in Kir3 potassium channel subunit knockout mice. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 28(5), 932-8. [PubMed:12637950] [WorldCat] [DOI] - ↑
Nishizawa, D., Nagashima, M., Katoh, R., Satoh, Y., Tagami, M., Kasai, S., ..., & Ikeda, K. (2009).
Association between KCNJ6 (GIRK2) gene polymorphisms and postoperative analgesic requirements after major abdominal surgery. PloS one, 4(9), e7060. [PubMed:19756153] [PMC] [WorldCat] [DOI] - ↑ 橋本謙二(著)、福居顯二(編)
III章 物質依存の神経生物学的基盤 物質依存の神経画像(脳とこころのプライマリケア(8)依存)
株式会社シナジー、2011 - ↑
Heinz, A., Reimold, M., Wrase, J., Hermann, D., Croissant, B., Mundle, G., ..., & Mann, K. (2005).
Correlation of stable elevations in striatal mu-opioid receptor availability in detoxified alcoholic patients with alcohol craving: a positron emission tomography study using carbon 11-labeled carfentanil. Archives of general psychiatry, 62(1), 57-64. [PubMed:15630073] [WorldCat] [DOI] - ↑
Williams, T.M., Davies, S.J., Taylor, L.G., Daglish, M.R., Hammers, A., Brooks, D.J., ..., & Lingford-Hughes, A. (2009).
Brain opioid receptor binding in early abstinence from alcohol dependence and relationship to craving: an [11C]diprenorphine PET study. European neuropsychopharmacology : the journal of the European College of Neuropsychopharmacology, 19(10), 740-8. [PubMed:19595579] [WorldCat] [DOI] - ↑
Heinz, A., Siessmeier, T., Wrase, J., Buchholz, H.G., Gründer, G., Kumakura, Y., ..., & Bartenstein, P. (2005).
Correlation of alcohol craving with striatal dopamine synthesis capacity and D2/3 receptor availability: a combined [18F]DOPA and [18F]DMFP PET study in detoxified alcoholic patients. The American journal of psychiatry, 162(8), 1515-20. [PubMed:16055774] [WorldCat] [DOI] - ↑
Hu, J., Henry, S., Gallezot, J.D., Ropchan, J., Neumaier, J.F., Potenza, M.N., ..., & Neumeister, A. (2010).
Serotonin 1B receptor imaging in alcohol dependence. Biological psychiatry, 67(9), 800-3. [PubMed:20172504] [PMC] [WorldCat] [DOI] - ↑
Volkow, N.D., Chang, L., Wang, G.J., Fowler, J.S., Ding, Y.S., Sedler, M., ..., & Pappas, N. (2001).
Low level of brain dopamine D2 receptors in methamphetamine abusers: association with metabolism in the orbitofrontal cortex. The American journal of psychiatry, 158(12), 2015-21. [PubMed:11729018] [WorldCat] [DOI] - ↑
Lee, B., London, E.D., Poldrack, R.A., Farahi, J., Nacca, A., Monterosso, J.R., ..., & Mandelkern, M.A. (2009).
Striatal dopamine d2/d3 receptor availability is reduced in methamphetamine dependence and is linked to impulsivity. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(47), 14734-40. [PubMed:19940168] [PMC] [WorldCat] [DOI] - ↑
Sekine, Y., Ouchi, Y., Takei, N., Yoshikawa, E., Nakamura, K., Futatsubashi, M., ..., & Mori, N. (2006).
Brain serotonin transporter density and aggression in abstinent methamphetamine abusers. Archives of general psychiatry, 63(1), 90-100. [PubMed:16389202] [WorldCat] [DOI] - ↑
Sekine, Y., Ouchi, Y., Sugihara, G., Takei, N., Yoshikawa, E., Nakamura, K., ..., & Cadet, J.L. (2008).
Methamphetamine causes microglial activation in the brains of human abusers. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(22), 5756-61. [PubMed:18509037] [PMC] [WorldCat] [DOI] - ↑
Cowan, R.L. (2007).
Neuroimaging research in human MDMA users: a review. Psychopharmacology, 189(4), 539-56. [PubMed:16847678] [WorldCat] [DOI] - ↑
Brody, A.L. (2006).
Functional brain imaging of tobacco use and dependence. Journal of psychiatric research, 40(5), 404-18. [PubMed:15979645] [PMC] [WorldCat] [DOI] - ↑
Brody, A.L., Mandelkern, M.A., Olmstead, R.E., Scheibal, D., Hahn, E., Shiraga, S., ..., & McCracken, J.T. (2006).
Gene variants of brain dopamine pathways and smoking-induced dopamine release in the ventral caudate/nucleus accumbens. Archives of general psychiatry, 63(7), 808-16. [PubMed:16818870] [PMC] [WorldCat] [DOI] - ↑
Martinez, D., Saccone, P.A., Liu, F., Slifstein, M., Orlowska, D., Grassetti, A., ..., & Comer, S.D. (2012).
Deficits in dopamine D(2) receptors and presynaptic dopamine in heroin dependence: commonalities and differences with other types of addiction. Biological psychiatry, 71(3), 192-8. [PubMed:22015315] [PMC] [WorldCat] [DOI] - ↑
Gruber, S.A., Rogowska, J., & Yurgelun-Todd, D.A. (2009).
Altered affective response in marijuana smokers: an FMRI study. Drug and alcohol dependence, 105(1-2), 139-53. [PubMed:19656642] [PMC] [WorldCat] [DOI] - ↑
Ibáñez, A., Blanco, C., Perez de Castro, I., Fernandez-Piqueras, J., & Sáiz-Ruiz, J. (2003).
Genetics of pathological gambling. Journal of gambling studies, 19(1), 11-22. [PubMed:12635538] [WorldCat] - ↑
Balodis, I.M., Lacadie, C.M., & Potenza, M.N. (2012).
A preliminary study of the neural correlates of the intensities of self-reported gambling urges and emotions in men with pathological gambling. Journal of gambling studies, 28(3), 493-513. [PubMed:21811809] [PMC] [WorldCat] [DOI] - ↑ 池田和隆(著)、福居顯二(編)
VIII章 予防と治療 薬物療法(脳とこころのプライマリケア(8)依存)
株式会社シナジー、2011 - ↑ 鈴木勇一、井澤志名野、村崎光邦(著)、和田 清(編)
ベンゾジアゼピン系薬物の臨床用量依存について(精神医学レビュー34、薬物依存)
ライフ・サイエンス、2000;74–79 - ↑ 日本精神神経学会(監訳)
米国精神医学会治療ガイドライン、物質使用障害―アルコール、コカインとオピオイド
医学書院、2000 - ↑ 森田展彰(著)、福居顯二(編)
VIII章 予防と治療 認知行動療法(脳とこころのプライマリケア(8)依存)
株式会社シナジー、2011 - ↑ GA Marlatt, JR Gordon
Relapse prevention: Maintenance Strategies in the Treatment of Addictive Behaviors.
Guilford Press, London, 1985 - ↑ AT Beck, FD Wright, CF Newman, BS Liese
Cognitive Therapy of Substance Abuse.
Guilford Press, London, 1993 - ↑ GJ Connors, DM Donovan, CC DiClemente
Substance Abuse Treatment and the Stages of Change: Selecting and Planning Interventions.
Guilford Press, New York, 2001 - ↑ WR Miller, SP Rollnick
Motivational Interviewing. Preparing People for Change, 2nd ed
Guilford Press, New York, 2002 - ↑ 猪野亜朗、広藤秀雄、長 徹二(著)、福居顯二(編)
VIII章 予防と治療 相互援助(自助)グループと治療共同体(脳とこころのプライマリケア(8)依存)
株式会社シナジー、2011
(執筆者:菅谷 渚、池田和隆 担当編集委員:加藤忠史)