「ClC塩素チャネル」の版間の差分
細 →疾患との関連 |
細 →疾患との関連 |
(相違点なし)
| |
2025年8月30日 (土) 14:36時点における最新版
秋田 天平、熊田 竜郎、福田 敦夫
浜松医科大学 医学部
DOI:10.14931/bsd.3453 原稿受付日:2013年3月7日 原稿完成日:2013年4月5日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英語名: CIC chloride channel
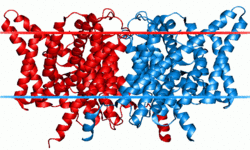 E. coli由来ClC塩素チャネルの構造 | |||||||||
| Identifiers | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Symbol | Voltage_CLC | ||||||||
| Pfam | PF00654 | ||||||||
| InterPro | IPR014743 | ||||||||
| SCOP | 1kpl | ||||||||
| SUPERFAMILY | 1kpl | ||||||||
| TCDB | 1.A.11 | ||||||||
| OPM superfamily | 10 | ||||||||
| OPM protein | 1ots | ||||||||
| CDD | cd00400 | ||||||||
| |||||||||
塩素チャネルとして最初にシビレエイ(学名 Torpedo marmorata)の発電器官からクローニングされた遺伝子ファミリーに属するものである[1]。哺乳類では9種類知られており、そのうち神経系に発現が知られているのは主にClC-2、-3、-4、-6、-7である。ClC-2は主に形質膜に分布して電位感受性塩素チャネルとして機能し、その他のClC-3、-4、-6、-7は主に細胞内小胞膜に分布し、チャネルというよりは、むしろCl-/H+-交換輸送体として機能すると考えられている。
構造
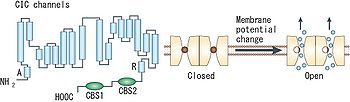
1つのサブユニットはA~Rの18のセグメントに分けられる。細胞質側にN末端とC末端があり、C末端側に2つのCBSドメインを持つ([2]より転載)。
1つのポアを持つサブユニットタンパク質が2つ会合して二量体を形成するため、計2つのポアを有するdouble-barreledチャネルである。各ポアはイオン選択性やコンダクタンスなどの特性を保持しており、各ポアに内在するゲート機構(‘fast gate’)により他方のポアの開閉状態に関わらず独立して開閉しうるが、別の共有するゲート機構(‘slow (common) gate’)を通じて両ポアの開閉が同時にも制御されうる。
バクテリアのClCタンパク質については既にX線結晶構造解析が進んでおり、各サブユニットが17の膜内へリックス構造(うち8つは膜を貫通せず途中で折り返す)を含む18のセグメントで構成された複雑なトポロジーが明らかになった(図1)。チャネル阻害剤の結合部位の解析やシステイン変異導入の解析から、この構造は全ての種のClCタンパク質で凡そ共通のものと考えられている。
チャネルとCl-/H+-交換輸送の機能の違いは、細胞質側の或る1つのグルタミン酸残基の有無に起因しており、構造上の大差は無いことが判明している。なお、真核生物のClCタンパク質のC末端には、サブユニット間の相互作用やチャネルの活性に影響を与えうる2つのcystathionine-β-synthase (CBS) ドメインが存在する。
発現
ClC-2は神経系では広く神経、グリアともに、また胎生期、生後ともに、その発現が認められる。ClC-3、-4、-6、-7も神経系に広く発現しているが、そのほとんどが細胞内小胞膜上(エンドソーム、リソソーム等、ClC-3は一部のシナプス小胞にも)に分布している。
機能
ClC-2
ClC-2は膜電位の過分極や細胞外pHの減少等で活性化される内向き整流性塩素チャネルである。多くの成熟した神経細胞のように細胞内Cl–濃度が低い(<10 mM)場合は、抑制性シナプス入力等で誘起される膜電位過分極の維持を通じて、神経細胞の興奮性の抑制に寄与しうる。 また、ClC-2 KOマウスでは中枢神経系の白質変性(髄鞘内に多数の液胞形成)が起こることが報告されており、そのことからClC-2チャネルが、他のK+チャネルとともに、細胞間隙中の細胞外イオン濃度の恒常性維持に関わっている可能性が示唆されている。ClC-2は細胞膨張により活性化しうることも知られているが、その後の細胞容積の復元への役割は、同時に活性化されるVSORに比して小さいことがClC-2 KOマウスで示されている。
ClC-3、-4、-6、-7
ClC-4についてはCl-/H+交換輸送の機能を有することが発現系にて確認されている。その他のClC-3、-6、-7については未だ交換輸送の機能は確定していないが、いずれも主に細胞内小胞膜上に分布していること、そして結晶構造の解かれているバクテリアのClCタンパク質がCl-/H+交換輸送体であり、その機能に特徴的なアミノ酸配列をClC-3、-4、-6、-7のいずれもが共通に持つことから、いずれもCl-/H+交換輸送の機能を有すると考えられている。交換輸送の割合はCl-:H+ = 2:1と考えられ、小胞内の酸性化促進(小胞性H+ポンプの駆動により生ずる電荷移動のCl-による中和を通じて)に寄与すると考えられている。
ClC-3と-4については、過剰発現により一部細胞膜に発現した際の電流が観測されており、急峻な外向き整流性(高い脱分極でのみ活性化)が確認されている。
ClC-3 KOマウスでは網膜と海馬の変性、脱失、ClC-7 KOマウスでも網膜変性やリソソーム蓄積による神経変性が認められることが報告されているが、それぞれのClCの機能との連関は明らかになっていない。
疾患との関連
神経系におけるClCタンパク質の異常と疾患との関連は未だ確立していない。但し、神経系以外では、ClC-1の変異と先天性ミオトニア、ClC-5の変異とDent病(近位尿細管障害と腎石灰化)、ClC-7の変異と大理石骨病(破骨細胞の骨吸収機能障害による骨硬化)との関連がよく知られている。
なお、かつてヒトClC-2の遺伝子(CLCN2)異常は特発性全般てんかんの原因となりうることが報告されたが、そのClC-2変異体の機能解析の結果、現在その報告に対しては否定的な見解が占める。
参考文献
- ↑
Jentsch, T.J. (2008).
CLC chloride channels and transporters: from genes to protein structure, pathology and physiology. Critical reviews in biochemistry and molecular biology, 43(1), 3-36. [PubMed:18307107] [WorldCat] [DOI] - ↑
Verkman, A.S., & Galietta, L.J. (2009).
Chloride channels as drug targets. Nature reviews. Drug discovery, 8(2), 153-71. [PubMed:19153558] [PMC] [WorldCat] [DOI]