「ダウン症」の版間の差分
細編集の要約なし |
細 →責任遺伝子 |
||
| (4人の利用者による、間の26版が非表示) | |||
| 1行目: | 1行目: | ||
[[image:ダウン症1.png|thumb|300px|'''図1. 部分トリソミーを持つダウン症モデルマウス<br>Ts65Dn, Ts2Cje, Ts1Cje, Ts1Rhr''']] | |||
'' | |||
英語名:Down syndrome 独:Down- | 英語名:Down syndrome 独:Down-Syndrom 仏:Syndrome de Down | ||
同義語:21トリソミー、ダウン症候群、蒙古症(今日は用いられない) | |||
== ダウン症とは == | |||
ダウン症は、知的障害の最も頻度の高い原因として知られており、およそ700人に一人の割合で生まれてくる<ref><pubmed> 6455611</pubmed></ref>。1866年に英国の眼科医[[wikipedia:John Langdon Down|ジョン・ラングドン・ハイドン・ダウン]](John Langdon Haydon Down) が論文でその存在を発表し、1965年にWHOによって「Down syndrome(ダウン症候群)」を正式な名称とすることが決定された。 | |||
==診断== | ==診断== | ||
精神遅滞と[[新生児筋緊張低下]]は患者のほとんどで認められる。 | |||
その他、特有の顔貌(目尻が上がっていてまぶたの肉が厚い、鼻が低い、頬がまるい、あごが未発達など)、[[wikipedia:ja:先天性心疾患|先天性心疾患]]、[[wikipedia:ja:消化器|消化器]]疾患、[[wikipedia:ja:免疫系|免疫系]]・[[wikipedia:ja:内分泌系|内分泌系]]の不全、[[wikipedia:ja:白血病|白血病]]、[[アルツハイマー病]]など、多くの症状を様々な頻度で伴う。例えば[[Hirschsprung病]]([[腸内神経叢]]が欠損し重篤な便秘を起こす)も多発することが知られており、一般集団における発症率が約5000人に1人であるのに対して、ダウン症では20−30人に1人の割合で発症する。 | |||
==病態== | |||
=== | |||
=== 染色体異常 === | === 染色体異常 === | ||
ダウン症患者では、[[21番染色体]]が1本余分で計3本(トリソミー)になっており (1959年、フランス人のジェローム・レジューンJérôme Lejeuneによる発見)、このことが発症の原因とされる。染色体の[[wikipedia:ja:染色体異常|不分離]]や[[wikipedia:ja:染色体異常|転座]]によっておこる。染色体の不分離によって起こるケースは全体の95%を占め、母親の出産年齢が高いほど発生頻度が増加する。2011年のGENCODEプロジェクト<ref>http://www.gencodegenes.org/</ref>の報告によると、21番染色体上には696個の遺伝子(タンパク質をコードするものは235個)が存在するとされるが、これらの遺伝子の発現量の過剰がダウン症の発症に関わると考えられる。ダウン症児の脳では、解剖学的所見として、[[大脳]]、[[小脳半球]]、[[腹側脳橋]]、[[乳頭体]]、[[海馬体]]の低形成、および[[海馬傍回]]の膨大などが、又、組織学的所見として[[神経細胞]]([[顆粒細胞]])密度の低下、[[神経細胞分化]]、[[軸策]][[有髄化]]、[[樹状突起]]形成などの異常などが報告され、これらの異常が精神遅滞の基礎をなしていると予想されている。 | |||
=== | === 染色体上の責任領域 === | ||
====症例からの研究==== | |||
実際にどの遺伝子がどの症状の発症にどのように関わるのかを調べることが重要な課題である。ダウン症はそのほとんどが第21染色体がトリソミー(3コピー)になることにより引き起こされるが、ごくわずかの症例で第21染色体の一部のみがトリソミーになっているものが見られる。これらの症例の症状とトリソミーになっている領域を比較することにより、それぞれの症状に責任のある遺伝子の場所をある程度推定することが出来るとして複数の研究が報告されている。Niebuhrら<ref><pubmed> 4276065</pubmed></ref>は[[APP]]から[[テロメア]]を部分トリソミーでもつ患者がダウン症の主な症状を有することから、この領域が重要であるとした。更に、[[セントロメア]]から[[SOD]]までをトリソミーで有する患者では精神遅滞の程度が軽いとする報告がある<ref><pubmed> 2149936</pubmed></ref>。Delabarら<ref><pubmed> 8055322</pubmed></ref>は複数の部分トリソミー患者を検討することによりD21S55を含む4Mbの領域が重要とし[[ダウン症責任領域]](DSCR)と名付けた。一方、Korenbergら<ref><pubmed> 8197171</pubmed></ref>は複数の領域が発症に関わるとし、DSCRのような単一の領域が主な症状すべてに責任を持つとする説を否定している。又、精神遅滞については軽重の差こそあれ重複のない異なる領域を部分トリソミーで有する複数の患者で見られることから、その発症にかかわる遺伝子が第21染色体上に複数あることは間違いない。 | |||
====動物モデル==== | |||
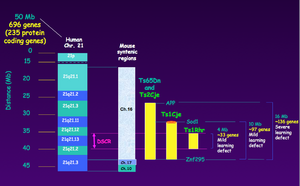
[[ヒト]]でのダウン症研究の一方で、[[マウス]]を使った研究も進められている。ヒト第21染色体に対応するのがマウス第16染色体の一部であり、現在までに、この第16染色体の部分トリソミーを持ついくつかのマウスがダウン症のモデルとして報告されている。Ts65Dn <ref><pubmed> 2147289</pubmed></ref>およびTs2Cje<ref name=villar2005><pubmed> 15859352</pubmed></ref>はAPPから[[wikipedia:Mx1|Mx1]]までの15.6Mbの部分をトリソミーで持ち、Ts1Cje <ref name=sago1998><pubmed> 9600952</pubmed></ref>はSOD1からMX1までの9.8Mbの大きさをトリソミーで持つ。これらのマウスでは[[モリス水迷路テスト]]などの行動学的試験が行われ精神遅滞様の行動異常が確認されているが、Ts1CjeはTs65Dn,Ts2Cjeに比べて学習障害の程度が軽く、ダウン症患者でみられる[[コリン]]作動性ニューロンの変性はTs65Dnのみで見られるなどの違いが確認されている<ref><pubmed>7550346</pubmed></ref><ref name=sago1998><pubmed> 9600952</pubmed></ref><ref name=villar2005><pubmed> 15859352</pubmed></ref>。ダウン症の患者では小脳が小さいことは先にも述べたが、これらのマウスモデルでも小脳が小さいことが確認されており、更にその程度はTs1CjeとTs65Dnでほぼ同じであることから、少なくとも小脳のサイズを小さくしている遺伝子はTs1Cjeがトリソミーで持つ領域に存在する遺伝子である可能性が高い。Ms1Ts65はTs65Dnがトリソミーで持つ部分のうち、Ts1Cjeに対応する部分をのぞいたAPPからSOD1までの領域をトリソミーで持つマウスであり、精神遅滞様行動の程度はTs1Cjeのそれよりも、更に軽いと報告されている<ref><pubmed>11044479</pubmed></ref>。最近では更に領域を絞り込んだトリソミーモデルマウス、Ts1Rhrも報告されている<ref><pubmed> 15499018</pubmed></ref> <ref><pubmed> 19420260</pubmed></ref>。 | |||
=== 責任遺伝子 === | === 責任遺伝子 === | ||
第21染色体上に存在する複数の遺伝子が精神遅滞の発症に関わる遺伝子の候補として報告されている。[[Sim2]]は[[helix-loop-helix]]構造を持ち、[[中枢神経]]系の初期発生に関わる[[転写制御因子]]であり、ベータ[[アクチン]][[プロモーター]]下で発現制御されたSIM2を持つ[[トランスジェニックマウス]]での[[記憶]]学習能力の異常<ref><pubmed> 10400987 </pubmed></ref>、Sim2を有する[[wikipedia:BAC|BAC]]クローンのトランスジェニックマウスでの[[不安行動]]、[[痛覚]]鈍麻、[[社会性行動]]減少 <ref><pubmed> 10915774</pubmed></ref>などが報告されている。[[DYRK1A]]は[[ショウジョウバエ|ハエ]]で同定され、細胞の[[wikipedia:ja:発生|発生]]・[[wikipedia:ja:分化|分化]]の制御に関わる遺伝子として知られる[[minibrain]]のヒトホモログであるが、DYRK1Aを含む[[wikipedia:YAC|YAC]]のトランスジェニックマウスで記憶学習能力の異常が報告されている<ref><pubmed> 9140392</pubmed></ref>。更にはDYRK1Aが[[wikipedia:DSCR1|DSCR1]]/RCAN1と共同して転写因子[[wikipedia:jNFATc|NFATc]]の機能を抑制し、これがダウン症症状の発現に寄与するとの報告もある<ref><pubmed> 16554754</pubmed></ref>。最近では転写因子[[Olig1]]/[[Olig2]]がある種の[[抑制性神経細胞]]の数を増やし、これが神経活動の過剰抑制につながり、ダウン症の知能障害につながるとの報告など<ref><pubmed> 20639873</pubmed></ref>がある。しかしながら、これらの遺伝子のダウン症発症に於ける実際の意義については確定的な事が言える状況では到底無く、それらを明らかにし、更には実際の治療に結びつけて行く為には今後更なる検証、研究が必要である。 | |||
: | |||
==関連項目== | ==関連項目== | ||
*[[トリソミー]] | *[[トリソミー]] | ||
*[[染色体不分離]] | *[[染色体不分離]] | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | |||
<references /> | |||
(執筆者:山川和弘 担当編集委員:高橋良輔) | |||
2012年5月15日 (火) 01:15時点における版
Ts65Dn, Ts2Cje, Ts1Cje, Ts1Rhr
英語名:Down syndrome 独:Down-Syndrom 仏:Syndrome de Down
同義語:21トリソミー、ダウン症候群、蒙古症(今日は用いられない)
ダウン症とは
ダウン症は、知的障害の最も頻度の高い原因として知られており、およそ700人に一人の割合で生まれてくる[1]。1866年に英国の眼科医ジョン・ラングドン・ハイドン・ダウン(John Langdon Haydon Down) が論文でその存在を発表し、1965年にWHOによって「Down syndrome(ダウン症候群)」を正式な名称とすることが決定された。
診断
精神遅滞と新生児筋緊張低下は患者のほとんどで認められる。
その他、特有の顔貌(目尻が上がっていてまぶたの肉が厚い、鼻が低い、頬がまるい、あごが未発達など)、先天性心疾患、消化器疾患、免疫系・内分泌系の不全、白血病、アルツハイマー病など、多くの症状を様々な頻度で伴う。例えばHirschsprung病(腸内神経叢が欠損し重篤な便秘を起こす)も多発することが知られており、一般集団における発症率が約5000人に1人であるのに対して、ダウン症では20−30人に1人の割合で発症する。
病態
染色体異常
ダウン症患者では、21番染色体が1本余分で計3本(トリソミー)になっており (1959年、フランス人のジェローム・レジューンJérôme Lejeuneによる発見)、このことが発症の原因とされる。染色体の不分離や転座によっておこる。染色体の不分離によって起こるケースは全体の95%を占め、母親の出産年齢が高いほど発生頻度が増加する。2011年のGENCODEプロジェクト[2]の報告によると、21番染色体上には696個の遺伝子(タンパク質をコードするものは235個)が存在するとされるが、これらの遺伝子の発現量の過剰がダウン症の発症に関わると考えられる。ダウン症児の脳では、解剖学的所見として、大脳、小脳半球、腹側脳橋、乳頭体、海馬体の低形成、および海馬傍回の膨大などが、又、組織学的所見として神経細胞(顆粒細胞)密度の低下、神経細胞分化、軸策有髄化、樹状突起形成などの異常などが報告され、これらの異常が精神遅滞の基礎をなしていると予想されている。
染色体上の責任領域
症例からの研究
実際にどの遺伝子がどの症状の発症にどのように関わるのかを調べることが重要な課題である。ダウン症はそのほとんどが第21染色体がトリソミー(3コピー)になることにより引き起こされるが、ごくわずかの症例で第21染色体の一部のみがトリソミーになっているものが見られる。これらの症例の症状とトリソミーになっている領域を比較することにより、それぞれの症状に責任のある遺伝子の場所をある程度推定することが出来るとして複数の研究が報告されている。Niebuhrら[3]はAPPからテロメアを部分トリソミーでもつ患者がダウン症の主な症状を有することから、この領域が重要であるとした。更に、セントロメアからSODまでをトリソミーで有する患者では精神遅滞の程度が軽いとする報告がある[4]。Delabarら[5]は複数の部分トリソミー患者を検討することによりD21S55を含む4Mbの領域が重要としダウン症責任領域(DSCR)と名付けた。一方、Korenbergら[6]は複数の領域が発症に関わるとし、DSCRのような単一の領域が主な症状すべてに責任を持つとする説を否定している。又、精神遅滞については軽重の差こそあれ重複のない異なる領域を部分トリソミーで有する複数の患者で見られることから、その発症にかかわる遺伝子が第21染色体上に複数あることは間違いない。
動物モデル
ヒトでのダウン症研究の一方で、マウスを使った研究も進められている。ヒト第21染色体に対応するのがマウス第16染色体の一部であり、現在までに、この第16染色体の部分トリソミーを持ついくつかのマウスがダウン症のモデルとして報告されている。Ts65Dn [7]およびTs2Cje[8]はAPPからMx1までの15.6Mbの部分をトリソミーで持ち、Ts1Cje [9]はSOD1からMX1までの9.8Mbの大きさをトリソミーで持つ。これらのマウスではモリス水迷路テストなどの行動学的試験が行われ精神遅滞様の行動異常が確認されているが、Ts1CjeはTs65Dn,Ts2Cjeに比べて学習障害の程度が軽く、ダウン症患者でみられるコリン作動性ニューロンの変性はTs65Dnのみで見られるなどの違いが確認されている[10][9][8]。ダウン症の患者では小脳が小さいことは先にも述べたが、これらのマウスモデルでも小脳が小さいことが確認されており、更にその程度はTs1CjeとTs65Dnでほぼ同じであることから、少なくとも小脳のサイズを小さくしている遺伝子はTs1Cjeがトリソミーで持つ領域に存在する遺伝子である可能性が高い。Ms1Ts65はTs65Dnがトリソミーで持つ部分のうち、Ts1Cjeに対応する部分をのぞいたAPPからSOD1までの領域をトリソミーで持つマウスであり、精神遅滞様行動の程度はTs1Cjeのそれよりも、更に軽いと報告されている[11]。最近では更に領域を絞り込んだトリソミーモデルマウス、Ts1Rhrも報告されている[12] [13]。
責任遺伝子
第21染色体上に存在する複数の遺伝子が精神遅滞の発症に関わる遺伝子の候補として報告されている。Sim2はhelix-loop-helix構造を持ち、中枢神経系の初期発生に関わる転写制御因子であり、ベータアクチンプロモーター下で発現制御されたSIM2を持つトランスジェニックマウスでの記憶学習能力の異常[14]、Sim2を有するBACクローンのトランスジェニックマウスでの不安行動、痛覚鈍麻、社会性行動減少 [15]などが報告されている。DYRK1Aはハエで同定され、細胞の発生・分化の制御に関わる遺伝子として知られるminibrainのヒトホモログであるが、DYRK1Aを含むYACのトランスジェニックマウスで記憶学習能力の異常が報告されている[16]。更にはDYRK1AがDSCR1/RCAN1と共同して転写因子NFATcの機能を抑制し、これがダウン症症状の発現に寄与するとの報告もある[17]。最近では転写因子Olig1/Olig2がある種の抑制性神経細胞の数を増やし、これが神経活動の過剰抑制につながり、ダウン症の知能障害につながるとの報告など[18]がある。しかしながら、これらの遺伝子のダウン症発症に於ける実際の意義については確定的な事が言える状況では到底無く、それらを明らかにし、更には実際の治療に結びつけて行く為には今後更なる検証、研究が必要である。
関連項目
参考文献
- ↑
Hook, E.B. (1981).
Rates of chromosome abnormalities at different maternal ages. Obstetrics and gynecology, 58(3), 282-5. [PubMed:6455611] [WorldCat] - ↑ http://www.gencodegenes.org/
- ↑
Niebuhr, E. (1974).
Down's syndrome. The possibility of a pathogenetic segment on chromosome no. 21. Humangenetik, 21(1), 99-101. [PubMed:4276065] [WorldCat] [DOI] - ↑
Williams, C.A., Frias, J.L., McCormick, M.K., Antonarakis, S.E., & Cantu, E.S. (1990).
Clinical, cytogenetic, and molecular evaluation of a patient with partial trisomy 21 (21q11-q22) lacking the classical Down syndrome phenotype. American journal of medical genetics. Supplement, 7, 110-4. [PubMed:2149936] [WorldCat] - ↑
Delabar, J.M., Theophile, D., Rahmani, Z., Chettouh, Z., Blouin, J.L., Prieur, M., ..., & Sinet, P.M. (1993).
Molecular mapping of twenty-four features of Down syndrome on chromosome 21. European journal of human genetics : EJHG, 1(2), 114-24. [PubMed:8055322] [WorldCat] [DOI] - ↑
Korenberg, J.R., Chen, X.N., Schipper, R., Sun, Z., Gonsky, R., Gerwehr, S., ..., & Disteche, C. (1994).
Down syndrome phenotypes: the consequences of chromosomal imbalance. Proceedings of the National Academy of Sciences of the United States of America, 91(11), 4997-5001. [PubMed:8197171] [PMC] [WorldCat] [DOI] - ↑
Davisson, M.T., Schmidt, C., & Akeson, E.C. (1990).
Segmental trisomy of murine chromosome 16: a new model system for studying Down syndrome. Progress in clinical and biological research, 360, 263-80. [PubMed:2147289] [WorldCat] - ↑ 8.0 8.1
Villar, A.J., Belichenko, P.V., Gillespie, A.M., Kozy, H.M., Mobley, W.C., & Epstein, C.J. (2005).
Identification and characterization of a new Down syndrome model, Ts[Rb(12.1716)]2Cje, resulting from a spontaneous Robertsonian fusion between T(171)65Dn and mouse chromosome 12. Mammalian genome : official journal of the International Mammalian Genome Society, 16(2), 79-90. [PubMed:15859352] [WorldCat] [DOI] - ↑ 9.0 9.1
Sago, H., Carlson, E.J., Smith, D.J., Kilbridge, J., Rubin, E.M., Mobley, W.C., ..., & Huang, T.T. (1998).
Ts1Cje, a partial trisomy 16 mouse model for Down syndrome, exhibits learning and behavioral abnormalities. Proceedings of the National Academy of Sciences of the United States of America, 95(11), 6256-61. [PubMed:9600952] [PMC] [WorldCat] [DOI] - ↑
Reeves, R.H., Irving, N.G., Moran, T.H., Wohn, A., Kitt, C., Sisodia, S.S., ..., & Davisson, M.T. (1995).
A mouse model for Down syndrome exhibits learning and behaviour deficits. Nature genetics, 11(2), 177-84. [PubMed:7550346] [WorldCat] [DOI] - ↑
Sago, H., Carlson, E.J., Smith, D.J., Rubin, E.M., Crnic, L.S., Huang, T.T., & Epstein, C.J. (2000).
Genetic dissection of region associated with behavioral abnormalities in mouse models for Down syndrome. Pediatric research, 48(5), 606-13. [PubMed:11044479] [WorldCat] [DOI] - ↑
Olson, L.E., Richtsmeier, J.T., Leszl, J., & Reeves, R.H. (2004).
A chromosome 21 critical region does not cause specific Down syndrome phenotypes. Science (New York, N.Y.), 306(5696), 687-90. [PubMed:15499018] [PMC] [WorldCat] [DOI] - ↑
Belichenko, N.P., Belichenko, P.V., Kleschevnikov, A.M., Salehi, A., Reeves, R.H., & Mobley, W.C. (2009).
The "Down syndrome critical region" is sufficient in the mouse model to confer behavioral, neurophysiological, and synaptic phenotypes characteristic of Down syndrome. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(18), 5938-48. [PubMed:19420260] [PMC] [WorldCat] [DOI] - ↑
Ema, M., Ikegami, S., Hosoya, T., Mimura, J., Ohtani, H., Nakao, K., ..., & Fujii-Kuriyama, Y. (1999).
Mild impairment of learning and memory in mice overexpressing the mSim2 gene located on chromosome 16: an animal model of Down's syndrome. Human molecular genetics, 8(8), 1409-15. [PubMed:10400987] [WorldCat] [DOI] - ↑
Chrast, R., Scott, H.S., Madani, R., Huber, L., Wolfer, D.P., Prinz, M., ..., & Antonarakis, S.E. (2000).
Mice trisomic for a bacterial artificial chromosome with the single-minded 2 gene (Sim2) show phenotypes similar to some of those present in the partial trisomy 16 mouse models of Down syndrome. Human molecular genetics, 9(12), 1853-64. [PubMed:10915774] [WorldCat] [DOI] - ↑
Smith, D.J., Stevens, M.E., Sudanagunta, S.P., Bronson, R.T., Makhinson, M., Watabe, A.M., ..., & Rubin, E.M. (1997).
Functional screening of 2 Mb of human chromosome 21q22.2 in transgenic mice implicates minibrain in learning defects associated with Down syndrome. Nature genetics, 16(1), 28-36. [PubMed:9140392] [WorldCat] [DOI] - ↑
Arron, J.R., Winslow, M.M., Polleri, A., Chang, C.P., Wu, H., Gao, X., ..., & Crabtree, G.R. (2006).
NFAT dysregulation by increased dosage of DSCR1 and DYRK1A on chromosome 21. Nature, 441(7093), 595-600. [PubMed:16554754] [WorldCat] [DOI] - ↑
Chakrabarti, L., Best, T.K., Cramer, N.P., Carney, R.S., Isaac, J.T., Galdzicki, Z., & Haydar, T.F. (2010).
Olig1 and Olig2 triplication causes developmental brain defects in Down syndrome. Nature neuroscience, 13(8), 927-34. [PubMed:20639873] [PMC] [WorldCat] [DOI]
(執筆者:山川和弘 担当編集委員:高橋良輔)