「S100タンパク質」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (2人の利用者による、間の6版が非表示) | |||
| 1行目: | 1行目: | ||
{{Pfam_box | {{Pfam_box | ||
| Symbol = S_100 | | Symbol = S_100 | ||
| 42行目: | 35行目: | ||
{{PDB3|1qls}}A:8-51 {{PDB3|1mr8}}B:5-48 {{PDB3|1psr}}B:6-46 | {{PDB3|1qls}}A:8-51 {{PDB3|1mr8}}B:5-48 {{PDB3|1psr}}B:6-46 | ||
{{PDB3|2psr}} :6-46 {{PDB3|3psr}}A:6-46 | {{PDB3|2psr}} :6-46 {{PDB3|3psr}}A:6-46 | ||
}} | }} S100 蛋白質は、[[wikipedia:JA:EFハンド|EFハンド]]型[[カルシウム]]結合性ドメイン(loop-helix-loop)をもつ、分子量が8~14kD程度の低分子量の蛋白質群である。B.W. Mooreにより、1965年にウシ脳から分離された。現在までに20種類以上のサブファミリーが同定されている。S100という名称は「中性硫酸アンモニウムに完全に(100%)溶ける(Soluble)」という特性に由来している。現在のところS100A1~S100A18、S100B、S100P、S100Z、Calbindin D<sub>9k</sub> (S100G)、Profilaggrin、Trychohyalin、Repetinに分類される。S100Bは特に[[脳]]での発現が高いことが知られている。[[wikipedia:JA:哺乳類|哺乳類]]の[[中枢神経]]系では、[[グリア細胞]]の一種である[[アストロサイト]]に選択的に発現する。末梢神経系ではグリア細胞の[[シュワン細胞]]に発現する。S100蛋白質群の機能は、細胞内カルシウム濃度を一定に保つバッファーとしての機能以外にも多岐にまたがると考えられており、未解明な部分が多い。またS100蛋白質は細胞内のシグナル伝達のみならず、細胞外にも分泌される事が知られており、実際に[[wikipedia:JA:血漿|血漿]]や[[脳脊髄液]]からも検出される。培養細胞系では、細胞外のS100Bは神経細胞の生存にかかわる[[栄養因子]]として働くことが提唱されている。 | ||
S100 | |||
== 構造 == | == 構造 == | ||
S100蛋白質群は、単量体として二つのEFハンド型カルシウム結合ドメインを有する。この二つのカルシウム結合ドメインは、それぞれ構造とカルシウム結合能が異なる。C末端側の12アミノ酸残基からなるリンカーループは[[カルモジュリン]]および[[トロポニン]]-Cと似たカルシウム結合様式を持ち、解離定数K<sub>d</sub>は10-50nM程度であるとされている。一方、N末端側の14アミノ酸残基からなる疑似正準的なEF-handリンカーループはK<sub>d</sub>=200-500µM程度の比較的弱いカルシウム結合能を持つ。ほとんどのS100蛋白質は生体内では二つの同一ポリペプチドが非共有結合で結合されている二量体として存在する。 | |||
== サブタイプ == | == サブタイプ == | ||
現在のところS100A1~S100A18、S100B、S100P、S100Z、Calbindin D9k (S100G) | 現在のところS100A1~S100A18、S100B、S100P、S100Z、Calbindin D9k (S100G)、Profilaggrin、Trychohyalin、Repetinに分類される... | ||
== 分布 == | == 分布 == | ||
S100蛋白質は、その種類により生体内での局在様式が異なる。例えばS100A1は[[wikipedia:JA:平滑筋|平滑筋]]の[[wikipedia:JA:細胞質|細胞質]]にある一方、100A2は平滑筋の[[wikipedia:JA:核内|核内]]に存在する。S100Pは[[wikipedia:JA:胎盤|胎盤]]の発現が高い。[http://mouse.brain-map.org/gene/show/19966 S100B]は脳での発現が顕著に認められ、中でもグリア細胞の一種であるアストロサイトに選択的に発現する。S100Bはアストロサイトにより分泌され、細胞外空間や血中に拡散する。脳損傷および炎症にて、血清中S100B濃度は高くなり、S100Bの血清濃度は神経疾患の一次的な診断材料となる。血清中S100B濃度は、[[てんかん]]および[[統合失調症]]患者では高くなる。また、S100B濃度の上昇は[[血液脳関門]]の損傷をも示唆し、診断ツールとしての有用性が広く認められている。 | |||
== 機能 == | == 機能 == | ||
S100蛋白質群は、カルシウムホメオスタシス、蛋白質の[[リン酸化]]の調節(例:、[[P53]]や[[Tau蛋白質]]のリン酸化の阻害、[[蛋白質リン酸化酵素]]活性)、細胞成長、細胞運動性、[[wikipedia:JA:細胞周期|細胞周期]]調節、[[wikipedia:JA:翻訳 (生物学)|翻訳]]、[[wikipedia:JA:細胞分化|細胞分化]]、細胞生存など、多様な機能をもつことが提唱されている<ref name=1a><pubmed>16683912</pubmed></ref> <ref name=1b><pubmed>12645002</pubmed></ref> <ref name=1c><pubmed> 20827421</pubmed></ref>。また、様々な疾患に関係するとされており、[[wikipedia:JA:乳がん|乳がん]]や[[wikipedia:JA:メラノーマ|メラノーマ]]を含む様々な癌細胞に発現する。また、S100蛋白質は、[[wikipedia:JA:炎症|炎症]]マーカーとしても利用される<ref name=2><pubmed></pubmed></ref>[2]。 | |||
S100Bは、[[神経突起]]および[[軸索]] | S100Bは、[[神経突起]]および[[軸索]]成長、メラノーマ細胞増殖、[[プロテインキナーゼC]]依存的なリン酸化、[[微小管]]の重合に関与しているとされている。また、培養神経細胞を使用した実験では、神経細胞生存に重要であるという報告もある<ref name=ref3><pubmed></pubmed></ref>[3]。しかし、S100Bノックアウト動物の神経回路形成には重篤な欠損がない<ref name=ref4><pubmed></pubmed></ref>[4]ことから、神経栄養因子としての機能は限定的であるという可能性も否めない。細胞外でのS100Bの標的としては[[終末糖化産物受容体]](RAGE)が知られている<ref name=5><pubmed></pubmed></ref>[5]。マウスを使用した実験で、S100Bの分泌は神経活動依存的に起こり、脳波活動に影響をもたらすことが報告されている[6]。 | ||
== 参考文献 == | == 参考文献 == | ||
< | Wikipedia entry: [http://en.wikipedia.org/wiki/S-100_protein S100 protein], [http://en.wikipedia.org/wiki/S100B S100B] | ||
[1] Santamaria-Kisiel L, Rintala-Dempsey AC, Shaw G. (2006) Calcium-dependent and -independent interactions of the S100 protein family. Biochem. J. 396:201-214; Donato R. (2003) Intracellular and extracellular roles of S100 proteins. Microscopy Res. Tech. 60:540-551; Sorci G, Bianchi R, Riuzzi F, Tubaro C, Arcuri C, Giambanco I, Donato R. S100B Protein, a damage-associated molecular pattern protein in the brain and heart, and beyond. Cardiovascular Psychiatry and Neurology. doi: 10.1155/2010/656481<br> | |||
[2] Sen J, Belli A. (2007) S100B in neuropathologic states: the CRP of the brain? J Neurosci Res. 15:1373-80. <br> | |||
[3] Van Eldik LJ, Christie-Pope B, Bolin LM, Shooter EM, Whetsell WO Jr. (1991) Neurotrophic activity of S-100 beta in cultures of dorsal root ganglia from embryonic chick and fetal rat. Brain Res. 542(2):280-5; <br> | |||
Huttunen HJ, Kuja-Panula J, Sorci G, Agneletti AL, Donato R, Rauvala H. (2000) Coregulation of neurite outgrowth and cell survival by amphoterin and S100 proteins through receptor for advanced glycation end products (RAGE) activation.J Biol Chem. 275:40096-105. | |||
[4] Nishiyama H, Takemura M, Takeda T, Itohara S. (2002) Normal development of serotonergic neurons in mice lacking S100B. Neurosci Lett. 321:49-52. | |||
[5] Hofmann MA, Drury S, Fu C, Qu W, Taguchi A, Lu Y, Avila C, Kambham N, Bierhaus A, Nawroth P, Neurath MF, Slattery T, Beach D, McClary J, Nagashima M, Morser J, Stern D, Schmidt AM. (1999) RAGE mediates a novel proinflammatory axis: a central cell surface receptor for S100/calgranulin polypeptides. Cell. 97:889-901. | |||
[6] Sakatani S, Seto-Ohshima A, Shinohara Y, Yamamoto Y, Yamamoto H, Itohara S, Hirase H. (2008) Neural-activity-dependent release of S100B from astrocytes enhances kainate-induced gamma oscillations in vivo. J Neurosci. 28:10928-36.<br> | |||
(執筆者:平瀬肇 担当編集委員:柚崎通介) | |||
2012年5月24日 (木) 11:56時点における版
| S-100/ICaBP type calcium binding domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
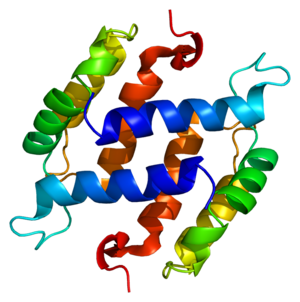 Structure of the S100B protein. Based on PyMOL rendering of PDB 1b4c. | |||||||||
| Identifiers | |||||||||
| Symbol | S_100 | ||||||||
| Pfam | PF01023 | ||||||||
| InterPro | IPR013787 | ||||||||
| PROSITE | PDOC00275 | ||||||||
| SCOP | 1cnp | ||||||||
| SUPERFAMILY | 1cnp | ||||||||
| |||||||||
S100 蛋白質は、EFハンド型カルシウム結合性ドメイン(loop-helix-loop)をもつ、分子量が8~14kD程度の低分子量の蛋白質群である。B.W. Mooreにより、1965年にウシ脳から分離された。現在までに20種類以上のサブファミリーが同定されている。S100という名称は「中性硫酸アンモニウムに完全に(100%)溶ける(Soluble)」という特性に由来している。現在のところS100A1~S100A18、S100B、S100P、S100Z、Calbindin D9k (S100G)、Profilaggrin、Trychohyalin、Repetinに分類される。S100Bは特に脳での発現が高いことが知られている。哺乳類の中枢神経系では、グリア細胞の一種であるアストロサイトに選択的に発現する。末梢神経系ではグリア細胞のシュワン細胞に発現する。S100蛋白質群の機能は、細胞内カルシウム濃度を一定に保つバッファーとしての機能以外にも多岐にまたがると考えられており、未解明な部分が多い。またS100蛋白質は細胞内のシグナル伝達のみならず、細胞外にも分泌される事が知られており、実際に血漿や脳脊髄液からも検出される。培養細胞系では、細胞外のS100Bは神経細胞の生存にかかわる栄養因子として働くことが提唱されている。
構造
S100蛋白質群は、単量体として二つのEFハンド型カルシウム結合ドメインを有する。この二つのカルシウム結合ドメインは、それぞれ構造とカルシウム結合能が異なる。C末端側の12アミノ酸残基からなるリンカーループはカルモジュリンおよびトロポニン-Cと似たカルシウム結合様式を持ち、解離定数Kdは10-50nM程度であるとされている。一方、N末端側の14アミノ酸残基からなる疑似正準的なEF-handリンカーループはKd=200-500µM程度の比較的弱いカルシウム結合能を持つ。ほとんどのS100蛋白質は生体内では二つの同一ポリペプチドが非共有結合で結合されている二量体として存在する。
サブタイプ
現在のところS100A1~S100A18、S100B、S100P、S100Z、Calbindin D9k (S100G)、Profilaggrin、Trychohyalin、Repetinに分類される...
分布
S100蛋白質は、その種類により生体内での局在様式が異なる。例えばS100A1は平滑筋の細胞質にある一方、100A2は平滑筋の核内に存在する。S100Pは胎盤の発現が高い。S100Bは脳での発現が顕著に認められ、中でもグリア細胞の一種であるアストロサイトに選択的に発現する。S100Bはアストロサイトにより分泌され、細胞外空間や血中に拡散する。脳損傷および炎症にて、血清中S100B濃度は高くなり、S100Bの血清濃度は神経疾患の一次的な診断材料となる。血清中S100B濃度は、てんかんおよび統合失調症患者では高くなる。また、S100B濃度の上昇は血液脳関門の損傷をも示唆し、診断ツールとしての有用性が広く認められている。
機能
S100蛋白質群は、カルシウムホメオスタシス、蛋白質のリン酸化の調節(例:、P53やTau蛋白質のリン酸化の阻害、蛋白質リン酸化酵素活性)、細胞成長、細胞運動性、細胞周期調節、翻訳、細胞分化、細胞生存など、多様な機能をもつことが提唱されている[1] [2] [3]。また、様々な疾患に関係するとされており、乳がんやメラノーマを含む様々な癌細胞に発現する。また、S100蛋白質は、炎症マーカーとしても利用される引用エラー: 無効な <ref> タグです。名前に単なる整数は使用できません。説明的なものにしてください[2]。
S100Bは、神経突起および軸索成長、メラノーマ細胞増殖、プロテインキナーゼC依存的なリン酸化、微小管の重合に関与しているとされている。また、培養神経細胞を使用した実験では、神経細胞生存に重要であるという報告もある[4][3]。しかし、S100Bノックアウト動物の神経回路形成には重篤な欠損がない[5][4]ことから、神経栄養因子としての機能は限定的であるという可能性も否めない。細胞外でのS100Bの標的としては終末糖化産物受容体(RAGE)が知られている引用エラー: 無効な <ref> タグです。名前に単なる整数は使用できません。説明的なものにしてください[5]。マウスを使用した実験で、S100Bの分泌は神経活動依存的に起こり、脳波活動に影響をもたらすことが報告されている[6]。
参考文献
Wikipedia entry: S100 protein, S100B
[1] Santamaria-Kisiel L, Rintala-Dempsey AC, Shaw G. (2006) Calcium-dependent and -independent interactions of the S100 protein family. Biochem. J. 396:201-214; Donato R. (2003) Intracellular and extracellular roles of S100 proteins. Microscopy Res. Tech. 60:540-551; Sorci G, Bianchi R, Riuzzi F, Tubaro C, Arcuri C, Giambanco I, Donato R. S100B Protein, a damage-associated molecular pattern protein in the brain and heart, and beyond. Cardiovascular Psychiatry and Neurology. doi: 10.1155/2010/656481
[2] Sen J, Belli A. (2007) S100B in neuropathologic states: the CRP of the brain? J Neurosci Res. 15:1373-80.
[3] Van Eldik LJ, Christie-Pope B, Bolin LM, Shooter EM, Whetsell WO Jr. (1991) Neurotrophic activity of S-100 beta in cultures of dorsal root ganglia from embryonic chick and fetal rat. Brain Res. 542(2):280-5;
Huttunen HJ, Kuja-Panula J, Sorci G, Agneletti AL, Donato R, Rauvala H. (2000) Coregulation of neurite outgrowth and cell survival by amphoterin and S100 proteins through receptor for advanced glycation end products (RAGE) activation.J Biol Chem. 275:40096-105.
[4] Nishiyama H, Takemura M, Takeda T, Itohara S. (2002) Normal development of serotonergic neurons in mice lacking S100B. Neurosci Lett. 321:49-52.
[5] Hofmann MA, Drury S, Fu C, Qu W, Taguchi A, Lu Y, Avila C, Kambham N, Bierhaus A, Nawroth P, Neurath MF, Slattery T, Beach D, McClary J, Nagashima M, Morser J, Stern D, Schmidt AM. (1999) RAGE mediates a novel proinflammatory axis: a central cell surface receptor for S100/calgranulin polypeptides. Cell. 97:889-901.
[6] Sakatani S, Seto-Ohshima A, Shinohara Y, Yamamoto Y, Yamamoto H, Itohara S, Hirase H. (2008) Neural-activity-dependent release of S100B from astrocytes enhances kainate-induced gamma oscillations in vivo. J Neurosci. 28:10928-36.
(執筆者:平瀬肇 担当編集委員:柚崎通介)
- ↑
Santamaria-Kisiel, L., Rintala-Dempsey, A.C., & Shaw, G.S. (2006).
Calcium-dependent and -independent interactions of the S100 protein family. The Biochemical journal, 396(2), 201-14. [PubMed:16683912] [PMC] [WorldCat] [DOI] - ↑
Donato, R. (2003).
Intracellular and extracellular roles of S100 proteins. Microscopy research and technique, 60(6), 540-51. [PubMed:12645002] [WorldCat] [DOI] - ↑
Sorci, G., Bianchi, R., Riuzzi, F., Tubaro, C., Arcuri, C., Giambanco, I., & Donato, R. (2010).
S100B Protein, A Damage-Associated Molecular Pattern Protein in the Brain and Heart, and Beyond. Cardiovascular psychiatry and neurology, 2010. [PubMed:20827421] [PMC] [WorldCat] [DOI] - ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.