「膜貫通AMPA受容体調節性タンパク質」の版間の差分
編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の3版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">富田 進</font><br> | <font size="+1">富田 進</font><br> | ||
''イェール大学''<br> | ''イェール大学''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2016年1月27日 原稿完成日:2016年2月25日<br> | ||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div> | </div> | ||
| 15行目: | 15行目: | ||
==イントロダクション== | ==イントロダクション== | ||
自然発生変異[[マウス]]であるスターゲイザーは[[運動失調]]や[[欠伸発作]]を示す<ref name=ref5><pubmed>2289471</pubmed></ref>。その原因遺伝子 は[[カルシウムチャネル]]γサブユニットと38%の相同性を示すことから Calcium channel γ subunit | 自然発生変異[[マウス]]であるスターゲイザーは[[運動失調]]や[[欠伸発作]]を示す<ref name=ref5><pubmed>2289471</pubmed></ref>。その原因遺伝子 は[[カルシウムチャネル]]γサブユニットと38%の相同性を示すことから Calcium channel γ subunit 2(CACNG2)/Stargazinと名付けられ<ref name=ref6><pubmed>9697694</pubmed></ref>、その後8つのCACNG類似遺伝子群が報告された<ref name=ref7><pubmed>11738816</pubmed></ref>。 | ||
ところが、電気生理学的解析により、スターゲイザーマウスの | ところが、電気生理学的解析により、スターゲイザーマウスの[[苔状線維]]-小脳[[顆粒細胞]][[シナプス]]における[[AMPA型グルタミン酸受容体]]活性が特異的に消失していること<ref name=ref8><pubmed>10407040</pubmed></ref>、カルシムチャネル活性に変化がないことが示された<ref name=ref9><pubmed>11140673</pubmed></ref>。さらなる解析により、8つのCACNGファミリーのうちCACNG2/3/4/5/7/8の6つがAMPA型[[グルタミン酸受容体]]に特異的に結合すること示され、これらはTransmembrane AMPA receptor Regulatory Protein(TARP)γ-2/3/4/5/7/8と名付けられた<ref name=ref10><pubmed>12771129</pubmed></ref> <ref name=ref11><pubmed>18817736</pubmed></ref> <ref name=ref12><pubmed>17475805</pubmed></ref>。 | ||
==ファミリー== | ==ファミリー== | ||
[[image:膜貫通AMPA受容体調節性タンパク質1.png|thumb|350px|''' | [[image:膜貫通AMPA受容体調節性タンパク質1.png|thumb|350px|'''図1.TARP 相同性タンパク質の系統樹'''<br>カルシウムチャネルγサブユニット(γ-1)の相同性タンパク質として、γ-2から8が同定された。これらのうち、AMPA型グルタミン酸受容体に特異的に結合するTARP として、γ-2/3(Type Ia)、γ-4/8(Type Ib)、γ-5/7(Type II)が同定されている。これらは、Tight Junctionの構成成分であるClaudinタンパク質群と相同性を有する。]] | ||
6つのアイソフォームが同定されており、後述のようにAMPA[[グルタミン酸]]受容体修飾機能の違いにより、さらにサブクラスに分類されている(図1)。また、[[線虫]]において、その機能的相同体[[STG-1]]/[[STG-2|2]]が示されている<ref name=ref13><pubmed>16818877</pubmed></ref> <ref name=ref14><pubmed>18817737</pubmed></ref>。 | 6つのアイソフォームが同定されており、後述のようにAMPA[[グルタミン酸]]受容体修飾機能の違いにより、さらにサブクラスに分類されている(図1)。また、[[線虫]]において、その機能的相同体[[STG-1]]/[[STG-2|2]]が示されている<ref name=ref13><pubmed>16818877</pubmed></ref> <ref name=ref14><pubmed>18817737</pubmed></ref>。 | ||
==構造== | ==構造== | ||
[[image:膜貫通AMPA受容体調節性タンパク質2.png|thumb|350px|''' | [[image:膜貫通AMPA受容体調節性タンパク質2.png|thumb|350px|'''図2.TARP の構造'''<BR>TARPは4回膜貫通タンパク質である。NとCの両末端が細胞内にあり、細胞外ドメインにN結合型糖鎖修飾部位をもつ。Type I TARP は細胞内ドメインにアルギニン酸残基(Arg)とリン酸化セリン(P-Ser)の集積部位(オレンジ)、C末端にPDZドメイン結合配列(-TTPV)を有する。]] | ||
4回膜貫通部位を有し、NとCの両末端が細胞内にある(図2)。1つ目の細胞外ドメインに、[[N結合型糖鎖修飾]]部位をもつ。この細胞外ドメインは、AMPAグルタミン酸受容体活性の調節に必須である<ref name=ref15><pubmed>15858532</pubmed></ref> <ref name=ref16><pubmed>16919685</pubmed></ref> <ref name=ref17><pubmed>16793768</pubmed></ref>。 | 4回膜貫通部位を有し、NとCの両末端が細胞内にある(図2)。1つ目の細胞外ドメインに、[[N結合型糖鎖修飾]]部位をもつ。この細胞外ドメインは、AMPAグルタミン酸受容体活性の調節に必須である<ref name=ref15><pubmed>15858532</pubmed></ref> <ref name=ref16><pubmed>16919685</pubmed></ref> <ref name=ref17><pubmed>16793768</pubmed></ref>。 | ||
| 32行目: | 32行目: | ||
TARPγ-2/3/4/8が含まれる。C末端には[[PDZドメイン]]結合配列を有し、[[PSD-95]]様[[MAGUKs]]や他の[[PDZ]]ドメイン含有タンパク質に結合し、シナプス局在を調節することが示されている<ref name=ref9 /> <ref name=ref18><pubmed> 12359873</pubmed></ref> <ref name=ref19><pubmed>14529722</pubmed></ref> <ref name=ref20><pubmed>17329211</pubmed></ref>。 | TARPγ-2/3/4/8が含まれる。C末端には[[PDZドメイン]]結合配列を有し、[[PSD-95]]様[[MAGUKs]]や他の[[PDZ]]ドメイン含有タンパク質に結合し、シナプス局在を調節することが示されている<ref name=ref9 /> <ref name=ref18><pubmed> 12359873</pubmed></ref> <ref name=ref19><pubmed>14529722</pubmed></ref> <ref name=ref20><pubmed>17329211</pubmed></ref>。 | ||
C末端細胞内ドメインには、[[アルギニン]]残基クラスターリング部位があり、陽性に荷電している。この領域には、少なくとも9つの[[リン酸化]][[セリン]] | C末端細胞内ドメインには、[[アルギニン]]残基クラスターリング部位があり、陽性に荷電している。この領域には、少なくとも9つの[[リン酸化]][[セリン]]残基(P-Ser)がこれまでに同定されており、[[タンパク質]]-[[脂質]]結合、タンパク質-タンパク質結合を調整していると考えられている<ref name=ref21><pubmed>15664178</pubmed></ref> <ref name=ref22><pubmed>20547132</pubmed></ref> <ref name=ref23><pubmed>18341993</pubmed></ref> <ref name=ref24><pubmed>24418105</pubmed></ref>。 | ||
TARP type I は、さらに、 アミノ酸配列相同性(図1)および機能の類似性(後述、チャネル活性)によりTARP type Ia (TARPγ-2/3)と type Ib(TARPγ-4/8)に分類される。 | |||
===TARP type II=== | ===TARP type II=== | ||
TARPγ-5/7が含まれる。Type Iと異なり、典型的な[[PDZドメイン]] | TARPγ-5/7が含まれる。Type Iと異なり、典型的な[[PDZドメイン]]結合配列およびアルギニン残基集積部位を有さない<ref name=ref2 />。 | ||
==分布== | ==分布== | ||
| 46行目: | 48行目: | ||
===チャネル活性=== | ===チャネル活性=== | ||
膜貫通AMPA受容体調節性タンパク質はAMPAグルタミン酸受容体のチャネル活性を制御する<ref name=ref15 /> <ref name=ref17 /> <ref name=ref30><pubmed>15758178</pubmed></ref>。膜貫通AMPA受容体調節性タンパク質の細胞外ドメインを介して、AMPA型グルタミン酸受容体のチャネルの[[開口速度]]を速くすることにより、[[脱感作]]、[[脱活性]]の速度を遅くする<ref name=ref15 />。さらに、脳において、AMPA型グルタミン酸受容体由来のシナプス伝達の減衰速度を調節しており<ref name=ref15 /> | 膜貫通AMPA受容体調節性タンパク質はAMPAグルタミン酸受容体のチャネル活性を制御する<ref name=ref15 /> <ref name=ref17 /> <ref name=ref30><pubmed>15758178</pubmed></ref>。膜貫通AMPA受容体調節性タンパク質の細胞外ドメインを介して、AMPA型グルタミン酸受容体のチャネルの[[開口速度]]を速くすることにより、[[脱感作]]、[[脱活性]]の速度を遅くする<ref name=ref15 />。さらに、脳において、AMPA型グルタミン酸受容体由来のシナプス伝達の減衰速度を調節しており<ref name=ref15 />、Type Ib TARPは、Type Ia TARPに比べて、定量的により効果的に減衰速度を遅延する<ref name=ref31><pubmed>17880893</pubmed></ref> <ref name=ref32><pubmed>17880894</pubmed></ref>。このとき、AMPA受容体にはコンダクタンスの異なる幾つかの開口状態が存在するが、膜貫通AMPA受容体調節性タンパク質は、AMPA受容体のそれぞれの開口状態にある確率(occupancy)を変化させる<ref name=ref15 />。 | ||
===シナプス局在=== | ===シナプス局在=== | ||
| 55行目: | 57行目: | ||
===細胞表面の発現=== | ===細胞表面の発現=== | ||
膜貫通AMPA受容体調節性タンパク質はAMPA型グルタミン酸受容体の細胞表面への発現を調節する。この機能に、PDZドメイン結合配列は関与していない<ref name=ref9 /> <ref name=ref33 /> | 膜貫通AMPA受容体調節性タンパク質はAMPA型グルタミン酸受容体の細胞表面への発現を調節する。この機能に、PDZドメイン結合配列は関与していない<ref name=ref9 /> <ref name=ref33 />。また、膜貫通AMPA受容体調節性タンパク質細胞質ドメインにクラスリンアダプタープロテイン4(AP-4)が結合することによって、AMPA受容体は樹状突起へ極性輸送される<ref name=ref23 />。さらに膜貫通AMPA受容体調節性タンパク質細胞質ドメインのリン酸化にともなって、クラスリンアダプタープロテイン2(AP2)とAP3への結合を介してAMPA受容体複合体のエンドサイトーシスが調節される<ref name=ref24217640><pubmed>24217640</pubmed></ref>。 | ||
===個体レベルでの機能=== | ===個体レベルでの機能=== | ||
2016年2月25日 (木) 13:44時点における最新版
富田 進
イェール大学
DOI:10.14931/bsd.6840 原稿受付日:2016年1月27日 原稿完成日:2016年2月25日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名: Transmembrane AMPA receptor regulatory protein
英語略称:TARP
類義語:スターゲージン(Stargazin)
膜貫通AMPA受容体調節性タンパク質は、線虫から哺乳類まで保存されているAMPA型グルタミン酸受容体の補助サブユニットである。構造上の類似性から、当初カルシウムチャネルγサブユニットと名付けられたが、 これまでにAMPA型グルタミン酸受容体に特異的に作用することが明らかになっている。膜貫通AMPA受容体調節性タンパク質はAMPA受容体に特異的に結合し、受容体発現量、シナプス局在、チャネル活性を制御する[1] [2] [3] [4]。
イントロダクション
自然発生変異マウスであるスターゲイザーは運動失調や欠伸発作を示す[5]。その原因遺伝子 はカルシウムチャネルγサブユニットと38%の相同性を示すことから Calcium channel γ subunit 2(CACNG2)/Stargazinと名付けられ[6]、その後8つのCACNG類似遺伝子群が報告された[7]。
ところが、電気生理学的解析により、スターゲイザーマウスの苔状線維-小脳顆粒細胞シナプスにおけるAMPA型グルタミン酸受容体活性が特異的に消失していること[8]、カルシムチャネル活性に変化がないことが示された[9]。さらなる解析により、8つのCACNGファミリーのうちCACNG2/3/4/5/7/8の6つがAMPA型グルタミン酸受容体に特異的に結合すること示され、これらはTransmembrane AMPA receptor Regulatory Protein(TARP)γ-2/3/4/5/7/8と名付けられた[10] [11] [12]。
ファミリー
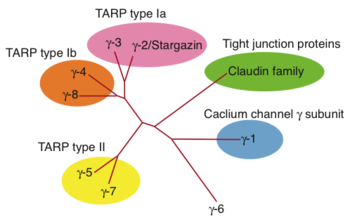
カルシウムチャネルγサブユニット(γ-1)の相同性タンパク質として、γ-2から8が同定された。これらのうち、AMPA型グルタミン酸受容体に特異的に結合するTARP として、γ-2/3(Type Ia)、γ-4/8(Type Ib)、γ-5/7(Type II)が同定されている。これらは、Tight Junctionの構成成分であるClaudinタンパク質群と相同性を有する。
6つのアイソフォームが同定されており、後述のようにAMPAグルタミン酸受容体修飾機能の違いにより、さらにサブクラスに分類されている(図1)。また、線虫において、その機能的相同体STG-1/2が示されている[13] [14]。
構造

TARPは4回膜貫通タンパク質である。NとCの両末端が細胞内にあり、細胞外ドメインにN結合型糖鎖修飾部位をもつ。Type I TARP は細胞内ドメインにアルギニン酸残基(Arg)とリン酸化セリン(P-Ser)の集積部位(オレンジ)、C末端にPDZドメイン結合配列(-TTPV)を有する。
4回膜貫通部位を有し、NとCの両末端が細胞内にある(図2)。1つ目の細胞外ドメインに、N結合型糖鎖修飾部位をもつ。この細胞外ドメインは、AMPAグルタミン酸受容体活性の調節に必須である[15] [16] [17]。
TARP type I
TARPγ-2/3/4/8が含まれる。C末端にはPDZドメイン結合配列を有し、PSD-95様MAGUKsや他のPDZドメイン含有タンパク質に結合し、シナプス局在を調節することが示されている[9] [18] [19] [20]。
C末端細胞内ドメインには、アルギニン残基クラスターリング部位があり、陽性に荷電している。この領域には、少なくとも9つのリン酸化セリン残基(P-Ser)がこれまでに同定されており、タンパク質-脂質結合、タンパク質-タンパク質結合を調整していると考えられている[21] [22] [23] [24]。
TARP type I は、さらに、 アミノ酸配列相同性(図1)および機能の類似性(後述、チャネル活性)によりTARP type Ia (TARPγ-2/3)と type Ib(TARPγ-4/8)に分類される。
TARP type II
TARPγ-5/7が含まれる。Type Iと異なり、典型的なPDZドメイン結合配列およびアルギニン残基集積部位を有さない[2]。
分布
組織レベルでは、脳に強い発現を示し、それぞれのアイソフォームは脳内で特徴的な発現パターンを示す[10] [25]。例えば、γ-2は小脳顆粒細胞、γ-8は海馬、γ-3は大脳皮質、γ-4は発生過程において強く発現している。
膜貫通AMPA受容体調節性タンパク質は、免疫染色、生化学分画によりAMPA型グルタミン酸受容体同様に、シナプス及び膜表面に強く検出される。また、膜貫通AMPA受容体調節性タンパク質はAMPA型グルタミン酸受容体と安定的複合体を形成することも、AMPA型グルタミン酸受容体との共局在を支持する[10] [26] [27] [28] [29]。
機能
膜貫通AMPA受容体調節性タンパク質はAMPA型グルタミン酸受容体に結合し、AMPA型グルタミン酸受容体のタンパク質発現量、チャネル活性、および細胞表面とシナプス局在を調節する。
チャネル活性
膜貫通AMPA受容体調節性タンパク質はAMPAグルタミン酸受容体のチャネル活性を制御する[15] [17] [30]。膜貫通AMPA受容体調節性タンパク質の細胞外ドメインを介して、AMPA型グルタミン酸受容体のチャネルの開口速度を速くすることにより、脱感作、脱活性の速度を遅くする[15]。さらに、脳において、AMPA型グルタミン酸受容体由来のシナプス伝達の減衰速度を調節しており[15]、Type Ib TARPは、Type Ia TARPに比べて、定量的により効果的に減衰速度を遅延する[31] [32]。このとき、AMPA受容体にはコンダクタンスの異なる幾つかの開口状態が存在するが、膜貫通AMPA受容体調節性タンパク質は、AMPA受容体のそれぞれの開口状態にある確率(occupancy)を変化させる[15]。
シナプス局在
膜貫通AMPA受容体調節性タンパク質はAMPA型グルタミン酸受容体のシナプス局在を制御する[9]。小脳顆粒細胞および海馬において、膜貫通AMPA受容体調節性タンパク質とそのPDZドメイン結合配列はAMPA型グルタミン酸受容体のシナプス局在に必須である[9] [33]。PDZドメイン結合配列は、PSD-95を始めとするMAGUKsに結合する[9] [18] [19] [20]。また、膜貫通AMPA受容体調節性タンパク質細胞質ドメインのリン酸化依存的に脂質結合が変化し、シナプス局在が調節されることが知られている[21] [22] [34]。
AMPA型グルタミン酸受容体のタンパク質発現量
膜貫通AMPA受容体調節性タンパク質はAMPA型グルタミン酸受容体の発現を安定化する。海馬に多く発現するγ-8遺伝子欠損マウスにおいて、海馬におけるAMPA型グルタミン酸受容体の発現量が10%になる[28] [29]。このとき、N結合型糖鎖が成熟したAMPA型グルタミン酸受容体のみが減少し、小胞体に多く局在するN結合型糖鎖の未成熟なAMPA型グルタミン酸受容体に影響を及ぼさないことから、膜貫通AMPA受容体調節性タンパク質は成熟したAMPA型グルタミン酸受容体を安定化していると考えられている[33]。また、小脳顆粒細胞に発現するγ-2の変異マウス、スターゲイザーにおいて、15%程度のAMPA型グルタミン酸受容体の発現量減少が小脳(全体)で観測される[10]。
細胞表面の発現
膜貫通AMPA受容体調節性タンパク質はAMPA型グルタミン酸受容体の細胞表面への発現を調節する。この機能に、PDZドメイン結合配列は関与していない[9] [33]。また、膜貫通AMPA受容体調節性タンパク質細胞質ドメインにクラスリンアダプタープロテイン4(AP-4)が結合することによって、AMPA受容体は樹状突起へ極性輸送される[23]。さらに膜貫通AMPA受容体調節性タンパク質細胞質ドメインのリン酸化にともなって、クラスリンアダプタープロテイン2(AP2)とAP3への結合を介してAMPA受容体複合体のエンドサイトーシスが調節される[35]。
個体レベルでの機能
TARP γ-2遺伝子欠損マウスでは、運動失調や欠伸発作が観測される[5]。
TARP γ-2を含むトリプルTARP type I遺伝子欠損マウスは致死となる[36]。
TARP γ-4遺伝子欠損マウスでは、けいれんが観測される[37]。
TARP γ-2/7の両TARP遺伝子欠損マウスにおいて、小脳プルキンエ細胞中のシナプスAMPA型グルタミン酸受容体活性が消失する[38]。
関連項目
参考文献
- ↑
Nicoll, R.A., Tomita, S., & Bredt, D.S. (2006).
Auxiliary subunits assist AMPA-type glutamate receptors. Science (New York, N.Y.), 311(5765), 1253-6. [PubMed:16513974] [WorldCat] [DOI] - ↑ 2.0 2.1
Kato, A.S., Gill, M.B., Yu, H., Nisenbaum, E.S., & Bredt, D.S. (2010).
TARPs differentially decorate AMPA receptors to specify neuropharmacology. Trends in neurosciences, 33(5), 241-8. [PubMed:20219255] [WorldCat] [DOI] - ↑
Jackson, A.C., & Nicoll, R.A. (2011).
The expanding social network of ionotropic glutamate receptors: TARPs and other transmembrane auxiliary subunits. Neuron, 70(2), 178-99. [PubMed:21521608] [PMC] [WorldCat] [DOI] - ↑
Yan, D., & Tomita, S. (2012).
Defined criteria for auxiliary subunits of glutamate receptors. The Journal of physiology, 590(1), 21-31. [PubMed:21946847] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1
Noebels, J.L., Qiao, X., Bronson, R.T., Spencer, C., & Davisson, M.T. (1990).
Stargazer: a new neurological mutant on chromosome 15 in the mouse with prolonged cortical seizures. Epilepsy research, 7(2), 129-35. [PubMed:2289471] [WorldCat] [DOI] - ↑
Letts, V.A., Felix, R., Biddlecome, G.H., Arikkath, J., Mahaffey, C.L., Valenzuela, A., ..., & Frankel, W.N. (1998).
The mouse stargazer gene encodes a neuronal Ca2+-channel gamma subunit. Nature genetics, 19(4), 340-7. [PubMed:9697694] [WorldCat] [DOI] - ↑
Chu, P.J., Robertson, H.M., & Best, P.M. (2001).
Calcium channel gamma subunits provide insights into the evolution of this gene family. Gene, 280(1-2), 37-48. [PubMed:11738816] [WorldCat] [DOI] - ↑
Hashimoto, K., Fukaya, M., Qiao, X., Sakimura, K., Watanabe, M., & Kano, M. (1999).
Impairment of AMPA receptor function in cerebellar granule cells of ataxic mutant mouse stargazer. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(14), 6027-36. [PubMed:10407040] [PMC] [WorldCat] - ↑ 9.0 9.1 9.2 9.3 9.4 9.5
Chen, L., Chetkovich, D.M., Petralia, R.S., Sweeney, N.T., Kawasaki, Y., Wenthold, R.J., ..., & Nicoll, R.A. (2001).
Stargazin regulates synaptic targeting of AMPA receptors by two distinct mechanisms. Nature, 408(6815), 936-43. [PubMed:11140673] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2 10.3
Tomita, S., Chen, L., Kawasaki, Y., Petralia, R.S., Wenthold, R.J., Nicoll, R.A., & Bredt, D.S. (2003).
Functional studies and distribution define a family of transmembrane AMPA receptor regulatory proteins. The Journal of cell biology, 161(4), 805-16. [PubMed:12771129] [PMC] [WorldCat] [DOI] - ↑
Kato, A.S., Siuda, E.R., Nisenbaum, E.S., & Bredt, D.S. (2008).
AMPA receptor subunit-specific regulation by a distinct family of type II TARPs. Neuron, 59(6), 986-96. [PubMed:18817736] [WorldCat] [DOI] - ↑
Kato, A.S., Zhou, W., Milstein, A.D., Knierman, M.D., Siuda, E.R., Dotzlaf, J.E., ..., & Bredt, D.S. (2007).
New transmembrane AMPA receptor regulatory protein isoform, gamma-7, differentially regulates AMPA receptors. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(18), 4969-77. [PubMed:17475805] [PMC] [WorldCat] [DOI] - ↑
Walker, C.S., Brockie, P.J., Madsen, D.M., Francis, M.M., Zheng, Y., Koduri, S., ..., & Maricq, A.V. (2006).
Reconstitution of invertebrate glutamate receptor function depends on stargazin-like proteins. Proceedings of the National Academy of Sciences of the United States of America, 103(28), 10781-6. [PubMed:16818877] [PMC] [WorldCat] [DOI] - ↑
Wang, R., Walker, C.S., Brockie, P.J., Francis, M.M., Mellem, J.E., Madsen, D.M., & Maricq, A.V. (2008).
Evolutionary conserved role for TARPs in the gating of glutamate receptors and tuning of synaptic function. Neuron, 59(6), 997-1008. [PubMed:18817737] [PMC] [WorldCat] [DOI] - ↑ 15.0 15.1 15.2 15.3 15.4
Tomita, S., Adesnik, H., Sekiguchi, M., Zhang, W., Wada, K., Howe, J.R., ..., & Bredt, D.S. (2005).
Stargazin modulates AMPA receptor gating and trafficking by distinct domains. Nature, 435(7045), 1052-8. [PubMed:15858532] [WorldCat] [DOI] - ↑
Tomita, S., Shenoy, A., Fukata, Y., Nicoll, R.A., & Bredt, D.S. (2007).
Stargazin interacts functionally with the AMPA receptor glutamate-binding module. Neuropharmacology, 52(1), 87-91. [PubMed:16919685] [WorldCat] [DOI] - ↑ 17.0 17.1
Bedoukian, M.A., Weeks, A.M., & Partin, K.M. (2006).
Different domains of the AMPA receptor direct stargazin-mediated trafficking and stargazin-mediated modulation of kinetics. The Journal of biological chemistry, 281(33), 23908-21. [PubMed:16793768] [WorldCat] [DOI] - ↑ 18.0 18.1
Schnell, E., Sizemore, M., Karimzadegan, S., Chen, L., Bredt, D.S., & Nicoll, R.A. (2002).
Direct interactions between PSD-95 and stargazin control synaptic AMPA receptor number. Proceedings of the National Academy of Sciences of the United States of America, 99(21), 13902-7. [PubMed:12359873] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Dakoji, S., Tomita, S., Karimzadegan, S., Nicoll, R.A., & Bredt, D.S. (2003).
Interaction of transmembrane AMPA receptor regulatory proteins with multiple membrane associated guanylate kinases. Neuropharmacology, 45(6), 849-56. [PubMed:14529722] [WorldCat] [DOI] - ↑ 20.0 20.1
Bats, C., Groc, L., & Choquet, D. (2007).
The interaction between Stargazin and PSD-95 regulates AMPA receptor surface trafficking. Neuron, 53(5), 719-34. [PubMed:17329211] [WorldCat] [DOI] - ↑ 21.0 21.1
Tomita, S., Stein, V., Stocker, T.J., Nicoll, R.A., & Bredt, D.S. (2005).
Bidirectional synaptic plasticity regulated by phosphorylation of stargazin-like TARPs. Neuron, 45(2), 269-77. [PubMed:15664178] [WorldCat] [DOI] - ↑ 22.0 22.1
Sumioka, A., Yan, D., & Tomita, S. (2010).
TARP phosphorylation regulates synaptic AMPA receptors through lipid bilayers. Neuron, 66(5), 755-67. [PubMed:20547132] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1
Matsuda, S., Miura, E., Matsuda, K., Kakegawa, W., Kohda, K., Watanabe, M., & Yuzaki, M. (2008).
Accumulation of AMPA receptors in autophagosomes in neuronal axons lacking adaptor protein AP-4. Neuron, 57(5), 730-45. [PubMed:18341993] [WorldCat] [DOI] - ↑
Itakura, M., Watanabe, I., Sugaya, T., & Takahashi, M. (2014).
Direct association of the unique C-terminal tail of transmembrane AMPA receptor regulatory protein γ-8 with calcineurin. The FEBS journal, 281(5), 1366-78. [PubMed:24418105] [WorldCat] [DOI] - ↑
Fukaya, M., Yamazaki, M., Sakimura, K., & Watanabe, M. (2005).
Spatial diversity in gene expression for VDCCgamma subunit family in developing and adult mouse brains. Neuroscience research, 53(4), 376-83. [PubMed:16171881] [WorldCat] [DOI] - ↑
Tomita, S., Fukata, M., Nicoll, R.A., & Bredt, D.S. (2004).
Dynamic interaction of stargazin-like TARPs with cycling AMPA receptors at synapses. Science (New York, N.Y.), 303(5663), 1508-11. [PubMed:15001777] [WorldCat] [DOI] - ↑
Vandenberghe, W., Nicoll, R.A., & Bredt, D.S. (2005).
Stargazin is an AMPA receptor auxiliary subunit. Proceedings of the National Academy of Sciences of the United States of America, 102(2), 485-90. [PubMed:15630087] [PMC] [WorldCat] [DOI] - ↑ 28.0 28.1
Rouach, N., Byrd, K., Petralia, R.S., Elias, G.M., Adesnik, H., Tomita, S., ..., & Nicoll, R.A. (2005).
TARP gamma-8 controls hippocampal AMPA receptor number, distribution and synaptic plasticity. Nature neuroscience, 8(11), 1525-33. [PubMed:16222232] [WorldCat] [DOI] - ↑ 29.0 29.1
Fukaya, M., Tsujita, M., Yamazaki, M., Kushiya, E., Abe, M., Akashi, K., ..., & Sakimura, K. (2006).
Abundant distribution of TARP gamma-8 in synaptic and extrasynaptic surface of hippocampal neurons and its major role in AMPA receptor expression on spines and dendrites. The European journal of neuroscience, 24(8), 2177-90. [PubMed:17074043] [WorldCat] [DOI] - ↑
Priel, A., Kolleker, A., Ayalon, G., Gillor, M., Osten, P., & Stern-Bach, Y. (2005).
Stargazin reduces desensitization and slows deactivation of the AMPA-type glutamate receptors. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(10), 2682-6. [PubMed:15758178] [PMC] [WorldCat] [DOI] - ↑
Cho, C.H., St-Gelais, F., Zhang, W., Tomita, S., & Howe, J.R. (2007).
Two families of TARP isoforms that have distinct effects on the kinetic properties of AMPA receptors and synaptic currents. Neuron, 55(6), 890-904. [PubMed:17880893] [WorldCat] [DOI] - ↑
Milstein, A.D., Zhou, W., Karimzadegan, S., Bredt, D.S., & Nicoll, R.A. (2007).
TARP subtypes differentially and dose-dependently control synaptic AMPA receptor gating. Neuron, 55(6), 905-18. [PubMed:17880894] [PMC] [WorldCat] [DOI] - ↑ 33.0 33.1 33.2
Sumioka, A., Brown, T.E., Kato, A.S., Bredt, D.S., Kauer, J.A., & Tomita, S. (2011).
PDZ binding of TARPγ-8 controls synaptic transmission but not synaptic plasticity. Nature neuroscience, 14(11), 1410-2. [PubMed:22002768] [PMC] [WorldCat] [DOI] - ↑
Hafner, A.S., Penn, A.C., Grillo-Bosch, D., Retailleau, N., Poujol, C., Philippat, A., ..., & Choquet, D. (2015).
Lengthening of the Stargazin Cytoplasmic Tail Increases Synaptic Transmission by Promoting Interaction to Deeper Domains of PSD-95. Neuron, 86(2), 475-89. [PubMed:25843401] [WorldCat] [DOI] - ↑
Matsuda, S., Kakegawa, W., Budisantoso, T., Nomura, T., Kohda, K., & Yuzaki, M. (2013).
Stargazin regulates AMPA receptor trafficking through adaptor protein complexes during long-term depression. Nature communications, 4, 2759. [PubMed:24217640] [WorldCat] [DOI] - ↑
Menuz, K., Kerchner, G.A., O'Brien, J.L., & Nicoll, R.A. (2009).
Critical role for TARPs in early development despite broad functional redundancy. Neuropharmacology, 56(1), 22-9. [PubMed:18634809] [PMC] [WorldCat] [DOI] - ↑
Letts, V.A., Mahaffey, C.L., Beyer, B., & Frankel, W.N. (2005).
A targeted mutation in Cacng4 exacerbates spike-wave seizures in stargazer (Cacng2) mice. Proceedings of the National Academy of Sciences of the United States of America, 102(6), 2123-8. [PubMed:15677329] [PMC] [WorldCat] [DOI] - ↑
Yamazaki, M., Fukaya, M., Hashimoto, K., Yamasaki, M., Tsujita, M., Itakura, M., ..., & Watanabe, M. (2010).
TARPs gamma-2 and gamma-7 are essential for AMPA receptor expression in the cerebellum. The European journal of neuroscience, 31(12), 2204-20. [PubMed:20529126] [WorldCat] [DOI]