英語名:Ca2+-dependent activator protein for secretion (CAPS)
| Ca2+-dependent secretion activator | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 PDB rendering based on 1wi1. | |||||||||||||
| |||||||||||||
| Identifiers | |||||||||||||
| Symbols | CADPS; CADPS1; CAPS; CAPS1 | ||||||||||||
| External IDs | OMIM: 604667 MGI: 1350922 HomoloGene: 2755 GeneCards: CADPS Gene | ||||||||||||
| |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 8618 | 27062 | |||||||||||
| Ensembl | ENSG00000163618 | ENSMUSG00000054423 | |||||||||||
| UniProt | Q9ULU8 | Q80TJ1 | |||||||||||
| RefSeq (mRNA) | NM_003716.3 | NM_001042617.1 | |||||||||||
| RefSeq (protein) | NP_003707.2 | NP_001036082.1 | |||||||||||
| Location (UCSC) |
Chr 3: 62.38 – 62.86 Mb |
Chr 14: 13.21 – 13.66 Mb | |||||||||||
| PubMed search | [1] | [2] | |||||||||||
| Ca2+-dependent secretion activator 2 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||||
| Symbols | CADPS2; FLJ40851; KIAA1591 | ||||||||||||
| External IDs | OMIM: 609978 MGI: 2443963 HomoloGene: 23060 GeneCards: CADPS2 Gene | ||||||||||||
| |||||||||||||
| RNA expression pattern | |||||||||||||
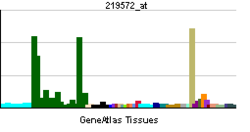 | |||||||||||||
| More reference expression data | |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 93664 | 320405 | |||||||||||
| Ensembl | ENSG00000081803 | ENSMUSG00000017978 | |||||||||||
| UniProt | Q86UW7 | Q8BYR5 | |||||||||||
| RefSeq (mRNA) | NM_001009571.3 | NM_001252105.1 | |||||||||||
| RefSeq (protein) | NP_001009571.2 | NP_001239034.1 | |||||||||||
| Location (UCSC) |
Chr 7: 121.96 – 122.53 Mb |
Chr 6: 23.21 – 23.79 Mb | |||||||||||
| PubMed search | [3] | [4] | |||||||||||
(概要を御願い致します)
ファミリー
脊椎動物においてはCAPS1、CAPS2の2つのファミリーメンバーが存在する(Official gene symbolはそれぞれCadps, Cadps2)が、線虫やショウジョウバエにおいてはパラログは存在せず、一遺伝子のみである。
研究の歴史
1992年、145kDのタンパク質がCa2+依存的な有芯小胞(DCV)の分泌に重要であることが報告された[1]。後にCAPS1 cDNAcDNAがクローニングクローニングされ、線虫UNC-31の脊椎動物ホモログであることが明らかになった[2]。さらにCAPS1のPHドメインはホスファチジルセリン、ホスファチジルイノシトール4,5-二リン酸を介して 細胞膜に結合すること、C末の135アミノ酸が有芯小胞に結合することなどが分かってきた[3]。2004年には、CAPS1の働きとして、有芯小胞のプライミングステップに関与すると報告された[4]。これがCAPS1の働きとしての最初の主張である。しかし、後のCAPS1 KOマウスを用いた報告では、CAPS1がプライミングステップに重要であるという結論を否定し、有芯小胞へのカテコールアミンのローディングステップに働いているという主張がされた[5]。その後、同グループはCAPS1とCAPS2はシナプス小胞のプライミングステップに関与すると大幅に主張を変えている[6]。また、CAPS1はゴルジ膜における有芯小胞の生合成に関与するという報告もあり[7]、CAPSタンパク質の働きとしては、有芯小胞の分泌に関与することは明らかなものの、どのステップに関与しているのかについては未だ統一的な見解がない。
構造
CAPS1、CAPS2ともに、C2ドメイン、PHドメインを有し、C末の135アミノ酸で有芯小胞に結合する。C末側はシナプス小胞のプライミングステップに関与するタンパク質であるMunc13と低い相同性がある(図1)。
分布
脳組織においてCAPS1は幅広く発現するが、CAPS2は特異的な細胞のみで発現する。CAPS2発現細胞としては、大脳介在ニューロン(一部)、海馬の顆粒細胞・CA1錐体細胞・介在ニューロン(一部)、小脳の顆粒細胞、中脳のドーパミン産生細胞、海馬台、手綱核で強い発現が見られる。CAPS1に関しては殆どの神経細胞で発現が見られる。
脳以外では、副腎髄質、 ランゲルハンス島などでCAPS1の強い発現が見られ、 甲状腺の C細胞、 胃主細胞、 気管支上皮などでCAPS2の強い発現が見られる。
疾患との関係
CAPS2遺伝子はヒト7番染色体長腕部にある自閉症責任領域(AUTS1)に位置している。自閉症は、三歳までに発病する精神疾患として知られ、「対人関係における障害」、「言語などによるコミュニケーションの障害」、「興味の限局、反復的で常同的な行動」を特徴とした疾患である。人口千人当たり一人以上の割合で発症する非常に発症率の高い病気であるが、その発症メカニズムは明らかになっていない。 一卵性双生児の一致率が70~90%であることから、遺伝子の異常が関与すると考えられている。
CAPS2 KOマウスは、社会性行動の異常、母性行動の異常、多動、新奇環境への適応力の低下、小脳VI, VII葉の低形成、プルキンエ細胞の減少といった自閉症様の形質を示すことが明らかになった。また、ヒト自閉症患者の血中におけるCAPS2の発現を解析したところ、自閉症患者特異的にCAPS2のexon3のスキップが亢進していることが分かった。このexon 3-skipped CAPS2は、軸索輸送タンパク質であるp150Gluedに結合できず、プレシナプス部に輸送されないことなどが明らかになった。これらの結果から、自閉症患者の脳内では、exon 3-skipped CAPS2の発現によってBDNFの局所的分泌が異常になり、これが神経ネットワークの形成異常につながる可能性が示唆された(図2)[8][9]。
参照文献
- ↑
Walent, J.H., Porter, B.W., & Martin, T.F. (1992).
A novel 145 kd brain cytosolic protein reconstitutes Ca(2+)-regulated secretion in permeable neuroendocrine cells. Cell, 70(5), 765-75. [PubMed:1516133] [WorldCat] [DOI] - ↑
Ann, K., Kowalchyk, J.A., Loyet, K.M., & Martin, T.F. (1997).
Novel Ca2+-binding protein (CAPS) related to UNC-31 required for Ca2+-activated exocytosis. The Journal of biological chemistry, 272(32), 19637-40. [PubMed:9289490] [WorldCat] [DOI] - ↑
Grishanin, R.N., Klenchin, V.A., Loyet, K.M., Kowalchyk, J.A., Ann, K., & Martin, T.F. (2002).
Membrane association domains in Ca2+-dependent activator protein for secretion mediate plasma membrane and dense-core vesicle binding required for Ca2+-dependent exocytosis. The Journal of biological chemistry, 277(24), 22025-34. [PubMed:11927595] [WorldCat] [DOI] - ↑
Grishanin, R.N., Kowalchyk, J.A., Klenchin, V.A., Ann, K., Earles, C.A., Chapman, E.R., ..., & Martin, T.F. (2004).
CAPS acts at a prefusion step in dense-core vesicle exocytosis as a PIP2 binding protein. Neuron, 43(4), 551-62. [PubMed:15312653] [WorldCat] [DOI] - ↑
Speidel, D., Bruederle, C.E., Enk, C., Voets, T., Varoqueaux, F., Reim, K., ..., & Rettig, J. (2005).
CAPS1 regulates catecholamine loading of large dense-core vesicles. Neuron, 46(1), 75-88. [PubMed:15820695] [WorldCat] [DOI] - ↑
Jockusch, W.J., Speidel, D., Sigler, A., Sørensen, J.B., Varoqueaux, F., Rhee, J.S., & Brose, N. (2007).
CAPS-1 and CAPS-2 are essential synaptic vesicle priming proteins. Cell, 131(4), 796-808. [PubMed:18022372] [WorldCat] [DOI] - ↑
Sadakata, T., Shinoda, Y., Sekine, Y., Saruta, C., Itakura, M., Takahashi, M., & Furuichi, T. (2010).
Interaction of calcium-dependent activator protein for secretion 1 (CAPS1) with the class II ADP-ribosylation factor small GTPases is required for dense-core vesicle trafficking in the trans-Golgi network. The Journal of biological chemistry, 285(49), 38710-9. [PubMed:20921225] [PMC] [WorldCat] [DOI] - ↑
Sadakata, T., Washida, M., Iwayama, Y., Shoji, S., Sato, Y., Ohkura, T., ..., & Furuichi, T. (2007).
Autistic-like phenotypes in Cadps2-knockout mice and aberrant CADPS2 splicing in autistic patients. The Journal of clinical investigation, 117(4), 931-43. [PubMed:17380209] [PMC] [WorldCat] [DOI] - ↑
Sadakata, T., Kakegawa, W., Mizoguchi, A., Washida, M., Katoh-Semba, R., Shutoh, F., ..., & Furuichi, T. (2007).
Impaired cerebellar development and function in mice lacking CAPS2, a protein involved in neurotrophin release. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(10), 2472-82. [PubMed:17344385] [PMC] [WorldCat] [DOI]
(執筆者:定方哲史 担当編集委員:柚崎通介)