江藤 圭
University of North Carolina at Chapel Hill, Department of Pharmacology
石橋 仁
北里大学医療衛生学部生理学研究室
鍋倉 淳一
自然科学研究機構生理学研究所
DOI:10.14931/bsd.4515 原稿受付日:2012年12月25日 原稿完成日:2014年3月13日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名:glycine
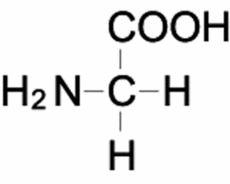
| Glycine[1] | |
|---|---|
| |
| |
Glycine | |
別称 Aminoethanoic acid Aminoacetic acid | |
| Identifiers | |
| 56-40-6 | |
| Abbreviations | Gly, G |
| ATC code | |
| ChEBI | |
| ChEMBL | ChEMBL773 |
| ChemSpider | 730 |
| DrugBank | {{{value}}} |
| EC-number | [1] |
| |
| 727 | |
| Jmol-3D images | Image |
| KEGG | D00011 |
| PubChem | 750 |
| |
| UNII | TE7660XO1C |
| Properties | |
| C2H5NO2 | |
| Molar mass | 75.07 g·mol−1 |
| Appearance | white solid |
| Density | 1.607 g/cm3 |
| Melting point | 233 °C (decomposition) |
| 24.99 g/100 mL (25 °C)[2] | |
| Solubility | soluble in ethanol, pyridine insoluble in ether |
| Acidity (pKa) | 2.34 (carboxyl), 9.6 (amino))[3] |
| 危険性 | |
| 半数致死量 LD50 | 2600 mg/kg (mouse, oral) |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
グリシンとは
グリシンはタンパク質を構成するアミノ酸の中でも最も単純な構造を持っており、不斉炭素を持たないため、D体やL体といった立体異性体が存在しない。
中枢神経系においては、GABAとともに抑制性シナプス伝達を担う。グリシンは、シナプス外に存在するNMDA型グルタミン酸受容体に結合してその機能を調節し[4]、NMDA型グルタミン酸受容体を介した神経細胞死にも関与する[5]。また、グリシンは髄鞘に存在するGluN1とGluN3から成るNMDA型グルタミン酸受容体にも結合する[6]。
グリシンは、主に脊髄や脳幹においてGABAとともに抑制性神経伝達物質として働くが、大脳皮質などの上位中枢では抑制性シナプス伝達はGABAが担っている。
生合成
グリシンは、食事から摂取する他、生体内でもいくつかの経路で合成される。生体内では、
- グリオキシル酸とグルタミン酸からグリシントランスアミナーゼの作用により合成、
- グルタミン酸デカルボキシラーゼ、セリンヒドロキシメチルトランスフェラーゼによって葉酸依存性にセリンから合成
- スレオニン(threonine)の異化
- コリンの代謝
によってグリシンが生成する。
機能
抑制性伝達物質としてグリシンが機能するためには、シナプス前神経終末部のシナプス小胞にグリシンが取り込まれて、神経終末部から放出される必要がある。グリシンを放出する抑制性シナプス前神経終末部には、グリシントランスポーター2型(GlyT2)が発現しており、これによってグリシンが神経終末部内へ取り込まれることにより、グリシン濃度が高まる[7]。神経終末部に取り込まれたグリシンは、小胞型抑制性アミノ酸運搬体によりシナプス小胞内へ充填され、神経終末部から放出される。小胞型抑制性アミノ酸運搬体はグリシンだけでなくGABAも輸送するので、単一神経終末部から GABAとグリシンが共放出(co-release)されることがある[8]。
グリシンはグリシン受容体に作用することで抑制性作用を示す。この作用はストリキニーネで拮抗される。NMDA型グルタミン酸受容体のグリシン結合部位はストリキニーネ感受性がない。グリシン受容体はGABAA受容体と同様Clイオンを通すイオンチャネル型受容体で、αサブユニットとβサブユニットから成る五量体である。グリシン受容体はGABAA受容体と同様にゲフィリンという足場タンパク質によりシナプス部位に維持される[9]。
関連項目
参考文献
- ↑ The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (11th ed.), Merck, 1989, ISBN 091191028X, 4386.
- ↑ http://prowl.rockefeller.edu/aainfo/solub.htm
- ↑ Dawson, R.M.C., et al.
Data for Biochemical Research
Oxford, Clarendon Press, 1959. - ↑
Dingledine, R., Borges, K., Bowie, D., & Traynelis, S.F. (1999).
The glutamate receptor ion channels. Pharmacological reviews, 51(1), 7-61. [PubMed:10049997] [WorldCat] - ↑
Katsuki, H., Watanabe, Y., Fujimoto, S., Kume, T., & Akaike, A. (2007).
Contribution of endogenous glycine and d-serine to excitotoxic and ischemic cell death in rat cerebrocortical slice cultures. Life sciences, 81(9), 740-9. [PubMed:17698151] [WorldCat] [DOI] - ↑
Piña-Crespo, J.C., Talantova, M., Micu, I., States, B., Chen, H.S., Tu, S., ..., & Lipton, S.A. (2010).
Excitatory glycine responses of CNS myelin mediated by NR1/NR3 "NMDA" receptor subunits. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(34), 11501-5. [PubMed:20739572] [PMC] [WorldCat] [DOI] - ↑
Gomeza, J., Hülsmann, S., Ohno, K., Eulenburg, V., Szöke, K., Richter, D., & Betz, H. (2003).
Inactivation of the glycine transporter 1 gene discloses vital role of glial glycine uptake in glycinergic inhibition. Neuron, 40(4), 785-96. [PubMed:14622582] [WorldCat] [DOI] - ↑
Wojcik, S.M., Katsurabayashi, S., Guillemin, I., Friauf, E., Rosenmund, C., Brose, N., & Rhee, J.S. (2006).
A shared vesicular carrier allows synaptic corelease of GABA and glycine. Neuron, 50(4), 575-87. [PubMed:16701208] [WorldCat] [DOI] - ↑
Tyagarajan, S.K., & Fritschy, J.M. (2014).
Gephyrin: a master regulator of neuronal function? Nature reviews. Neuroscience, 15(3), 141-56. [PubMed:24552784] [WorldCat] [DOI]