中心体
英:centrosome
重要な関連語:中心小体、中心子、微小管形成中心、一次繊毛、基底小体
動物細胞に存在する細胞内小器官の一つであり、主要な微小管形成中心(microtubule organizing center: MTOC)として機能する。細胞分裂の際に紡錘体極に存在し紡錘体の形成に関与する他、神経細胞を含む多くの細胞において細胞極性の形成・維持に関与すると考えられている。また、ある種の細胞においては基底小体(basal body)として一次繊毛(primary cilia)の基部に存在しその形成に重要な役割を担う。
構造
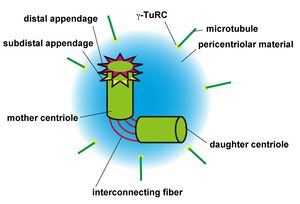
mother centriole:母中心子、daugher centriole:娘中心子、pericentriolar material:中心小体周辺物質、γ-TuRC: γ-tubulin ring complex、microtubule:微小管
中心体は、シリンダー状の構造をした一対の中心小体(または中心子;centriole)および多数の蛋白質が集まった不定形の中心小体周辺物質(pericentriolar material: PCM)によって構成される。微小管はPCMに存在するγ-tubulin ring complex (γ-TuRC)から伸長する。細胞分裂の際には中心小体が分離し各々から新しい中心小体が複製され二つの中心体が形成される。新たに形成された二つの中心体は紡錘体の両端にそれぞれ局在し細胞分裂によって娘細胞に一つずつ分配される。中心体内に存在する一対の中心小体は同質ではなく、”より古い”方の中心小体(mother centriole)はdistal appendageやsubdistal appendageと呼ばれる構造を持つ。distal appendageは一次繊毛形成時に中心体を形質膜へと移動させるのに必要であると考えられている。subdistal appendageにはNineinなどの蛋白質が局在しており微小管を中心小体に繋ぎ留めている[1]。このような中心小体の非対称性は神経幹細胞の非対称分裂機構に寄与している可能性が示唆されている。
神経発生における役割
神経幹細胞の非対称分裂
大脳皮質の神経幹細胞は発生初期においては対称分裂により自らと同じ性質をもつ娘細胞を二つ産生し神経幹細胞の数を増大させる。その後、神経幹細胞は非対称分裂により一つの神経細胞と一つの神経幹細胞を産生し、神経幹細胞の数を維持しながら神経細胞を産生していく。中心体は細胞分裂に関与するのに加えて非対称分裂の制御にも重要であると考えられている。Cdk5rap2などの中心体関連蛋白質を欠失させると神経幹細胞が維持できなくなり、大脳皮質の神経細胞数が著しく減少する(小頭症)。また、非対称分裂の際には”より古い”方の中心小体が神経幹細胞側の娘細胞に継承され、subdistal appendageに局在するNineinが神経幹細胞の維持に必要であることが報告されている[2]。
神経細胞移動
移動中の神経細胞はまず先導突起と呼ばれる神経突起を移動方向へと伸長させ、その内部に細胞核およびその他の細胞内小器官を移入させる。この際、中心体は細胞核の前方(先導突起側)に局在することが知られている。また、タイムラプス解析から中心体が細胞核に先行して先導突起内に移動する様子が報告されたこと、細胞核が微小管の籠状構造(microtubule cage)に囲まれていることから、中心体がそこから伸長する微小管によって先導突起と細胞核を連結し細胞核を牽引するというモデルが提唱された[3]。実際、多くの中心体および微小管関連蛋白質が神経細胞移動に関与することが報告されている。その一方で、神経細胞移動において細胞核が中心体を一時的に追い抜く事例や移動中の神経細胞内では細胞核周辺の微小管が必ずしも中心体に収束していないといった上記のモデルとは矛盾する結果も報告されており[4]、神経細胞移動における中心体の正確な役割についてはいまだ結論が出ていない。また中心体自体の移動についても微小管モータータンパク質であるダイニンに依存するという報告[5]とアクチンモーターであるミオシンに依存するという報告[6]があるがその詳細についてもいまだ不明である。
軸索形成
分散培養下の海馬ニューロンはまず複数の未分化な神経突起を形成する。その後、そのうちの1本が急速に伸長を開始し軸索へと分化する。その際、中心体は軸索へと分化する神経突起の根元に局在することが報告されており、中心体が神経細胞における軸索決定を担う因子であることが示唆されている。同様の結果は組織培養下の大脳皮質ニューロンにおいても得られている。中心体は主要な微小管重合開始点であるのに加えてゴルジ体が中心体近傍に局在することも知られていることから、中心体の局在により特定の神経突起に選択的に微小管や膜成分を供給している可能性が考えられる。しかしその一方で、他のニューロンにおいては軸索決定と中心体の位置に相関は見られないという報告もあり、軸索決定における中心体の局在は特定の神経細胞において必要なのか、もしくは神経細胞の極性形成に付随して起こる結果にすぎないのかという問題に関してはさらなる検証が必要とされる。また、決定した後の軸索の伸長には中心体が必要ないことも報告されている。軸索決定後の神経細胞においてレーザー照射により中心体を破壊しても軸索の伸長および再生には影響を与えない。分化した神経細胞では中心体の微小管重合能は低下しており、主な微小管重合は軸索および樹状突起内に広く分布した非中心体性のγ-tubulinによって担われると考えられている[7]。
一次繊毛の形成
神経幹細胞を含む多くの細胞は一次繊毛と呼ばれる微小管束によって膜が突出したアンテナ状構造を持つ。一次繊毛はhedgehogシグナルなどの細胞外シグナル分子に対するセンサーとして働く。間期の細胞において中心体は基底小体となって一次繊毛の基部に存在しその形成に関与する。一次繊毛の欠失は脳の発生過程においてhedgehogシグナル依存的な細胞増殖の不全を始めとして様々な障害を引き起こすと考えられている[8]。
中心体関連遺伝子と神経疾患
これまで脳の形成不全を伴う神経疾患の原因遺伝子として多くの中心体関連分子が同定されている。小頭症ではその原因遺伝子として7つの中心体関連遺伝子(MCPH1~7)が同定されている。小頭症では大脳皮質の神経細胞数が著しく減少していることから、細胞分裂または対称・非対称分裂の制御に異常があることが示唆される。ただし、中心体関連蛋白質の多くはDNA損傷応答にも関与しており、DNA損傷に伴う細胞死が関与している可能性もある。一方、小頭症では皮質の層構造には異常が見られないことから神経細胞移動の関与は少ないと考えられる。Ⅰ型滑脳症では神経細胞移動の障害に起因する皮質の層構造異常が見られる。Ⅰ型滑脳症の原因遺伝子としてLis1、Doublecortinなどが同定されているがこれらの分子もまた中心体や微小管に局在することが報告されている。また、一次繊毛の形成および機能に関連する遺伝子の変異はJoubert症候群やBardet – Biedl症候群等のciliopathyと呼ばれる疾患を引き起こすことが知られている。
関連項目
参考文献
- ↑
Brito, D.A., Gouveia, S.M., & Bettencourt-Dias, M. (2012).
Deconstructing the centriole: structure and number control. Current opinion in cell biology, 24(1), 4-13. [PubMed:22321829] [WorldCat] [DOI] - ↑
Megraw, T.L., Sharkey, J.T., & Nowakowski, R.S. (2011).
Cdk5rap2 exposes the centrosomal root of microcephaly syndromes. Trends in cell biology, 21(8), 470-80. [PubMed:21632253] [PMC] [WorldCat] [DOI] - ↑
Tanaka, T., Serneo, F.F., Higgins, C., Gambello, M.J., Wynshaw-Boris, A., & Gleeson, J.G. (2004).
Lis1 and doublecortin function with dynein to mediate coupling of the nucleus to the centrosome in neuronal migration. The Journal of cell biology, 165(5), 709-21. [PubMed:15173193] [PMC] [WorldCat] [DOI] - ↑
Umeshima, H., Hirano, T., & Kengaku, M. (2007).
Microtubule-based nuclear movement occurs independently of centrosome positioning in migrating neurons. Proceedings of the National Academy of Sciences of the United States of America, 104(41), 16182-7. [PubMed:17913873] [PMC] [WorldCat] [DOI] - ↑
Tsai, J.W., Bremner, K.H., & Vallee, R.B. (2007).
Dual subcellular roles for LIS1 and dynein in radial neuronal migration in live brain tissue. Nature neuroscience, 10(8), 970-9. [PubMed:17618279] [WorldCat] [DOI] - ↑
Solecki, D.J., Trivedi, N., Govek, E.E., Kerekes, R.A., Gleason, S.S., & Hatten, M.E. (2009).
Myosin II motors and F-actin dynamics drive the coordinated movement of the centrosome and soma during CNS glial-guided neuronal migration. Neuron, 63(1), 63-80. [PubMed:19607793] [PMC] [WorldCat] [DOI] - ↑
Kuijpers, M., & Hoogenraad, C.C. (2011).
Centrosomes, microtubules and neuronal development. Molecular and cellular neurosciences, 48(4), 349-58. [PubMed:21722732] [WorldCat] [DOI] - ↑
Lee, J.E., & Gleeson, J.G. (2011).
Cilia in the nervous system: linking cilia function and neurodevelopmental disorders. Current opinion in neurology, 24(2), 98-105. [PubMed:21386674] [PMC] [WorldCat] [DOI]
(執筆者:梅嶋 宏樹 担当編集委員:村上 冨士夫)