「シナプスタグ仮説」の版間の差分
Daisukeokada (トーク | 投稿記録) 細編集の要約なし |
細 (→発展) |
||
| (3人の利用者による、間の53版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/okadada 岡田 大助]</font><br> | |||
''北里大学 医学部 生化学''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年6月6日 原稿完成日:2018年10月14日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](京都大学大学院医学研究科システム神経薬理分野)<br> | |||
</div> | |||
英語名:synaptic tagging hypothesis, synaptic tag hypothesis | |||
{{box|text= 神経回路が経験を反映して形成される際にシナプス可塑性が重要であるが、このような神経回路を長期間にわたって持続するには、経験時にシナプスに起きた一過的な可塑的変化を、新規遺伝子発現で合成されるシナプスタンパク質の機能により持続的なものに変えることが必要である。このとき、細胞体で新規に合成されたシナプスタンパク質が、一過的な可塑性の起きたシナプスでだけ機能すれば、経験時に獲得した神経回路活動が持続できると思われる。この仕組みとして提唱されたシナプスタグ仮説では、細胞体で合成された新規シナプスタンパク質は樹状突起を目的地を決めずに輸送され、一過的可塑性に付随してシナプスタグが活性化したシナプスでのみ機能するとされた。細胞体で神経活動依存的に合成されるHomer1aタンパク質が樹状突起を非特異的に輸送された後、NMDA型グルタミン酸受容体が活性化されたシナプス特異的に蓄積することが明らかとなり、シナプスタグの存在が確認された。Homer1aのスパイン輸送に関わるシグナル伝達系は解明されているが、可塑性を持続的なものにするスイッチという意味でのシナプスタグの分子実体は未解明である。}} | |||
==提唱== | |||
[[海馬]][[CA1野]][[錐体細胞]]と[[Schaffer側枝]]([[CA3]]錐体細胞の軸索分枝)の間の[[シナプス伝達]]は、Schaffer側枝が走行するCA1野[[分子層]]を高頻度(100Hz、1秒など)で刺激すると長期にわたり増強する。これを[[長期増強]] (long-term potentiation, LTP)と呼び、[[記憶学習]]に関わる細胞レベルでの現象と考えられ、多くの研究がなされている。 | |||
上述のような刺激条件では、LTP誘導後、[[脳スライス標本|急性切片]]では1-2時間程度以内に反応は減弱し、EPSPの大きさは誘導前のレベルに戻る。しかし、条件を選ぶ事により(たとえば複数回刺激にする、[[ドーパミン]]のアゴニストを加えるなど)、長期のLTPを誘導する事が出来る。この両者の差は一過性の[[初期長期増強]] (early LTP, E-LTP) は既存シナプスタンパク質の[[翻訳後修飾]]によって起き、新規タンパク質合成を必要としないのに対し、急性切片でも4時間以上保たれる持続性の[[後期長期増強]] (late LTP, L-LTP)は新しいタンパク質の合成を必要とする。 | |||
新規に合成されたタンパク質はシナプス部で機能し、その結果後期長期増強が発現すると考えられる。一つのニューロンには多数のシナプスが存在するので、新規合成されたタンパク質が長期増強刺激を起こしたシナプスでのみ機能するためには、入力を受けたシナプス特異的に新規タンパク質が機能する仕組みが必要である。Freyと[[w:Richard G. Morris|Morris]]はこの仕組みとして主に次の三つの可能性を検討した<ref name=ref1><pubmed>9020359</pubmed></ref> <ref name=ref2><pubmed>9610879</pubmed></ref>。 | |||
[[ | #'''局所合成''' すでに[[樹状突起]]に局在する[[mRNA]]がシナプス活動依存的に翻訳される。 | ||
#'''メイル仮説''' [[細胞体]]で合成されたタンパク質には予め目的地がコードされている、もしくは目的地特異的な輸送ルートで活動シナプスに運ばれる。 | |||
#'''シナプスタグ仮説''' 細胞体で新規合成された後期可塑性関連タンパク質が機能できるシナプスでは、何らかの生化学的活性が活性化しており、この活性によって後期長期増強の発現が可能になる。この仮想活性をシナプスタグと呼ぶ。 | |||
彼らは、次のような実験から、これらの可能性の中でもシナプスタグ仮説が結果をうまく説明すると提唱した。[[wj:ラット|ラット]]海馬急性切片でCA1野Schaffer側枝を二箇所刺激し、独立した二経路の[[集合シナプス電位]]を一つの記録電極から測定した('''図1''')。 一方の刺激電極S1に長く持続する[[後期長期増強]]を起こす電気刺激を与えた後、他方の刺激電極S2からは、普通であれば持続の短い初期長期増強のみを起こす刺激を与えた。S1経路では予想通り入力特異的な後期長期増強が見られた。一方S2経路には、初期長期増強のみ起きる刺激を加えたのにもかかわらず後期長期増強が見られた('''図2''')。S2の変化は[[連合性後期長期増強]]と呼ばれる。 | |||
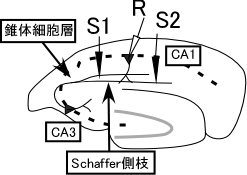
[[Image: | [[Image:図1二経路実験.jpg|thumb|500px|'''図1 二経路実験の配置'''<br>海馬急性切片に刺激電極S1、S2と記録電極Rを置く。]] | ||
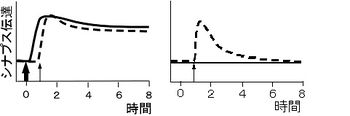
[[Image:図2連合性後期可塑性.jpg|thumb|right|350px|'''図2 連合性後期可塑性'''<br>'''左''' S1に持続的可塑性を起こす刺激(太矢印)、S2に一過性可塑性を起こす刺激(細矢印)を与えた時の集合シナプス後電位の時間変化で、両経路で持続的なLTPが起きている(S1が実線、S2が破線)。<br>'''右''' S2だけを刺激した時の様子で、一過性のLTPがおきている。]] | |||
二経路実験で、S1に後期長期増強を起こす刺激を与えた後、タンパク質合成を阻害した状態でS2に初期長期増強を起こす刺激を与えた場合も、両経路に後期長期増強が見られた('''図3''')。つまり、S2シナプス近傍の局所合成は不要であること、及び、S1刺激で合成されたタンパク質がS2シナプスに運ばれたことを示している。細胞体で合成されたタンパク質は全てのシナプスに使用のチャンスがある状態で輸送されることになるので、メイル仮説は否定される。 | |||
< | 一方、シナプスタグ仮説によれば、細胞体で合成されたシナプスタンパク質は輸送途上では目的地を持たず全ての[[樹状突起]]を輸送されており、シナプスタグが活性化したシナプスだけで機能する。この実験結果は、S1とS2の両シナプスではシナプスタグが活性化しているので新規合成タンパク質が機能し後期可塑性が発現したと説明できる。FreyとMorrisらは更にS1とS2の順番を入れ替える実験を行い、S2の弱い刺激の後でタンパク合成を起こしても連合性後期長期増強が起きることも見出した<ref name=ref4><pubmed>9704995</pubmed></ref>。 | ||
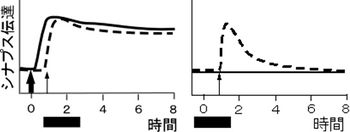
[[Image:図3シナプスタグ仮説.jpg|thumb|right|350px|'''図3 連合可塑性のタンパク質合成依存性'''<br>'''左''' 四角の時点でタンパク質合成阻害剤を与えてもS1、S2経路ともに後期可塑性がおきことを示す。この結果はシナプスタグ仮説を支持する。<br>'''右''' S2に一過性可塑性を起こす刺激をタンパク質合成阻害下で与えても一過性可塑性が起き、持続性の可塑性は起きないことを示す。]] | |||
以上から、後期可塑性の入力特異性機構としてシナプスタグ仮説が有力視され、様々な実験結果から、シナプスタグは以下の性質を持つと思われた<ref name=ref2><pubmed>9610879</pubmed></ref>。 | |||
#シナプスタグは初期可塑性が起きたシナプスで[[NMDA型グルタミン酸受容体]]依存的かつ入力特異的に活性化される。 | |||
#細胞体で新規合成されたタンパク質は目的地を持たずに樹状突起を輸送され、シナプスタグの活性化されたシナプスでのみ機能できる。 | |||
#シナプスタグの活性化にはタンパク質合成は不要である。 | |||
#シナプスタグは一度活性化されるとしばらく活性を保つ。 | |||
==実証== | |||
樹状突起を輸送されるシナプスタンパク質はまず[[スパイン]]内に輸送されないとシナプス部で機能できないが、樹状突起とスパインの間には輸送障壁があると考えられている<ref><pubmed>16272125</pubmed></ref>。岡田らは、持続的な長期増強に必要で細胞体で合成されるシナプスタンパク質の、この障壁を超えた輸送がシナプス活動で調節されれば、シナプスタグの性質に合致するのではないかと考え、ラット海馬[[初代培養|培養神経細胞]]において仮説が示唆するようにシナプス部に取り込まれるタンパク質があるかどうか調べた<ref name=ref3><pubmed>19443779</pubmed></ref>。 | |||
[[ | [[Homer1a]]([[Vesl-1S]])は後期長期増強時に細胞体で発現誘導されるタンパク質で、シナプスのlong-form Homer ([[Homer1b]]ならびに[[Homer1c|1c]]) と[[Shank]]タンパク質が作るネットワークを壊すことでシナプス可塑性を起こすきっかけを作るとされる[[最初期遺伝子産物]]である<ref name=ref5><pubmed>18006237</pubmed></ref><ref name=ref12867517><pubmed>12867517</pubmed></ref><ref name=ref19345194 ><pubmed> 19345194 </pubmed></ref>。[[細胞体]]で合成されたHomer1a タンパク質は全ての樹状突起を輸送された。ところが、運ばれたHomer1aはNMDA型グルタミン酸受容体刺激があったシナプスにだけ集積し、それ以外のシナプスには集積しないことが観察された。Homer1aタンパク質の樹状突起からスパイン内への移動がシナプス入力により制御されており、この移動制御の仕組みはシナプスタグの上記性質を全て満たすことが確認されたので、シナプスタグという仕組みが存在する事が実証された。 | ||
== 分子実体== | |||
二経路実験は、[[PKM zeta|タンパク質キナーゼMζ]] (protein kinase Mζ, PKMζ)<ref name=ref6><pubmed>15958741</pubmed></ref>、[[cAMP依存性タンパク質キナーゼ]] ([[cAMP-dependent protein kinase]], [[A-kinase]], [[PKA]])、[[MEK1/2]]、[[カルシウム/カルモジュリン依存性タンパク質キナーゼII]] ([[calcium/calmodulin dependent protein kinase|calcium/calmodulin dependent protein kinase]], [[CaMKⅡ]])<ref name=ref7><pubmed>17494693</pubmed></ref>、[[ニューロプシン]]<ref name=ref8><pubmed>18216192</pubmed></ref> などが連合性可塑性に必要であることを明らかにした。 これらの論文の著者らはこれがシナプスタグに関与すると推察しているが、解釈には注意を要する。 | |||
一般に後期可塑性には、先行する初期可塑性、新規タンパク質合成と輸送、シナプス部での新規タンパク質の機能発現といった複数の内部過程が必要と考えられており、シナプスタグはこれらの内部過程の一つ、あるいは内部過程を調節するシナプス活動、であると考えられる。二経路実験ではこれら複数の過程を経た最終結果である連合性可塑性の有無を測定するので、ある分子が連合性後期可塑性に必要だとしても、それがシナプスタグの仕組みに関与するかどうかを二経路実験から決定することは原理的にはできず、これらの内部過程の多くがNMDA型グルタミン酸受容体活動をきっかけに始まると考えられる状況で、一定の実験操作が内部過程の特定のものだけに影響するという仮定が必要になる。 | |||
岡田らのシナプスタグの実証実験<ref name=ref3/>では、上記内部過程のうち輸送の一部がシナプス活動依存的であることをシナプスタグと捉えている。細胞体で合成され樹状突起を非特異的に輸送されるタンパク質は、シナプス部での機能に先立ってシナプスに取り込まれる (capture)。この二つの過程を分けてsynaptic tagging and capture という語が用いられることがある。岡田らの結果<ref name=ref3/>は、capture が入力特異的に起きる可能性を示唆するので、captureがtaggingの機能を持つとも言える。 | |||
この考えを進めれば、輸送されるタンパク質毎や輸送過程の種類に応じて各々のシナプスタグがあると考えることもできるし、全ての輸送過程に共通するものがあってこれの調節をシナプスタグとする考えもあるだろう。輸送調節以外のシナプスタグも考えられる。Captureされたタンパク質が機能して可塑性を起こすために、シナプス部、特に[[シナプス後膜肥厚]] (postsynaptic density, PSD) の分子集合体の修飾が必要ならば、この修飾もシナプスタグである。 | |||
FreyとMorrisの初期の実験で考えられた[[sensitization仮説]]はこの方向の考え方であった<ref name=ref5/>。このように、シナプスタグの定義は一義的ではない。100を超える遺伝子が後期可塑性に伴って新規に発現誘導される<ref name=Matsuo2000><pubmed>10820183</pubmed></ref>。これらのタンパク質の一つがシナプス部で機能すればシナプス可塑性は持続性を獲得する(運命が決まる、実際に獲得する、獲得して持続するなど全てを含む)というものがあるのかもしれない。一方で、これらのタンパク質は異なる機能カテゴリーに属し、発現時期も異なることから<ref><pubmed>22802965 </pubmed></ref>、シナプス伝達効率を調節するいくつかの異なる表現形それぞれが決定的に持続型に移行するためのシナプスタグがある可能性がある<ref>'''D Okada, K Inokuchi'''<br>"Activity-Dependent Protein Transport as a Synaptic Tag "in "Synaptic tagging and capture, From synapses to behaviour"<br>'' S Sajikumar ed. Springer, NY, pp79-98'':2015</ref>。 | |||
シナプスタグの実体とされる分子はまだ確定したものはない。Homer1aのシナプスタグの分子的実体としては、岡田らはprotein kinase Gの活性化を示唆しており、そのリン酸化基質の機能が輸送調節に関わる可能性がある<ref name=ref3/>。 | |||
岡本らは[[アクチン]]の重要性を提唱している<ref name=ref15361876 ><pubmed>15361876</pubmed></ref><ref name=ref19996366 ><pubmed> 19996366 </pubmed></ref>。アクチンは[[興奮性シナプス]]での主要な[[細胞骨格]]成分としてスパインの形態形成と維持に関わっている他、その他の多数のタンパク質の結合部位としても機能している<ref name=ref19996366 />。薬理学的にF-アクチンを増加させると、アクチン結合タンパク質がシナプスにて増加する<ref name=ref15361876 />。一方、アクチン重合を阻害すると、後期長期増強が起こらなくなる<ref name=ref19793974 ><pubmed>19793974</pubmed></ref>。LTP誘導に伴い、アクチンが増加する事によりスパインの容積が増大する事で、シナプスの結合容量が増える。これは可塑性が起こったシナプス特異的にNMDA受容体活性化依存的に起こり(上の条件1.)、またタンパク質合成は必要としない(上の条件3.)。一回形成されたアクチンは数十分の単位で安定である(上の条件4.)。従って、アクチンの重合調節はシナプスタグの要件を満たしている。 | |||
[[超解像顕微鏡]]の使用により、シナプス前後の分子構築が詳細に解明されつつある。シナプス前の神経伝達物質放出機構と、シナプス後部の受容体を中心としたクラスターは向かい合っているという観察はシナプス伝達効率を高める上で重要な配置であり、興味深い<ref><pubmed>27462810</pubmed></ref>。シナプスタグはこの配置を調節するものだとすれば、細胞接着因子や各クラスターの構成因子などが重要な候補となる。例えば[[Eph]]-[[エフリン|Ephlin]]はシナプス前後の結合に関わりLTPに必要で、前述の[[ニューロプシン]]により切断されるなど、重要な因子であると考えられる<ref><pubmed> 21508957</pubmed></ref>。 | |||
==発展== | |||
[[シナプス前]]線維が運ぶ情報はシナプス後細胞が興奮すれば次の細胞に伝えられる。この興奮しやすさの制御がシナプス可塑性の機能である。細胞が受ける複数の入力の統合によりその細胞が発火するかどうかが決まるので、シナプス可塑性により増強されたシナプスは発火に貢献する確率が高くなり、そのシナプスが運んでいる情報が次に伝えられやすくなる。この連鎖により、ある入力で一定の神経回路が作動するようになる。シナプス可塑性を起こすシナプスを決めるということは、シナプスを選ぶことにより伝える情報を選ぶということである。シナプス可塑性は記憶などの脳高次機能を担う神経回路網の経験依存的形成に関わる重要な細胞レベルの仕組みとして研究が盛んである。シナプスタグは後期シナプス可塑性の仕組みの一部として、何を覚えるかなど情報の選別に関わる仕組みと考えられる。このため、より高次レベルの研究においても、シナプスの目印機能という意味でタグという言葉が以下のように使われることがある。また、シナプス伝達の長期抑圧についても同様の仕組みがあるとされている<ref name=ref7/>。 | |||
=== 局所合成 === | |||
local synthesis | |||
== | 後期シナプス可塑性に必要な新規タンパク質の一部は、樹状突起やスパインに局在するmRNAを用いて合成される。ラット海馬で二経路実験を用いた測定では連合性可塑性に局所合成は必要ではないが<ref name=ref1><pubmed>9020359</pubmed></ref>、条件によってはPKMζなどの局所合成に依存している<ref name=ref10><pubmed>15728837</pubmed></ref>。 | ||
局所合成は[[wj:アメフラシ|アメフラシ]]では後期可塑性の主要なメカニズムと考えられシナプスタグに相当する仕組みも報告されている<ref name=ref11><pubmed>19443737</pubmed></ref>。 | |||
後期可塑性で発現誘導されるタンパク質は多岐に亘る。タンパク質合成と機能の部位が近い局所合成と違って、細胞体での新規合成はシナプス入力による[[転写]]開始シグナルが[[wj:細胞核|細胞核]]に伝わり、mRNAの転写、翻訳の後、合成されたタンパク質をシナプス近傍まで輸送する必要がるため、シナプス入力から時間がかかる。これら二つの機構を併用することで、異なる種類のタンパク質が異なるタイミングで後期可塑性に貢献できると思われる。 | |||
シナプス可塑性の入力特異性は厳密ではなく、周囲のシナプスが影響を受けることが報告されている<ref name=ref12><pubmed>9230437</pubmed></ref>。局所合成されシグナル伝達を担う分子が一定のコンパートメント内のシナプスに影響を与えると、コンパートメント単位での可塑性[[clustered plasticity]]が起きる可能性があり、実験的にも確認されている<ref name=ref13><pubmed>16791146 </pubmed></ref> <ref name=ref14><pubmed>21220104</pubmed></ref>。 | |||
=== 逆シナプスタグ === | |||
inverse tag | |||
後期可塑性を起こす強いシナプス入力があった細胞内で、活動の低かったシナプスには特異的に[[後期長期抑圧]]がおきる。これには[[Arc]]/[[Arg3.1]]タンパク質が関与しており、[[カルシウム]]活動が低く[[カルモジュリン]]が活性化していないシナプスではカルシウムカルモジュリン依存性キナーゼⅡβがArc/Arg3.1タンパク質を結合し蓄積することが可塑的変化を起こす「逆シナプスタグ」として働き、その結果[[GluR1]]受容体の表面発現が減少する[[長期抑圧]]が起きることが報告されている <ref name=ref15><pubmed>22579289</pubmed></ref>。 | |||
===行動タグ === | |||
behavioral tag | |||
二つの海馬依存的行動タスクを、一つは[[短期記憶]]を作るような条件で、他方は[[長期記憶]]を作るような条件を用いて、同時にトレーニングすると、両タスクで長期記憶が形成された<ref name=ref16><pubmed>19706547</pubmed></ref>。二経路実験をそのまま行動実験に移したような実験パラダイムなので、この連合性長期記憶を起こす仕組みは[[行動タグ]]と呼ばれている。二つの記憶をコードする神経回路に共通して活動する細胞があり二つの行動をリンクしていると思われた<ref><pubmed>28126819</pubmed></ref>(27N)。 | |||
=== システム固定化 === | |||
system consolidation | |||
海馬で獲得された記憶の一部は時間が経つと[[想起]]に海馬活動が不要になり、皮質の活動により想起されるようになる。この移行を[[システム固定化]]、[[皮質]]依存になった記憶を[[遠隔記憶]]と言う。システム固定化の仕組みの詳細はまだ不明だが、初めに海馬が各モダリティ担当の皮質に情報を送り返し、長い時間をかけて遠隔記憶の想起時に活動する神経回路網を皮質に作ると考えられる<ref><pubmed>28386011 </pubmed></ref>。この時、複数の皮質に分散したシステム固定化後の記憶が一つの記憶として想起できるためには、これらが目印によってつながっている必要がある。この目印が「タグ」という言葉で表現されている<ref name=ref17><pubmed>21330548</pubmed></ref>。 | |||
== 関連項目 == | |||
*[[シナプスキャプチャー]] Synaptic capture | |||
*[[後期シナプス可塑性]] late-phase synaptic plasticity | |||
*[[連合性シナプス可塑性]] associative synaptic plasticity | |||
== 参考文献 == | |||
<references /> | |||
2018年11月14日 (水) 14:38時点における最新版
岡田 大助
北里大学 医学部 生化学
DOI:10.14931/bsd.1182 原稿受付日:2012年6月6日 原稿完成日:2018年10月14日
担当編集委員:林 康紀(京都大学大学院医学研究科システム神経薬理分野)
英語名:synaptic tagging hypothesis, synaptic tag hypothesis
神経回路が経験を反映して形成される際にシナプス可塑性が重要であるが、このような神経回路を長期間にわたって持続するには、経験時にシナプスに起きた一過的な可塑的変化を、新規遺伝子発現で合成されるシナプスタンパク質の機能により持続的なものに変えることが必要である。このとき、細胞体で新規に合成されたシナプスタンパク質が、一過的な可塑性の起きたシナプスでだけ機能すれば、経験時に獲得した神経回路活動が持続できると思われる。この仕組みとして提唱されたシナプスタグ仮説では、細胞体で合成された新規シナプスタンパク質は樹状突起を目的地を決めずに輸送され、一過的可塑性に付随してシナプスタグが活性化したシナプスでのみ機能するとされた。細胞体で神経活動依存的に合成されるHomer1aタンパク質が樹状突起を非特異的に輸送された後、NMDA型グルタミン酸受容体が活性化されたシナプス特異的に蓄積することが明らかとなり、シナプスタグの存在が確認された。Homer1aのスパイン輸送に関わるシグナル伝達系は解明されているが、可塑性を持続的なものにするスイッチという意味でのシナプスタグの分子実体は未解明である。
提唱
海馬CA1野錐体細胞とSchaffer側枝(CA3錐体細胞の軸索分枝)の間のシナプス伝達は、Schaffer側枝が走行するCA1野分子層を高頻度(100Hz、1秒など)で刺激すると長期にわたり増強する。これを長期増強 (long-term potentiation, LTP)と呼び、記憶学習に関わる細胞レベルでの現象と考えられ、多くの研究がなされている。
上述のような刺激条件では、LTP誘導後、急性切片では1-2時間程度以内に反応は減弱し、EPSPの大きさは誘導前のレベルに戻る。しかし、条件を選ぶ事により(たとえば複数回刺激にする、ドーパミンのアゴニストを加えるなど)、長期のLTPを誘導する事が出来る。この両者の差は一過性の初期長期増強 (early LTP, E-LTP) は既存シナプスタンパク質の翻訳後修飾によって起き、新規タンパク質合成を必要としないのに対し、急性切片でも4時間以上保たれる持続性の後期長期増強 (late LTP, L-LTP)は新しいタンパク質の合成を必要とする。
新規に合成されたタンパク質はシナプス部で機能し、その結果後期長期増強が発現すると考えられる。一つのニューロンには多数のシナプスが存在するので、新規合成されたタンパク質が長期増強刺激を起こしたシナプスでのみ機能するためには、入力を受けたシナプス特異的に新規タンパク質が機能する仕組みが必要である。FreyとMorrisはこの仕組みとして主に次の三つの可能性を検討した[1] [2]。
- 局所合成 すでに樹状突起に局在するmRNAがシナプス活動依存的に翻訳される。
- メイル仮説 細胞体で合成されたタンパク質には予め目的地がコードされている、もしくは目的地特異的な輸送ルートで活動シナプスに運ばれる。
- シナプスタグ仮説 細胞体で新規合成された後期可塑性関連タンパク質が機能できるシナプスでは、何らかの生化学的活性が活性化しており、この活性によって後期長期増強の発現が可能になる。この仮想活性をシナプスタグと呼ぶ。
彼らは、次のような実験から、これらの可能性の中でもシナプスタグ仮説が結果をうまく説明すると提唱した。ラット海馬急性切片でCA1野Schaffer側枝を二箇所刺激し、独立した二経路の集合シナプス電位を一つの記録電極から測定した(図1)。 一方の刺激電極S1に長く持続する後期長期増強を起こす電気刺激を与えた後、他方の刺激電極S2からは、普通であれば持続の短い初期長期増強のみを起こす刺激を与えた。S1経路では予想通り入力特異的な後期長期増強が見られた。一方S2経路には、初期長期増強のみ起きる刺激を加えたのにもかかわらず後期長期増強が見られた(図2)。S2の変化は連合性後期長期増強と呼ばれる。
二経路実験で、S1に後期長期増強を起こす刺激を与えた後、タンパク質合成を阻害した状態でS2に初期長期増強を起こす刺激を与えた場合も、両経路に後期長期増強が見られた(図3)。つまり、S2シナプス近傍の局所合成は不要であること、及び、S1刺激で合成されたタンパク質がS2シナプスに運ばれたことを示している。細胞体で合成されたタンパク質は全てのシナプスに使用のチャンスがある状態で輸送されることになるので、メイル仮説は否定される。
一方、シナプスタグ仮説によれば、細胞体で合成されたシナプスタンパク質は輸送途上では目的地を持たず全ての樹状突起を輸送されており、シナプスタグが活性化したシナプスだけで機能する。この実験結果は、S1とS2の両シナプスではシナプスタグが活性化しているので新規合成タンパク質が機能し後期可塑性が発現したと説明できる。FreyとMorrisらは更にS1とS2の順番を入れ替える実験を行い、S2の弱い刺激の後でタンパク合成を起こしても連合性後期長期増強が起きることも見出した[3]。
以上から、後期可塑性の入力特異性機構としてシナプスタグ仮説が有力視され、様々な実験結果から、シナプスタグは以下の性質を持つと思われた[2]。
- シナプスタグは初期可塑性が起きたシナプスでNMDA型グルタミン酸受容体依存的かつ入力特異的に活性化される。
- 細胞体で新規合成されたタンパク質は目的地を持たずに樹状突起を輸送され、シナプスタグの活性化されたシナプスでのみ機能できる。
- シナプスタグの活性化にはタンパク質合成は不要である。
- シナプスタグは一度活性化されるとしばらく活性を保つ。
実証
樹状突起を輸送されるシナプスタンパク質はまずスパイン内に輸送されないとシナプス部で機能できないが、樹状突起とスパインの間には輸送障壁があると考えられている[4]。岡田らは、持続的な長期増強に必要で細胞体で合成されるシナプスタンパク質の、この障壁を超えた輸送がシナプス活動で調節されれば、シナプスタグの性質に合致するのではないかと考え、ラット海馬培養神経細胞において仮説が示唆するようにシナプス部に取り込まれるタンパク質があるかどうか調べた[5]。
Homer1a(Vesl-1S)は後期長期増強時に細胞体で発現誘導されるタンパク質で、シナプスのlong-form Homer (Homer1bならびに1c) とShankタンパク質が作るネットワークを壊すことでシナプス可塑性を起こすきっかけを作るとされる最初期遺伝子産物である[6][7][8]。細胞体で合成されたHomer1a タンパク質は全ての樹状突起を輸送された。ところが、運ばれたHomer1aはNMDA型グルタミン酸受容体刺激があったシナプスにだけ集積し、それ以外のシナプスには集積しないことが観察された。Homer1aタンパク質の樹状突起からスパイン内への移動がシナプス入力により制御されており、この移動制御の仕組みはシナプスタグの上記性質を全て満たすことが確認されたので、シナプスタグという仕組みが存在する事が実証された。
分子実体
二経路実験は、タンパク質キナーゼMζ (protein kinase Mζ, PKMζ)[9]、cAMP依存性タンパク質キナーゼ (cAMP-dependent protein kinase, A-kinase, PKA)、MEK1/2、カルシウム/カルモジュリン依存性タンパク質キナーゼII (calcium/calmodulin dependent protein kinase, CaMKⅡ)[10]、ニューロプシン[11] などが連合性可塑性に必要であることを明らかにした。 これらの論文の著者らはこれがシナプスタグに関与すると推察しているが、解釈には注意を要する。
一般に後期可塑性には、先行する初期可塑性、新規タンパク質合成と輸送、シナプス部での新規タンパク質の機能発現といった複数の内部過程が必要と考えられており、シナプスタグはこれらの内部過程の一つ、あるいは内部過程を調節するシナプス活動、であると考えられる。二経路実験ではこれら複数の過程を経た最終結果である連合性可塑性の有無を測定するので、ある分子が連合性後期可塑性に必要だとしても、それがシナプスタグの仕組みに関与するかどうかを二経路実験から決定することは原理的にはできず、これらの内部過程の多くがNMDA型グルタミン酸受容体活動をきっかけに始まると考えられる状況で、一定の実験操作が内部過程の特定のものだけに影響するという仮定が必要になる。
岡田らのシナプスタグの実証実験[5]では、上記内部過程のうち輸送の一部がシナプス活動依存的であることをシナプスタグと捉えている。細胞体で合成され樹状突起を非特異的に輸送されるタンパク質は、シナプス部での機能に先立ってシナプスに取り込まれる (capture)。この二つの過程を分けてsynaptic tagging and capture という語が用いられることがある。岡田らの結果[5]は、capture が入力特異的に起きる可能性を示唆するので、captureがtaggingの機能を持つとも言える。
この考えを進めれば、輸送されるタンパク質毎や輸送過程の種類に応じて各々のシナプスタグがあると考えることもできるし、全ての輸送過程に共通するものがあってこれの調節をシナプスタグとする考えもあるだろう。輸送調節以外のシナプスタグも考えられる。Captureされたタンパク質が機能して可塑性を起こすために、シナプス部、特にシナプス後膜肥厚 (postsynaptic density, PSD) の分子集合体の修飾が必要ならば、この修飾もシナプスタグである。
FreyとMorrisの初期の実験で考えられたsensitization仮説はこの方向の考え方であった[6]。このように、シナプスタグの定義は一義的ではない。100を超える遺伝子が後期可塑性に伴って新規に発現誘導される[12]。これらのタンパク質の一つがシナプス部で機能すればシナプス可塑性は持続性を獲得する(運命が決まる、実際に獲得する、獲得して持続するなど全てを含む)というものがあるのかもしれない。一方で、これらのタンパク質は異なる機能カテゴリーに属し、発現時期も異なることから[13]、シナプス伝達効率を調節するいくつかの異なる表現形それぞれが決定的に持続型に移行するためのシナプスタグがある可能性がある[14]。
シナプスタグの実体とされる分子はまだ確定したものはない。Homer1aのシナプスタグの分子的実体としては、岡田らはprotein kinase Gの活性化を示唆しており、そのリン酸化基質の機能が輸送調節に関わる可能性がある[5]。
岡本らはアクチンの重要性を提唱している[15][16]。アクチンは興奮性シナプスでの主要な細胞骨格成分としてスパインの形態形成と維持に関わっている他、その他の多数のタンパク質の結合部位としても機能している[16]。薬理学的にF-アクチンを増加させると、アクチン結合タンパク質がシナプスにて増加する[15]。一方、アクチン重合を阻害すると、後期長期増強が起こらなくなる[17]。LTP誘導に伴い、アクチンが増加する事によりスパインの容積が増大する事で、シナプスの結合容量が増える。これは可塑性が起こったシナプス特異的にNMDA受容体活性化依存的に起こり(上の条件1.)、またタンパク質合成は必要としない(上の条件3.)。一回形成されたアクチンは数十分の単位で安定である(上の条件4.)。従って、アクチンの重合調節はシナプスタグの要件を満たしている。
超解像顕微鏡の使用により、シナプス前後の分子構築が詳細に解明されつつある。シナプス前の神経伝達物質放出機構と、シナプス後部の受容体を中心としたクラスターは向かい合っているという観察はシナプス伝達効率を高める上で重要な配置であり、興味深い[18]。シナプスタグはこの配置を調節するものだとすれば、細胞接着因子や各クラスターの構成因子などが重要な候補となる。例えばEph-Ephlinはシナプス前後の結合に関わりLTPに必要で、前述のニューロプシンにより切断されるなど、重要な因子であると考えられる[19]。
発展
シナプス前線維が運ぶ情報はシナプス後細胞が興奮すれば次の細胞に伝えられる。この興奮しやすさの制御がシナプス可塑性の機能である。細胞が受ける複数の入力の統合によりその細胞が発火するかどうかが決まるので、シナプス可塑性により増強されたシナプスは発火に貢献する確率が高くなり、そのシナプスが運んでいる情報が次に伝えられやすくなる。この連鎖により、ある入力で一定の神経回路が作動するようになる。シナプス可塑性を起こすシナプスを決めるということは、シナプスを選ぶことにより伝える情報を選ぶということである。シナプス可塑性は記憶などの脳高次機能を担う神経回路網の経験依存的形成に関わる重要な細胞レベルの仕組みとして研究が盛んである。シナプスタグは後期シナプス可塑性の仕組みの一部として、何を覚えるかなど情報の選別に関わる仕組みと考えられる。このため、より高次レベルの研究においても、シナプスの目印機能という意味でタグという言葉が以下のように使われることがある。また、シナプス伝達の長期抑圧についても同様の仕組みがあるとされている[10]。
局所合成
local synthesis
後期シナプス可塑性に必要な新規タンパク質の一部は、樹状突起やスパインに局在するmRNAを用いて合成される。ラット海馬で二経路実験を用いた測定では連合性可塑性に局所合成は必要ではないが[1]、条件によってはPKMζなどの局所合成に依存している[20]。 局所合成はアメフラシでは後期可塑性の主要なメカニズムと考えられシナプスタグに相当する仕組みも報告されている[21]。
後期可塑性で発現誘導されるタンパク質は多岐に亘る。タンパク質合成と機能の部位が近い局所合成と違って、細胞体での新規合成はシナプス入力による転写開始シグナルが細胞核に伝わり、mRNAの転写、翻訳の後、合成されたタンパク質をシナプス近傍まで輸送する必要がるため、シナプス入力から時間がかかる。これら二つの機構を併用することで、異なる種類のタンパク質が異なるタイミングで後期可塑性に貢献できると思われる。
シナプス可塑性の入力特異性は厳密ではなく、周囲のシナプスが影響を受けることが報告されている[22]。局所合成されシグナル伝達を担う分子が一定のコンパートメント内のシナプスに影響を与えると、コンパートメント単位での可塑性clustered plasticityが起きる可能性があり、実験的にも確認されている[23] [24]。
逆シナプスタグ
inverse tag
後期可塑性を起こす強いシナプス入力があった細胞内で、活動の低かったシナプスには特異的に後期長期抑圧がおきる。これにはArc/Arg3.1タンパク質が関与しており、カルシウム活動が低くカルモジュリンが活性化していないシナプスではカルシウムカルモジュリン依存性キナーゼⅡβがArc/Arg3.1タンパク質を結合し蓄積することが可塑的変化を起こす「逆シナプスタグ」として働き、その結果GluR1受容体の表面発現が減少する長期抑圧が起きることが報告されている [25]。
行動タグ
behavioral tag
二つの海馬依存的行動タスクを、一つは短期記憶を作るような条件で、他方は長期記憶を作るような条件を用いて、同時にトレーニングすると、両タスクで長期記憶が形成された[26]。二経路実験をそのまま行動実験に移したような実験パラダイムなので、この連合性長期記憶を起こす仕組みは行動タグと呼ばれている。二つの記憶をコードする神経回路に共通して活動する細胞があり二つの行動をリンクしていると思われた[27](27N)。
システム固定化
system consolidation
海馬で獲得された記憶の一部は時間が経つと想起に海馬活動が不要になり、皮質の活動により想起されるようになる。この移行をシステム固定化、皮質依存になった記憶を遠隔記憶と言う。システム固定化の仕組みの詳細はまだ不明だが、初めに海馬が各モダリティ担当の皮質に情報を送り返し、長い時間をかけて遠隔記憶の想起時に活動する神経回路網を皮質に作ると考えられる[28]。この時、複数の皮質に分散したシステム固定化後の記憶が一つの記憶として想起できるためには、これらが目印によってつながっている必要がある。この目印が「タグ」という言葉で表現されている[29]。
関連項目
- シナプスキャプチャー Synaptic capture
- 後期シナプス可塑性 late-phase synaptic plasticity
- 連合性シナプス可塑性 associative synaptic plasticity
参考文献
- ↑ 1.0 1.1
Frey, U., & Morris, R.G. (1997).
Synaptic tagging and long-term potentiation. Nature, 385(6616), 533-6. [PubMed:9020359] [WorldCat] [DOI] - ↑ 2.0 2.1
Frey, U., & Morris, R.G. (1998).
Synaptic tagging: implications for late maintenance of hippocampal long-term potentiation. Trends in neurosciences, 21(5), 181-8. [PubMed:9610879] [WorldCat] [DOI] - ↑
Frey, U., & Morris, R.G. (1998).
Weak before strong: dissociating synaptic tagging and plasticity-factor accounts of late-LTP. Neuropharmacology, 37(4-5), 545-52. [PubMed:9704995] [WorldCat] [DOI] - ↑
Bloodgood, B.L., & Sabatini, B.L. (2005).
Neuronal activity regulates diffusion across the neck of dendritic spines. Science (New York, N.Y.), 310(5749), 866-9. [PubMed:16272125] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 5.3
Okada, D., Ozawa, F., & Inokuchi, K. (2009).
Input-specific spine entry of soma-derived Vesl-1S protein conforms to synaptic tagging. Science (New York, N.Y.), 324(5929), 904-9. [PubMed:19443779] [WorldCat] [DOI] - ↑ 6.0 6.1
Inoue, Y., Udo, H., Inokuchi, K., & Sugiyama, H. (2007).
Homer1a regulates the activity-induced remodeling of synaptic structures in cultured hippocampal neurons. Neuroscience, 150(4), 841-52. [PubMed:18006237] [WorldCat] [DOI] - ↑
Sala, C., Futai, K., Yamamoto, K., Worley, P.F., Hayashi, Y., & Sheng, M. (2003).
Inhibition of dendritic spine morphogenesis and synaptic transmission by activity-inducible protein Homer1a. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(15), 6327-37. [PubMed:12867517] [PMC] [WorldCat] - ↑
Hayashi, M.K., Tang, C., Verpelli, C., Narayanan, R., Stearns, M.H., Xu, R.M., ..., & Hayashi, Y. (2009).
The postsynaptic density proteins Homer and Shank form a polymeric network structure. Cell, 137(1), 159-71. [PubMed:19345194] [PMC] [WorldCat] [DOI] - ↑
Sajikumar, S., Navakkode, S., Sacktor, T.C., & Frey, J.U. (2005).
Synaptic tagging and cross-tagging: the role of protein kinase Mzeta in maintaining long-term potentiation but not long-term depression. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(24), 5750-6. [PubMed:15958741] [PMC] [WorldCat] [DOI] - ↑ 10.0 10.1
Sajikumar, S., Navakkode, S., & Frey, J.U. (2007).
Identification of compartment- and process-specific molecules required for "synaptic tagging" during long-term potentiation and long-term depression in hippocampal CA1. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(19), 5068-80. [PubMed:17494693] [PMC] [WorldCat] [DOI] - ↑
Ishikawa, Y., Horii, Y., Tamura, H., & Shiosaka, S. (2008).
Neuropsin (KLK8)-dependent and -independent synaptic tagging in the Schaffer-collateral pathway of mouse hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(4), 843-9. [PubMed:18216192] [PMC] [WorldCat] [DOI] - ↑
Matsuo, R., Murayama, A., Saitoh, Y., Sakaki, Y., & Inokuchi, K. (2000).
Identification and cataloging of genes induced by long-lasting long-term potentiation in awake rats. Journal of neurochemistry, 74(6), 2239-49. [PubMed:10820183] [WorldCat] [DOI] - ↑
Ryan, M.M., Ryan, B., Kyrke-Smith, M., Logan, B., Tate, W.P., Abraham, W.C., & Williams, J.M. (2012).
Temporal profiling of gene networks associated with the late phase of long-term potentiation in vivo. PloS one, 7(7), e40538. [PubMed:22802965] [PMC] [WorldCat] [DOI] - ↑ D Okada, K Inokuchi
"Activity-Dependent Protein Transport as a Synaptic Tag "in "Synaptic tagging and capture, From synapses to behaviour"
S Sajikumar ed. Springer, NY, pp79-98:2015 - ↑ 15.0 15.1
Okamoto, K., Nagai, T., Miyawaki, A., & Hayashi, Y. (2004).
Rapid and persistent modulation of actin dynamics regulates postsynaptic reorganization underlying bidirectional plasticity. Nature neuroscience, 7(10), 1104-12. [PubMed:15361876] [WorldCat] [DOI] - ↑ 16.0 16.1
Okamoto, K., Bosch, M., & Hayashi, Y. (2009).
The roles of CaMKII and F-actin in the structural plasticity of dendritic spines: a potential molecular identity of a synaptic tag? Physiology (Bethesda, Md.), 24, 357-66. [PubMed:19996366] [WorldCat] [DOI] - ↑
Ramachandran, B., & Frey, J.U. (2009).
Interfering with the actin network and its effect on long-term potentiation and synaptic tagging in hippocampal CA1 neurons in slices in vitro. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(39), 12167-73. [PubMed:19793974] [PMC] [WorldCat] [DOI] - ↑
Tang, A.H., Chen, H., Li, T.P., Metzbower, S.R., MacGillavry, H.D., & Blanpied, T.A. (2016).
A trans-synaptic nanocolumn aligns neurotransmitter release to receptors. Nature, 536(7615), 210-4. [PubMed:27462810] [PMC] [WorldCat] [DOI] - ↑
Attwood, B.K., Bourgognon, J.M., Patel, S., Mucha, M., Schiavon, E., Skrzypiec, A.E., ..., & Pawlak, R. (2011).
Neuropsin cleaves EphB2 in the amygdala to control anxiety. Nature, 473(7347), 372-5. [PubMed:21508957] [PMC] [WorldCat] [DOI] - ↑
Serrano, P., Yao, Y., & Sacktor, T.C. (2005).
Persistent phosphorylation by protein kinase Mzeta maintains late-phase long-term potentiation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(8), 1979-84. [PubMed:15728837] [PMC] [WorldCat] [DOI] - ↑
Wang, D.O., Kim, S.M., Zhao, Y., Hwang, H., Miura, S.K., Sossin, W.S., & Martin, K.C. (2009).
Synapse- and stimulus-specific local translation during long-term neuronal plasticity. Science (New York, N.Y.), 324(5934), 1536-40. [PubMed:19443737] [PMC] [WorldCat] [DOI] - ↑
Engert, F., & Bonhoeffer, T. (1997).
Synapse specificity of long-term potentiation breaks down at short distances. Nature, 388(6639), 279-84. [PubMed:9230437] [WorldCat] [DOI] - ↑
Govindarajan, A., Kelleher, R.J., & Tonegawa, S. (2006).
A clustered plasticity model of long-term memory engrams. Nature reviews. Neuroscience, 7(7), 575-83. [PubMed:16791146] [WorldCat] [DOI] - ↑
Govindarajan, A., Israely, I., Huang, S.Y., & Tonegawa, S. (2011).
The dendritic branch is the preferred integrative unit for protein synthesis-dependent LTP. Neuron, 69(1), 132-46. [PubMed:21220104] [PMC] [WorldCat] [DOI] - ↑
Okuno, H., Akashi, K., Ishii, Y., Yagishita-Kyo, N., Suzuki, K., Nonaka, M., ..., & Bito, H. (2012).
Inverse synaptic tagging of inactive synapses via dynamic interaction of Arc/Arg3.1 with CaMKIIβ. Cell, 149(4), 886-98. [PubMed:22579289] [PMC] [WorldCat] [DOI] - ↑
Ballarini, F., Moncada, D., Martinez, M.C., Alen, N., & Viola, H. (2009).
Behavioral tagging is a general mechanism of long-term memory formation. Proceedings of the National Academy of Sciences of the United States of America, 106(34), 14599-604. [PubMed:19706547] [PMC] [WorldCat] [DOI] - ↑
Yokose, J., Okubo-Suzuki, R., Nomoto, M., Ohkawa, N., Nishizono, H., Suzuki, A., ..., & Inokuchi, K. (2017).
Overlapping memory trace indispensable for linking, but not recalling, individual memories. Science (New York, N.Y.), 355(6323), 398-403. [PubMed:28126819] [WorldCat] [DOI] - ↑
Kitamura, T., Ogawa, S.K., Roy, D.S., Okuyama, T., Morrissey, M.D., Smith, L.M., ..., & Tonegawa, S. (2017).
Engrams and circuits crucial for systems consolidation of a memory. Science (New York, N.Y.), 356(6333), 73-78. [PubMed:28386011] [PMC] [WorldCat] [DOI] - ↑
Lesburguères, E., Gobbo, O.L., Alaux-Cantin, S., Hambucken, A., Trifilieff, P., & Bontempi, B. (2011).
Early tagging of cortical networks is required for the formation of enduring associative memory. Science (New York, N.Y.), 331(6019), 924-8. [PubMed:21330548] [WorldCat] [DOI]