「内側視索前野」の版間の差分
Yasuosakuma (トーク | 投稿記録) 細編集の要約なし |
Yasuosakuma (トーク | 投稿記録) 細編集の要約なし |
||
| (2人の利用者による、間の68版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/UCR2GH 佐久間 康夫]</font><br> | <font size="+1">[http://researchmap.jp/UCR2GH 佐久間 康夫]</font><br> | ||
''日本医科大学大学院医学研究科''<br> | ''日本医科大学大学院医学研究科''<br> | ||
DOI:<selfdoi /> 原稿受付日:2012年6月14日 原稿完成日:2022年3月30日<br> | |||
担当編集委員:[http://researchmap.jp/ichirofujita 藤田 一郎](大阪大学 大学院生命機能研究科)<br> | 担当編集委員:[http://researchmap.jp/ichirofujita 藤田 一郎](大阪大学 大学院生命機能研究科)<br> | ||
</div> | </div> | ||
羅:area praeoptica medialis 英:medial preoptic | 羅:area praeoptica medialis 英:medial preoptic area 独:mediales präoptisches Areal 仏:aire préoptique médiane<br> | ||
英略称:MPOA | |||
{{box|text= 脳の腹側部、前交連の尾側から視交叉までの第3脳室最吻側部を囲む領域を内側視索前野という。背側は中隔や分界条床核、外側は外側視索前野に接する。大脳半球が前脳の外反によって生じるのに対し、外反せずにとどまったのが内側視索前野である。3脳胞のうち前脳forebrainの尾側端に由来するので発生学的には終脳telencephalonに属する。脳原基の部域化に関わる転写因子やシグナル分子のいくつかが間脳diencephalonである視床下部と共通で、機能的な関連が大きいことから、内側視索前野はしばしば視床下部の最吻側部と見なされるが、内側視索前野の細胞が第3脳室壁に由来するのに対し、視床下部諸核の細胞が間脳尾側に発生すること、発生初期から各段階で細胞レベルでの遺伝子発現が両部位で異なることから、今後は二部位を区別することが必要と思われる。機能的には視床下部と不可分で、循環、呼吸、排尿、内分泌調節、生殖行動、母性行動・育仔行動、睡眠、体温調節、歩行の調節に関わっており、これらの機能にかかわる視床下部諸核、扁桃核、海馬、中脳中心灰白質、腹側被蓋野などとの入出力がある。}} | |||
< | == 発生 == | ||
== | [[Bromodeoxyuridine]] ([[BrdU]]) の取り込み実験から、内側視索前野の主な[[ニューロン]]は[[ラット]]では胎生14-18日に[[第3脳室]]壁から発生することが示されている<ref name=Orikasa2010a><pubmed>20538023</pubmed></ref>。3[[脳胞]]のうち[[前脳]] (forebrain)の尾側端に由来するので、発生学的には[[終脳]] (telencephalon)に属する。[[大脳半球]]が前脳の外反によって生じるのに対し、外反せずにとどまったのが内側視索前野である。 | ||
機能的観点からは、[[間脳]] ([[diencephalon]]) の最吻側部である[[視床下部]]と一体とされることがある<ref name=Clark1950><pubmed>15420400</pubmed></ref>。かつては[[脳原基]]の[[領域化|部域化]]に関わる多くの[[転写因子]]や[[シグナル分子]]に視床下部と共通するものがあり、たとえば[[Dlx5]]、[[Pax6]]、[[Nkx2.1a]]の発現パターンから終脳と間脳の[[分節境界域]] prosomeric boundaryを決定することはできないと論じられた<ref name=Puelles2003><pubmed>12948657</pubmed></ref>。 | |||
一方、下郡らは異なった発生段階の[[マウス]]胎仔の内側視索前野と視床下部のマイクロアレイ解析からマウス胎児の終脳では[[Foxg1]]が、間脳吻側端には[[Gdf10]]が発現し境界が存在することを示した<ref name=Blackshaw2010><pubmed>21068293</pubmed></ref>。内側視索前野は終脳のFoxg1陽性細胞に由来し、間脳由来の視床下部とは起源が異なる。また、視床下部のランドマーク遺伝子である[[ソニックヘッジホッグ]] ([[Shh]])のノックアウトマウスでは視床下部吻側部が欠損するが、内側視索前野は形成される。 | |||
第3脳室壁から発生するニューロンに加え、[[齧歯類]]では[[性腺刺激ホルモン放出ホルモン]]([[gonadotropin releasing hormone]], [[GnRH]])産生ニューロンが[[嗅上皮]]の原基である[[内側嗅板]][[medial olfactory placode]]に発生し内側視索前野に移動し定着する <ref name=Schwanzel-Fukuda1989><pubmed>2645530</pubmed></ref>。Xp22.3上の[[KAL-1]]遺伝子の異常により生じるヒトの[[カルマン症候群]] (Kallman syndrom)は[[無嗅覚症]]を伴う[[伴性低ゴナドトロピン性性腺機能不全]]で、GnRHニューロンは前頭の[[篩骨]]を透過できずこの移動が起こらない。ただし、正常な[[アカゲザル]]や[[ヒト]]ではGnRHニューロンはさらに尾側に移動を続け、視床下部内側底部から[[隆起漏斗部]]に定着する。この移動・定着の障害が視床下部性性腺機能低下症の一つであるカルマン症候群の病因である<ref name=Schwanzel-Fukuda1989b><pubmed>2687610</pubmed></ref>([[#病態]]を参照)。 | |||
== 構造 == | |||
[[Image:2視床下部の神経核.jpg|thumb|right|300px|<b>図.内側視索前野および隣接する主な視床下部神経核と脳領域</b><br>NetterのAtlas of Neuroanatomy and Neurophysiologyより改変して転載(転載許可取得済)。犬束、山中「[[視床下部]]」より。]] | |||
内側視索前野は吻側で[[対角帯核]]と[[側坐核]]に接し、尾側は形態学上明確な境界を持たず、[[視交叉]]の高さで視床下部前野に移行する。背側は[[前交連]]をはさんで、機能的に関連の深い[[分界条床核]]や[[中隔]]に接する。なお、ラット、マウスの中隔は、ヒトの[[25野]]、[[嗅傍領]]と相同で、[[透明中隔]]とは異なる。腹側は脳底で視交叉に接しており、視交叉の後縁が視床下部前野との境界となる。前額断面では内側視索前野は第3脳室に接する最内側の傍室部とその外側で[[脳弓]]により境される内側部に区分される。傍室部最吻側の細胞群を[[前腹側傍室核]]と呼ぶことがある。脳弓より外側は[[外側視索前野]]である。外側視索前野は局所のニューロンに加え、傍室部や内側視索前野に発する下行線維が内側前脳束として通過する<ref name=SIMERLY>'''SIMERLY, R. B. (2004).'''<br>Anatomical substrates of hypothalamic integration. In: PAXINOS, G. (ed.) The Rat Nervous System. San Diego: Academic Press. </ref>。''位置関係の概要は[[視床下部]]および'''図'''を参照。'' | |||
内側視索前野には複数の細胞集積が認められるが、視床下部の「核」と異なり、必ずしも境界は鮮明ではない。中央部に位置する[[性的二型核]] (Gorskiの命名<ref name=Gorski1978><pubmed>656937</pubmed></ref>によるsexually dimorphic nucleus of the preoptic area, SDN-POA)はニッスル染色で比較的鮮明に描出され、ラットでは雄が雌より多数のニューロンを擁する<ref name=Orikasa2002><pubmed>11854469</pubmed></ref>。この核は[[ハムスター]]、[[フェレット]]、[[テンジクネズミ]]、[[ヒツジ]]、[[サル]]、ヒトで認められ<ref name=Orikasa2010><pubmed>20593361</pubmed></ref>、長年にわたりマウスではこの核が存在しないとする主張<ref name=Young1982><pubmed>7093678</pubmed></ref>は、[[カルビンディン28k]]を標識タンパク質として用いて2010年に複数の系統で反駁・立証された<ref name=Orikasa2010></ref>。 | |||
その他の細胞集積には、第3脳室に接する傍室部で吻側から[[終板器官]]、[[前腹側傍室核]]、[[腹内側視索前野核]]、[[正中視索前核]]、[[傍室視索前核]]などが同定されている。内側部では内側視索前核が中心部に大きな体積を占め、そのほかに[[傍分界条核]]、[[後背側視索前核]]、[[腹外側視索前核]]、[[中隔視床下部核]]といった細胞集積がある。マウス内側視索前野前額断の概要はAllen Brain Atlas<ref name=Allan2004>[https://mouse.brain-map.org/static/atlas Allen Brain Atlas]</ref>に見ることができる。 | |||
== 入出力 == | |||
===入力=== | |||
[[視索上核]]、[[視交叉上核]]、[[乳頭体核]]を除く視床下部諸核から内側視索前野への投射があり、視床下部の第3脳室周辺部は内側視索前野の内側、視床下部前野と腹内側核を除く外側の諸核は内側視索前野の外側に至る。視床下部前野と腹内側核は内側視索前野全体に投射する。[[扁桃体中心核]]と強い結合を持つ分界条床核の背外側部は内側視索前野の中央部を支配し、[[扁桃核]]、[[海馬台]]、外側中隔腹側部からは内側視索前野の外側部に投射がある。[[下辺縁皮質]]と[[島皮質]]、[[側坐核]]、[[無名質]]からの入力はまばらである。[[縫線核]]からの[[セロトニン]]作動性線維は内側視索前野の外側部に、[[ノルアドレナリン]]作動性終末は内側視索前野の中心部と内側部に終わる。[[腹側被蓋野]]、[[中脳中心灰白質]]、[[橋被蓋核]]、[[脚周核]]からの投射は軽度である。これらの投射のうち内側に終わるものは室周囲を、外側に終わるものは[[内側前脳束]]を上行する<ref name=Simerly1986><pubmed>3517086]</pubmed></ref>。 | |||
=== 出力 === | |||
内側視索前野に電気泳動を用いて投与したインゲンマメ白血球凝集素 ([[phaseolus vulgaris leucoagglutinin]], [[PHA-L]])により前脳・[[脳幹]]の構造が順行性に標識された。多くは内側視索前野への投射が知られている部位で、相互の支配が明らかである。視床下部の第3脳室周辺部には特に多くの投射があり、[[前腹側室周囲核]]、室傍核の小細胞領域、弓状核など[[神経内分泌]]調節に関わる部位、あるいは[[外側結合腕傍核]]・[[孤束核]]といった[[自律神経]]調節に関わる部位、[[腹内側核]]・[[背内側核]]など[[生殖]]・[[摂食]]といった行動調節に関わる部位が含まれる。 | |||
=== 相互支配 === | |||
逆行性・順行性双方に輸送される[[西洋ワサビ過酸化酵素]] ([[horseradish peroxidase]], [[HRP]])と[[小麦胚芽凝集素]] ([[wheat-germ agglutinin]], [[WGA]])の結合体である[[WGA-HRP]]により内側視索前野と[[外側中隔]]、分界条床核、[[扁桃核内側核]]、[[外側視床下部]]、室傍核、腹内側核、弓状核、[[乳頭上核]]、中脳中心灰白質、縫線核、[[結合腕傍核]]のそれぞれとの相互支配が示されている。[[大脳基底核]]([[腹側線条体]]、[[側坐核]]、[[マイネルト基底核]]、[[視床下核]]を含む)、[[外側手綱核]]、視床の内側諸核、[[正中隆起]]、[[乳頭体内側核]]、[[黒質]]、[[動眼神経核]]、[[赤核]]、[[背外側被蓋核]]、[[脳幹網様体]]、[[青斑核]]、[[迷走神経背側核]]へは投射が存在する。 | |||
==機能 == | |||
内側視索前野は自律機能の最高中枢と呼ばれてきた<ref name=Swanson1999><pubmed>10643453</pubmed></ref>。視床下部と共に古くは前額断で第3脳室に隣接する第3脳室室傍域、隣接して脳弓の内側を占める領域、より外側の領域がそれぞれ[[副交感]]・[[交感]]機能に関与するとされた<ref name=CROSBY1969>'''Crosby, E. C. & Showers, M. J. C. (1969).'''<br>Comparative anatomy of the preoptic and hypothalamic areas. In: Haymaker, W., Anderson, E. & Nauta, W. J. H. (eds.) The Hypothalamus. Springfield, Il: Charles C. Thomas. </ref>。[[循環]]、[[呼吸]]、[[排尿]]、[[消化]]、[[体温調節]]、[[内分泌]]、生殖、[[代謝]]など体温・循環調節など古典的な自律機能に加え、[[睡眠]]、[[ストレス反応]]、[[歩行]]運動の歩調取り、雌雄の[[生殖行動]]や[[社会的慰撫行動]]など、[[情動]]・行動要素の調節に内側視索前野が関わる報告がある。 | |||
===循環=== | |||
血中[[アンギオテンシン]]の増加や[[大動脈弓圧受容器]]の除神経により、[[血圧]]が上昇する。脳室周囲器官の一つである[[脳弓下器官]]の破壊あるいは脳弓下器官から[[正中視索前核]](median preoptic nucleus, MnPO)への投射の切断によりアンギオテンシンの作用は消失するが、[[圧受容器]]の除神経の効果は影響を受けない。内側視索前野正中部の破壊により、二つの昇圧効果は共に失われる <ref name=Saper1983><pubmed>6198025</pubmed></ref>。 | |||
===呼吸=== | |||
視交叉より吻側の視索前野の電気刺激は古くはRansonらが示したように浅く緩徐な呼吸を起こし、尾側の刺激が深く、急速な呼吸を起すのと対照的な効果を持つ<ref name=Ranson1935>'''Ranson, S. W., Kabat, H. & Magoun, H. W. (1935).'''<br>Autonomic responses to electrical stimulation of hypothalamus, preoptic region and septum. ''Archives of Neurology & Psychiatry'', 33, 467-77.</ref>。 | |||
===排尿=== | |||
排尿中枢は古典的には脳幹の橋に存在する。[[橋排尿中枢]]の下行性[[コルチコトロピン放出ホルモン]]陽性ニューロンには[[γアミノ酪酸]](GABA)作動性内側視索前野ニューロンが投射しており、発情雄マウスの尿による[[マーキング行動]]を起す<ref name=Hou2016><pubmed>27662084</pubmed></ref>。シナプスを乗り越えて神経に感染するpseudorabies virusによる逆行性標識により内側視索前野から[[膀胱]]に至る下行性投射が示された(ラットとネコ)<ref name=deGroat1998><pubmed>9638955</pubmed></ref>。[[テンジクネズミ]]と[[ネコ]]で、[[仙腰随]]から内側視索前野の前交連腹側に上行性の直接投射があり、排尿や生殖に関わる骨盤臓器からの[[下腹神経]]、[[骨盤神経]]、[[陰部神経]]からの感覚入力を伝えている<ref name=Klop2009><pubmed>19733632</pubmed></ref>。 | |||
===生殖内分泌調節=== | |||
雌ラット内側視索前野のGABA作動性ニューロンに[[エストロゲン受容体]]が発現している<ref name=Herbison1991><pubmed>19215454</pubmed></ref>。[[パルブアルブミン]]陽性のGABA作動性ニューロンが内側中隔から内側視索前野吻側・[[対角帯野]]に分布<ref name=Smith2005><pubmed>15802181</pubmed></ref>し、上述のGnRHニューロンの分布領域<ref name=Schwanzel-Fukuda1989><pubmed>2645530</pubmed></ref>と重なる。また内側視索前野のGABA<sub>A</sub>受容体はエストロゲンにより発現が増す<ref name=Herbison1997><pubmed>9370195</pubmed></ref>。GnRHニューロンは[[クロライドトランスポーター]]の発現パターン(搬入する[[NKCC1]]が多く、排出する[[KCC2]]が少ない)から、細胞内クロライドイオン濃度が高く、[[GABAA受容体|GABA<sub>A</sub>受容体]]活性化で興奮し、GnRH分泌を起す<ref name=Watanabe2009><pubmed>19357366</pubmed></ref>ことと相まって、GABAの生殖内分泌調節への関与を示唆している。 | |||
一方、エストロゲン作用をGnRHニューロンに伝え、[[排卵]]時の[[黄体形成ホルモン]]の一過性大量分泌に関わることが臨床例<ref name=deRoux2003><pubmed>12944565</pubmed></ref><ref name=Seminara2003><pubmed>14573733</pubmed></ref>を通じて詳細が判明している分子に[[GPR54]][[リガンド]]である[[キスペプチン]]がある<ref name=Oakley2009><pubmed>19770291</pubmed></ref>。キスペプチンニューロンは前腹側傍室核に分布するエストロゲン受容体陽性ニューロン<ref name=Orikasa2002><pubmed>11854469</pubmed></ref>と重なると考えられる。GnRHニューロン膜上にキスペプチン受容体GPR54が存在する<ref name=Parhar2004><pubmed>15155576</pubmed></ref>。なお、視床下部弓状核のエストロゲン受容体陽性キスペプチンニューロンはGnRHの律動的分泌により、[[下垂体前葉]][[ゴナドトローフ細胞]]のGnRH受容体を維持するとされる<ref name=Wakabayashi2010><pubmed>20181609</pubmed></ref>。 | |||
===生殖行動=== | |||
内側視索前野から中脳[[腹側被蓋野]]への投射は雌<ref name=Erskine1989><pubmed>2691387</pubmed></ref>、雄<ref name=Agmo1997><pubmed>9385085</pubmed></ref>の性行動の調節に関わる。雄ラットでは内側視索前野の電気凝固<ref name=Larsson1964><pubmed>14152848</pubmed></ref>、あるいは興奮性神経毒による内側視索前野の神経細胞の脱落により、性行動の動機付け要素と実行要素の双方が消失する。一方、雌ラットでは内側視索前野の破壊により雌が雄を避けられる条件では性行動が消失するが、避けられない条件では性行動、特に[[ロードーシス行動]]が存続することが報じられてきた<ref name=Whitney1986><pubmed>3964425</pubmed></ref>。[[興奮性神経毒]]による神経細胞の脱落<ref name=Hoshina1994><pubmed>8037867</pubmed></ref>と微小ナイフによる下行性通過線維の選択的切断<ref name=Takeo1993><pubmed>8511198</pubmed></ref>により、内側視索前野から雌型性行動の動機付け要素を促進する回路と実行要素を抑制する回路が起始していることが示されている。実行要素であるロードーシス行動は、特に[[分界条]]由来の通過線維を除去した状態でのこの部位の電気刺激により強く抑制される<ref name=Takeo1993><pubmed>8511198</pubmed></ref> 。この抑制は腹側被蓋野の電気刺激により得られる効果と同一の大きさと時間経過で得られる<ref name=Hasegawa1991><pubmed>1805265</pubmed></ref>ことから、内側視索前野に起こり腹側被蓋野に終わる[[エストロゲン]]感受性下行性ニューロン<ref name=Hasegawa1993><pubmed>8518936</pubmed></ref>が関わる。逆行性興奮閾値から、このニューロンの軸索の興奮性がエストロゲンにより低下することが示されている。この現象はエストロゲンによる[[BKチャネル]](高コンダクタンスの電位及び[[カルシウム|Ca<sup>2+</sup>]]によって活性化される[[カリウムチャネル#カルシウム活性化カリウムチャネル|K<sup>+</sup>チャネル]])の発現増加による<ref name=Nishimura2008><pubmed>17962348</pubmed></ref>。雄、あるいは生直後の[[性ホルモン]]投与により雄型の脳を持ちロードーシス行動を示さない雌では、エストロゲンの効果は見られない。ロードーシス行動の促進回路である視床下部腹内側核から中脳中心灰白質への投射軸索においては、エストロゲンにより興奮性が高まり、逆行性興奮[[閾値]]が低下する。内側視索前野から腹側被蓋野への投射と同じく、エストロゲンが効くのはロードーシス行動を起す雌あるいは生直後去勢雄に限られる<ref name=Sakuma1984><pubmed>6737296</pubmed></ref>。つまり行動の抑制回路の脱抑制と促進回路の興奮が同時に起こることが、ロードーシス行動の発現に必要である。 | |||
===母性行動・育仔行動=== | |||
ラットでは妊娠末期に血中[[プロゲステロン]]濃度が低下し、エストロゲンと[[プロラクチン]]濃度が上昇すると、分娩後[[母性行動]]が現れる。適切な母性行動の発揮には、まず新生仔を忌避し、敵対する行動が抑制される必要がある。未経産の雌ラットのケージに新生仔を入れると、雌はその場所を忌避する<ref name=Numan1997><pubmed>9071346</pubmed></ref>。雌マウス内側視索前野中心部の選択的破壊は、この部位に存在する[[ガラニン]]の脱落により母性行動を消失させる<ref name=Wu2014><pubmed>24828191</pubmed></ref>。哺育中の母マウスは内側視索前野・[[扁桃核]]のエストロゲン受容体陽性ニューロンを介して、接近してきた新奇雄を激しく攻撃する母性攻撃行動を示す<ref name=Ogawa2004><pubmed>15817742</pubmed></ref>、この行動の一側面として、哺育中の母マウスはリスクを顧みずに仔を守る行動を取る。最近黒田らは脳幹へ投射する内側視索前野の[[カルシトニン受容体]]陽性ニューロンとリガンドである[[アミリン]]がこのリスクテーキング行動に関わっていることを示した<ref name=Yoshihara2021><pubmed>34077719</pubmed></ref>。雌雄双方で内側視索前野のガラニン作動性ニューロンが育仔に関与する<ref name=Wu2014><pubmed>24828191</pubmed></ref>。他方、内側視索前野脳弓周辺部に分布する[[ウロコルチン]]ニューロンが雌雄マウスで新生仔の無視や攻撃といった育仔放棄を誘発する<ref name=Autry2021><pubmed>34423776</pubmed></ref>。 | |||
===睡眠=== | |||
ヒトを含む哺乳類で内側視索前野の損傷が睡眠の障害を起こす。視索前野の腹外側部に分布するGABAやガラニン作動ニューロンが[[non-REM睡眠]]を起こす<ref name=Sherin1996><pubmed>8539624</pubmed></ref><ref name=Gong2004><pubmed>14966298</pubmed></ref><ref name=Takahashi2009><pubmed>19285545</pubmed></ref>。一方、これらの細胞群の背側と内側に散在するニューロンの破壊は[[REM睡眠]]の減少をきたした。Jouvetらは興奮性神経毒によるネコ視索前野ニューロンの破壊が持続的な不眠を起こし、この効果は視床下部後部へのGABA注入で拮抗されることを示した<ref name=Sallanon1989><pubmed>2601839</pubmed></ref>。最近の[[光遺伝学]]的研究によれば、マウス内側視索前野腹側部のGABA作動性ニューロンの光刺激により、視床下部後部の[[隆起乳頭体核]]の[[ヒスタミン]]作動ニューロンの抑制によりnon-REM睡眠、REM睡眠を起すとの報告があり<ref name=Chung2017><pubmed>28514446</pubmed></ref>、Jouvetら<ref name=Sallanon1989></ref>の先行研究と合致する。 | |||
===体温調節=== | |||
[[ウレタン]]麻酔下のネコの内側視索前野、中でも前交連の前腹側に局所の加温により放電頻度を増す温感受性ニューロンが存在する。反応の特異性は周辺のニューロンが反応しないので特異的であるという中山らの先駆的報告が行われている<ref name=Hardy1962><pubmed>17745919</pubmed></ref>。ラットでは内側視索前野の片側破壊により散熱の抑制(尾血管の収縮、酸素消費の亢進、体温保持姿勢)による致死的な高体温が急速に生じる。術後強制的な冷却により生存した個体は体温の恒常性を維持できず変温動物となる<ref name=Szymusiak1982><pubmed>7079312</pubmed></ref>。。ウレタン麻酔下の[[ウサギ]]でプロゲステロンの全身投与は視索前野の[[温感受性ニューロン]]を抑制し、ひいては個体の体温上昇を起す<ref name=Nakayama1975><pubmed>1186885</pubmed></ref>。ヒト女性の排卵と黄体期における約0.5°Cの基礎体温の上昇は<ref name=Buxton1948><pubmed>18939188</pubmed></ref>この機序による。 | |||
。 | |||
===歩行=== | |||
発情期の雌ラットは運動量が増す。エストロゲン結晶の局所投与により輪回し行動の増加が見られることから、この効果は内側視索前野を介している<ref name=Takeo1995><pubmed>7792083</pubmed></ref><ref name=Fahrbach1985><pubmed>4095192</pubmed></ref>。歩行の開始とステッピング(リズム取り)は中脳[[楔状核]]と[[脚橋被蓋核]]吻側に同定されている[[中脳歩行領域]]により制御されており <ref name=SHIK1966>'''SHIK, M. L., SEVERIN, F. V. & ORLOVSKII, G. N. (1966).'''<br>Control of walking and running by means of electrical stimulation of the midbrain. Biofizyka (English translation), 11, 756-65.</ref>、森ら<ref name=MORI1982>'''MORI, S., MATSUYAMA, K., KOHYAMA, J., KOBAYASHI, Y. & TAKAKUSAKI, K. (1992).'''<br>Neuronal constituents of postural and locomotor control systems and their interactions in cats. Brain Dev., 14 Suppl., S109-S120.</ref>は内側視索前野から中脳歩行領域に至る下行性の歩行調節軸の存在を示した。この部位への[[グルタミン酸]]や[[ピクロトキシン]]の注入により麻酔下のラットに歩行運動を起こすことができる<ref name=Sinnamon1987><pubmed>2880639</pubmed></ref>。Sinnamonの名付けた「視索前野の歩行領域<ref name=Sinnamon1992><pubmed>1407556</pubmed></ref>」の電気刺激により、麻酔下のラットが微弱な電流で歩行を開始し、電流強度の増加に伴うステッピング頻度の上昇が起こる。一方、内側視索前野最内側の室傍領域への[[カルバコール]]注入など、[[アセチルコリン受容体]]の刺激は歩行運動抑制する<ref name=Brudzynski1986><pubmed>3719372</pubmed></ref>。武尾らはラット外側視索前野内側部と内側視索前野のそれぞれから中脳歩行領域への投射を示し、前者がエストロゲンにより興奮性を増すのに対し、後者は抑制されることを見ている<ref name=Takeo1993><pubmed>8511198</pubmed></ref>。 | |||
==病態== | |||
ヒトの内側視索前野の機能不全に起因する病態については緒方勤 & 田中敏章(2006)に詳しい<ref name=緒方勤>'''緒方勤 & 田中敏章. (2006).'''<br>低ゴナドトロピン性性腺機能不全:分子遺伝学的および臨床的側面. 日本生殖内分泌学会雑誌, 11, 11-16.</ref>。 | |||
何れも[[低ゴナドトロピン性性腺機能不全症]] (hypogonadotropic hypogonadism または hypothalamic hypogonadism)を示す: | |||
===フレーリヒ症候群=== | |||
Fröhlich syndrom<br> | |||
[[w:Alfred Fröhlich|Fröhlich]]<ref name=FRÖLICH1901>'''Frölich, A. (1901).'''<br>Ein fall von Tumor der Hypophysis cerebri ohne Akromegalie, ''Wiener klinische Rundschau'', 15:883-906. </ref>の症例報告(1901)が初出(英訳は<ref name=Bruch1939><pubmed>16350582</pubmed></ref>)。発症に間脳[[下垂体]]系の障害が関わることが示された最初の疾患である。腫瘍や結核性髄膜炎、外傷などによる間脳底部の破壊により飽食感覚が低下して肥胖が起こり,視索前野から視床下部の機能障害によるGnRH分泌の低下により性腺機能が低下する。 | |||
===カルマン症候群=== | |||
Kallman syndrom<br> | |||
X染色体上のKAL1遺伝子の変異により[[嗅上皮]]に発生したGnRHニューロンの脳内への移動不全により、嗅覚脱失を伴う性腺機能低下症が生じる。X連鎖性の伴性遺伝のため、女性ではまれである(出生男子の1万人に1人,出生女子の5万人に1人;1型[[Kallman症候]])。[[常染色体]]8p21-22上の[[FGFR1]]遺伝子の異常は口唇口蓋裂を伴う2型のカルマン症候群を生じる。 | |||
===キスペプチン受容体異常=== | |||
< | [[思春期]]が発来せず、低ゴナドトロピン性性腺機能不全を示すヒト症例がGnRHニューロン膜上の[[キスペプチン受容体]]であるGPR54の異常によることが二つのグループにより同時期に報じられ、[[ノックアウトマウス]]の作成で確かめられた<ref name=deRoux2003><pubmed>12944565</pubmed></ref><ref name=Seminara2003><pubmed>14573733</pubmed></ref>。 | ||
===バルデー・ビードル症候群=== | |||
Bardet-Biedl syndrom<br> | |||
[[性腺機能低下]]に加え、[[肥満]]、[[知能障害]]、[[網膜色素変性症]]、慢性腎障害、多指症・合指症を6主徴とする常染色体劣性疾患。発症機転に間脳下垂体の関与が示唆されている。多くは小児期に診断される。 | |||
==関連項目== | |||
* [[視床下部]] | |||
* [[養育行動の神経回路]] | |||
* [[摂食制御の神経回路]] | |||
* [[性行動の神経回路]] | |||
== 参考文献 == | |||
<references /> | |||
< | |||
2022年3月30日 (水) 20:43時点における最新版
佐久間 康夫
日本医科大学大学院医学研究科
DOI:10.14931/bsd.1999 原稿受付日:2012年6月14日 原稿完成日:2022年3月30日
担当編集委員:藤田 一郎(大阪大学 大学院生命機能研究科)
羅:area praeoptica medialis 英:medial preoptic area 独:mediales präoptisches Areal 仏:aire préoptique médiane
英略称:MPOA
脳の腹側部、前交連の尾側から視交叉までの第3脳室最吻側部を囲む領域を内側視索前野という。背側は中隔や分界条床核、外側は外側視索前野に接する。大脳半球が前脳の外反によって生じるのに対し、外反せずにとどまったのが内側視索前野である。3脳胞のうち前脳forebrainの尾側端に由来するので発生学的には終脳telencephalonに属する。脳原基の部域化に関わる転写因子やシグナル分子のいくつかが間脳diencephalonである視床下部と共通で、機能的な関連が大きいことから、内側視索前野はしばしば視床下部の最吻側部と見なされるが、内側視索前野の細胞が第3脳室壁に由来するのに対し、視床下部諸核の細胞が間脳尾側に発生すること、発生初期から各段階で細胞レベルでの遺伝子発現が両部位で異なることから、今後は二部位を区別することが必要と思われる。機能的には視床下部と不可分で、循環、呼吸、排尿、内分泌調節、生殖行動、母性行動・育仔行動、睡眠、体温調節、歩行の調節に関わっており、これらの機能にかかわる視床下部諸核、扁桃核、海馬、中脳中心灰白質、腹側被蓋野などとの入出力がある。
発生
Bromodeoxyuridine (BrdU) の取り込み実験から、内側視索前野の主なニューロンはラットでは胎生14-18日に第3脳室壁から発生することが示されている[1]。3脳胞のうち前脳 (forebrain)の尾側端に由来するので、発生学的には終脳 (telencephalon)に属する。大脳半球が前脳の外反によって生じるのに対し、外反せずにとどまったのが内側視索前野である。
機能的観点からは、間脳 (diencephalon) の最吻側部である視床下部と一体とされることがある[2]。かつては脳原基の部域化に関わる多くの転写因子やシグナル分子に視床下部と共通するものがあり、たとえばDlx5、Pax6、Nkx2.1aの発現パターンから終脳と間脳の分節境界域 prosomeric boundaryを決定することはできないと論じられた[3]。
一方、下郡らは異なった発生段階のマウス胎仔の内側視索前野と視床下部のマイクロアレイ解析からマウス胎児の終脳ではFoxg1が、間脳吻側端にはGdf10が発現し境界が存在することを示した[4]。内側視索前野は終脳のFoxg1陽性細胞に由来し、間脳由来の視床下部とは起源が異なる。また、視床下部のランドマーク遺伝子であるソニックヘッジホッグ (Shh)のノックアウトマウスでは視床下部吻側部が欠損するが、内側視索前野は形成される。
第3脳室壁から発生するニューロンに加え、齧歯類では性腺刺激ホルモン放出ホルモン(gonadotropin releasing hormone, GnRH)産生ニューロンが嗅上皮の原基である内側嗅板medial olfactory placodeに発生し内側視索前野に移動し定着する [5]。Xp22.3上のKAL-1遺伝子の異常により生じるヒトのカルマン症候群 (Kallman syndrom)は無嗅覚症を伴う伴性低ゴナドトロピン性性腺機能不全で、GnRHニューロンは前頭の篩骨を透過できずこの移動が起こらない。ただし、正常なアカゲザルやヒトではGnRHニューロンはさらに尾側に移動を続け、視床下部内側底部から隆起漏斗部に定着する。この移動・定着の障害が視床下部性性腺機能低下症の一つであるカルマン症候群の病因である[6](#病態を参照)。
構造
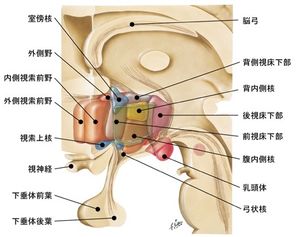
NetterのAtlas of Neuroanatomy and Neurophysiologyより改変して転載(転載許可取得済)。犬束、山中「視床下部」より。
内側視索前野は吻側で対角帯核と側坐核に接し、尾側は形態学上明確な境界を持たず、視交叉の高さで視床下部前野に移行する。背側は前交連をはさんで、機能的に関連の深い分界条床核や中隔に接する。なお、ラット、マウスの中隔は、ヒトの25野、嗅傍領と相同で、透明中隔とは異なる。腹側は脳底で視交叉に接しており、視交叉の後縁が視床下部前野との境界となる。前額断面では内側視索前野は第3脳室に接する最内側の傍室部とその外側で脳弓により境される内側部に区分される。傍室部最吻側の細胞群を前腹側傍室核と呼ぶことがある。脳弓より外側は外側視索前野である。外側視索前野は局所のニューロンに加え、傍室部や内側視索前野に発する下行線維が内側前脳束として通過する[7]。位置関係の概要は視床下部および図を参照。
内側視索前野には複数の細胞集積が認められるが、視床下部の「核」と異なり、必ずしも境界は鮮明ではない。中央部に位置する性的二型核 (Gorskiの命名[8]によるsexually dimorphic nucleus of the preoptic area, SDN-POA)はニッスル染色で比較的鮮明に描出され、ラットでは雄が雌より多数のニューロンを擁する[9]。この核はハムスター、フェレット、テンジクネズミ、ヒツジ、サル、ヒトで認められ[10]、長年にわたりマウスではこの核が存在しないとする主張[11]は、カルビンディン28kを標識タンパク質として用いて2010年に複数の系統で反駁・立証された[10]。
その他の細胞集積には、第3脳室に接する傍室部で吻側から終板器官、前腹側傍室核、腹内側視索前野核、正中視索前核、傍室視索前核などが同定されている。内側部では内側視索前核が中心部に大きな体積を占め、そのほかに傍分界条核、後背側視索前核、腹外側視索前核、中隔視床下部核といった細胞集積がある。マウス内側視索前野前額断の概要はAllen Brain Atlas[12]に見ることができる。
入出力
入力
視索上核、視交叉上核、乳頭体核を除く視床下部諸核から内側視索前野への投射があり、視床下部の第3脳室周辺部は内側視索前野の内側、視床下部前野と腹内側核を除く外側の諸核は内側視索前野の外側に至る。視床下部前野と腹内側核は内側視索前野全体に投射する。扁桃体中心核と強い結合を持つ分界条床核の背外側部は内側視索前野の中央部を支配し、扁桃核、海馬台、外側中隔腹側部からは内側視索前野の外側部に投射がある。下辺縁皮質と島皮質、側坐核、無名質からの入力はまばらである。縫線核からのセロトニン作動性線維は内側視索前野の外側部に、ノルアドレナリン作動性終末は内側視索前野の中心部と内側部に終わる。腹側被蓋野、中脳中心灰白質、橋被蓋核、脚周核からの投射は軽度である。これらの投射のうち内側に終わるものは室周囲を、外側に終わるものは内側前脳束を上行する[13]。
出力
内側視索前野に電気泳動を用いて投与したインゲンマメ白血球凝集素 (phaseolus vulgaris leucoagglutinin, PHA-L)により前脳・脳幹の構造が順行性に標識された。多くは内側視索前野への投射が知られている部位で、相互の支配が明らかである。視床下部の第3脳室周辺部には特に多くの投射があり、前腹側室周囲核、室傍核の小細胞領域、弓状核など神経内分泌調節に関わる部位、あるいは外側結合腕傍核・孤束核といった自律神経調節に関わる部位、腹内側核・背内側核など生殖・摂食といった行動調節に関わる部位が含まれる。
相互支配
逆行性・順行性双方に輸送される西洋ワサビ過酸化酵素 (horseradish peroxidase, HRP)と小麦胚芽凝集素 (wheat-germ agglutinin, WGA)の結合体であるWGA-HRPにより内側視索前野と外側中隔、分界条床核、扁桃核内側核、外側視床下部、室傍核、腹内側核、弓状核、乳頭上核、中脳中心灰白質、縫線核、結合腕傍核のそれぞれとの相互支配が示されている。大脳基底核(腹側線条体、側坐核、マイネルト基底核、視床下核を含む)、外側手綱核、視床の内側諸核、正中隆起、乳頭体内側核、黒質、動眼神経核、赤核、背外側被蓋核、脳幹網様体、青斑核、迷走神経背側核へは投射が存在する。
機能
内側視索前野は自律機能の最高中枢と呼ばれてきた[14]。視床下部と共に古くは前額断で第3脳室に隣接する第3脳室室傍域、隣接して脳弓の内側を占める領域、より外側の領域がそれぞれ副交感・交感機能に関与するとされた[15]。循環、呼吸、排尿、消化、体温調節、内分泌、生殖、代謝など体温・循環調節など古典的な自律機能に加え、睡眠、ストレス反応、歩行運動の歩調取り、雌雄の生殖行動や社会的慰撫行動など、情動・行動要素の調節に内側視索前野が関わる報告がある。
循環
血中アンギオテンシンの増加や大動脈弓圧受容器の除神経により、血圧が上昇する。脳室周囲器官の一つである脳弓下器官の破壊あるいは脳弓下器官から正中視索前核(median preoptic nucleus, MnPO)への投射の切断によりアンギオテンシンの作用は消失するが、圧受容器の除神経の効果は影響を受けない。内側視索前野正中部の破壊により、二つの昇圧効果は共に失われる [16]。
呼吸
視交叉より吻側の視索前野の電気刺激は古くはRansonらが示したように浅く緩徐な呼吸を起こし、尾側の刺激が深く、急速な呼吸を起すのと対照的な効果を持つ[17]。
排尿
排尿中枢は古典的には脳幹の橋に存在する。橋排尿中枢の下行性コルチコトロピン放出ホルモン陽性ニューロンにはγアミノ酪酸(GABA)作動性内側視索前野ニューロンが投射しており、発情雄マウスの尿によるマーキング行動を起す[18]。シナプスを乗り越えて神経に感染するpseudorabies virusによる逆行性標識により内側視索前野から膀胱に至る下行性投射が示された(ラットとネコ)[19]。テンジクネズミとネコで、仙腰随から内側視索前野の前交連腹側に上行性の直接投射があり、排尿や生殖に関わる骨盤臓器からの下腹神経、骨盤神経、陰部神経からの感覚入力を伝えている[20]。
生殖内分泌調節
雌ラット内側視索前野のGABA作動性ニューロンにエストロゲン受容体が発現している[21]。パルブアルブミン陽性のGABA作動性ニューロンが内側中隔から内側視索前野吻側・対角帯野に分布[22]し、上述のGnRHニューロンの分布領域[5]と重なる。また内側視索前野のGABAA受容体はエストロゲンにより発現が増す[23]。GnRHニューロンはクロライドトランスポーターの発現パターン(搬入するNKCC1が多く、排出するKCC2が少ない)から、細胞内クロライドイオン濃度が高く、GABAA受容体活性化で興奮し、GnRH分泌を起す[24]ことと相まって、GABAの生殖内分泌調節への関与を示唆している。
一方、エストロゲン作用をGnRHニューロンに伝え、排卵時の黄体形成ホルモンの一過性大量分泌に関わることが臨床例[25][26]を通じて詳細が判明している分子にGPR54リガンドであるキスペプチンがある[27]。キスペプチンニューロンは前腹側傍室核に分布するエストロゲン受容体陽性ニューロン[9]と重なると考えられる。GnRHニューロン膜上にキスペプチン受容体GPR54が存在する[28]。なお、視床下部弓状核のエストロゲン受容体陽性キスペプチンニューロンはGnRHの律動的分泌により、下垂体前葉ゴナドトローフ細胞のGnRH受容体を維持するとされる[29]。
生殖行動
内側視索前野から中脳腹側被蓋野への投射は雌[30]、雄[31]の性行動の調節に関わる。雄ラットでは内側視索前野の電気凝固[32]、あるいは興奮性神経毒による内側視索前野の神経細胞の脱落により、性行動の動機付け要素と実行要素の双方が消失する。一方、雌ラットでは内側視索前野の破壊により雌が雄を避けられる条件では性行動が消失するが、避けられない条件では性行動、特にロードーシス行動が存続することが報じられてきた[33]。興奮性神経毒による神経細胞の脱落[34]と微小ナイフによる下行性通過線維の選択的切断[35]により、内側視索前野から雌型性行動の動機付け要素を促進する回路と実行要素を抑制する回路が起始していることが示されている。実行要素であるロードーシス行動は、特に分界条由来の通過線維を除去した状態でのこの部位の電気刺激により強く抑制される[35] 。この抑制は腹側被蓋野の電気刺激により得られる効果と同一の大きさと時間経過で得られる[36]ことから、内側視索前野に起こり腹側被蓋野に終わるエストロゲン感受性下行性ニューロン[37]が関わる。逆行性興奮閾値から、このニューロンの軸索の興奮性がエストロゲンにより低下することが示されている。この現象はエストロゲンによるBKチャネル(高コンダクタンスの電位及びCa2+によって活性化されるK+チャネル)の発現増加による[38]。雄、あるいは生直後の性ホルモン投与により雄型の脳を持ちロードーシス行動を示さない雌では、エストロゲンの効果は見られない。ロードーシス行動の促進回路である視床下部腹内側核から中脳中心灰白質への投射軸索においては、エストロゲンにより興奮性が高まり、逆行性興奮閾値が低下する。内側視索前野から腹側被蓋野への投射と同じく、エストロゲンが効くのはロードーシス行動を起す雌あるいは生直後去勢雄に限られる[39]。つまり行動の抑制回路の脱抑制と促進回路の興奮が同時に起こることが、ロードーシス行動の発現に必要である。
母性行動・育仔行動
ラットでは妊娠末期に血中プロゲステロン濃度が低下し、エストロゲンとプロラクチン濃度が上昇すると、分娩後母性行動が現れる。適切な母性行動の発揮には、まず新生仔を忌避し、敵対する行動が抑制される必要がある。未経産の雌ラットのケージに新生仔を入れると、雌はその場所を忌避する[40]。雌マウス内側視索前野中心部の選択的破壊は、この部位に存在するガラニンの脱落により母性行動を消失させる[41]。哺育中の母マウスは内側視索前野・扁桃核のエストロゲン受容体陽性ニューロンを介して、接近してきた新奇雄を激しく攻撃する母性攻撃行動を示す[42]、この行動の一側面として、哺育中の母マウスはリスクを顧みずに仔を守る行動を取る。最近黒田らは脳幹へ投射する内側視索前野のカルシトニン受容体陽性ニューロンとリガンドであるアミリンがこのリスクテーキング行動に関わっていることを示した[43]。雌雄双方で内側視索前野のガラニン作動性ニューロンが育仔に関与する[41]。他方、内側視索前野脳弓周辺部に分布するウロコルチンニューロンが雌雄マウスで新生仔の無視や攻撃といった育仔放棄を誘発する[44]。
睡眠
ヒトを含む哺乳類で内側視索前野の損傷が睡眠の障害を起こす。視索前野の腹外側部に分布するGABAやガラニン作動ニューロンがnon-REM睡眠を起こす[45][46][47]。一方、これらの細胞群の背側と内側に散在するニューロンの破壊はREM睡眠の減少をきたした。Jouvetらは興奮性神経毒によるネコ視索前野ニューロンの破壊が持続的な不眠を起こし、この効果は視床下部後部へのGABA注入で拮抗されることを示した[48]。最近の光遺伝学的研究によれば、マウス内側視索前野腹側部のGABA作動性ニューロンの光刺激により、視床下部後部の隆起乳頭体核のヒスタミン作動ニューロンの抑制によりnon-REM睡眠、REM睡眠を起すとの報告があり[49]、Jouvetら[48]の先行研究と合致する。
体温調節
ウレタン麻酔下のネコの内側視索前野、中でも前交連の前腹側に局所の加温により放電頻度を増す温感受性ニューロンが存在する。反応の特異性は周辺のニューロンが反応しないので特異的であるという中山らの先駆的報告が行われている[50]。ラットでは内側視索前野の片側破壊により散熱の抑制(尾血管の収縮、酸素消費の亢進、体温保持姿勢)による致死的な高体温が急速に生じる。術後強制的な冷却により生存した個体は体温の恒常性を維持できず変温動物となる[51]。。ウレタン麻酔下のウサギでプロゲステロンの全身投与は視索前野の温感受性ニューロンを抑制し、ひいては個体の体温上昇を起す[52]。ヒト女性の排卵と黄体期における約0.5°Cの基礎体温の上昇は[53]この機序による。 。
歩行
発情期の雌ラットは運動量が増す。エストロゲン結晶の局所投与により輪回し行動の増加が見られることから、この効果は内側視索前野を介している[54][55]。歩行の開始とステッピング(リズム取り)は中脳楔状核と脚橋被蓋核吻側に同定されている中脳歩行領域により制御されており [56]、森ら[57]は内側視索前野から中脳歩行領域に至る下行性の歩行調節軸の存在を示した。この部位へのグルタミン酸やピクロトキシンの注入により麻酔下のラットに歩行運動を起こすことができる[58]。Sinnamonの名付けた「視索前野の歩行領域[59]」の電気刺激により、麻酔下のラットが微弱な電流で歩行を開始し、電流強度の増加に伴うステッピング頻度の上昇が起こる。一方、内側視索前野最内側の室傍領域へのカルバコール注入など、アセチルコリン受容体の刺激は歩行運動抑制する[60]。武尾らはラット外側視索前野内側部と内側視索前野のそれぞれから中脳歩行領域への投射を示し、前者がエストロゲンにより興奮性を増すのに対し、後者は抑制されることを見ている[35]。
病態
ヒトの内側視索前野の機能不全に起因する病態については緒方勤 & 田中敏章(2006)に詳しい[61]。
何れも低ゴナドトロピン性性腺機能不全症 (hypogonadotropic hypogonadism または hypothalamic hypogonadism)を示す:
フレーリヒ症候群
Fröhlich syndrom
Fröhlich[62]の症例報告(1901)が初出(英訳は[63])。発症に間脳下垂体系の障害が関わることが示された最初の疾患である。腫瘍や結核性髄膜炎、外傷などによる間脳底部の破壊により飽食感覚が低下して肥胖が起こり,視索前野から視床下部の機能障害によるGnRH分泌の低下により性腺機能が低下する。
カルマン症候群
Kallman syndrom
X染色体上のKAL1遺伝子の変異により嗅上皮に発生したGnRHニューロンの脳内への移動不全により、嗅覚脱失を伴う性腺機能低下症が生じる。X連鎖性の伴性遺伝のため、女性ではまれである(出生男子の1万人に1人,出生女子の5万人に1人;1型Kallman症候)。常染色体8p21-22上のFGFR1遺伝子の異常は口唇口蓋裂を伴う2型のカルマン症候群を生じる。
キスペプチン受容体異常
思春期が発来せず、低ゴナドトロピン性性腺機能不全を示すヒト症例がGnRHニューロン膜上のキスペプチン受容体であるGPR54の異常によることが二つのグループにより同時期に報じられ、ノックアウトマウスの作成で確かめられた[25][26]。
バルデー・ビードル症候群
Bardet-Biedl syndrom
性腺機能低下に加え、肥満、知能障害、網膜色素変性症、慢性腎障害、多指症・合指症を6主徴とする常染色体劣性疾患。発症機転に間脳下垂体の関与が示唆されている。多くは小児期に診断される。
関連項目
参考文献
- ↑
Orikasa, C., Kondo, Y., Usui, S., & Sakuma, Y. (2010).
Similar numbers of neurons are generated in the male and female rat preoptic area in utero. Neuroscience research, 68(1), 9-14. [PubMed:20538023] [WorldCat] [DOI] - ↑
CLARK, W.E., & MEYER, M. (1950).
Anatomical relationships between the cerebral cortex and the hypothalamus. British medical bulletin, 6(4), 341-5. [PubMed:15420400] [WorldCat] [DOI] - ↑
Puelles, L., & Rubenstein, J.L. (2003).
Forebrain gene expression domains and the evolving prosomeric model. Trends in neurosciences, 26(9), 469-76. [PubMed:12948657] [WorldCat] [DOI] - ↑
Blackshaw, S., Scholpp, S., Placzek, M., Ingraham, H., Simerly, R., & Shimogori, T. (2010).
Molecular pathways controlling development of thalamus and hypothalamus: from neural specification to circuit formation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(45), 14925-30. [PubMed:21068293] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1
Schwanzel-Fukuda, M., & Pfaff, D.W. (1989).
Origin of luteinizing hormone-releasing hormone neurons. Nature, 338(6211), 161-4. [PubMed:2645530] [WorldCat] [DOI] - ↑
Schwanzel-Fukuda, M., Bick, D., & Pfaff, D.W. (1989).
Luteinizing hormone-releasing hormone (LHRH)-expressing cells do not migrate normally in an inherited hypogonadal (Kallmann) syndrome. Brain research. Molecular brain research, 6(4), 311-26. [PubMed:2687610] [WorldCat] [DOI] - ↑ SIMERLY, R. B. (2004).
Anatomical substrates of hypothalamic integration. In: PAXINOS, G. (ed.) The Rat Nervous System. San Diego: Academic Press. - ↑
Gorski, R.A., Gordon, J.H., Shryne, J.E., & Southam, A.M. (1978).
Evidence for a morphological sex difference within the medial preoptic area of the rat brain. Brain research, 148(2), 333-46. [PubMed:656937] [WorldCat] [DOI] - ↑ 9.0 9.1
Orikasa, C., Kondo, Y., Hayashi, S., McEwen, B.S., & Sakuma, Y. (2002).
Sexually dimorphic expression of estrogen receptor beta in the anteroventral periventricular nucleus of the rat preoptic area: implication in luteinizing hormone surge. Proceedings of the National Academy of Sciences of the United States of America, 99(5), 3306-11. [PubMed:11854469] [PMC] [WorldCat] [DOI] - ↑ 10.0 10.1
Orikasa, C., & Sakuma, Y. (2010).
Estrogen configures sexual dimorphism in the preoptic area of C57BL/6J and ddN strains of mice. The Journal of comparative neurology, 518(17), 3618-29. [PubMed:20593361] [WorldCat] [DOI] - ↑
Young, J.K. (1982).
A comparison of hypothalami of rats and mice: lack of gross sexual dimorphism in the mouse. Brain research, 239(1), 233-9. [PubMed:7093678] [WorldCat] [DOI] - ↑ Allen Brain Atlas
- ↑
Simerly, R.B., & Swanson, L.W. (1986).
The organization of neural inputs to the medial preoptic nucleus of the rat. The Journal of comparative neurology, 246(3), 312-42. [PubMed:3517086] [WorldCat] [DOI] - ↑
Swanson, L.W. (2000).
The neuroanatomy revolution of the 1970s and the hypothalamus. Brain research bulletin, 50(5-6), 397. [PubMed:10643453] [WorldCat] [DOI] - ↑ Crosby, E. C. & Showers, M. J. C. (1969).
Comparative anatomy of the preoptic and hypothalamic areas. In: Haymaker, W., Anderson, E. & Nauta, W. J. H. (eds.) The Hypothalamus. Springfield, Il: Charles C. Thomas. - ↑
Saper, C.B., & Levisohn, D. (1983).
Afferent connections of the median preoptic nucleus in the rat: anatomical evidence for a cardiovascular integrative mechanism in the anteroventral third ventricular (AV3V) region. Brain research, 288(1-2), 21-31. [PubMed:6198025] [WorldCat] [DOI] - ↑ Ranson, S. W., Kabat, H. & Magoun, H. W. (1935).
Autonomic responses to electrical stimulation of hypothalamus, preoptic region and septum. Archives of Neurology & Psychiatry, 33, 467-77. - ↑
Hou, X.H., Hyun, M., Taranda, J., Huang, K.W., Todd, E., Feng, D., ..., & Sabatini, B.L. (2016).
Central Control Circuit for Context-Dependent Micturition. Cell, 167(1), 73-86.e12. [PubMed:27662084] [PMC] [WorldCat] [DOI] - ↑
de Groat, W.C., Araki, I., Vizzard, M.A., Yoshiyama, M., Yoshimura, N., Sugaya, K., ..., & Roppolo, J.R. (1998).
Developmental and injury induced plasticity in the micturition reflex pathway. Behavioural brain research, 92(2), 127-40. [PubMed:9638955] [WorldCat] [DOI] - ↑
Klop, E.M., Kuipers, R., & Mouton, L.J. (2009).
Direct projections from the sacral spinal cord to the medial preoptic area in cat and guinea pig. Neuroscience, 164(4), 1732-43. [PubMed:19733632] [WorldCat] [DOI] - ↑
Herbison, A.E., Heavens, R.P., Dye, S., & Dyer, R.G. (1991).
Acute action of oestrogen on medial preoptic gamma-aminobutyric Acid neurons: correlation with oestrogen negative feedback on luteinizing hormone secretion. Journal of neuroendocrinology, 3(1), 101-6. [PubMed:19215454] [WorldCat] [DOI] - ↑
Smith, H.R., & Pang, K.C. (2005).
Orexin-saporin lesions of the medial septum impair spatial memory. Neuroscience, 132(2), 261-71. [PubMed:15802181] [WorldCat] [DOI] - ↑
Herbison, A.E. (1997).
Estrogen regulation of GABA transmission in rat preoptic area. Brain research bulletin, 44(4), 321-6. [PubMed:9370195] [WorldCat] [DOI] - ↑
Watanabe, M., Sakuma, Y., & Kato, M. (2009).
GABAA receptors mediate excitation in adult rat GnRH neurons. Biology of reproduction, 81(2), 327-32. [PubMed:19357366] [WorldCat] [DOI] - ↑ 25.0 25.1
de Roux, N., Genin, E., Carel, J.C., Matsuda, F., Chaussain, J.L., & Milgrom, E. (2003).
Hypogonadotropic hypogonadism due to loss of function of the KiSS1-derived peptide receptor GPR54. Proceedings of the National Academy of Sciences of the United States of America, 100(19), 10972-6. [PubMed:12944565] [PMC] [WorldCat] [DOI] - ↑ 26.0 26.1
Seminara, S.B., Messager, S., Chatzidaki, E.E., Thresher, R.R., Acierno, J.S., Shagoury, J.K., ..., & Colledge, W.H. (2003).
The GPR54 gene as a regulator of puberty. The New England journal of medicine, 349(17), 1614-27. [PubMed:14573733] [WorldCat] [DOI] - ↑
Oakley, A.E., Clifton, D.K., & Steiner, R.A. (2009).
Kisspeptin signaling in the brain. Endocrine reviews, 30(6), 713-43. [PubMed:19770291] [PMC] [WorldCat] [DOI] - ↑
Parhar, I.S., Ogawa, S., & Sakuma, Y. (2004).
Laser-captured single digoxigenin-labeled neurons of gonadotropin-releasing hormone types reveal a novel G protein-coupled receptor (Gpr54) during maturation in cichlid fish. Endocrinology, 145(8), 3613-8. [PubMed:15155576] [WorldCat] [DOI] - ↑
Wakabayashi, Y., Nakada, T., Murata, K., Ohkura, S., Mogi, K., Navarro, V.M., ..., & Okamura, H. (2010).
Neurokinin B and dynorphin A in kisspeptin neurons of the arcuate nucleus participate in generation of periodic oscillation of neural activity driving pulsatile gonadotropin-releasing hormone secretion in the goat. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(8), 3124-32. [PubMed:20181609] [PMC] [WorldCat] [DOI] - ↑
Erskine, M.S. (1989).
Solicitation behavior in the estrous female rat: a review. Hormones and behavior, 23(4), 473-502. [PubMed:2691387] [WorldCat] [DOI] - ↑
Agmo, A. (1997).
Male rat sexual behavior. Brain research. Brain research protocols, 1(2), 203-9. [PubMed:9385085] [WorldCat] [DOI] - ↑
LARSSON, K., & HEIMER, L. (1964).
MATING BEHAVIOUR OF MALE RATS AFTER LESIONS IN THE PREOPTIC AREA. Nature, 202, 413-4. [PubMed:14152848] [WorldCat] [DOI] - ↑
Whitney, J.F. (1986).
Effect of medial preoptic lesions on sexual behavior of female rats is determined by test situation. Behavioral neuroscience, 100(2), 230-5. [PubMed:3964425] [WorldCat] [DOI] - ↑
Hoshina, Y., Takeo, T., Nakano, K., Sato, T., & Sakuma, Y. (1994).
Axon-sparing lesion of the preoptic area enhances receptivity and diminishes proceptivity among components of female rat sexual behavior. Behavioural brain research, 61(2), 197-204. [PubMed:8037867] [WorldCat] [DOI] - ↑ 35.0 35.1 35.2
Takeo, T., Chiba, Y., & Sakuma, Y. (1993).
Suppression of the lordosis reflex of female rats by efferents of the medial preoptic area. Physiology & behavior, 53(5), 831-8. [PubMed:8511198] [WorldCat] [DOI] - ↑
Hasegawa, T., Takeo, T., Akitsu, H., Hoshina, Y., & Sakuma, Y. (1991).
Interruption of the lordosis reflex of female rats by ventral midbrain stimulation. Physiology & behavior, 50(5), 1033-8. [PubMed:1805265] [WorldCat] [DOI] - ↑
Hasegawa, T., & Sakuma, Y. (1993).
Developmental effect of testosterone on estrogen sensitivity of the rat preoptic neurons with axons to the ventral tegmental area. Brain research, 611(1), 1-6. [PubMed:8518936] [WorldCat] [DOI] - ↑
Nishimura, I., Ui-Tei, K., Saigo, K., Ishii, H., Sakuma, Y., & Kato, M. (2008).
17beta-estradiol at physiological concentrations augments Ca(2+) -activated K+ currents via estrogen receptor beta in the gonadotropin-releasing hormone neuronal cell line GT1-7. Endocrinology, 149(2), 774-82. [PubMed:17962348] [WorldCat] [DOI] - ↑
Sakuma, Y. (1984).
Influences of neonatal gonadectomy or androgen exposure on the sexual differentiation of the rat ventromedial hypothalamus. The Journal of physiology, 349, 273-86. [PubMed:6737296] [PMC] [WorldCat] [DOI] - ↑
Numan, M., & Sheehan, T.P. (1997).
Neuroanatomical circuitry for mammalian maternal behavior. Annals of the New York Academy of Sciences, 807, 101-25. [PubMed:9071346] [WorldCat] [DOI] - ↑ 41.0 41.1
Wu, Z., Autry, A.E., Bergan, J.F., Watabe-Uchida, M., & Dulac, C.G. (2014).
Galanin neurons in the medial preoptic area govern parental behaviour. Nature, 509(7500), 325-30. [PubMed:24828191] [PMC] [WorldCat] [DOI] - ↑
Ogawa, S., Choleris, E., & Pfaff, D. (2004).
Genetic influences on aggressive behaviors and arousability in animals. Annals of the New York Academy of Sciences, 1036, 257-66. [PubMed:15817742] [WorldCat] [DOI] - ↑
Yoshihara, C., Tokita, K., Maruyama, T., Kaneko, M., Tsuneoka, Y., Fukumitsu, K., ..., & Kuroda, K.O. (2021).
Calcitonin receptor signaling in the medial preoptic area enables risk-taking maternal care. Cell reports, 35(9), 109204. [PubMed:34077719] [WorldCat] [DOI] - ↑
Autry, A.E., Wu, Z., Kapoor, V., Kohl, J., Bambah-Mukku, D., Rubinstein, N.D., ..., & Dulac, C. (2021).
Urocortin-3 neurons in the mouse perifornical area promote infant-directed neglect and aggression. eLife, 10. [PubMed:34423776] [PMC] [WorldCat] [DOI] - ↑
Sherin, J.E., Shiromani, P.J., McCarley, R.W., & Saper, C.B. (1996).
Activation of ventrolateral preoptic neurons during sleep. Science (New York, N.Y.), 271(5246), 216-9. [PubMed:8539624] [WorldCat] [DOI] - ↑
Gong, H., McGinty, D., Guzman-Marin, R., Chew, K.T., Stewart, D., & Szymusiak, R. (2004).
Activation of c-fos in GABAergic neurones in the preoptic area during sleep and in response to sleep deprivation. The Journal of physiology, 556(Pt 3), 935-46. [PubMed:14966298] [PMC] [WorldCat] [DOI] - ↑
Takahashi, K., Lin, J.S., & Sakai, K. (2009).
Characterization and mapping of sleep-waking specific neurons in the basal forebrain and preoptic hypothalamus in mice. Neuroscience, 161(1), 269-92. [PubMed:19285545] [WorldCat] [DOI] - ↑ 48.0 48.1
Sallanon, M., Denoyer, M., Kitahama, K., Aubert, C., Gay, N., & Jouvet, M. (1989).
Long-lasting insomnia induced by preoptic neuron lesions and its transient reversal by muscimol injection into the posterior hypothalamus in the cat. Neuroscience, 32(3), 669-83. [PubMed:2601839] [WorldCat] [DOI] - ↑
Chung, S., Weber, F., Zhong, P., Tan, C.L., Nguyen, T.N., Beier, K.T., ..., & Dan, Y. (2017).
Identification of preoptic sleep neurons using retrograde labelling and gene profiling. Nature, 545(7655), 477-481. [PubMed:28514446] [PMC] [WorldCat] [DOI] - ↑
Hardy, J.D., Hammel, H.T., & Nakayama, T. (1962).
Observations on the Physiological Thermostat in Homoiotherms. Science (New York, N.Y.), 136(3513), 326. [PubMed:17745919] [WorldCat] [DOI] - ↑
Szymusiak, R., & Satinoff, E. (1982).
Acute thermoregulatory effects of unilateral electrolytic lesions of the medial and lateral preoptic area in rats. Physiology & behavior, 28(1), 161-70. [PubMed:7079312] [WorldCat] [DOI] - ↑
Nakayama, T., Suzuki, M., & Ishizuka, N. (1975).
Action of progesterone on preoptic thermosensitive neurones. Nature, 258(5530), 80. [PubMed:1186885] [WorldCat] [DOI] - ↑
BUXTON, C.L., & ATKINSON, W.B. (1948).
Hormonal factors involved in the regulation of basal body temperature during the menstrual cycle and pregnancy. The Journal of clinical endocrinology and metabolism, 8(7), 585. [PubMed:18939188] [WorldCat] - ↑
Takeo, T., & Sakuma, Y. (1995).
Diametrically opposite effects of estrogen on the excitability of female rat medial and lateral preoptic neurons with axons to the midbrain locomotor region. Neuroscience research, 22(1), 73-80. [PubMed:7792083] [WorldCat] [DOI] - ↑
Fahrbach, S.E., Meisel, R.L., & Pfaff, D.W. (1985).
Preoptic implants of estradiol increase wheel running but not the open field activity of female rats. Physiology & behavior, 35(6), 985-92. [PubMed:4095192] [WorldCat] [DOI] - ↑ SHIK, M. L., SEVERIN, F. V. & ORLOVSKII, G. N. (1966).
Control of walking and running by means of electrical stimulation of the midbrain. Biofizyka (English translation), 11, 756-65. - ↑ MORI, S., MATSUYAMA, K., KOHYAMA, J., KOBAYASHI, Y. & TAKAKUSAKI, K. (1992).
Neuronal constituents of postural and locomotor control systems and their interactions in cats. Brain Dev., 14 Suppl., S109-S120. - ↑
Sinnamon, H.M. (1987).
Glutamate and picrotoxin injections into the preoptic basal forebrain initiate locomotion in the anesthetized rat. Brain research, 400(2), 270-7. [PubMed:2880639] [WorldCat] [DOI] - ↑
Sinnamon, H.M. (1992).
Microstimulation mapping of the basal forebrain in the anesthetized rat: the "preoptic locomotor region". Neuroscience, 50(1), 197-207. [PubMed:1407556] [WorldCat] [DOI] - ↑
Brudzynski, S.M., & Mogenson, G.J. (1986).
Decrease of locomotor activity by injections of carbachol into the anterior hypothalamic/preoptic area of the rat. Brain research, 376(1), 38-46. [PubMed:3719372] [WorldCat] [DOI] - ↑ 緒方勤 & 田中敏章. (2006).
低ゴナドトロピン性性腺機能不全:分子遺伝学的および臨床的側面. 日本生殖内分泌学会雑誌, 11, 11-16. - ↑ Frölich, A. (1901).
Ein fall von Tumor der Hypophysis cerebri ohne Akromegalie, Wiener klinische Rundschau, 15:883-906. - ↑
Bruch, H. (1993).
The Fröhlich syndrome: report of the original case. 1939. Obesity research, 1(4), 329-31. [PubMed:16350582] [WorldCat] [DOI]