「味蕾」の版間の差分
Junko kurahashi (トーク | 投稿記録) 細 (→存在部位) |
Junko kurahashi (トーク | 投稿記録) 細編集の要約なし |
||
| (2人の利用者による、間の7版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">吉田 竜介</font><br> | <font size="+1">吉田 竜介</font><br> | ||
''九州大学大学院歯学研究院口腔機能解析学分野、九州大学大学院歯学研究院OBT研究センター''<br> | ''九州大学大学院歯学研究院口腔機能解析学分野、九州大学大学院歯学研究院OBT研究センター''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2018年1月23日 原稿完成日:2018年4月26日<br> | ||
担当編集委員:[http://researchmap.jp/ichirofujita 藤田 一郎](大阪大学 大学院生命機能研究科)<br> | 担当編集委員:[http://researchmap.jp/ichirofujita 藤田 一郎](大阪大学 大学院生命機能研究科)<br> | ||
</div> | </div> | ||
| 12行目: | 12行目: | ||
== 存在部位== | == 存在部位== | ||
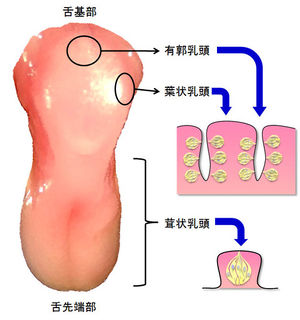
舌表面には乳頭と呼ばれる多数の小突起が存在し、形態や存在部位により4種([[茸状乳頭]](じじょうにゅうとう)、[[有郭乳頭]]、[[葉状乳頭]]、[[糸状乳頭]])に分類される。味蕾は舌上の3種の[[乳頭]](茸状乳頭、有郭乳頭、葉状乳頭)に存在するが、糸状乳頭には存在しない('''図1''')。また味蕾は、[[軟口蓋]]、[[喉頭蓋]]、[[咽頭]]などにも存在する。 | 舌表面には乳頭と呼ばれる多数の小突起が存在し、形態や存在部位により4種([[茸状乳頭]](じじょうにゅうとう)、[[有郭乳頭]]、[[葉状乳頭]]、[[糸状乳頭]])に分類される。味蕾は舌上の3種の[[乳頭]](茸状乳頭、有郭乳頭、葉状乳頭)に存在するが、糸状乳頭には存在しない('''図1''')。また味蕾は、[[軟口蓋]]、[[喉頭蓋]]、[[咽頭]]などにも存在する。 | ||
[[ファイル: | [[ファイル:mirai_rev1-Fig1.jpg|サムネイル|300px|'''図1. マウス舌上における味蕾の存在位置'''<br>舌上では味蕾は茸状、有郭、葉状乳頭に存在する。有郭、葉状乳頭では、溝の壁面に沿って多くの味蕾が存在する。]] | ||
=== 茸状乳頭 === | === 茸状乳頭 === | ||
| 27行目: | 27行目: | ||
== 味蕾細胞 == | == 味蕾細胞 == | ||
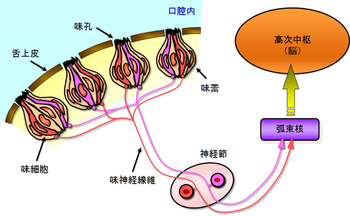
[[ファイル:味蕾図2.jpg|サムネイル|300px|''' | [[ファイル:mirai_fig2.png|サムネイル|350px|'''図2. 末梢味覚伝導路の模式図'''<br>味蕾内に存在する味細胞は味孔を介し味物質を検知する。その情報は味神経線維へと伝達され、さらに高次への中枢へと伝達される。]] | ||
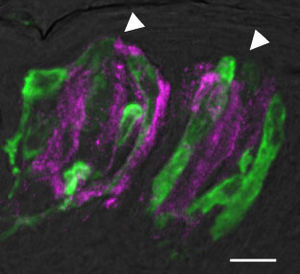
各味蕾の中には、その長軸方向に沿って50~150個程度の細胞が存在し、味孔を介して口腔内の化学物質(味物質)と接触する。これら細胞は電子顕微鏡像より[[I型細胞|I]]、[[II型細胞|II]]、[[III型細胞|III型]]に分類され<ref>'''Murray R.'''<br>The ultrastructure of taste buds.<br>In: Friedemann, I. (Ed.)The Ultrastructure of Sensory Organs<br>''North-Holland'', Amsterdam, pp. 1-81, 1973</ref>、基底部には幹細胞と考えられる[[IV型細胞]]が存在する。味蕾細胞のターンオーバーは早く、約10日とされる<ref><pubmed>5884625</pubmed></ref> | [[ファイル:味蕾図2.jpg|サムネイル|300px|'''図3. マウス有郭乳頭の薄切[[切片]]像'''<br>緑色の細胞はPLCβ2を発現する味細胞(II型細胞)。マゼンタの細胞はCAR4を発現する細胞(III型細胞)。白色の矢頭は味孔の位置を示す。バーは10μm。]] | ||
各味蕾の中には、その長軸方向に沿って50~150個程度の細胞が存在し、味孔を介して口腔内の化学物質(味物質)と接触する。これら細胞は電子顕微鏡像より[[I型細胞|I]]、[[II型細胞|II]]、[[III型細胞|III型]]に分類され<ref>'''Murray R.'''<br>The ultrastructure of taste buds.<br>In: Friedemann, I. (Ed.)The Ultrastructure of Sensory Organs<br>''North-Holland'', Amsterdam, pp. 1-81, 1973</ref>、基底部には幹細胞と考えられる[[IV型細胞]]が存在する。味蕾細胞のターンオーバーは早く、約10日とされる<ref><pubmed>5884625</pubmed></ref>('''図2'''、'''図3''')。 | |||
=== I型細胞 === | === I型細胞 === | ||
電子顕微鏡像で細胞質の部分が暗く見えることから'''暗調細胞'''とも呼ばれる。味蕾の中ではおよそ50~60%程度の割合を占める。 | 電子顕微鏡像で細胞質の部分が暗く見えることから'''暗調細胞'''とも呼ばれる。味蕾の中ではおよそ50~60%程度の割合を占める。 | ||
味孔側には長い[[微絨毛]]が存在し、湾入した核を持つ。[[ | 味孔側には長い[[微絨毛]]が存在し、湾入した核を持つ。[[グルタミン酸トランスポーター|グルタミン酸・アスパラギン酸トランスポーター]] ([[glutamate-aspartate transporter]]; [[GLAST]])<ref><pubmed>10998100</pubmed></ref>や[[エクトヌクレオチド三リン酸ジホスホヒドロラーゼ‐2]] ([[ectonucleoside triphosphate diphosphohydrolase-2]]; [[ecto-ATPase]])<ref><pubmed>16680780</pubmed></ref>などを発現し、神経系における[[グリア細胞]]様の機能を持つと考えられる。また形態的にはII型細胞やIII型細胞を包むように存在する様子が見られる。 | ||
I型細胞には[[塩味受容体]]として機能する[[ | I型細胞には[[塩味受容体]]として機能する[[上皮性ナトリウムチャネル]]([[ENaC]])が存在するという報告<ref><pubmed>18171468</pubmed></ref>もあるが、I型細胞が塩味受容細胞として機能するかは不明である。 | ||
=== II型細胞 === | === II型細胞 === | ||
| 42行目: | 43行目: | ||
味孔側には短い微絨毛が存在し、大きな丸い核を持つ。[[甘味受容体|甘味]]、[[苦味受容体|苦味]]、[[うま味受容体|うま味]]の受容に関連する遺伝子群([[ガストドューシン]], [[ホスホリパーゼCβ2]], [[transient receptor potential channel M5]] ([[TRPM5]])など)を発現し<ref name=ref14681927><pubmed>14681927</pubmed></ref><ref><pubmed>10940948</pubmed></ref><ref><pubmed>12368808</pubmed></ref>、これらの味質の受容を担うと考えられる。実際II型細胞は甘味、苦味またはうま味刺激に対し最も強い応答を示す<ref name=ref17913917><pubmed>17913917</pubmed></ref><ref name=ref12368808 ><pubmed>12368808</pubmed></ref>。 | 味孔側には短い微絨毛が存在し、大きな丸い核を持つ。[[甘味受容体|甘味]]、[[苦味受容体|苦味]]、[[うま味受容体|うま味]]の受容に関連する遺伝子群([[ガストドューシン]], [[ホスホリパーゼCβ2]], [[transient receptor potential channel M5]] ([[TRPM5]])など)を発現し<ref name=ref14681927><pubmed>14681927</pubmed></ref><ref><pubmed>10940948</pubmed></ref><ref><pubmed>12368808</pubmed></ref>、これらの味質の受容を担うと考えられる。実際II型細胞は甘味、苦味またはうま味刺激に対し最も強い応答を示す<ref name=ref17913917><pubmed>17913917</pubmed></ref><ref name=ref12368808 ><pubmed>12368808</pubmed></ref>。 | ||
II型細胞には明確な[[シナプス]]構造が見られないが、神経線維と非常に近接した部位に[[subsurface cisternae]]と呼ばれる構造が見られ<ref name=ref14681927 /> | II型細胞には明確な[[シナプス]]構造が見られないが、神経線維と非常に近接した部位に[[subsurface cisternae]]と呼ばれる構造が見られ<ref name=ref14681927 />、ここで神経線維への情報伝達が行われると考えられる。II型細胞は味刺激に応じ[[活動電位]]を生じ、[[calcium homeostasis modulator 1]] ([[CALHM1]]、[[ATP透過性イオンチャネル]])や[[ヘミチャネル]](1~2 nmの孔を持つ六角柱状のタンパク質複合体)を通じ[[ATP]]を放出する<ref><pubmed>17389364</pubmed></ref><ref><pubmed>20519578</pubmed></ref><ref><pubmed>23467090</pubmed></ref>。放出された[[ATP]]は神経線維側に存在する受容体([[P2X2受容体|P2X2]]/[[P2X3受容体]])を活性化<ref><pubmed>16322458</pubmed></ref>することでII型細胞から神経線維へシナプスを介さずに情報が伝達されると考えられる。[[skn-1a]][[遺伝子欠損マウス]]ではII型細胞が消失することから<ref><pubmed>21572433</pubmed></ref>、[[skn-1a]]がII型細胞の[[分化]]や維持に重要な機能を持つと考えられる。 | ||
=== III型細胞 === | === III型細胞 === | ||
| 51行目: | 52行目: | ||
III型細胞は[[酸味受容体]]候補遺伝子である[[polycystic kidney disease 2L1]] ([[PKD2L1]])を発現し<ref><pubmed>18156604</pubmed></ref>、実際に多くのIII型細胞は酸味刺激に対し応答を示す12)。また多種の味質に対し応答を示すIII型細胞も存在する。さらに、III型細胞が水の受容に関与することも示されている<ref><pubmed>28553944</pubmed></ref>)。 | III型細胞は[[酸味受容体]]候補遺伝子である[[polycystic kidney disease 2L1]] ([[PKD2L1]])を発現し<ref><pubmed>18156604</pubmed></ref>、実際に多くのIII型細胞は酸味刺激に対し応答を示す12)。また多種の味質に対し応答を示すIII型細胞も存在する。さらに、III型細胞が水の受容に関与することも示されている<ref><pubmed>28553944</pubmed></ref>)。 | ||
味神経線維への情報伝達はシナプスを介すると考えられ、酸刺激によりセロトニンや[[ノルエピネフリン]]などの神経伝達物質が放出されることが示されているが<ref><pubmed>15673664</pubmed></ref><ref><pubmed>19052199</pubmed></ref>、実際にどの神経伝達物質が機能するかについては明らかとなっていない。 | |||
=== IV型細胞 === | === IV型細胞 === | ||
2018年4月26日 (木) 09:38時点における最新版
吉田 竜介
九州大学大学院歯学研究院口腔機能解析学分野、九州大学大学院歯学研究院OBT研究センター
DOI:10.14931/bsd.7487 原稿受付日:2018年1月23日 原稿完成日:2018年4月26日
担当編集委員:藤田 一郎(大阪大学 大学院生命機能研究科)
英語:taste bud 独語:Geschmacksknospe 仏語:bourgeon du goût
味蕾は主に舌、軟口蓋などに存在する蕾状の器官で味覚の受容を担う。各味蕾はおよそ50~150個の様々な性質を持つ細胞から構成され、それらの一部が味覚受容体を発現し、味刺激に応答する味受容細胞(味細胞)として機能する。味蕾内の細胞は上皮細胞由来だが、味刺激に応答を示す味細胞は電位依存性Na+チャネルを発現し活動電位を発生することから神経細胞様の性質を持つ[1]。また、味蕾の維持には神経支配が必要で、支配神経を挫滅・切断すると味蕾は消失する[2]。本稿ではヒトおよびげっ歯類(マウス、ラット)の味蕾について概説する。
存在部位
舌表面には乳頭と呼ばれる多数の小突起が存在し、形態や存在部位により4種(茸状乳頭(じじょうにゅうとう)、有郭乳頭、葉状乳頭、糸状乳頭)に分類される。味蕾は舌上の3種の乳頭(茸状乳頭、有郭乳頭、葉状乳頭)に存在するが、糸状乳頭には存在しない(図1)。また味蕾は、軟口蓋、喉頭蓋、咽頭などにも存在する。
茸状乳頭
茸状乳頭(じじょう)は舌の前方部に点在し、舌の先端部での密度が高い。各茸状乳頭にはげっ歯類では1つ、ヒトでは1~数個の味蕾が存在する。茸状乳頭味蕾は鼓索神経により支配される。
有郭乳頭
有郭乳頭は舌後方部に存在する大きな乳頭で、げっ歯類では1個、ヒトでは7~12個程度が認められる。各有郭乳頭の壁面に沿って非常に多くの味蕾が存在する。有郭乳頭味蕾は舌咽神経により支配される。
葉状乳頭
葉状乳頭は舌後方の側面に存在し、複数の溝で構成される。葉状乳頭味蕾はこの溝の壁面に沿って多数存在する。個々の葉状乳頭味蕾は鼓索神経(前方部)、または舌咽神経(後方部)のいずれかにより支配される。
軟口蓋
軟口蓋は口蓋後方の柔らかい部分であり、ここにも味蕾が点在する。軟口蓋味蕾は上喉頭神経により支配される。
味蕾細胞
各味蕾の中には、その長軸方向に沿って50~150個程度の細胞が存在し、味孔を介して口腔内の化学物質(味物質)と接触する。これら細胞は電子顕微鏡像よりI、II、III型に分類され[3]、基底部には幹細胞と考えられるIV型細胞が存在する。味蕾細胞のターンオーバーは早く、約10日とされる[4](図2、図3)。
I型細胞
電子顕微鏡像で細胞質の部分が暗く見えることから暗調細胞とも呼ばれる。味蕾の中ではおよそ50~60%程度の割合を占める。
味孔側には長い微絨毛が存在し、湾入した核を持つ。グルタミン酸・アスパラギン酸トランスポーター (glutamate-aspartate transporter; GLAST)[5]やエクトヌクレオチド三リン酸ジホスホヒドロラーゼ‐2 (ectonucleoside triphosphate diphosphohydrolase-2; ecto-ATPase)[6]などを発現し、神経系におけるグリア細胞様の機能を持つと考えられる。また形態的にはII型細胞やIII型細胞を包むように存在する様子が見られる。
I型細胞には塩味受容体として機能する上皮性ナトリウムチャネル(ENaC)が存在するという報告[7]もあるが、I型細胞が塩味受容細胞として機能するかは不明である。
II型細胞
電子顕微鏡像では細胞質の部分が明るく見えることから明調細胞とも呼ばれる。味蕾の中では20~30%程度の割合を占める。
味孔側には短い微絨毛が存在し、大きな丸い核を持つ。甘味、苦味、うま味の受容に関連する遺伝子群(ガストドューシン, ホスホリパーゼCβ2, transient receptor potential channel M5 (TRPM5)など)を発現し[8][9][10]、これらの味質の受容を担うと考えられる。実際II型細胞は甘味、苦味またはうま味刺激に対し最も強い応答を示す[11][12]。
II型細胞には明確なシナプス構造が見られないが、神経線維と非常に近接した部位にsubsurface cisternaeと呼ばれる構造が見られ[8]、ここで神経線維への情報伝達が行われると考えられる。II型細胞は味刺激に応じ活動電位を生じ、calcium homeostasis modulator 1 (CALHM1、ATP透過性イオンチャネル)やヘミチャネル(1~2 nmの孔を持つ六角柱状のタンパク質複合体)を通じATPを放出する[13][14][15]。放出されたATPは神経線維側に存在する受容体(P2X2/P2X3受容体)を活性化[16]することでII型細胞から神経線維へシナプスを介さずに情報が伝達されると考えられる。skn-1a遺伝子欠損マウスではII型細胞が消失することから[17]、skn-1aがII型細胞の分化や維持に重要な機能を持つと考えられる。
III型細胞
電子顕微鏡像では中間調を示し中間調細胞とも呼ばれる。味蕾の中では10~20%程度の割合を占める。
味孔側には1本の厚い突起が見られ、湾入した核を持つ。また神経線維との間に明確なシナプス構造が見られ、synaptosomal-associated protein 25 kD (SNAP25), neural cell adhesion molecule (NCAM), 芳香族アミノ酸脱炭酸酵素 (aromatic L-amino acid decarboxylase, AADC), グルタミン酸脱炭酸酵素 (glutamic acid decarboxylase, GAD67), セロトニンなど、シナプス伝達や神経伝達物質の合成に関与する分子の発現も見られる[18][19]。
III型細胞は酸味受容体候補遺伝子であるpolycystic kidney disease 2L1 (PKD2L1)を発現し[20]、実際に多くのIII型細胞は酸味刺激に対し応答を示す12)。また多種の味質に対し応答を示すIII型細胞も存在する。さらに、III型細胞が水の受容に関与することも示されている[21])。
味神経線維への情報伝達はシナプスを介すると考えられ、酸刺激によりセロトニンやノルエピネフリンなどの神経伝達物質が放出されることが示されているが[22][23]、実際にどの神経伝達物質が機能するかについては明らかとなっていない。
IV型細胞
味蕾の基底部に存在し、味蕾細胞の前駆細胞であると考えられている。
味細胞の応答性
味覚受容体の発現を検索した研究により、甘味、うま味、苦味、酸味、塩味の受容体はそれぞれ別々の味細胞に発現することが示され[24][25][26][27]、味細胞には味質特異性があることを示唆している。
しかし、マウス味細胞から味応答を記録した場合、一部の味細胞は明らかに複数の味質に対し応答する[1][11][12]。同様に、味神経線維や神経節細胞においても複数の味質に対し応答するものが存在することから[28][29]、実際には一部の味細胞は多種の味質に対し応答し得ると考えられる。以下に、これまでに明らかとなっているマウス味細胞の応答性について概説する。
甘味応答味細胞
甘味刺激に最大応答を示す味細胞は主にII型細胞に見られる。基本味刺激への応答特性を見ると、甘味にのみ特異的に応答するタイプと、うま味にも応答するタイプが見られる。後者は甘味、うま味受容体コンポーネントであるT1R1、T1R2、T1R3を全て発現する味細胞であると考えられる。また、甘味応答細胞はマウスの甘味抑制物質であるグルマリンに対する感受性により2群に分けられる[30]。甘味応答細胞は様々な甘味物質(シュクロース、グルコース等の糖類、サッカリンなどの人工甘味料)に対し応答する。
うま味応答細胞
うま味応答細胞は主にII型細胞に見られる。うま味応答細胞は大きくうま味特異的応答を示すタイプと、うま味と甘味に応答するタイプに分けられる。うま味はグルタミン酸と核酸の間で相乗効果が生じることが知られているが、この相乗効果の有無により更に2群に分類され、全部で4つのタイプに分類できる[31]。
うま味刺激として用いられるグルタミン酸ナトリウムやグルタミン酸カリウムはナトリウムやカリウムのイオン成分も有するため、電解質に応答する味細胞もこれらの刺激に応答を示す。
苦味応答細胞
苦味応答細胞は主にII型細胞に見られ、苦味に特異的に応答するものが多い。様々な物質が苦味を呈するが、マウス茸状乳頭では様々な苦味刺激に対し応答するものが多い[32]。ラットの有郭乳頭では多くの苦味応答細胞が特定の苦味物質にのみ応答することが示されている[33]。
酸味応答細胞
酸味応答細胞は主にIII型細胞に見られる。酸味に特異的に応答するタイプと様々な電解質に応答するタイプに分けられる。酸味応答細胞は様々な酸味物質に対し応答を示し、同じpHであれば強酸(HClなど)よりも弱酸(酢酸、クエン酸など)に対しより大きい応答を示す[12]。
塩味応答細胞
塩味応答細胞はNaClに対し特異的応答を示すタイプと、様々な電解質(HCl, KClなど)に応答を示すタイプに分けられる。前者はENaCの阻害剤であるアミロライドにより応答が抑制されるが、後者はアミロライドに感受性はない[34]。電解質に応答するタイプの一部はIII型細胞であると考えられるが、NaClに特異的応答を示す味細胞の細胞型は不明である。
細胞間コミュニケーション
味蕾内で放出される様々な伝達物質が自己分泌(オートクライン)、または傍分泌(パラクライン)様に働き、味蕾内での味覚情報のプロセシングに関与する可能性が示されている[35]。特にIII型細胞に見られる様々な味質に応答を示す細胞は、周囲の甘味、苦味、うま味細胞からの入力を受けることで幅広い応答性を持つ可能性が示唆されている。
参考文献
- ↑ 1.0 1.1
Yoshida, R., Shigemura, N., Sanematsu, K., Yasumatsu, K., Ishizuka, S., & Ninomiya, Y. (2006).
Taste responsiveness of fungiform taste cells with action potentials. Journal of neurophysiology, 96(6), 3088-95. [PubMed:16971686] [WorldCat] [DOI] - ↑
Cheal, M., & Oakley, B. (1977).
Regeneration of fungiform taste buds: temporal and spatial characteristics. The Journal of comparative neurology, 172(4), 609-26. [PubMed:838892] [WorldCat] [DOI] - ↑ Murray R.
The ultrastructure of taste buds.
In: Friedemann, I. (Ed.)The Ultrastructure of Sensory Organs
North-Holland, Amsterdam, pp. 1-81, 1973 - ↑
Beidler, L.M., & Smallman, R.L. (1965).
Renewal of cells within taste buds. The Journal of cell biology, 27(2), 263-72. [PubMed:5884625] [PMC] [WorldCat] [DOI] - ↑
Lawton, D.M., Furness, D.N., Lindemann, B., & Hackney, C.M. (2000).
Localization of the glutamate-aspartate transporter, GLAST, in rat taste buds. The European journal of neuroscience, 12(9), 3163-71. [PubMed:10998100] [WorldCat] [DOI] - ↑
Bartel, D.L., Sullivan, S.L., Lavoie, E.G., Sévigny, J., & Finger, T.E. (2006).
Nucleoside triphosphate diphosphohydrolase-2 is the ecto-ATPase of type I cells in taste buds. The Journal of comparative neurology, 497(1), 1-12. [PubMed:16680780] [PMC] [WorldCat] [DOI] - ↑
Vandenbeuch, A., Clapp, T.R., & Kinnamon, S.C. (2008).
Amiloride-sensitive channels in type I fungiform taste cells in mouse. BMC neuroscience, 9, 1. [PubMed:18171468] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1
Clapp, T.R., Yang, R., Stoick, C.L., Kinnamon, S.C., & Kinnamon, J.C. (2004).
Morphologic characterization of rat taste receptor cells that express components of the phospholipase C signaling pathway. The Journal of comparative neurology, 468(3), 311-21. [PubMed:14681927] [WorldCat] [DOI] - ↑
Yang, R., Tabata, S., Crowley, H.H., Margolskee, R.F., & Kinnamon, J.C. (2000).
Ultrastructural localization of gustducin immunoreactivity in microvilli of type II taste cells in the rat. The Journal of comparative neurology, 425(1), 139-51. [PubMed:10940948] [WorldCat] [DOI] - ↑
Pérez, C.A., Huang, L., Rong, M., Kozak, J.A., Preuss, A.K., Zhang, H., ..., & Margolskee, R.F. (2002).
A transient receptor potential channel expressed in taste receptor cells. Nature neuroscience, 5(11), 1169-76. [PubMed:12368808] [WorldCat] [DOI] - ↑ 11.0 11.1
Tomchik, S.M., Berg, S., Kim, J.W., Chaudhari, N., & Roper, S.D. (2007).
Breadth of tuning and taste coding in mammalian taste buds. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(40), 10840-8. [PubMed:17913917] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1 12.2
Pérez, C.A., Huang, L., Rong, M., Kozak, J.A., Preuss, A.K., Zhang, H., ..., & Margolskee, R.F. (2002).
A transient receptor potential channel expressed in taste receptor cells. Nature neuroscience, 5(11), 1169-76. [PubMed:12368808] [WorldCat] [DOI] - ↑
Huang, Y.J., Maruyama, Y., Dvoryanchikov, G., Pereira, E., Chaudhari, N., & Roper, S.D. (2007).
The role of pannexin 1 hemichannels in ATP release and cell-cell communication in mouse taste buds. Proceedings of the National Academy of Sciences of the United States of America, 104(15), 6436-41. [PubMed:17389364] [PMC] [WorldCat] [DOI] - ↑
Murata, Y., Yasuo, T., Yoshida, R., Obata, K., Yanagawa, Y., Margolskee, R.F., & Ninomiya, Y. (2010).
Action potential-enhanced ATP release from taste cells through hemichannels. Journal of neurophysiology, 104(2), 896-901. [PubMed:20519578] [PMC] [WorldCat] [DOI] - ↑
Taruno, A., Vingtdeux, V., Ohmoto, M., Ma, Z., Dvoryanchikov, G., Li, A., ..., & Foskett, J.K. (2013).
CALHM1 ion channel mediates purinergic neurotransmission of sweet, bitter and umami tastes. Nature, 495(7440), 223-6. [PubMed:23467090] [PMC] [WorldCat] [DOI] - ↑
Finger, T.E., Danilova, V., Barrows, J., Bartel, D.L., Vigers, A.J., Stone, L., ..., & Kinnamon, S.C. (2005).
ATP signaling is crucial for communication from taste buds to gustatory nerves. Science (New York, N.Y.), 310(5753), 1495-9. [PubMed:16322458] [WorldCat] [DOI] - ↑
Matsumoto, I., Ohmoto, M., Narukawa, M., Yoshihara, Y., & Abe, K. (2011).
Skn-1a (Pou2f3) specifies taste receptor cell lineage. Nature neuroscience, 14(6), 685-7. [PubMed:21572433] [PMC] [WorldCat] [DOI] - ↑
Yang, R., Crowley, H.H., Rock, M.E., & Kinnamon, J.C. (2000).
Taste cells with synapses in rat circumvallate papillae display SNAP-25-like immunoreactivity. The Journal of comparative neurology, 424(2), 205-15. [PubMed:10906698] [WorldCat] [DOI] - ↑
Yee, C.L., Yang, R., Böttger, B., Finger, T.E., & Kinnamon, J.C. (2001).
"Type III" cells of rat taste buds: immunohistochemical and ultrastructural studies of neuron-specific enolase, protein gene product 9.5, and serotonin. The Journal of comparative neurology, 440(1), 97-108. [PubMed:11745610] [WorldCat] [DOI] - ↑
Kataoka, S., Yang, R., Ishimaru, Y., Matsunami, H., Sévigny, J., Kinnamon, J.C., & Finger, T.E. (2008).
The candidate sour taste receptor, PKD2L1, is expressed by type III taste cells in the mouse. Chemical senses, 33(3), 243-54. [PubMed:18156604] [PMC] [WorldCat] [DOI] - ↑
Zocchi, D., Wennemuth, G., & Oka, Y. (2017).
The cellular mechanism for water detection in the mammalian taste system. Nature neuroscience, 20(7), 927-933. [PubMed:28553944] [WorldCat] [DOI] - ↑
Huang, Y.J., Maruyama, Y., Lu, K.S., Pereira, E., Plonsky, I., Baur, J.E., ..., & Roper, S.D. (2005).
Mouse taste buds use serotonin as a neurotransmitter. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(4), 843-7. [PubMed:15673664] [PMC] [WorldCat] [DOI] - ↑
Huang, Y.A., Maruyama, Y., & Roper, S.D. (2008).
Norepinephrine is coreleased with serotonin in mouse taste buds. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(49), 13088-93. [PubMed:19052199] [PMC] [WorldCat] [DOI] - ↑
Nelson, G., Hoon, M.A., Chandrashekar, J., Zhang, Y., Ryba, N.J., & Zuker, C.S. (2001).
Mammalian sweet taste receptors. Cell, 106(3), 381-90. [PubMed:11509186] [WorldCat] [DOI] - ↑
Huang, A.L., Chen, X., Hoon, M.A., Chandrashekar, J., Guo, W., Tränkner, D., ..., & Zuker, C.S. (2006).
The cells and logic for mammalian sour taste detection. Nature, 442(7105), 934-8. [PubMed:16929298] [PMC] [WorldCat] [DOI] - ↑
Ishimaru, Y., Inada, H., Kubota, M., Zhuang, H., Tominaga, M., & Matsunami, H. (2006).
Transient receptor potential family members PKD1L3 and PKD2L1 form a candidate sour taste receptor. Proceedings of the National Academy of Sciences of the United States of America, 103(33), 12569-74. [PubMed:16891422] [PMC] [WorldCat] [DOI] - ↑
Chandrashekar, J., Kuhn, C., Oka, Y., Yarmolinsky, D.A., Hummler, E., Ryba, N.J., & Zuker, C.S. (2010).
The cells and peripheral representation of sodium taste in mice. Nature, 464(7286), 297-301. [PubMed:20107438] [PMC] [WorldCat] [DOI] - ↑
Ninomiya, Y., Tonosaki, K., & Funakoshi, M. (1982).
Gustatory neural response in the mouse. Brain research, 244(2), 370-3. [PubMed:7116182] [WorldCat] [DOI] - ↑
Wu, A., Dvoryanchikov, G., Pereira, E., Chaudhari, N., & Roper, S.D. (2015).
Breadth of tuning in taste afferent neurons varies with stimulus strength. Nature communications, 6, 8171. [PubMed:26373451] [PMC] [WorldCat] [DOI] - ↑
Ninomiya, Y., & Imoto, T. (1995).
Gurmarin inhibition of sweet taste responses in mice. The American journal of physiology, 268(4 Pt 2), R1019-25. [PubMed:7733384] [WorldCat] [DOI] - ↑
Niki, M., Takai, S., Kusuhara, Y., Ninomiya, Y., & Yoshida, R. (2011).
Responses to apical and basolateral application of glutamate in mouse fungiform taste cells with action potentials. Cellular and molecular neurobiology, 31(7), 1033-40. [PubMed:21573975] [WorldCat] [DOI] - ↑
McCarroll, J.E., & Zych, K.A. (1989).
Descriptive epidemiologic survey of head injury in the Army: 1983 hospitalized cases. Neuroepidemiology, 8(1), 48-52. [PubMed:2911393] [WorldCat] [DOI] - ↑
Caicedo, A., & Roper, S.D. (2001).
Taste receptor cells that discriminate between bitter stimuli. Science (New York, N.Y.), 291(5508), 1557-60. [PubMed:11222863] [PMC] [WorldCat] [DOI] - ↑
Yoshida, R., Horio, N., Murata, Y., Yasumatsu, K., Shigemura, N., & Ninomiya, Y. (2009).
NaCl responsive taste cells in the mouse fungiform taste buds. Neuroscience, 159(2), 795-803. [PubMed:19167465] [WorldCat] [DOI] - ↑
Roper, S.D. (2006).
Cell communication in taste buds. Cellular and molecular life sciences : CMLS, 63(13), 1494-500. [PubMed:16732426] [PMC] [WorldCat] [DOI]