NCAM
石 龍徳
東京医科大学組織・神経解剖学分野
DOI:10.14931/bsd.6770 原稿受付日:2016年1月31日 原稿完成日:2016年9月13日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英語名:neural cell adhesion molecules
同義語:CD56、神経細胞接着分子
NCAMは免疫グロブリンスーパーファミリーに属する細胞接着分子である。3つのサブタイプがあり、140/180kD分子は膜貫通型、120kD分子はGPIアンカー型である。発生期の発達中の組織では、翻訳後に長鎖の糖鎖であるポリシアル酸(polysialic acid, PSA)によって修飾される(PSA-NCAMと呼ばれる)。主に神経組織や筋組織に発現しているが、その他感覚器や内分泌器など多様な組織で発現している。癌組織でも発現が見られ、癌転移との関係が報告されている。NCAMはホモフィリックな結合の他、細胞外基質のヘパリンなどとヘテロフィリックな結合をする。また、細胞接着分子のL1やFGF受容体などとcis型の結合をする。糖鎖のPSAは負の電荷と大きさにより立体障害的にNCAMの結合能を低下させる。NCAMは細胞接着を介して、神経発生、筋発生に重要な役割を果たしている。また、学習・記憶、精神疾患などとの関係が報告されている。
研究の歴史
1972年に抗体分子の構造決定によりノーベル生理学・医学賞を受賞したエーデルマン(Gerald Maurice Edelman)は、受賞後に胚発生や神経機能に係わる細胞間相互作用の研究を始めた。エーデルマンらは、まず始めにニワトリの網膜細胞表面に対するポリクローナル抗体を作製し、この抗体が解離した網膜細胞の再集合を阻害することを見出した。つぎに、この抗体の阻害効果を中和する物質を探索し、網膜細胞の膜可溶画分から神経細胞接着因子を単離した。この分子の構造決定をしたところ、奇しくも、彼が以前に構造決定をした免疫グロブリン分子と非常によく似た分子であった[1]。
構造
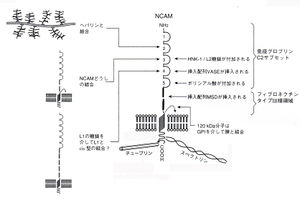
細胞外領域には免疫グロブリンC2サブセットが5つ、フィブロネクチンタイプIII様領域(ただしRGD配列はない)が2つある。分子量140、180 kDaのアイソフォームでは細胎内領域があるが、120 kDa分子のC末端は細胞膜表面のグリコシルフォスファチジルイノシトール(GPI)と結合している。ホモフィリックな結合には3番目のC2領域が関与している。4番目のC2領域とフィブロネクチンタイプIII様領域には、それぞれVASE(varjable alternatively spliced exon)、MSD(muscle specific domain)などの配列が挿入される。発連中の組織では、5番目のC2領域が多量のポリシアル酸(PSA)によって修飾されている。140/180 kDa分子の細胎内領域は、スペクトリンと直接結合している。また、チューブリンとは、キネシン1、MAP1Aなどを介して結合している。
NCAMの細胞外領域は、5つの免疫グロブリンC2サブセットと2つのフィブロネクチンタイプIII様領域(RGD配列はない)からなっている(図1)[2]。
分子量140、180 kDaのアイソフォームでは細胞内領域があるが、120 kDa分子のC末端は細胞膜表面のグリコシルフォスファチジルイノシトール(glycosylphosphatidyl inositol;GPI)と結合している。
5番目のC2ドメインには、N-グルコシド結合により、2カ所でポリシアル酸(2-8-linked N-acetylneuraminic acid, PSA)が結合している[3] [4] [5]。ポリシアル化されたNCAMはPSA-NCAMと呼ばれる。NCAMをポリシアル化する酵素としては、2つのα-2,8シアル酸転移酵素α-2,8 syalyltransferase(ST8)が知られていて、それぞれST8SiaII(STX)・ST8SiaIV(PST-1)と呼ばれている[5]。
140/180 kDa-NCAM の3番目のC2領域には、HNK-1/L2エピトープが存在する。挿入配列のMSD(muscle spedfic domain)にはO-グリコシド結合型糖鎖が結合している[6]。140/180 kDa分子の細胎内領域は、スペクトリンと直接結合している。また、チューブリンとは、キネシン1、MAP1Aなどを介して結合している[7]。
サブファミリー
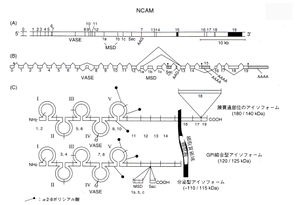
(A)エクソン1から19は番号で上に示してある。挿入配列VASE、MSD(1a・1b・1c)、Sec、AAGは下に記号で示した。
(B)エクソンを結ぶ山形の線はスプライシングの様式を示している。膜貫通領域は黒色で,翻訳されない部分は斜線で示してある。Secを使う場合(分泌型)は、それより下流は翻訳されない。
(C)NCAMの3つのアイソフォームはすべてエクソン1から14を使う.このほかに120 kDa分子では、エクソン15、140kDa分子ではエクソン16十17十19、180 kDa分子ではエクソン16十17十18十19を使う。筋組織では,筋特異的配列領域(MSD1,37個のアミノ酸残基)がエクソン12と13の間に挿入される([2]を改変)。
主に3つのサブタイプがあり、120kD分子はGPIアンカー型、140/180kD分子は膜貫通型である。180kD分子は細胞骨格と相互作用を持つ長い細胞内領域を持っている。各アイソフォームは、alternative splicingによって生成される[6] [8](図2)。
この他、C2領域に、30bpの挿入配列VASE(varjable alternatively spliced exon)が、フィブロネクチンタイプIII様領域にMSD(muscle specific domain)が挿入される場合がある。NCAM遺伝子には多数の短い挿入配列があるために、100以上のアイソフォームが存在するとの報告がある[9]。
翻訳後にポリシアル酸によって修飾をうけると、電気泳動では見かけ上約180~280 kDaの分子量を示す。
発現
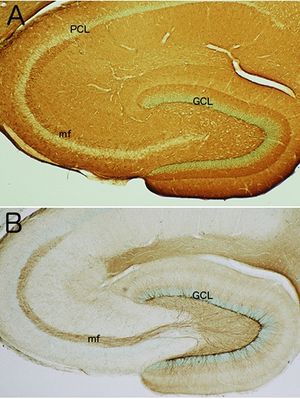
(NCAMは海馬全体に発現している。一方、PSA-NCAMは顆粒細胞層(GCL)内側の新生ニューロンとその軸索(mf, 苔状線維)に発現している。PCL, 錐体細胞層。
NCAMは以下のようなさまざまな組織に広く分布している(*は発生期に発現し、成体組織では消失する組織)。:神経組織(神経細胞・グリア細胞・シュワン細胞・脳脊髄液)、筋組織(骨格筋*・心筋・平滑筋*)(神経・筋組織は後述)、網膜[10]、コルチ器*[11]、嗅上皮[12] [13]、味蕾[14]、歯*[15]、表皮、パチニ小体[16]、中腎管*[17]、下垂体[18]、傍濾細胞*(カルシトニン産生細胞)[19]、膵臓(ラングルハンス島)[20]、副腎(皮質・髄質)[18]、卵巣[18]、精巣[21]、ナチュラルキラー(NK)細胞[22]
長鎖の糖鎖であるポリシアル酸(PSA)で修飾されたPSA-NCAMは、主に発生中の組織で発現している[4]。中枢神経系では、成体になるとほとんどの部位でPSA-NCAMの発現は著しく低下するが、例外的にニューロン新生が続く、前脳側脳室下帯や海馬歯状回顆粒細胞層下帯では、新生ニューロンに強いPSA-NCAMの発現が見られる[23] [5](図3)。
機能
NCAMが接着活性を示すときには、NCAMどうしが3番目のC2ドメインでホモフィリックに結合するほか、2番目のドメインで細胞外基質のヘパリンなどの分子と結合する[24](図1)。また、NCAMは、は、同じ細胞膜上の他の接着分子(L1など)やFGF受容体とCis型の相互作用をする[25]。NCAMが細胞内に情報を伝えるときには、Fyn/Src[26]や、FGF受容体[27]を介することが示唆されている。
180 kD 分子は、細胞内骨格のスペクトリンと結合していることから、安定な細胞接着を形成すると考えられている[28] [29]。
5番目のC2ドメインにはポリシアル酸が結合している[4]。シアル酸が負に荷電しているため、長鎖のPSA分子はその大きさと電荷によってNCAM同士又はNCAMと他の接着分子との結合を阻害すると考えられている[4]。この長鎖のPSAは、発達期の神経細胞などに発現しているが、成体になると限られた部位を除き発現がほとんど見られなくなる[23](図3)。
NCAMは、細胞-細胞、および細胞-細胞外基質間の接着分子で、神経発生や筋発生に重要な分子である[8] [30] [31]。発生期のNCAMはポリシアル化されているので、発生期のNCAMの機能は、PSA-NCAMを中心に研究されている[4] [5]。神経発生では、細胞移動[13] [32]、神経突起の伸長・束形成・分岐[33] [34]、シナプス形成・可塑性(後述)、学習・記憶[35] [36]、神経疾患[37] [38]に関与する。その他の組織でも形態形成に関与していると考えられている(発現の項を参照)。
シナプス形成
NCAMは、シナプス前膜とシナプス後膜に存在する[39]。しかし、NCAM180は、シナプス後膜だけに存在する。NCAM180は細胞骨格と相互作用をするので[28]、NCAM180はシナプスの安定性と関係していると考えられる。シナプス形成期には、NCAMの糖鎖PSAの発現がみられるが、成熟したシナプスではPSAの発現はほとんど見られない[40]。
神経-筋シナプスが形成される発生期には、NCAMは運動ニューロンと筋の両方に発現している。その後、成熟したシナプスが形成される頃になると、筋全体のNCAM発現は低下し、神経筋接合部に限局してNCAMの発現が残るようになる[41]。また、成体でも運動ニューロンを切断して、筋の神経支配を除去してやると、再びNCAMが発現してくる。この筋のNCAM発現は、運動ニューロンが再生されて、筋の神経支配が完了すると、再び低下する[42]。これらの結果は、神経-筋シナプスの形成には筋のNCAM発現が必要であることを示唆している。
NCAM欠損マウスの神経筋接合部を野生型と比較すると、多少の形態的な差異が認められるが、運動機能はほぼ正常である[43]。しかし、NCAM欠損マウスでは、繰り返し刺激などで神経伝達物質の放出量を上げてやると、正常な神経伝達効率を維持できない[43]。
シナプス可塑性
NCAM欠損マウスでは、シナプスのLTP発現が、海馬Schaffer側枝-CA1間[44]と苔状線維-錐体細胞間[45]で低下している。しかし、苔状線維-錐体細胞間では、短期の可塑性は正常である。また、endo-Nによって海馬からPSAを除去すると、同様に海馬Schaffer側枝-CA1間のシナプスのLTP発現が低下する[46]。NCAMのポリシアル化酵素ST8IV(PST-1)を欠損したマウスでは、海馬Schaffer側枝-CA1間シナプスのLTPとLTDの発現が低下しているが、苔状線維-錐体細胞間シナプスのLTPは正常である[47]。一方、Crossinらのグループの結果では、NCAMの発現が欠損しても、海馬Schaffer側枝-CA1間シナプスのLTPは野生型と同じように起こるという[48]。
成体脳のニューロン新生とPSA-NCAM
胎生期から生後初期にかけて、ニューロンが発達する時期には、NCAMは長鎖の糖鎖ポリシアル酸(PSA)によって修飾されている[4] [5]。したがって、PSA-NCAMは、発達中の神経細胞の非常に良いマーカー分子である。
脳のほとんどの部位では成体になるとニューロンは新生しないが、例外的に海馬や前脳側脳室下帯では成体になってもニューロンの新生が続いている[49] [50] [51]。この例外的なニューロン新生によって生まれたニューロブラストが移動するときや神経突起が発達するときにはPSA-NCAMが発現している[52] [53] [54] [4](図3)。ただし、これらのニューロン新生部位以外(梨状皮質など)にPSA-NCAMの発現が見られることがあり、これに関してはニューロン新生とは関係がないので注意を要する[23] [55]。
海馬では、成体になっても顆粒細胞の新生が続いているので、苔状線維終末が、錐体細胞の樹状突起にシナプスを形成する過程が、成体でも観察される[40]。発達中の不規則な形態の軸索末端はPSA陽性であるが、シナプスが形成されるとPSAは消失する。成体脳からPSAを除去すると、異所性の苔状線維シナプスボタンが形成される[56]。
成体海馬におけるPSA-NCAMの発現は、海馬の学習・記憶機能に関係していると考えられている[4] [5]。
疾患との関わり
ウィルムス腫瘍(Wilms' tumor)、ユーイング肉腫(Ewing's sarcoma)、メラノーマ、肺癌(小細胞癌)、神経芽細胞腫など、種々の腫瘍でポリシアル化したNCAMが発現している.癌転移との関係が示唆されている[57] [58]。
関連語
参考文献
- ↑
Edelman, G.M. (2004).
Biochemistry and the sciences of recognition. The Journal of biological chemistry, 279(9), 7361-9. [PubMed:14718522] [WorldCat] [DOI] - ↑ 2.0 2.1
Goridis, C., & Brunet, J.F. (1992).
NCAM: structural diversity, function and regulation of expression. Seminars in cell biology, 3(3), 189-97. [PubMed:1623208] [WorldCat] - ↑
Kiss, J.Z., & Rougon, G. (1997).
Cell biology of polysialic acid. Current opinion in neurobiology, 7(5), 640-6. [PubMed:9384537] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2 4.3 4.4 4.5 4.6 4.7
Rutishauser, U. (2008).
Polysialic acid in the plasticity of the developing and adult vertebrate nervous system. Nature reviews. Neuroscience, 9(1), 26-35. [PubMed:18059411] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 5.3 5.4 5.5
Schnaar, R.L., Gerardy-Schahn, R., & Hildebrandt, H. (2014).
Sialic acids in the brain: gangliosides and polysialic acid in nervous system development, stability, disease, and regeneration. Physiological reviews, 94(2), 461-518. [PubMed:24692354] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1
Cunningham, B.A., Hemperly, J.J., Murray, B.A., Prediger, E.A., Brackenbury, R., & Edelman, G.M. (1987).
Neural cell adhesion molecule: structure, immunoglobulin-like domains, cell surface modulation, and alternative RNA splicing. Science (New York, N.Y.), 236(4803), 799-806. [PubMed:3576199] [WorldCat] [DOI] - ↑
Leshchyns'ka, I., & Sytnyk, V. (2016).
Reciprocal Interactions between Cell Adhesion Molecules of the Immunoglobulin Superfamily and the Cytoskeleton in Neurons. Frontiers in cell and developmental biology, 4, 9. [PubMed:26909348] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1
Rutishauser, U., & Jessell, T.M. (1988).
Cell adhesion molecules in vertebrate neural development. Physiological reviews, 68(3), 819-57. [PubMed:3293093] [WorldCat] [DOI] - ↑
Barthels, D., Vopper, G., Boned, A., Cremer, H., & Wille, W. (1992).
High Degree of NCAM Diversity Generated by Alternative RNA Splicing in Brain and Muscle. The European journal of neuroscience, 4(4), 327-337. [PubMed:12106359] [WorldCat] [DOI] - ↑
Bartsch, U., Kirchhoff, F., & Schachner, M. (1990).
Highly sialylated N-CAM is expressed in adult mouse optic nerve and retina. Journal of neurocytology, 19(4), 550-65. [PubMed:2243247] [WorldCat] [DOI] - ↑
Simonneau, L., Gallego, M., & Pujol, R. (2003).
Comparative expression patterns of T-, N-, E-cadherins, beta-catenin, and polysialic acid neural cell adhesion molecule in rat cochlea during development: implications for the nature of Kölliker's organ. The Journal of comparative neurology, 459(2), 113-26. [PubMed:12640664] [WorldCat] [DOI] - ↑
Miragall, F., Kadmon, G., & Schachner, M. (1989).
Expression of L1 and N-CAM cell adhesion molecules during development of the mouse olfactory system. Developmental biology, 135(2), 272-86. [PubMed:2776969] [WorldCat] [DOI] - ↑ 13.0 13.1
Murakami, S., Seki, T., Wakabayashi, K., & Arai, Y. (1991).
The ontogeny of luteinizing hormone-releasing hormone (LHRH) producing neurons in the chick embryo: possible evidence for migrating LHRH neurons from the olfactory epithelium expressing a highly polysialylated neural cell adhesion molecule. Neuroscience research, 12(3), 421-31. [PubMed:1664924] [WorldCat] [DOI] - ↑
Smith, D.V., Klevitsky, R., Akeson, R.A., & Shipley, M.T. (1994).
Expression of the neural cell adhesion molecule (NCAM) and polysialic acid during taste bud degeneration and regeneration. The Journal of comparative neurology, 347(2), 187-96. [PubMed:7814663] [WorldCat] [DOI] - ↑
Obara, N., & Takeda, M. (1997).
Distribution of the neural cell adhesion molecule (NCAM) during pre- and postnatal development of mouse incisors. Anatomy and embryology, 195(2), 193-202. [PubMed:9045989] [WorldCat] [DOI] - ↑
Nolte, C., Schachner, M., & Martini, R. (1989).
Immunocytochemical localization of the neural cell adhesion molecules L1, N-CAM, and J1 in Pacinian corpuscles of the mouse during development, in the adult and during regeneration. Journal of neurocytology, 18(6), 795-808. [PubMed:2482863] [WorldCat] [DOI] - ↑
Lackie, P.M., Zuber, C., & Roth, J. (1990).
Polysialic acid and N-CAM localisation in embryonic rat kidney: mesenchymal and epithelial elements show different patterns of expression. Development (Cambridge, England), 110(3), 933-47. [PubMed:2088729] [WorldCat] - ↑ 18.0 18.1 18.2
Lahr, G., & Mayerhofer, A. (1995).
Expression of the Neural Cell Adhesion Molecule NCAM by Peptide- and Steroid-Producing Endocrine Cells and Tumors: Alternatively Spliced Forms and Polysialylation. Endocrine pathology, 6(2), 91-101. [PubMed:12114645] [WorldCat] - ↑
Nishiyama, I., Ogiso, M., Oota, T., Kimura, T., & Seki, T. (1996).
Developmental change in expression of highly polysialylated neural cell adhesion molecule in C-cells in rat thyroid gland. Anatomy and embryology, 194(4), 419-26. [PubMed:8896706] [WorldCat] [DOI] - ↑
Cirulli, V., Baetens, D., Rutishauser, U., Halban, P.A., Orci, L., & Rouiller, D.G. (1994).
Expression of neural cell adhesion molecule (N-CAM) in rat islets and its role in islet cell type segregation. Journal of cell science, 107 ( Pt 6), 1429-36. [PubMed:7962186] [WorldCat] - ↑
Li, L.H., Jester, W.F., & Orth, J.M. (1998).
Expression of 140-kDa neural cell adhesion molecule in developing testes in vivo and in long-term Sertoli cell-gonocyte cocultures. Journal of andrology, 19(3), 365-73. [PubMed:9639054] [WorldCat] - ↑
Poli, A., Michel, T., Thérésine, M., Andrès, E., Hentges, F., & Zimmer, J. (2009).
CD56bright natural killer (NK) cells: an important NK cell subset. Immunology, 126(4), 458-65. [PubMed:19278419] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1 23.2
Seki, T., & Arai, Y. (1993).
Distribution and possible roles of the highly polysialylated neural cell adhesion molecule (NCAM-H) in the developing and adult central nervous system. Neuroscience research, 17(4), 265-90. [PubMed:8264989] [WorldCat] [DOI] - ↑
Storms, S.D., & Rutishauser, U. (1998).
A role for polysialic acid in neural cell adhesion molecule heterophilic binding to proteoglycans. The Journal of biological chemistry, 273(42), 27124-9. [PubMed:9765230] [WorldCat] [DOI] - ↑
Hall, H., Walsh, F.S., & Doherty, P. (1996).
Review: a role for the FGF receptor in the axonal growth response stimulated by cell adhesion molecules? Cell adhesion and communication, 3(6), 441-50. [PubMed:8807188] [WorldCat] - ↑
Crossin, K.L., & Krushel, L.A. (2000).
Cellular signaling by neural cell adhesion molecules of the immunoglobulin superfamily. Developmental dynamics : an official publication of the American Association of Anatomists, 218(2), 260-79. [PubMed:10842356] [WorldCat] [DOI] - ↑
Cavallaro, U., Niedermeyer, J., Fuxa, M., & Christofori, G. (2001).
N-CAM modulates tumour-cell adhesion to matrix by inducing FGF-receptor signalling. Nature cell biology, 3(7), 650-7. [PubMed:11433297] [WorldCat] [DOI] - ↑ 28.0 28.1
Pollerberg, G.E., Burridge, K., Krebs, K.E., Goodman, S.R., & Schachner, M. (1987).
The 180-kD component of the neural cell adhesion molecule N-CAM is involved in cell-cell contacts and cytoskeleton-membrane interactions. Cell and tissue research, 250(1), 227-36. [PubMed:3308110] [WorldCat] [DOI] - ↑
Leshchyns'ka, I., & Sytnyk, V. (2016).
Reciprocal Interactions between Cell Adhesion Molecules of the Immunoglobulin Superfamily and the Cytoskeleton in Neurons. Frontiers in cell and developmental biology, 4, 9. [PubMed:26909348] [PMC] [WorldCat] [DOI] - ↑
Edelman, G.M., & Crossin, K.L. (1991).
Cell adhesion molecules: implications for a molecular histology. Annual review of biochemistry, 60, 155-90. [PubMed:1883195] [WorldCat] [DOI] - ↑
Rougon, G., & Hobert, O. (2003).
New insights into the diversity and function of neuronal immunoglobulin superfamily molecules. Annual review of neuroscience, 26, 207-38. [PubMed:12598678] [WorldCat] [DOI] - ↑
Ono, K., Tomasiewicz, H., Magnuson, T., & Rutishauser, U. (1994).
N-CAM mutation inhibits tangential neuronal migration and is phenocopied by enzymatic removal of polysialic acid. Neuron, 13(3), 595-609. [PubMed:7917293] [WorldCat] [DOI] - ↑
Rafuse, V.F., & Landmesser, L.T. (2000).
The pattern of avian intramuscular nerve branching is determined by the innervating motoneuron and its level of polysialic acid. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(3), 1056-65. [PubMed:10648711] [PMC] [WorldCat] - ↑
Yamamoto, N., Inui, K., Matsuyama, Y., Harada, A., Hanamura, K., Murakami, F., ..., & Seki, T. (2000).
Inhibitory mechanism by polysialic acid for lamina-specific branch formation of thalamocortical axons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(24), 9145-51. [PubMed:11124992] [PMC] [WorldCat] - ↑
Welzl, H., & Stork, O. (2003).
Cell adhesion molecules: key players in memory consolidation? News in physiological sciences : an international journal of physiology produced jointly by the International Union of Physiological Sciences and the American Physiological Society, 18, 147-50. [PubMed:12869614] [WorldCat] - ↑
Lopez-Fernandez, M.A., Montaron, M.F., Varea, E., Rougon, G., Venero, C., Abrous, D.N., & Sandi, C. (2007).
Upregulation of polysialylated neural cell adhesion molecule in the dorsal hippocampus after contextual fear conditioning is involved in long-term memory formation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(17), 4552-61. [PubMed:17460068] [PMC] [WorldCat] [DOI] - ↑
Cotman, C.W., Hailer, N.P., Pfister, K.K., Soltesz, I., & Schachner, M. (1998).
Cell adhesion molecules in neural plasticity and pathology: similar mechanisms, distinct organizations? Progress in neurobiology, 55(6), 659-69. [PubMed:9670224] [WorldCat] - ↑
Sato, C., & Kitajima, K. (2013).
Impact of structural aberrancy of polysialic acid and its synthetic enzyme ST8SIA2 in schizophrenia. Frontiers in cellular neuroscience, 7, 61. [PubMed:23675315] [PMC] [WorldCat] [DOI] - ↑
Persohn, E., Pollerberg, G.E., & Schachner, M. (1989).
Immunoelectron-microscopic localization of the 180 kD component of the neural cell adhesion molecule N-CAM in postsynaptic membranes. The Journal of comparative neurology, 288(1), 92-100. [PubMed:2794140] [WorldCat] [DOI] - ↑ 40.0 40.1
Seki, T., & Arai, Y. (1999).
Different polysialic acid-neural cell adhesion molecule expression patterns in distinct types of mossy fiber boutons in the adult hippocampus. The Journal of comparative neurology, 410(1), 115-25. [PubMed:10397399] [WorldCat] [DOI] - ↑
Covault, J., & Sanes, J.R. (1986).
Distribution of N-CAM in synaptic and extrasynaptic portions of developing and adult skeletal muscle. The Journal of cell biology, 102(3), 716-30. [PubMed:3512581] [PMC] [WorldCat] [DOI] - ↑
Covault, J., & Sanes, J.R. (1985).
Neural cell adhesion molecule (N-CAM) accumulates in denervated and paralyzed skeletal muscles. Proceedings of the National Academy of Sciences of the United States of America, 82(13), 4544-8. [PubMed:3892537] [PMC] [WorldCat] [DOI] - ↑ 43.0 43.1
Rafuse, V.F., Polo-Parada, L., & Landmesser, L.T. (2000).
Structural and functional alterations of neuromuscular junctions in NCAM-deficient mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(17), 6529-39. [PubMed:10964958] [PMC] [WorldCat] - ↑
Cremer, H., Lange, R., Christoph, A., Plomann, M., Vopper, G., Roes, J., ..., & Scheff, S. (1994).
Inactivation of the N-CAM gene in mice results in size reduction of the olfactory bulb and deficits in spatial learning. Nature, 367(6462), 455-9. [PubMed:8107803] [WorldCat] [DOI] - ↑
Cremer, H., Chazal, G., Carleton, A., Goridis, C., Vincent, J.D., & Lledo, P.M. (1998).
Long-term but not short-term plasticity at mossy fiber synapses is impaired in neural cell adhesion molecule-deficient mice. Proceedings of the National Academy of Sciences of the United States of America, 95(22), 13242-7. [PubMed:9789073] [PMC] [WorldCat] [DOI] - ↑
Muller, D., Wang, C., Skibo, G., Toni, N., Cremer, H., Calaora, V., ..., & Kiss, J.Z. (1996).
PSA-NCAM is required for activity-induced synaptic plasticity. Neuron, 17(3), 413-22. [PubMed:8816705] [WorldCat] [DOI] - ↑
Eckhardt, M., Bukalo, O., Chazal, G., Wang, L., Goridis, C., Schachner, M., ..., & Dityatev, A. (2000).
Mice deficient in the polysialyltransferase ST8SiaIV/PST-1 allow discrimination of the roles of neural cell adhesion molecule protein and polysialic acid in neural development and synaptic plasticity. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(14), 5234-44. [PubMed:10884307] [PMC] [WorldCat] - ↑
Holst, B.D., Vanderklish, P.W., Krushel, L.A., Zhou, W., Langdon, R.B., McWhirter, J.R., ..., & Crossin, K.L. (1998).
Allosteric modulation of AMPA-type glutamate receptors increases activity of the promoter for the neural cell adhesion molecule, N-CAM. Proceedings of the National Academy of Sciences of the United States of America, 95(5), 2597-602. [PubMed:9482932] [PMC] [WorldCat] [DOI] - ↑
Altman, J., & Das, G.D. (1965).
Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. The Journal of comparative neurology, 124(3), 319-35. [PubMed:5861717] [WorldCat] [DOI] - ↑ Kempermann G
Adult neurogenesis2.
Oxford: oxford university press. 2011 - ↑
Lim, D.A., & Alvarez-Buylla, A. (2014).
Adult neural stem cells stake their ground. Trends in neurosciences, 37(10), 563-71. [PubMed:25223700] [PMC] [WorldCat] [DOI] - ↑
Seki, T., & Arai, Y. (1993).
Highly polysialylated neural cell adhesion molecule (NCAM-H) is expressed by newly generated granule cells in the dentate gyrus of the adult rat. The Journal of neuroscience : the official journal of the Society for Neuroscience, 13(6), 2351-8. [PubMed:7684771] [WorldCat] - ↑
Alvarez-Buylla, A. (1997).
Mechanism of migration of olfactory bulb interneurons. Seminars in cell & developmental biology, 8(2), 207-13. [PubMed:15001097] [WorldCat] [DOI] - ↑
Alvarez-Buylla, A., & Garcia-Verdugo, J.M. (2002).
Neurogenesis in adult subventricular zone. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(3), 629-34. [PubMed:11826091] [PMC] [WorldCat] - ↑
Gomez-Climent, M.A., Guirado, R., Varea, E., & Nàcher, J. (2010).
"Arrested development". Immature, but not recently generated, neurons in the adult brain. Archives italiennes de biologie, 148(2), 159-72. [PubMed:20830977] [WorldCat] - ↑
Seki, T., & Rutishauser, U. (1998).
Removal of polysialic acid-neural cell adhesion molecule induces aberrant mossy fiber innervation and ectopic synaptogenesis in the hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 18(10), 3757-66. [PubMed:9570806] [PMC] [WorldCat] - ↑
Seidenfaden, R., Krauter, A., Schertzinger, F., Gerardy-Schahn, R., & Hildebrandt, H. (2003).
Polysialic acid directs tumor cell growth by controlling heterophilic neural cell adhesion molecule interactions. Molecular and cellular biology, 23(16), 5908-18. [PubMed:12897159] [PMC] [WorldCat] [DOI] - ↑
Al-Saraireh, Y.M., Sutherland, M., Springett, B.R., Freiberger, F., Ribeiro Morais, G., Loadman, P.M., ..., & Falconer, R.A. (2013).
Pharmacological inhibition of polysialyltransferase ST8SiaII modulates tumour cell migration. PloS one, 8(8), e73366. [PubMed:23951351] [PMC] [WorldCat] [DOI]