「小脳によるタイミング制御」の版間の差分
Soichinagao (トーク | 投稿記録) 細編集の要約なし |
細 (→タイミング制御に関係する課題) |
||
| (3人の利用者による、間の22版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/tyam 山崎 匡]</font><br> | |||
''電気通信大学 大学院情報理工学研究科 情報・通信工学専攻・情報理工学部 情報・通信工学科''<br> | |||
<font size="+1">[http://researchmap.jp/read0023042 永雄 総一]</font><br> | |||
''のぞみ病院''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年7月4日 原稿完成日:2015年4月15日 一部改訂:2021年9月10日<br> | |||
担当編集委員:[http://researchmap.jp/noritakaichinohe 一戸 紀孝](国立精神・神経医療研究センター 神経研究所)<br> | |||
</div> | |||
英語名:cerebellar timing control | |||
{{box|text= 運動を正確に行うには、複数の筋が協調して活動することが必要である。それには筋をそれぞれ適切な強さ(ゲイン)と的確なタイミングで収縮させるような制御が必須である。小脳は運動のゲインを制御するのみならず、同時に数十ミリ秒〜数百ミリ秒の単位のタイミングの制御にも重要であることが、臨床医学、生理学や計算論的な研究により示唆されている。小脳によるタイミング制御の研究には主に瞬目反射の遅延型条件づけ学習が用いられる。小脳による運動の大きさ(ゲイン)の最適化の学習との関連から、瞬目反射の遅延型条件づけ学習の原因が小脳皮質のプルキンエ細胞のシナプス伝達可塑性の長期抑圧であるという液状態機械モデルが提案されている。}} | |||
== タイミング制御に関係する課題 == | |||
[[Image:Yamazaki Nagao 図1rev.jpg|thumb|250px|<b>図1. 小脳によるタイミング制御を調べるのに用いられる課題</b><br />(A) 回内・回外運動課題、(B) タッピング課題、(C) 時間長弁別課題、(D) Voice Onset Time (VOT)。]] | |||
一般的に、[[小脳]]が障害されると運動の速度が遅くなるとともに運動のリズムが不正確になる 。運動のタイミングに関して、以下のような検査法が知られている<ref name="ref1"><pubmed>12582062</pubmed></ref>。代表的な[[小脳症状]]に[[反復性拮抗不全]] (adiadochokinesis)がある('''図1A''')。これは例えば、手のひらをくるくる回すなどの[[主動筋]]と[[拮抗筋]]を交互に活動させる動作を行う時に、滑らかな一定のリズムで動かすことができないという症状であり、リズム形成の障害と考えられる。 | |||
[[タッピング課題]]('''図1B''')は、音や光の点滅による指示に従って一定のリズムでボタンを押し、指示が消えた後もそのリズムでボタン押しを続けられるかを調べるものである。健常者は指示されたリズムでボタン押しを続けることができるが、小脳疾患の患者はボタン押しのタイミングにばらつきが生じることが知られている。 | |||
[[時間長弁別課題]]('''図1C''')は、持続の長さの異なる2種類の音を間隔をおいて提示し、その持続時間の違いを問う課題であり、小脳の[[認知]]機能を調べるものである。音声言語医学の分野では、小脳症状の検査として、[[Voice Onset Time]] (VOT)の生成と認識の課題が利用される('''図1D''')。「バ」と「パ」等の[[wikipedia:ja:無声破裂音|無声破裂音]]と[[wikipedia:ja:有声破裂音|有声破裂音]]では、第一フォルマントの立ち上がりのタイミングに数十ミリ秒の違いしかない。その発音には[[wikipedia:ja:構音筋|構音筋]]の微妙な協調運動を必要するため、小脳疾患の患者では発音を仕分けるのが困難になる。またその聞き分けは、時間長弁別課題と同様に小脳の認知機能に関係する。 | |||
== 遅延型瞬目反射条件づけ == | |||
[[Image:Yamazaki Nagao 図2.jpg|thumb|250px|<b>図2. 遅延型瞬目反射条件づけ</b><br />(A) は条件づけのスキーム、(B)は関与する神経伝達の経路。]] | |||
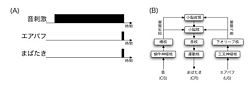
小脳のタイミング制御機構を実験的に検討するのに、[[瞬目反射条件づけ]]のパラダイム('''図2A''')が用いられる<ref name="ref2"><pubmed>14657256</pubmed></ref>。遅延型瞬目反射条件づけとは、[[無条件反射]](Unconditioned Stimulus, US)である瞬きを引き起こす[[無条件刺激]] (眼球へのエアパフ刺激)と、音やフラッシュ光による[[条件刺激]](Conditioned Stimulus, CS)を組み合わせて提示することを繰り返すと、CSだけで瞬きをするという[[条件反応]](Conditioned Response, CR)が生じる運動学習である。この反射の目的は、CSが提示されるタイミングを予測し、その時点で眼を閉じることを学習することで、侵害刺激であるUSを回避することにある。瞬きは刺激開始直後ではなく、エアパフのタイミングに同期して起こることが重要である。 | |||
[ | |||
[ | |||
[ | |||
[ | |||
[ | |||
[ | |||
[ | |||
'''図2B'''に遅延型瞬目反射条件づけに関係する神経回路を示す。エアパフの情報(US)は、眼球の知覚を司る[[三叉神経核]]から、[[下オリーブ核]]を経由し、[[登上線維]]によって[[小脳皮質]]の第VI[[小脳半球]]の[[プルキンエ細胞]]とその出力先である小脳[[中位核]]と[[歯状核]]に、それぞれ伝えられる。音に関する情報(CS)は、[[蝸牛神経核]]から[[橋核]]を経て、[[苔状線維]]により、同じく第VI小脳半球の[[顆粒細胞]]に送られるとともに、その側枝により、第VI小脳半球のプルキンエ細胞の出力先の小脳中位核と歯状核にも送られる。従って、小脳皮質と小脳核にはそれぞれ苔状線維と登上線維の入力によりCSとUSの情報が伝えられることになる。小脳核の出力は[[赤核]]を経て、瞬きを引き起こす筋群を駆動する[[顔面神経]]の[[運動核]]と[[外転神経核]]に伝えられる。 | |||
( | 遅延型瞬目反射条件づけに小脳を含む神経回路が重要な役割を演じていることが、破壊実験や薬物を用いた不活化の実験、神経活動の記録実験の結果により示唆されている。条件づけを行なう前に小脳皮質を破壊すると、いくらトレーニングを行なってもCSに同期した正確なCRが生じない。また条件づけが生じた後に小脳皮質を破壊すると、CSのタイミングに同期したCRが消失する。このことは小脳皮質がCSの時間情報を正確に反映する条件づけに必要であり、CSとCRの連合には主に小脳核が関与していることを示唆する。 | ||
小脳皮質の[[平行線維]]―プルキンエ細胞間[[シナプス]]には、登上線維入力によって[[長期抑圧]](long-term depression, LTD)と呼ばれる可塑性が生じる<ref name="ref3"><pubmed>7097592</pubmed></ref>が、これが小脳皮質によるCSのタイミングの学習の原因であるという仮説が提出されている。これについては以降で解説する。 | |||
== 小脳神経回路の神経活動の同期的振動 == | |||
神経細胞集団の同期した[[スパイク]]発射や[[膜電位]]の小さな振動が、脳の情報処理の基盤となるという仮説が、[[海馬]]や[[大脳皮質]][[視覚野]]について提出されている<ref name="ref4"><pubmed>14643372</pubmed></ref>。小脳でも複数の場所で神経活動の同期振動が見られ、それがタイミング制御に関係しているとする考え方が提出されている。小脳皮質の顆粒細胞層の局所電場電位に、10Hz程度の同期的振動があることが知られている。[[顆粒細胞層]]は顆粒細胞と[[ゴルジ細胞]]からなるが、この同期的振動に、これらの神経細胞の膜の性質や神経細胞間ネットワークなどが関与することが示唆されている(次節参照)。この振動は主に動物が静止している時に観測され、運動開始とともに消失するのが特徴であり、運動の開始に関係すると考えられている<ref name="ref5"><pubmed>19409229</pubmed></ref>。小脳皮質に登上線維を送る下オリーブ核の神経細胞には電気的結合があり、その膜電位にも小さな10Hz程度の同期振動が見られる。ハルマリン[[Harmaline]]を全身投与すると、全身に10Hz程度の振戦症状が出現することから、下オリーブ核の神経細胞の同期的振動が、小脳のベースクロックとなるという考え方が提出されている<ref name="ref6"><pubmed>3795074</pubmed></ref>。ハルマリンはモノアミン酸化酵素の阻害作用をもつ向精神性アルカロイドで、下オリーブ核の神経細胞の膜電位を発振させる薬理作用を持つが、その機序はよく分かっていない。しかしながら、無麻酔覚醒の動物から記録される下オリーブ核の神経活動(複雑発射)には同期する傾向はなく、むしろ運動の開始や運動誤差を反映していることが報告されており、この考え方は広く認められるにはいたっていない<ref name="ref7"><pubmed>16182386</pubmed></ref> <ref name="ref8">'''Ito M.'''<br>The cerebellum: Brain for an Implicit Self.<br>''FT Press'', New York, 2011</ref> <ref name="ref9">'''永雄総一, 山崎匡'''<br>生体の科学 2012, 63:3-10. </ref>。 | |||
== 小脳皮質によるタイミング学習の理論 == | |||
[[Image:Yamazaki Nagao 図3.jpg|thumb|250px|<b>図3. 遅延型瞬目反射条件づけに関わる小脳回路</b><br />(A)は全体、(B)では小脳皮質のみの回路を示す。]] [[Image:Yamazaki Nagao 図4.jpg|thumb|250px|<b>図4. CSの時系列を表現する顆粒細胞集団の活動の理論モデル</b><br /> (A) ゴルジ細胞―顆粒細胞フィードバック回路によるランダムネットワークモデル。(B) シミュレーションされた顆粒細胞集団によるCSの時系列のコーデイング。(C) 遅延型瞬目反射条件づけの計算機シミュレーション。トレーニング中のトライアル1,18,19でのプルキンエ細胞(上)と小脳核(下)の膜電位のプロット。USが500ミリ秒で呈示されるとすると、プルキンエ細胞はその前後でスパイク発射を停止し、その結果脱抑制された小脳核がバースト的にスパイクを発射する。]] | |||
小脳のタイミング制御機構については、[[遅延型瞬目反射]]の条件づけの実験をもとに、理論モデルが提案されている。 | |||
'''図3A'''に、条件づけに関係する小脳皮質と小脳核の神経回路を示す。小脳の出力細胞であるプルキンエ細胞には、苔状線維の入力を受けた顆粒細胞の[[軸索]]突起である平行線維を介して、CSの時系列を反映する情報が伝えられる。CSが呈示されると、小脳核は興奮性入力とプルキンエ細胞を介する抑制性入力をともに受けるので強く興奮できず、その結果CRは生じない。USの信号は登上線維によってプルキンエ細胞に伝えられているので、CSとUSを同時に提示することを繰り返すと平行線維―プルキンエ細胞間シナプスに長期抑圧がおこり、USが生じる時に活性化する平行線維とプルキンエ細胞間のシナプスの伝達効率は低下する。その結果、小脳核はCSに対して強く興奮するようになり、CRが生じるようになる。 | |||
このように長期抑圧が遅延型瞬目反射条件づけの原因であると仮定すると、CS呈示開始からUSまでの時間経過の情報が、平行線維―プルキンエ細胞間シナプス入力という空間情報に変換されることが必要となる。もしCSが呈示されている間、異なる顆粒細胞集団が時系列的に順番に活動するものとすれば('''図3B''')、USが生じた時点で活動している顆粒細胞の平行線維が形成するシナプスのみが長期抑圧によって減弱されるが、他の顆粒細胞集団が形成する平行線維のシナプスは影響を受けないことになる(図3B)。しかしながら、顆粒細胞は小脳皮質の他の神経細胞に比べ小さくかつ数が極めて多いので、無麻酔覚醒の動物を対象にした[[微小電極]]による細胞レベルの解析は技術的に困難であり、顆粒細胞の集団の活動がCSの時系列を反映しているかどうかについては、実験的に検証されていない。 | |||
顆粒細胞の集団がCSの時系列をコードする可能性については、理論モデルを用いたシミュレーションによる研究がなされている<ref name="ref10"><pubmed>19495900</pubmed></ref>。'''図4'''はその代表例である。顆粒細胞層は顆粒細胞とゴルジ細胞からなり、顆粒細胞は[[ゴルジ細胞]]を興奮させゴルジ細胞は顆粒細胞を抑制する。即ちこの2種類の神経細胞からなる神経回路は抑制性フィードバック回路を形成する('''図4A''')。ここで、ゴルジ細胞-顆粒細胞間の結合が空間的にランダムだと仮定すると、時間的に定常的な入力に対して、各顆粒細胞はそれぞれ異なる時間パターンで間欠的にスパイクの発射活動と停止を繰り返すことが可能である('''図4B''')。つまり集団として見ると、ある特定の時刻で活動する顆粒細胞の集団は一意に定まり、かつ活動する顆粒細胞集団は時間経過とともに徐々に変化することになる。従って、活動する顆粒細胞集団が遷移することによって、CS呈示開始からの時系列を表現することが可能になる。この様な考え方に基づいて、遅延型瞬目反射条件づけを計算機シミュレーションにより再現することが可能である('''図4C'''<ref name="ref10"><pubmed>19495900</pubmed></ref>)。今後このようなモデルに対する実験的検証が望まれる。小脳プラットフォーム<ref>http://cerebellum.neuroinf.jp/</ref>にはこのモデルを含めた様々なモデルが登録されているので、参照されたい。 | |||
== 小脳によるタイミング制御の特徴 == | |||
時間情報は脳の様々な部位で表現され、運動制御や認知機能に利用される。小脳のタイミング制御の特徴は、無意識で行われる前向き制御の運動のタイミングを学習により正確にすることであり、制御できる時間は数十ミリ秒~数百ミリ秒の範囲である。一方、大脳皮質の時間情報処理は、[[ワーキングメモリー]](作業記憶)を特異的にコードする神経細胞があることからもわかるように、制御できる時間は数百ミリ秒~数秒以上にわたり、かつ意識されることが特徴である。また、その時間情報の精度は小脳ほど正確ではない。[[大脳基底核]]の障害では、[[パーキンソン病]]のように自発的な運動が全般的に遅くなるような症状と、[[舞踏病]]や[[チック]]のような急速な[[不随意運動]]と、対極的な症状が出現する。大脳基底核の機能については、運動によって生じる報酬の予測という考え方が主流となっているが、これが運動の遅延と急速化という2つの対極的状態とどのように関連するかは今のところ知られてはいない。小脳障害では、運動の開始が遅延し、運動のリズムが遅くなることがしばしば生じるが、これは、感覚フィードバックを用いる運動に比べて十分に速い運動を可能にする小脳による前向き制御の障害によるものと解釈される。瞬目反射条件づけの例が示すように、小脳皮質のタイミング学習の目標は、あくまでも、運動を起こす時間を正確にすることにより運動誤差を最小にすることにある。ヒトでは小脳皮質のタイミング学習は認知機能とも深く関わっているようであるが、その詳細については今後の研究課題である。 | |||
== 関連項目 == | |||
*[[小脳の神経回路]] | |||
*[[瞬目反射条件づけ]] | |||
*[[前庭動眼反射]] | |||
== 参考文献 == | |||
<references /> | |||
2021年9月10日 (金) 15:50時点における最新版
山崎 匡
電気通信大学 大学院情報理工学研究科 情報・通信工学専攻・情報理工学部 情報・通信工学科
永雄 総一
のぞみ病院
DOI:10.14931/bsd.2076 原稿受付日:2012年7月4日 原稿完成日:2015年4月15日 一部改訂:2021年9月10日
担当編集委員:一戸 紀孝(国立精神・神経医療研究センター 神経研究所)
英語名:cerebellar timing control
運動を正確に行うには、複数の筋が協調して活動することが必要である。それには筋をそれぞれ適切な強さ(ゲイン)と的確なタイミングで収縮させるような制御が必須である。小脳は運動のゲインを制御するのみならず、同時に数十ミリ秒〜数百ミリ秒の単位のタイミングの制御にも重要であることが、臨床医学、生理学や計算論的な研究により示唆されている。小脳によるタイミング制御の研究には主に瞬目反射の遅延型条件づけ学習が用いられる。小脳による運動の大きさ(ゲイン)の最適化の学習との関連から、瞬目反射の遅延型条件づけ学習の原因が小脳皮質のプルキンエ細胞のシナプス伝達可塑性の長期抑圧であるという液状態機械モデルが提案されている。
タイミング制御に関係する課題
一般的に、小脳が障害されると運動の速度が遅くなるとともに運動のリズムが不正確になる 。運動のタイミングに関して、以下のような検査法が知られている[1]。代表的な小脳症状に反復性拮抗不全 (adiadochokinesis)がある(図1A)。これは例えば、手のひらをくるくる回すなどの主動筋と拮抗筋を交互に活動させる動作を行う時に、滑らかな一定のリズムで動かすことができないという症状であり、リズム形成の障害と考えられる。
タッピング課題(図1B)は、音や光の点滅による指示に従って一定のリズムでボタンを押し、指示が消えた後もそのリズムでボタン押しを続けられるかを調べるものである。健常者は指示されたリズムでボタン押しを続けることができるが、小脳疾患の患者はボタン押しのタイミングにばらつきが生じることが知られている。
時間長弁別課題(図1C)は、持続の長さの異なる2種類の音を間隔をおいて提示し、その持続時間の違いを問う課題であり、小脳の認知機能を調べるものである。音声言語医学の分野では、小脳症状の検査として、Voice Onset Time (VOT)の生成と認識の課題が利用される(図1D)。「バ」と「パ」等の無声破裂音と有声破裂音では、第一フォルマントの立ち上がりのタイミングに数十ミリ秒の違いしかない。その発音には構音筋の微妙な協調運動を必要するため、小脳疾患の患者では発音を仕分けるのが困難になる。またその聞き分けは、時間長弁別課題と同様に小脳の認知機能に関係する。
遅延型瞬目反射条件づけ
小脳のタイミング制御機構を実験的に検討するのに、瞬目反射条件づけのパラダイム(図2A)が用いられる[2]。遅延型瞬目反射条件づけとは、無条件反射(Unconditioned Stimulus, US)である瞬きを引き起こす無条件刺激 (眼球へのエアパフ刺激)と、音やフラッシュ光による条件刺激(Conditioned Stimulus, CS)を組み合わせて提示することを繰り返すと、CSだけで瞬きをするという条件反応(Conditioned Response, CR)が生じる運動学習である。この反射の目的は、CSが提示されるタイミングを予測し、その時点で眼を閉じることを学習することで、侵害刺激であるUSを回避することにある。瞬きは刺激開始直後ではなく、エアパフのタイミングに同期して起こることが重要である。
図2Bに遅延型瞬目反射条件づけに関係する神経回路を示す。エアパフの情報(US)は、眼球の知覚を司る三叉神経核から、下オリーブ核を経由し、登上線維によって小脳皮質の第VI小脳半球のプルキンエ細胞とその出力先である小脳中位核と歯状核に、それぞれ伝えられる。音に関する情報(CS)は、蝸牛神経核から橋核を経て、苔状線維により、同じく第VI小脳半球の顆粒細胞に送られるとともに、その側枝により、第VI小脳半球のプルキンエ細胞の出力先の小脳中位核と歯状核にも送られる。従って、小脳皮質と小脳核にはそれぞれ苔状線維と登上線維の入力によりCSとUSの情報が伝えられることになる。小脳核の出力は赤核を経て、瞬きを引き起こす筋群を駆動する顔面神経の運動核と外転神経核に伝えられる。
遅延型瞬目反射条件づけに小脳を含む神経回路が重要な役割を演じていることが、破壊実験や薬物を用いた不活化の実験、神経活動の記録実験の結果により示唆されている。条件づけを行なう前に小脳皮質を破壊すると、いくらトレーニングを行なってもCSに同期した正確なCRが生じない。また条件づけが生じた後に小脳皮質を破壊すると、CSのタイミングに同期したCRが消失する。このことは小脳皮質がCSの時間情報を正確に反映する条件づけに必要であり、CSとCRの連合には主に小脳核が関与していることを示唆する。
小脳皮質の平行線維―プルキンエ細胞間シナプスには、登上線維入力によって長期抑圧(long-term depression, LTD)と呼ばれる可塑性が生じる[3]が、これが小脳皮質によるCSのタイミングの学習の原因であるという仮説が提出されている。これについては以降で解説する。
小脳神経回路の神経活動の同期的振動
神経細胞集団の同期したスパイク発射や膜電位の小さな振動が、脳の情報処理の基盤となるという仮説が、海馬や大脳皮質視覚野について提出されている[4]。小脳でも複数の場所で神経活動の同期振動が見られ、それがタイミング制御に関係しているとする考え方が提出されている。小脳皮質の顆粒細胞層の局所電場電位に、10Hz程度の同期的振動があることが知られている。顆粒細胞層は顆粒細胞とゴルジ細胞からなるが、この同期的振動に、これらの神経細胞の膜の性質や神経細胞間ネットワークなどが関与することが示唆されている(次節参照)。この振動は主に動物が静止している時に観測され、運動開始とともに消失するのが特徴であり、運動の開始に関係すると考えられている[5]。小脳皮質に登上線維を送る下オリーブ核の神経細胞には電気的結合があり、その膜電位にも小さな10Hz程度の同期振動が見られる。ハルマリンHarmalineを全身投与すると、全身に10Hz程度の振戦症状が出現することから、下オリーブ核の神経細胞の同期的振動が、小脳のベースクロックとなるという考え方が提出されている[6]。ハルマリンはモノアミン酸化酵素の阻害作用をもつ向精神性アルカロイドで、下オリーブ核の神経細胞の膜電位を発振させる薬理作用を持つが、その機序はよく分かっていない。しかしながら、無麻酔覚醒の動物から記録される下オリーブ核の神経活動(複雑発射)には同期する傾向はなく、むしろ運動の開始や運動誤差を反映していることが報告されており、この考え方は広く認められるにはいたっていない[7] [8] [9]。
小脳皮質によるタイミング学習の理論
小脳のタイミング制御機構については、遅延型瞬目反射の条件づけの実験をもとに、理論モデルが提案されている。
図3Aに、条件づけに関係する小脳皮質と小脳核の神経回路を示す。小脳の出力細胞であるプルキンエ細胞には、苔状線維の入力を受けた顆粒細胞の軸索突起である平行線維を介して、CSの時系列を反映する情報が伝えられる。CSが呈示されると、小脳核は興奮性入力とプルキンエ細胞を介する抑制性入力をともに受けるので強く興奮できず、その結果CRは生じない。USの信号は登上線維によってプルキンエ細胞に伝えられているので、CSとUSを同時に提示することを繰り返すと平行線維―プルキンエ細胞間シナプスに長期抑圧がおこり、USが生じる時に活性化する平行線維とプルキンエ細胞間のシナプスの伝達効率は低下する。その結果、小脳核はCSに対して強く興奮するようになり、CRが生じるようになる。
このように長期抑圧が遅延型瞬目反射条件づけの原因であると仮定すると、CS呈示開始からUSまでの時間経過の情報が、平行線維―プルキンエ細胞間シナプス入力という空間情報に変換されることが必要となる。もしCSが呈示されている間、異なる顆粒細胞集団が時系列的に順番に活動するものとすれば(図3B)、USが生じた時点で活動している顆粒細胞の平行線維が形成するシナプスのみが長期抑圧によって減弱されるが、他の顆粒細胞集団が形成する平行線維のシナプスは影響を受けないことになる(図3B)。しかしながら、顆粒細胞は小脳皮質の他の神経細胞に比べ小さくかつ数が極めて多いので、無麻酔覚醒の動物を対象にした微小電極による細胞レベルの解析は技術的に困難であり、顆粒細胞の集団の活動がCSの時系列を反映しているかどうかについては、実験的に検証されていない。
顆粒細胞の集団がCSの時系列をコードする可能性については、理論モデルを用いたシミュレーションによる研究がなされている[10]。図4はその代表例である。顆粒細胞層は顆粒細胞とゴルジ細胞からなり、顆粒細胞はゴルジ細胞を興奮させゴルジ細胞は顆粒細胞を抑制する。即ちこの2種類の神経細胞からなる神経回路は抑制性フィードバック回路を形成する(図4A)。ここで、ゴルジ細胞-顆粒細胞間の結合が空間的にランダムだと仮定すると、時間的に定常的な入力に対して、各顆粒細胞はそれぞれ異なる時間パターンで間欠的にスパイクの発射活動と停止を繰り返すことが可能である(図4B)。つまり集団として見ると、ある特定の時刻で活動する顆粒細胞の集団は一意に定まり、かつ活動する顆粒細胞集団は時間経過とともに徐々に変化することになる。従って、活動する顆粒細胞集団が遷移することによって、CS呈示開始からの時系列を表現することが可能になる。この様な考え方に基づいて、遅延型瞬目反射条件づけを計算機シミュレーションにより再現することが可能である(図4C[10])。今後このようなモデルに対する実験的検証が望まれる。小脳プラットフォーム[11]にはこのモデルを含めた様々なモデルが登録されているので、参照されたい。
小脳によるタイミング制御の特徴
時間情報は脳の様々な部位で表現され、運動制御や認知機能に利用される。小脳のタイミング制御の特徴は、無意識で行われる前向き制御の運動のタイミングを学習により正確にすることであり、制御できる時間は数十ミリ秒~数百ミリ秒の範囲である。一方、大脳皮質の時間情報処理は、ワーキングメモリー(作業記憶)を特異的にコードする神経細胞があることからもわかるように、制御できる時間は数百ミリ秒~数秒以上にわたり、かつ意識されることが特徴である。また、その時間情報の精度は小脳ほど正確ではない。大脳基底核の障害では、パーキンソン病のように自発的な運動が全般的に遅くなるような症状と、舞踏病やチックのような急速な不随意運動と、対極的な症状が出現する。大脳基底核の機能については、運動によって生じる報酬の予測という考え方が主流となっているが、これが運動の遅延と急速化という2つの対極的状態とどのように関連するかは今のところ知られてはいない。小脳障害では、運動の開始が遅延し、運動のリズムが遅くなることがしばしば生じるが、これは、感覚フィードバックを用いる運動に比べて十分に速い運動を可能にする小脳による前向き制御の障害によるものと解釈される。瞬目反射条件づけの例が示すように、小脳皮質のタイミング学習の目標は、あくまでも、運動を起こす時間を正確にすることにより運動誤差を最小にすることにある。ヒトでは小脳皮質のタイミング学習は認知機能とも深く関わっているようであるが、その詳細については今後の研究課題である。
関連項目
参考文献
- ↑
Ivry, R.B., Spencer, R.M., Zelaznik, H.N., & Diedrichsen, J. (2002).
The cerebellum and event timing. Annals of the New York Academy of Sciences, 978, 302-17. [PubMed:12582062] [WorldCat] [DOI] - ↑
Christian, K.M., & Thompson, R.F. (2003).
Neural substrates of eyeblink conditioning: acquisition and retention. Learning & memory (Cold Spring Harbor, N.Y.), 10(6), 427-55. [PubMed:14657256] [WorldCat] [DOI] - ↑
Ito, M., Sakurai, M., & Tongroach, P. (1982).
Climbing fibre induced depression of both mossy fibre responsiveness and glutamate sensitivity of cerebellar Purkinje cells. The Journal of physiology, 324, 113-34. [PubMed:7097592] [PMC] [WorldCat] [DOI] - ↑
Ward, L.M. (2003).
Synchronous neural oscillations and cognitive processes. Trends in cognitive sciences, 7(12), 553-9. [PubMed:14643372] [WorldCat] - ↑
D'Angelo, E., Koekkoek, S.K., Lombardo, P., Solinas, S., Ros, E., Garrido, J., ..., & De Zeeuw, C.I. (2009).
Timing in the cerebellum: oscillations and resonance in the granular layer. Neuroscience, 162(3), 805-15. [PubMed:19409229] [WorldCat] [DOI] - ↑
Llinás, R., & Yarom, Y. (1986).
Oscillatory properties of guinea-pig inferior olivary neurones and their pharmacological modulation: an in vitro study. The Journal of physiology, 376, 163-82. [PubMed:3795074] [PMC] [WorldCat] [DOI] - ↑
Kitazawa, S., & Wolpert, D.M. (2005).
Rhythmicity, randomness and synchrony in climbing fiber signals. Trends in neurosciences, 28(11), 611-9. [PubMed:16182386] [WorldCat] [DOI] - ↑ Ito M.
The cerebellum: Brain for an Implicit Self.
FT Press, New York, 2011 - ↑ 永雄総一, 山崎匡
生体の科学 2012, 63:3-10. - ↑ 10.0 10.1
Yamazaki, T., & Tanaka, S. (2009).
Computational models of timing mechanisms in the cerebellar granular layer. Cerebellum (London, England), 8(4), 423-32. [PubMed:19495900] [PMC] [WorldCat] [DOI] - ↑ http://cerebellum.neuroinf.jp/