「性行動の神経回路」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (2人の利用者による、間の16版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | <div align="right"> | ||
<font size="+1">[http://researchmap.jp/read0007804 岡 | <font size="+1">[http://researchmap.jp/read0007804 岡 良隆]</font><br> | ||
''東京大学大学院理学系研究科 生物科学専攻''<br> | ''東京大学大学院理学系研究科 生物科学専攻''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2016年5月17日 原稿完成日:2021年10月11日<br> | ||
担当編集委員:[http://researchmap.jp/tsuyoshimiyakawa 宮川 剛] | 担当編集委員:[http://researchmap.jp/tsuyoshimiyakawa 宮川 剛](藤田医科大学)<br> | ||
</div> | </div> | ||
英:neural circuit for sexual behavior | |||
{{box|text= | {{box|text= 一般に動物は、繁殖期になると、日長や温度などの外界の環境に依存して生殖腺(性腺)を発達させると共に、非繁殖期には示さない、求愛行動をはじめとする、生殖に関係した一連の性行動を行うようになる。この時、生殖腺の発達は、脳の情報処理システムが外界の環境の情報を適切に処理し、それを主に視床下部のニューロンに伝え、さらにその情報を脳下垂体という脳と内分泌系のインターフェースに伝えて、脳下垂体ホルモンを放出させ、末梢の生殖腺を刺激することにより起きる。一方、視床下部のニューロンは、繁殖期特有の性行動の賦活化にも極めて重要なはたらきをしている。この時に重要なのは、生殖腺の発達と性行動が、タイミング良く進むように協調的に調節されることである。さらに、いずれの現象においても、雌雄でそれらがうまく足並みを揃えて調節されることが生殖の成功に繋がり、無事に子孫を残すことができる。このようなしくみは、神経系と内分泌系の協調的な調節機能により実現されている。}} | ||
== 研究の歴史 == | |||
[[image:性行動の神経回路1.png|thumb|300px|'''図1. ステロイド取り込み細胞のオートラジオグラム'''<br>トリチウム標識エストラジオール17βの結合するニューロンの脳内分布を、一般化したほ乳類脳の水平断面(上図)および矢状断面(下図)に丸印でプロットしたもの。文献<ref name=Morrel1978/>より改変。]] | |||
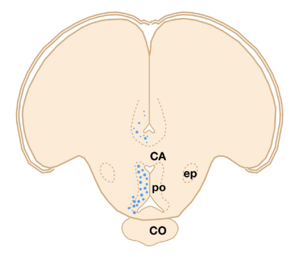
[[image:性行動の神経回路2A.png|thumb|300px|'''図2. キンギョにおけるエストロゲン感受性ニューロンの分布(オートラジオグラム)'''<br>トリチウム標識したエストラジオール17βを結合した脳内のニューロンを丸印で示す。CA:[[前交連]]、PO:[[視索前野]]、CO:[[視交差]]、ep:[[脚間核]]。文献<ref name=ref3><pubmed>721971</pubmed></ref>より改変。]] | |||
「[[性行動]]」と「[[生殖行動]]」は似ているが、後者が生殖の行為そのものを指すことが多いのに対して、前者は生殖に関わる一連のすべての行動パターンの連鎖を指す、より広義の用語として用いられることが多い。本項では、より広義の用語である「性行動」について解説する。性行動を引き起こす[[中枢神経系]]のしくみを科学的な研究の対象として考えるきっかけを作ったのは、1973年に[[wj:ノーベル医学生理学賞|ノーベル医学生理学賞]]を受賞した[[wj:カール・フォン・フリッシュ|フォン・フリッシュ]](K. von Frisch)、[[wj:コンラート・ローレンツ|ローレンツ]](K. Lorenz)、[[wj:ニコ・ティンバーゲン|ティンバーゲン]](N. Tinbergen)の3人の功績によるところが大きい。 | |||
[[生得的行動]]([[本能行動]]とも言う)を触発する最適刺激が,あるときには弱い反応しか起こさないことやまったく効果を与えないことがある。このように、外的刺激の変化によらず行動の閾値が変わったりする場合、それは動物の「内的要因」の強さの変化に起因すると考えられる。逆に、内的要因が強まると、解発刺激がなくても行動が解発されるような応答の閾値の極端な低下が見られることもある。これらのことから,ティンバーゲンは行動の自発性の原因となる内的要因が「行動の動機づけ」を決定する、と考えた。ティンバーゲンは、生まれつき動物に備わっているような生得的反応の内的・外的な要因について詳細に解析していたが、[[ホルモン]]の役割については特に注目していた。そして、ホルモンは中枢神経系に作用し、本能的活動と特に関係深い[[感覚神経系]]の[[興奮性]]を高めるように作用するのではないか、と考えた。性行動は生得的行動の中でも、例えば、ティンバーゲンの[[wj:トゲウオ|トゲウオ]]の性行動の解析のように、上記の行動学者達が好んで研究例として取り上げたものである<ref>'''岡良隆'''<br>環境に適応した行動を発言させる脊椎動物神経系・内分泌系のしくみ<br>岡・蟻川編 「行動とコミュニケーション」<br> シリーズ21世紀の動物科学 1998: 東京. p. 197-226. 2</ref>。 | |||
= | このような動物行動学者のノーベル賞受賞に触発され、特に、こうした動物行動学が初期に盛んであったドイツを中心として、生得的行動の神経機構に対する実証可能な作業仮説をたてて、それを神経生物学的な手法で解析しようとする、[[神経行動学]]([[ニューロエソロジー]] [[neuroethology]])という学問分野が、ヨーロッパから始まり、次第に世界的に研究分野として広まっていった<ref>'''Ewert J.-P. (1980).'''<br>Neuroethology. Springer, Berlin, ISBN 3-540-09790-2</ref>。 | ||
一方、ホルモンの機能を研究する内分泌学者の一部にも、動物が[[繁殖期]]に見せる性行動がホルモンによる調節を受けることに興味を寄せる研究者がいた。例えば、[[カエル]]においては次のような一連の研究がなされている。カエルは産卵期になると生息地から水辺の繁殖地へと移動し、つがいを形成するが、このとき、オスは[[メイティングコール]]([[mating call]])とよばれる鳴き声を発し、メスをひきつける。メイティングコールに対する[[性ステロイド]](生殖腺で[[コレステロール]]から合成される性ホルモン)の影響に関しては、脳内への性ステロイドの局所投与や生殖腺除去実験などの多数の研究が見られる<ref><pubmed> 301849 </pubmed></ref><ref><pubmed> 5933272 </pubmed></ref>。これらの実験から、性ホルモンの影響を受けて性行動を促進する脳部位としては脳の[[視索前野]]や[[視床下部]]が重要な脳部位である事がわかってきた。 | |||
性ステロイドは、生殖腺で作られ、いわゆる[[二次性徴]]を促し生殖そのものを可能にするという生物学的作用をもつが、同じ性ステロイドが性行動を同時に促進的に調節することにより、生殖と性行動を同時に調節するという、理にかなった調節が可能となっている。このような性行動の研究において、ホルモンと神経系の関係が様々な角度から解析された好例としては、雌[[ラット]]が交尾時に示す[[ロードシス行動]](メスがオスの[[マウンティング]]をやりやすくするように背中を反らせる行動)がある<ref name=Morrel1978>'''Morrel, J.I., & Pfaff, D.W. (1978).'''<br>A Neuroendocrine Approach to Brain Function: Localization of Sex Steroid Concentrating Cells in Vertebrate Brains. American Zoologist, 18(3), 447-60.</ref>。さらに、2000年以降、社会行動の神経機構の研究が盛んになると同時に、[[光遺伝学]]や[[designer receptor exclusively activated by designer drugs]] ([[DREADD]])を用いた[[化学遺伝学]]などの手法の開発が進み、雌雄のマウスそれぞれに特異的な、性行動も含めた社会行動の神経機構についての研究も[[w:Catherine Dulac|Dulac]]らにより強力に推進されている<ref name=Li2018><pubmed> 30059820 </pubmed></ref>。 | |||
== 性ステロイドホルモンと性行動 == | == 性ステロイドホルモンと性行動 == | ||
[[image: | [[image:性行動の神経回路2B.png|thumb|300px|'''図3. オス・キンギョの脳局所破壊により性行動に有意な阻害のあった部位'''<br>局所破壊された脳部位をシェードで示す。終脳腹側野前交連上核(Vs)と終脳腹側野腹側部の後方部(pVv)、および視索前野脳室周囲部(NPP)の局所的脳破壊により、オスの性行動が有意に阻害された。数字は視索前野脳室周囲部の前端を0とした位置をµmで示す。<br>文献<ref name=Koyama1984></ref>より改変]] | ||
[[image: | [[image:性行動の神経回路2C.png|thumb|300px|'''図4. オス・ヒメマスの脳局所電気刺激により性行動が特異的に引き起こされた部位'''<br>脳の左側には求愛行動(アプローチA、アプローチ・クイバリングAQ、転位行動DA)が生じた脳の刺激部位が、刺激の閾値の大きさに応じた記号で示されている。脳の右側には放精行動(スポーニング・アクトSp.Act)が生じた脳の刺激部位が、刺激の閾値の大きさに応じた記号で示されている。求愛行動では■、▲、●が、放精行動では★が最も有効な部位であり、それらは終脳腹側野前交連上核(Vs)および視索前野脳室周囲部(NPP)に局在していた。<br>文献<ref name=Satou1984><pubmed> 6393162 </pubmed></ref>より改変]] | ||
[[ | |||
1970年代に、性ステロイドホルモンを用いた[[オートラジオグラフィー]]の研究から、性ステロイドを取り込む脳内ニューロンの分布について、[[哺乳類]]、[[両生類]]、[[魚類]]等を用いて研究が行なわれた。その結果、動物によらず、視索前野、[[外側中隔野]]、[[扁桃体]]、視床下部、[[海馬]]、[[中脳灰白質]]等の脳部位に性ステロイドを感受するニューロンが分布していることがわかった('''図1''')。 | |||
興味深いことに、これらの脳部位の多くは、メス[[ラット]]の[[ロードシス]]行動などに深く関与することが多くの研究から明らかになっている。たとえば、視床下部[[腹内側核]]や中脳灰白質は、それらの脳部位を破壊すると性行動が阻害され、電気刺激すると性行動が誘起される<ref name=Pfaff1980>'''D.W. Pfaff'''<br>Estrogens and Brain Function.<br>New York, Heidelberg, Berlin: 1980, Springer-Verlag. 281</ref>。したがって、性ステロイドがこれらの脳部位のニューロンに直接結合することによって、それらのニューロンの活動状態(興奮性)に影響を与え、それが性行動を制御する神経回路を賦活化してロードシス行動が起こることが考えられる。 | |||
一方、[[キンギョ]]などの魚類の脳においても[[エストロゲン]]などの性ステロイドを取り込むニューロンの分布が調べられたが('''図2''')<ref name=ref3><pubmed>721971</pubmed></ref>、多くのステロイド取り込み細胞の見られた[[終脳腹側野前交連上核]]Vsとよばれる部位や視索前野は、脳の局所破壊を行うことによってオスキンギョの性行動が阻害され('''図3''')<ref name=Koyama1984><pubmed> 6610412 </pubmed></ref>、電気刺激することによって雌雄の[[ヒメマス]]の性行動が促進される('''図4''')ような脳部位<ref name=Satou1984 />と極めて似かよった部位であった。 | |||
メスの性ステロイドであるエストロゲンが中枢神経系に及ぼす影響については、従来多数の報告がある。エストロゲンは標的ニューロンの[[受容体]]に結合した後、核移行して標的遺伝子の[[転写]]活性を調節することによりゆっくりと効果を及ぼす遺伝子レベルの調節が主であると考えられていた。しかしながら、[[Gタンパク質共役型]]の膜レセプターを介する速いノンゲノミック作用も知られている。ロードシスなどの性行動に対する脳内性ステロイド感受性ニューロンの性行動への関与に関しても、まずは性ステロイドの遺伝子レベルの調節か非遺伝子レベルの調節かをまず厳密に区別し、この作用機構について分子・細胞生物学的観点から今一度見直す必要がある。性行動に関与する脳部位や、性ステロイドの性行動に対する影響などの研究は1970年代から1980年代にかけて比較的盛んに行われていたが、その後研究の大きな進展がないままになっていた。 | |||
ところが、最近、[[光遺伝学]]の技術の発展により、上述の視床下部[[腹内側核]]ニューロンにおいて、[[エストロゲン受容体]]を発現する少数ニューロンの特異的活性化により、オスマウスのマウンティング様の行動が起きるが、それらの刺激を強くしていくと攻撃行動に転じていく、と言う興味ある研究結果が報告されている<ref><pubmed> 24739975 </pubmed></ref>(ただし、この場合、エストロゲン受容体発現ニューロンはニューロンのマーカーとして用いられているだけで、これらのオスの行動にエストロゲンが関わっているのかはよくわかっていない)。このように、遺伝学的技術をイメージングや電気生理学的・形態学的手法と組み合わせる事により、古くから興味を持たれていた問題に対して新たなアプローチが可能となり、性行動の神経回路に対する理解が飛躍的に進むことが期待される。 | |||
以上のように、性行動が性ステロイドホルモンの影響を受ける事は、生殖腺の発達と性行動が協調的にタイミング良く調節されるのに、理にかなったしくみであると考えられる。この良い例として、ほ乳類において生殖の中枢制御に中心的なはたらきをする[[キスペプチン]]ニューロンが、同時に雌マウスの性行動も制御している(RP3Vとよばれる部位に局在するキスペプチンニューロンは、[[正中隆起]]に投射する[[GnRH]]ニューロンに入力してパルス状のGnRH放出を引き起こす事で、生殖腺の発達調節をすることが知られているが、一方で、そのニューロンがメスのオス選択、ひいてはロードシス行動に必須であることを実験的に示した)、と言う研究成果が報告されている<ref><pubmed> 29374161 </pubmed></ref>。 | |||
== ペプチドホルモンと性行動~GnRHを例として~ == | == ペプチドホルモンと性行動~GnRHを例として~ == | ||
[[image:性行動の神経回路3.png|thumb|300px|''' | [[image:性行動の神経回路3.png|thumb|300px|'''図5. 3つのGnRH系の電気生理学的特徴と形態学的特徴およびGnRHのアミノ酸配列'''<br>ここに示す[[シクリッド]]の一種[[ドワーフグーラミー]]においては、進化の過程において3つのGnRHパラログがすべて保存されており、それぞれ異なるニューロン群がそれらのパラログ遺伝子を発現し(赤丸;産物のアミノ酸配列の違いにも注目)、機能も異なっている(GnRH2とGnRH3は脳内で神経修飾作用、[[GnRH1]]は[[脳下垂体]]Pitに軸索投射をして下垂体の生殖腺刺激ホルモンの放出を促進する)。また、それらは、異なる電気生理学的特徴(電気活動のトレースは自発的活動電位発火パターンを示す;神経修飾作用をもつ[[GnRH2]]と[[GnRH3]]では規則的[[ペースメーカー]]活動、神経分泌作用をもつGnRH1は不規則な活動)と[[軸索]]投射パターン(GnRH2とGnRH3では脳内への広範な軸索投射、GnRH1では脳下垂体への軸索投射)を示すことがわかっている<ref name=Karigo2013 />。<br>文献<ref name=Karigo2013 /><ref name=Yamamoto1995><pubmed>7636018</pubmed></ref>より改変]] | ||
脳内の代表的なペプチドホルモンとして、視床下部ニューロンで産生され、脳底の[[正中隆起]]とよばれる部位の[[脳下垂体門脈]]血中に放出され、[[脳下垂体前葉]]に運ばれて[[脳下垂体ホルモン]]放出を促進・抑制する、いわゆる[[向下垂体ホルモン]](hypophysiotropic hormone)とよばれる一群のホルモンがある。 | |||
ここで解説する[[生殖腺刺激ホルモン放出ホルモン]]([[gonadotropin-releasing hormone]], [[GnRH]])は、生殖を中枢制御する働きをもつ視床下部ホルモンとして、1977年ノーベル生理学・医学賞を受賞した[[wj:ロジェ・ギルマン|ギルマン]]と[[wj:ロジェ・ギルマン|シャリー]]により発見された代表的な視床下部の向下垂体ホルモンである。近年[[免疫組織化学]]および[[in situ hybridization]](ISH)を用いた形態学的な研究がなされ、脊椎動物脳内では、形態的・機能的に異なる以下の3つのGnRH神経系が存在している(GnRHには3つの[[パラログ]]遺伝子、[[gnrh1]], [[gnrh2]], [[gnrh3]]が存在しており、それぞれのパラログが異なるニューロン群に発現し、異なる機能を果たす)という基本的コンセンサスが得られている('''図5''')<ref name=Karigo2013 /><ref name=Yamamoto1995 />。 | |||
#'''視索前野GnRH1(POA-GnRH)神経系''':視索前野の[[細胞体]]から軸索を正中隆起に投射して、[[下垂体門脈系]]を介して下垂体からの[[性腺刺激ホルモン]]放出を促進する(ただし、[[wj:真骨魚|真骨魚]]においては直接下垂体前葉に投射)。遺伝子パラログgnrh1を発現。 | |||
#'''中脳GnRH2(Midbrain GnRH)神経系''':[[中脳被蓋]]に細胞体をもち、脳内に広く軸索投射して主に神経修飾作用をもつ(正中隆起には投射しない)。遺伝子パラログgnrh2を発現。 | |||
#'''終神経GnRH3(Terminal nerve-GnRH; TN-GnRH)神経系''':[[終脳]]と[[嗅球]]の境界部に細胞塊を形成し、軸索を脳全体に広く投射しており、主に神経修飾作用をもつ(正中隆起には投射しない)。遺伝子パラログgnrh3を発現。 | |||
この中で、性行動の神経回路と最も深い関わりを持つのが'''3.'''の終神経GnRH3ニューロンである。Okaらは'''図5'''に示す[[ドワーフグーラミー]]や[[GFP]][[トランスジェニックメダカ]]を用いてこれらのニューロンの形態学的・電気生理学的特徴の解析を行うと同時に、これらのニューロンの細胞塊を破壊した[[熱帯魚]]の行動学的解析を行い、これらのニューロンが作るGnRH3ペプチドが、脳内に極めて広く張り巡らされた軸索から放出されて引き起こされる神経修飾作用が、熱帯魚の性行動レパートリーの一つである[[巣作り行動]]などの行動の動機付けを調節している、と言う説を提唱している<ref name=Karigo2013><pubmed> 24312079 </pubmed></ref><ref name=Yamamoto1997><pubmed>9208402</pubmed></ref>。最近、遺伝子改変メダカを用いた行動学的実験や電気生理学的実験を組み合わせた研究により、この作業仮説を支持するような実験結果が得られ、今後のさらなる研究が期待されている<ref><pubmed> 24385628 </pubmed></ref>。GnRH2とGnRH3は視床下部外GnRH系とも呼ばれるが、それらの機能については、文献を参照のこと<ref name=Umatani2019><pubmed>31367467</pubmed></ref>。ラットや[[ウシガエル]]の[[交感神経節]]には、これらのGnRHの一部が投射していて、後期の[[遅いシナプス後電位]](late slow synaptic potential)を発生させている、ということが知られており、同様の神経修飾作用が脳内でもはたらいているのではないかと考えられる。 | |||
[[ファイル:Oka Sexual Behavior Fig6.jpg|サムネイル|'''図6. マウスにおいて、性特異的に社会的な信号を処理して行動を引き起こすのに関与する神経回路'''<br> | |||
'''(a)'''性特異的な社会的信号および社会行動の制御に関わる脳部位。主に鋤鼻神経回路と神経修飾系より成る。<br>'''(b)'''オス(青)とメス(赤)における本能的社会行動の制御神経回路。攻撃行動、性行動、および子育て行動は、それぞれ異なる視床下部神経核によって制御される。腹内側核腹外側部(VMHvl)、内側視索前野(MPOA)等は雌雄で同じような社会性行動を、メスのVMHvll(VMHvlの外側部)やAVPVは雌雄で異なる行動を、それぞれ引き起こすことが知られている。それぞれの視床下部神経核は鋤鼻神経系(扁桃体内側核、分界条床核)からの入力を受け、異なる神経修飾物質(ホルモンや神経ペプチド)によって、性特異的な調節を受ける。<br> | |||
略語:AOB[[副嗅球]]、AVPV[[前腹側室周囲核]]、BNST[[分界条床核]]、DR[[背側縫線核]]、MeA[[扁桃体内側核]]、MPOA[[内側視索前野]]、PVN[[視床下部室傍核]]、VMHvl[[視床下部]][[腹内側核腹外側部]]、VMHvllおよびVMHvm VMHvlの外側部と内側部、VNO[[鋤鼻器官]]、VTA[[腹側被蓋野]]。<br> | |||
文献<ref name=Li2018 />より[http://creativecommons.org/licenses/by/4.0/ CC BY license]に基づき引用]] | |||
== フェロモンと性行動 == | |||
[[フェロモン]]が様々な動物の性行動を始めとする行動に関与するという研究は意外と古く1970年代からあったが、神経科学における最先端の各種研究ツールの発達に加えて、社会行動という観点からフェロモンの関与する性行動の脳内におけるしくみについて興味が持たれ、盛んに研究されてくるようになった。 | |||
Dulacらは、以前よりフェロモンと性行動の関係についての研究も多い上に、最近の光遺伝学や化学遺伝学、さらには各種の遺伝子改変動物作成等の技術開発も進んでいるマウスを中心として、交配、攻撃、子育てなどを含む様々な社会的行動の神経機構について、その雌雄差にも着目して最近の研究を解説している<ref name=Li2018 />。それによると、特に、[[鋤鼻神経系]](vomeronasal system)が、[[主嗅覚系]]と共に、異性からのフェロモン刺激を受取り、雌雄それぞれに特異的な行動を引き起こすと考えられている。また、雌雄に特異的な社会行動は周産期の生殖腺によって作られるホルモンによる影響を受けること、しかし一方で、ある種の状況においては異性が示す行動を行うこともある事が知られてきた。 | |||
こうしたことは、哺乳類以外の脊椎動物においても広く見られる現象であり、こうした社会行動の発現に関わる神経回路は、少なくともその一部は雌雄で共有されていると共に、社会的な経験や動物の生理学的な状態に依存して形成される、と考えられている('''図6''')。 | |||
== 関連項目 == | == 関連項目 == | ||
* 性腺刺激ホルモン | * [[性腺刺激ホルモン]] | ||
* ステロイド | * [[ステロイド]] | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2022年12月1日 (木) 08:25時点における最新版
岡 良隆
東京大学大学院理学系研究科 生物科学専攻
DOI:10.14931/bsd.7121 原稿受付日:2016年5月17日 原稿完成日:2021年10月11日
担当編集委員:宮川 剛(藤田医科大学)
英:neural circuit for sexual behavior
一般に動物は、繁殖期になると、日長や温度などの外界の環境に依存して生殖腺(性腺)を発達させると共に、非繁殖期には示さない、求愛行動をはじめとする、生殖に関係した一連の性行動を行うようになる。この時、生殖腺の発達は、脳の情報処理システムが外界の環境の情報を適切に処理し、それを主に視床下部のニューロンに伝え、さらにその情報を脳下垂体という脳と内分泌系のインターフェースに伝えて、脳下垂体ホルモンを放出させ、末梢の生殖腺を刺激することにより起きる。一方、視床下部のニューロンは、繁殖期特有の性行動の賦活化にも極めて重要なはたらきをしている。この時に重要なのは、生殖腺の発達と性行動が、タイミング良く進むように協調的に調節されることである。さらに、いずれの現象においても、雌雄でそれらがうまく足並みを揃えて調節されることが生殖の成功に繋がり、無事に子孫を残すことができる。このようなしくみは、神経系と内分泌系の協調的な調節機能により実現されている。
研究の歴史
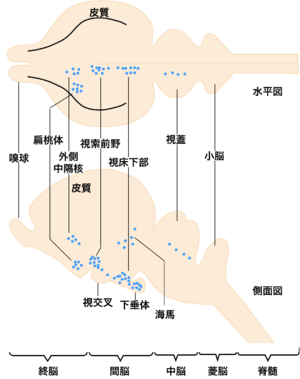
トリチウム標識エストラジオール17βの結合するニューロンの脳内分布を、一般化したほ乳類脳の水平断面(上図)および矢状断面(下図)に丸印でプロットしたもの。文献[1]より改変。
「性行動」と「生殖行動」は似ているが、後者が生殖の行為そのものを指すことが多いのに対して、前者は生殖に関わる一連のすべての行動パターンの連鎖を指す、より広義の用語として用いられることが多い。本項では、より広義の用語である「性行動」について解説する。性行動を引き起こす中枢神経系のしくみを科学的な研究の対象として考えるきっかけを作ったのは、1973年にノーベル医学生理学賞を受賞したフォン・フリッシュ(K. von Frisch)、ローレンツ(K. Lorenz)、ティンバーゲン(N. Tinbergen)の3人の功績によるところが大きい。
生得的行動(本能行動とも言う)を触発する最適刺激が,あるときには弱い反応しか起こさないことやまったく効果を与えないことがある。このように、外的刺激の変化によらず行動の閾値が変わったりする場合、それは動物の「内的要因」の強さの変化に起因すると考えられる。逆に、内的要因が強まると、解発刺激がなくても行動が解発されるような応答の閾値の極端な低下が見られることもある。これらのことから,ティンバーゲンは行動の自発性の原因となる内的要因が「行動の動機づけ」を決定する、と考えた。ティンバーゲンは、生まれつき動物に備わっているような生得的反応の内的・外的な要因について詳細に解析していたが、ホルモンの役割については特に注目していた。そして、ホルモンは中枢神経系に作用し、本能的活動と特に関係深い感覚神経系の興奮性を高めるように作用するのではないか、と考えた。性行動は生得的行動の中でも、例えば、ティンバーゲンのトゲウオの性行動の解析のように、上記の行動学者達が好んで研究例として取り上げたものである[3]。
このような動物行動学者のノーベル賞受賞に触発され、特に、こうした動物行動学が初期に盛んであったドイツを中心として、生得的行動の神経機構に対する実証可能な作業仮説をたてて、それを神経生物学的な手法で解析しようとする、神経行動学(ニューロエソロジー neuroethology)という学問分野が、ヨーロッパから始まり、次第に世界的に研究分野として広まっていった[4]。
一方、ホルモンの機能を研究する内分泌学者の一部にも、動物が繁殖期に見せる性行動がホルモンによる調節を受けることに興味を寄せる研究者がいた。例えば、カエルにおいては次のような一連の研究がなされている。カエルは産卵期になると生息地から水辺の繁殖地へと移動し、つがいを形成するが、このとき、オスはメイティングコール(mating call)とよばれる鳴き声を発し、メスをひきつける。メイティングコールに対する性ステロイド(生殖腺でコレステロールから合成される性ホルモン)の影響に関しては、脳内への性ステロイドの局所投与や生殖腺除去実験などの多数の研究が見られる[5][6]。これらの実験から、性ホルモンの影響を受けて性行動を促進する脳部位としては脳の視索前野や視床下部が重要な脳部位である事がわかってきた。
性ステロイドは、生殖腺で作られ、いわゆる二次性徴を促し生殖そのものを可能にするという生物学的作用をもつが、同じ性ステロイドが性行動を同時に促進的に調節することにより、生殖と性行動を同時に調節するという、理にかなった調節が可能となっている。このような性行動の研究において、ホルモンと神経系の関係が様々な角度から解析された好例としては、雌ラットが交尾時に示すロードシス行動(メスがオスのマウンティングをやりやすくするように背中を反らせる行動)がある[1]。さらに、2000年以降、社会行動の神経機構の研究が盛んになると同時に、光遺伝学やdesigner receptor exclusively activated by designer drugs (DREADD)を用いた化学遺伝学などの手法の開発が進み、雌雄のマウスそれぞれに特異的な、性行動も含めた社会行動の神経機構についての研究もDulacらにより強力に推進されている[7]。
性ステロイドホルモンと性行動
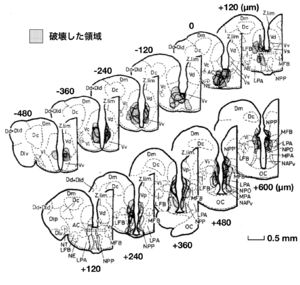
局所破壊された脳部位をシェードで示す。終脳腹側野前交連上核(Vs)と終脳腹側野腹側部の後方部(pVv)、および視索前野脳室周囲部(NPP)の局所的脳破壊により、オスの性行動が有意に阻害された。数字は視索前野脳室周囲部の前端を0とした位置をµmで示す。
文献[8]より改変
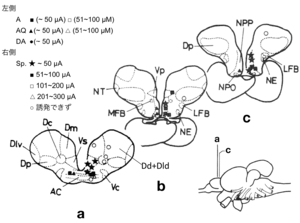
脳の左側には求愛行動(アプローチA、アプローチ・クイバリングAQ、転位行動DA)が生じた脳の刺激部位が、刺激の閾値の大きさに応じた記号で示されている。脳の右側には放精行動(スポーニング・アクトSp.Act)が生じた脳の刺激部位が、刺激の閾値の大きさに応じた記号で示されている。求愛行動では■、▲、●が、放精行動では★が最も有効な部位であり、それらは終脳腹側野前交連上核(Vs)および視索前野脳室周囲部(NPP)に局在していた。
文献[9]より改変
1970年代に、性ステロイドホルモンを用いたオートラジオグラフィーの研究から、性ステロイドを取り込む脳内ニューロンの分布について、哺乳類、両生類、魚類等を用いて研究が行なわれた。その結果、動物によらず、視索前野、外側中隔野、扁桃体、視床下部、海馬、中脳灰白質等の脳部位に性ステロイドを感受するニューロンが分布していることがわかった(図1)。
興味深いことに、これらの脳部位の多くは、メスラットのロードシス行動などに深く関与することが多くの研究から明らかになっている。たとえば、視床下部腹内側核や中脳灰白質は、それらの脳部位を破壊すると性行動が阻害され、電気刺激すると性行動が誘起される[10]。したがって、性ステロイドがこれらの脳部位のニューロンに直接結合することによって、それらのニューロンの活動状態(興奮性)に影響を与え、それが性行動を制御する神経回路を賦活化してロードシス行動が起こることが考えられる。
一方、キンギョなどの魚類の脳においてもエストロゲンなどの性ステロイドを取り込むニューロンの分布が調べられたが(図2)[2]、多くのステロイド取り込み細胞の見られた終脳腹側野前交連上核Vsとよばれる部位や視索前野は、脳の局所破壊を行うことによってオスキンギョの性行動が阻害され(図3)[8]、電気刺激することによって雌雄のヒメマスの性行動が促進される(図4)ような脳部位[9]と極めて似かよった部位であった。
メスの性ステロイドであるエストロゲンが中枢神経系に及ぼす影響については、従来多数の報告がある。エストロゲンは標的ニューロンの受容体に結合した後、核移行して標的遺伝子の転写活性を調節することによりゆっくりと効果を及ぼす遺伝子レベルの調節が主であると考えられていた。しかしながら、Gタンパク質共役型の膜レセプターを介する速いノンゲノミック作用も知られている。ロードシスなどの性行動に対する脳内性ステロイド感受性ニューロンの性行動への関与に関しても、まずは性ステロイドの遺伝子レベルの調節か非遺伝子レベルの調節かをまず厳密に区別し、この作用機構について分子・細胞生物学的観点から今一度見直す必要がある。性行動に関与する脳部位や、性ステロイドの性行動に対する影響などの研究は1970年代から1980年代にかけて比較的盛んに行われていたが、その後研究の大きな進展がないままになっていた。
ところが、最近、光遺伝学の技術の発展により、上述の視床下部腹内側核ニューロンにおいて、エストロゲン受容体を発現する少数ニューロンの特異的活性化により、オスマウスのマウンティング様の行動が起きるが、それらの刺激を強くしていくと攻撃行動に転じていく、と言う興味ある研究結果が報告されている[11](ただし、この場合、エストロゲン受容体発現ニューロンはニューロンのマーカーとして用いられているだけで、これらのオスの行動にエストロゲンが関わっているのかはよくわかっていない)。このように、遺伝学的技術をイメージングや電気生理学的・形態学的手法と組み合わせる事により、古くから興味を持たれていた問題に対して新たなアプローチが可能となり、性行動の神経回路に対する理解が飛躍的に進むことが期待される。
以上のように、性行動が性ステロイドホルモンの影響を受ける事は、生殖腺の発達と性行動が協調的にタイミング良く調節されるのに、理にかなったしくみであると考えられる。この良い例として、ほ乳類において生殖の中枢制御に中心的なはたらきをするキスペプチンニューロンが、同時に雌マウスの性行動も制御している(RP3Vとよばれる部位に局在するキスペプチンニューロンは、正中隆起に投射するGnRHニューロンに入力してパルス状のGnRH放出を引き起こす事で、生殖腺の発達調節をすることが知られているが、一方で、そのニューロンがメスのオス選択、ひいてはロードシス行動に必須であることを実験的に示した)、と言う研究成果が報告されている[12]。
ペプチドホルモンと性行動~GnRHを例として~
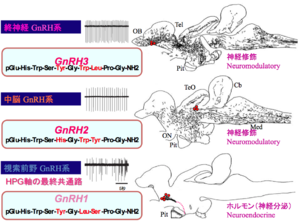
ここに示すシクリッドの一種ドワーフグーラミーにおいては、進化の過程において3つのGnRHパラログがすべて保存されており、それぞれ異なるニューロン群がそれらのパラログ遺伝子を発現し(赤丸;産物のアミノ酸配列の違いにも注目)、機能も異なっている(GnRH2とGnRH3は脳内で神経修飾作用、GnRH1は脳下垂体Pitに軸索投射をして下垂体の生殖腺刺激ホルモンの放出を促進する)。また、それらは、異なる電気生理学的特徴(電気活動のトレースは自発的活動電位発火パターンを示す;神経修飾作用をもつGnRH2とGnRH3では規則的ペースメーカー活動、神経分泌作用をもつGnRH1は不規則な活動)と軸索投射パターン(GnRH2とGnRH3では脳内への広範な軸索投射、GnRH1では脳下垂体への軸索投射)を示すことがわかっている[13]。
文献[13][14]より改変
脳内の代表的なペプチドホルモンとして、視床下部ニューロンで産生され、脳底の正中隆起とよばれる部位の脳下垂体門脈血中に放出され、脳下垂体前葉に運ばれて脳下垂体ホルモン放出を促進・抑制する、いわゆる向下垂体ホルモン(hypophysiotropic hormone)とよばれる一群のホルモンがある。
ここで解説する生殖腺刺激ホルモン放出ホルモン(gonadotropin-releasing hormone, GnRH)は、生殖を中枢制御する働きをもつ視床下部ホルモンとして、1977年ノーベル生理学・医学賞を受賞したギルマンとシャリーにより発見された代表的な視床下部の向下垂体ホルモンである。近年免疫組織化学およびin situ hybridization(ISH)を用いた形態学的な研究がなされ、脊椎動物脳内では、形態的・機能的に異なる以下の3つのGnRH神経系が存在している(GnRHには3つのパラログ遺伝子、gnrh1, gnrh2, gnrh3が存在しており、それぞれのパラログが異なるニューロン群に発現し、異なる機能を果たす)という基本的コンセンサスが得られている(図5)[13][14]。
- 視索前野GnRH1(POA-GnRH)神経系:視索前野の細胞体から軸索を正中隆起に投射して、下垂体門脈系を介して下垂体からの性腺刺激ホルモン放出を促進する(ただし、真骨魚においては直接下垂体前葉に投射)。遺伝子パラログgnrh1を発現。
- 中脳GnRH2(Midbrain GnRH)神経系:中脳被蓋に細胞体をもち、脳内に広く軸索投射して主に神経修飾作用をもつ(正中隆起には投射しない)。遺伝子パラログgnrh2を発現。
- 終神経GnRH3(Terminal nerve-GnRH; TN-GnRH)神経系:終脳と嗅球の境界部に細胞塊を形成し、軸索を脳全体に広く投射しており、主に神経修飾作用をもつ(正中隆起には投射しない)。遺伝子パラログgnrh3を発現。
この中で、性行動の神経回路と最も深い関わりを持つのが3.の終神経GnRH3ニューロンである。Okaらは図5に示すドワーフグーラミーやGFPトランスジェニックメダカを用いてこれらのニューロンの形態学的・電気生理学的特徴の解析を行うと同時に、これらのニューロンの細胞塊を破壊した熱帯魚の行動学的解析を行い、これらのニューロンが作るGnRH3ペプチドが、脳内に極めて広く張り巡らされた軸索から放出されて引き起こされる神経修飾作用が、熱帯魚の性行動レパートリーの一つである巣作り行動などの行動の動機付けを調節している、と言う説を提唱している[13][15]。最近、遺伝子改変メダカを用いた行動学的実験や電気生理学的実験を組み合わせた研究により、この作業仮説を支持するような実験結果が得られ、今後のさらなる研究が期待されている[16]。GnRH2とGnRH3は視床下部外GnRH系とも呼ばれるが、それらの機能については、文献を参照のこと[17]。ラットやウシガエルの交感神経節には、これらのGnRHの一部が投射していて、後期の遅いシナプス後電位(late slow synaptic potential)を発生させている、ということが知られており、同様の神経修飾作用が脳内でもはたらいているのではないかと考えられる。
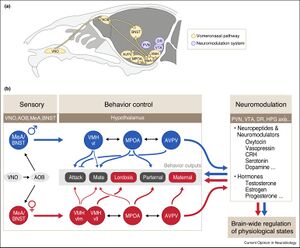
(a)性特異的な社会的信号および社会行動の制御に関わる脳部位。主に鋤鼻神経回路と神経修飾系より成る。
(b)オス(青)とメス(赤)における本能的社会行動の制御神経回路。攻撃行動、性行動、および子育て行動は、それぞれ異なる視床下部神経核によって制御される。腹内側核腹外側部(VMHvl)、内側視索前野(MPOA)等は雌雄で同じような社会性行動を、メスのVMHvll(VMHvlの外側部)やAVPVは雌雄で異なる行動を、それぞれ引き起こすことが知られている。それぞれの視床下部神経核は鋤鼻神経系(扁桃体内側核、分界条床核)からの入力を受け、異なる神経修飾物質(ホルモンや神経ペプチド)によって、性特異的な調節を受ける。
略語:AOB副嗅球、AVPV前腹側室周囲核、BNST分界条床核、DR背側縫線核、MeA扁桃体内側核、MPOA内側視索前野、PVN視床下部室傍核、VMHvl視床下部腹内側核腹外側部、VMHvllおよびVMHvm VMHvlの外側部と内側部、VNO鋤鼻器官、VTA腹側被蓋野。
文献[7]よりCC BY licenseに基づき引用
フェロモンと性行動
フェロモンが様々な動物の性行動を始めとする行動に関与するという研究は意外と古く1970年代からあったが、神経科学における最先端の各種研究ツールの発達に加えて、社会行動という観点からフェロモンの関与する性行動の脳内におけるしくみについて興味が持たれ、盛んに研究されてくるようになった。
Dulacらは、以前よりフェロモンと性行動の関係についての研究も多い上に、最近の光遺伝学や化学遺伝学、さらには各種の遺伝子改変動物作成等の技術開発も進んでいるマウスを中心として、交配、攻撃、子育てなどを含む様々な社会的行動の神経機構について、その雌雄差にも着目して最近の研究を解説している[7]。それによると、特に、鋤鼻神経系(vomeronasal system)が、主嗅覚系と共に、異性からのフェロモン刺激を受取り、雌雄それぞれに特異的な行動を引き起こすと考えられている。また、雌雄に特異的な社会行動は周産期の生殖腺によって作られるホルモンによる影響を受けること、しかし一方で、ある種の状況においては異性が示す行動を行うこともある事が知られてきた。
こうしたことは、哺乳類以外の脊椎動物においても広く見られる現象であり、こうした社会行動の発現に関わる神経回路は、少なくともその一部は雌雄で共有されていると共に、社会的な経験や動物の生理学的な状態に依存して形成される、と考えられている(図6)。
関連項目
参考文献
- ↑ 1.0 1.1 Morrel, J.I., & Pfaff, D.W. (1978).
A Neuroendocrine Approach to Brain Function: Localization of Sex Steroid Concentrating Cells in Vertebrate Brains. American Zoologist, 18(3), 447-60. - ↑ 2.0 2.1
Kim, Y.S., Stumpf, W.E., & Sar, M. (1978).
Topography of estrogen target cells in the forebrain of goldfish, Carassius auratus. The Journal of comparative neurology, 182(4), 611-20. [PubMed:721971] [WorldCat] [DOI] - ↑ 岡良隆
環境に適応した行動を発言させる脊椎動物神経系・内分泌系のしくみ
岡・蟻川編 「行動とコミュニケーション」
シリーズ21世紀の動物科学 1998: 東京. p. 197-226. 2 - ↑ Ewert J.-P. (1980).
Neuroethology. Springer, Berlin, ISBN 3-540-09790-2 - ↑
Wada, M., & Gorbman, A. (1977).
Relation of mode of administration of testosterone to evocation of male sex behavior in frogs. Hormones and behavior, 8(3), 310-9. [PubMed:301849] [WorldCat] [DOI] - ↑
Schmidt, R.S. (1966).
Central mechanisms of frog calling. Behaviour, 26(3), 251-85. [PubMed:5933272] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Li, Y., & Dulac, C. (2018).
Neural coding of sex-specific social information in the mouse brain. Current opinion in neurobiology, 53, 120-130. [PubMed:30059820] [WorldCat] [DOI] - ↑ 8.0 8.1
Koyama, Y., Satou, M., Oka, Y., & Ueda, K. (1984).
Involvement of the telencephalic hemispheres and the preoptic area in sexual behavior of the male goldfish, Carassius auratus: a brain-lesion study. Behavioral and neural biology, 40(1), 70-86. [PubMed:6610412] [WorldCat] [DOI] - ↑ 9.0 9.1
Satou, M., Oka, Y., Kusunoki, M., Matsushima, T., Kato, M., Fujita, I., & Ueda, K. (1984).
Telencephalic and preoptic areas integrate sexual behavior in hime salmon (landlocked red salmon, Oncorhynchus nerka): results of electrical brain stimulation experiments. Physiology & behavior, 33(3), 441-7. [PubMed:6393162] [WorldCat] [DOI] - ↑ D.W. Pfaff
Estrogens and Brain Function.
New York, Heidelberg, Berlin: 1980, Springer-Verlag. 281 - ↑
Lee, H., Kim, D.W., Remedios, R., Anthony, T.E., Chang, A., Madisen, L., ..., & Anderson, D.J. (2014).
Scalable control of mounting and attack by Esr1+ neurons in the ventromedial hypothalamus. Nature, 509(7502), 627-32. [PubMed:24739975] [PMC] [WorldCat] [DOI] - ↑
Hellier, V., Brock, O., Candlish, M., Desroziers, E., Aoki, M., Mayer, C., ..., & Bakker, J. (2018).
Female sexual behavior in mice is controlled by kisspeptin neurons. Nature communications, 9(1), 400. [PubMed:29374161] [PMC] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2 13.3
Karigo, T., & Oka, Y. (2013).
Neurobiological study of fish brains gives insights into the nature of gonadotropin-releasing hormone 1-3 neurons. Frontiers in endocrinology, 4, 177. [PubMed:24312079] [PMC] [WorldCat] [DOI] - ↑ 14.0 14.1
Yamamoto, N., Oka, Y., Amano, M., Aida, K., Hasegawa, Y., & Kawashima, S. (1995).
Multiple gonadotropin-releasing hormone (GnRH)-immunoreactive systems in the brain of the dwarf gourami, Colisa lalia: immunohistochemistry and radioimmunoassay. The Journal of comparative neurology, 355(3), 354-68. [PubMed:7636018] [WorldCat] [DOI] - ↑
Yamamoto, N., Oka, Y., & Kawashima, S. (1997).
Lesions of gonadotropin-releasing hormone-immunoreactive terminal nerve cells: effects on the reproductive behavior of male dwarf gouramis. Neuroendocrinology, 65(6), 403-12. [PubMed:9208402] [WorldCat] [DOI] - ↑
Okuyama, T., Yokoi, S., Abe, H., Isoe, Y., Suehiro, Y., Imada, H., ..., & Takeuchi, H. (2014).
A neural mechanism underlying mating preferences for familiar individuals in medaka fish. Science (New York, N.Y.), 343(6166), 91-4. [PubMed:24385628] [WorldCat] [DOI] - ↑
Umatani, C., & Oka, Y. (2019).
Multiple functions of non-hypophysiotropic gonadotropin releasing hormone neurons in vertebrates. Zoological letters, 5, 23. [PubMed:31367467] [PMC] [WorldCat] [DOI]