細胞増殖
石川 寛、中島 欽一
奈良先端科学技術大学院大学 バイオサイエンス研究科
DOI:10.14931/bsd.1843 原稿受付日:2012年8月23日 原稿完成日:2012年9月24日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
英語名:cell proliferation 独:Zellproliferation 仏:prolifération des cellules
細胞増殖とは、細胞の成長と分裂により細胞の数が増加することである。細胞増殖は、1つの母細胞が同一の染色体をもつ2つの娘細胞へ分裂する細胞分裂(cell division)によって起こり、細胞周期(cell cycle)によって調節されている。
細胞増殖の制御
細胞周期
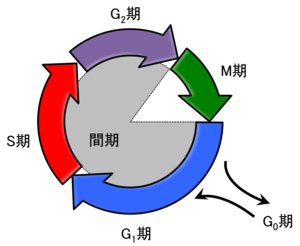
細胞は、まずその中身を倍加し、その後に二分することで増殖を行う。この倍加と分裂の循環を細胞周期(cell cycle)といい、生物の増殖には必要不可欠な機構である。細胞周期の最も基本的な機能は核内の膨大な量のDNAを正確に複製し、そのDNAを2つの娘細胞に正確に分配することである。この二つの重要な時期はそれぞれS期(DNA Synthesis)、M期(Mitosis)と呼ばれる。さらに、細胞の分裂にはタンパク質、細胞小器官の倍加と分離も必要であるが、ほとんどの細胞ではタンパク質と細胞小器官の倍加に必要な時間は、DNAの倍加と分離に必要な時間よりもはるかに長い。そのため、細胞周期には“間の時期”(Gap phase)として、G1期(G1 phase)とG2期(G2 phase)があり、M期の終わりからS期の始まりまでをG1期、S期の終わりからM期の始めまでをG2期と呼ぶ。これらをまとめると、真核生物の細胞周期は全部で4つの期間、すなわちG1期、S期、G2期、M期に分けることができ、G1期、S期、G2期をまとめて間期と呼ぶ。また、G1期において、細胞外の環境が分裂に適切でない場合、G0期と呼ばれる休止状態に入る場合があると考えられており、数日、あるいは数年にわたって増殖せずにいることもある(表1)(図1)[1]。
| G0期 | 制止/休止状態 | |
| 間期 | G1期 | 外部環境のチェック |
| S期 | DNAの合成 | |
| G2期 | タンパク質、細胞小器官の合成、外部環境のチェック | |
| M期 | 有糸分裂、細胞質分裂 |
細胞周期制御系
細胞周期は細胞周期制御系によって調節されており、サイクリン依存性キナーゼ(cyclin-dependent kinase, Cdk)ファミリーがその中心タンパク質として知られている。これらのキナーゼ活性が細胞周期に依存して上下することにより、細胞周期の進行、停止を調節する。この細胞周期依存的な活性はCdk調節因子であるサイクリン(cyclin)に依存しており、Cdkとサイクリンが結合したサイクリン−Cdk複合体(cyclin-Cdk complex)を形成した時、キナーゼ活性を示し細胞周期が進行する。脊椎動物には主に4種類のCdkと4種類のサイクリンが存在し、それぞれの時期を制御している(表2)[1]。
上記のサイクリンの合成と分解が細胞周期におけるCdk活性を調節する主要な要因であるが、その他にもCdk活性を微調整する機構が存在する。Cdk阻害タンパク質(Cdk inhibitor protein : CKI)と呼ばれるタンパク質は、Cdkまたはサイクリン-Cdk複合体と結合することにより、サイクリン存在下でもCdkの活性を阻害する。CKIにはp16INK4a、p15INK4b、p18INK4c、p19INK4dの4種類が属するINK4ファミリーと、p21Cip1、p27Kip1、p57Kip2の3種類が属するCip/Kipファミリーの2つのファミリーが存在する。INK4ファミリーはG1期においてCdk4またはCdk6に対し、サイクリンDと競合的に結合することでCdkの活性を阻害する。Cip/KipファミリーはサイクリンE-Cdk2、サイクリンA-Cdk2、またサイクリンB-Cdk1複合体に結合しCdkの活性を阻害する[2][3]。p27Kip1の阻害において、サイクリン-Cdk-CKI複合体のX線結晶解析により、CKIの結合がCdk活性部位の構造を大きく変化させることが明らかにされた。
| サイクリン-Cdk複合体 | サイクリン | Cdk | 複合体の機能 |
| G1-Cdk | サイクリンD | Cdk4, Cdk6 | 開始点あるいはG1後期の制限点の通過促進 |
| G1/S-Cdk | サイクリンE | Cdk2 | DNA複製の開始を促進 |
| S-Cdk | サイクリンA | Cdk2, Cdk1 | DNA複製の開始に必要 |
| M-Cdk | サイクリンB | Cdk1 | 有糸分裂の促進 |
発生過程における中枢神経系での細胞増殖
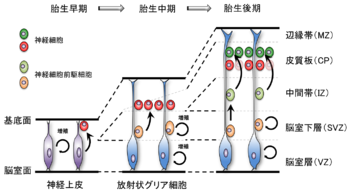
中枢神経系は発生過程において神経幹細胞(neural stem cell)の増殖、分化によって形成される。神経幹細胞は、神経管(neural tube)の閉鎖直後では、神経上皮(neuroepithelium)という一列の層状に並んだ形態をとっており、対称分裂を繰り返すことで自己増殖を行うと同時に、一部は非対称分裂により神経細胞を産生する。神経上皮細胞は放射状に伸びた細長い形態をとっており、その末端はそれぞれ脳室面と基底面に結合しているが、細胞増殖に伴い脳の層が厚くなると基底面側が突起となって放射状に引き伸ばされていく。胎生中期においては、この放射状グリア細胞(radial glial cell)が神経幹細胞と考えられ、非対称分裂によって神経細胞あるいは神経前駆細胞を産生している。これらの細胞は放射状グリア細胞の突起にガイドされ、基底面側に移動していくことで辺縁帯(marginal zone : MZ)を形成する。また放射状グリア細胞は脳室面側にとどまり脳室層(ventricular zone : VZ)を形成しているが、この時放射状グリア細胞は細胞周期に連動した上下運動を繰り返しながら分裂を行うと考えられている。この時期においては放射状グリア細胞から産生された一部の神経細胞前駆細胞も、移動中、脳室下層(subventricular zone : SVZ)において対称分裂により増殖し、前駆細胞の集団を形成することが確認されている(図2)[1][4][5]。
これまで、in vitroの細胞培養において、線維芽細胞成長因子(fibroblast growth factor : FGF)や上皮成長因子(epidermal growth factor : EGF)を添加することで神経幹細胞の増殖を維持できることが明らかになっている[6][7]。また、大脳皮質形成においてNotchシグナルが神経細胞の分化と神経幹細胞の維持に関与していることが示されており[8]、Mouseの放射状グリア細胞における非対称分裂では、放射状グリア細胞として維持される娘細胞は、神経細胞前駆細胞になる娘細胞よりもNotchを高発現していることが明らかとなった[9]。最近、ゼブラフィッシュにおいてもNotchシグナルが神経幹細胞の分化と増殖を制御していることが報告されている[10]。さらに、Cyclin D2の発現が放射状グリア細胞の娘細胞の運命決定に重要であるという報告もなされている。放射状グリア細胞の分裂において、Cyclin D2を発現する娘細胞は増殖能を有する未分化な状態として維持され、Cyclin D2を発現しない娘細胞ではNeurogenin-2(Ngn2)を発現するようになり、将来ニューロンに分化する[11]。
成体における脳での細胞増殖
成体の脳において細胞の増殖を行う細胞は、海馬の顆粒細胞下帯(subgranular zone : SGZ)と脳室下層(subventricular zone : SVZ)において確認されている。この二か所で観察される神経幹細胞は、アストロサイトマーカーとして知られているグリア線維性酸性タンパク質(glial fibrillary acidic protein, GFAP)を発現していることも明らかとなっているが、成熟したアストロサイトとは形態的、また機能的に異なっている。この領域では生涯を通して神経系細胞の供給が行われており、新たに産生されたニューロンは記憶、学習行動に関与していることが示唆されている[12]。
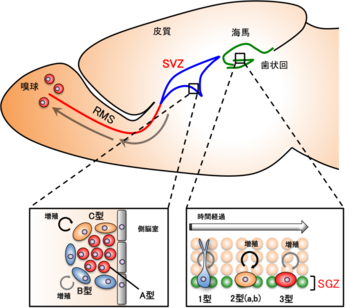
海馬のSGZに存在する増殖性の細胞は、それらの形態や特異的マーカーによって1型、2型、3型の3種類に分類することができる。
1型細胞はSGZに常在し、この細胞により成体での幹細胞が維持されている。1型細胞は放射状の突起を持っており、GFAPや放射状グリアのマーカーとして知られるbrain lipid binding protein(BLBP)、また幹細胞マーカーとして知られるnestin、sry-related HMG box transcription factor 2(Sox2)を発現している。
2型細胞は 1型細胞の分裂によって産生され、高い分裂能を持つ神経細胞前駆細胞と考えられている。GFAPは陰性で、BLBPやnestinの発現と、ニューロンマーカーであるdoublecortin(DCX)やpolysialylated form of neural cell adhesion molecule(PSA-NCAM)の発現が重複する時期である。2型細胞はさらに2a型、2b型に分けることができ、2a型は主にnestinを発現し、2b型は主にNeuroDやProspero homeobox protein 1(Prox1)を発現する。3型細胞はゆるやかな増殖能を持つ細胞で、神経芽細胞から未成熟ニューロンに移行する細胞である。
3型細胞は幹細胞マーカーを発現しておらず、ニューロンマーカーであるDCX、PSA-NCAM、NeuroD、Prox1を発現する(図3)[13]。
SVZではB型細胞(GFAP-positive progenitors)、C型細胞(transit amplifying cells)、A型細胞(migrating neuroblast)の3種類に分けられる。
B型細胞は神経幹細胞と考えられており、GFAP陽性細胞である。B型細胞からC型細胞は産生され、C型細胞が自己複製を繰返して集団を増幅させた後、神経細胞前駆細胞であるA型細胞へと分化する。
C型細胞はDlx2やmammalian achaete-scute homologue 1(Mash1)を発現し、A型細胞はDCXやPSA-NCAMを発現している[3][12]。SVZで産生されたA型細胞は吻側細胞移動路(rostral migratory stream : RMS)を移動し、嗅球(olfactory bulb : OB)へ移動後、ニューロンに分化して臭いの識別や記憶の形成に関与していることが示唆されている(図3)。
成体における神経幹細胞の増殖、分化はホルモンや成長因子、外部環境などの外的因子と、細胞内の転写因子などの内的因子によって調節されている[14]。最近、海馬のSGZにおいて、遺伝子の網羅的解析からinsulin-like growth factor(IGF2)が神経幹細胞の増殖に関与していることが示された[15]。また、胎生期だけでなく成体海馬のSGZにおける神経幹細胞の増殖にもNotchシグナルが関わることが明らかになっていたが、SVZにおいてもNotch1が神経幹細胞の増殖、分化に必要であることが報告されている[16]。
関連項目
参考文献
- ↑ 1.0 1.1 1.2 Bruce Alberts, Alexander Johonson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter
監訳 中村桂子,松原謙一
翻訳 青山聖子,滋賀陽子,滝田郁子,中塚公子,羽田裕子,宮下悦子
細胞の分子生物学 第5版
NEWTON PRESS:2010 - ↑
Cánepa, E.T., Scassa, M.E., Ceruti, J.M., Marazita, M.C., Carcagno, A.L., Sirkin, P.F., & Ogara, M.F. (2007).
INK4 proteins, a family of mammalian CDK inhibitors with novel biological functions. IUBMB life, 59(7), 419-26. [PubMed:17654117] [WorldCat] [DOI] - ↑ 3.0 3.1
Starostina, N.G., & Kipreos, E.T. (2012).
Multiple degradation pathways regulate versatile CIP/KIP CDK inhibitors. Trends in cell biology, 22(1), 33-41. [PubMed:22154077] [PMC] [WorldCat] [DOI] - ↑ Jonathan Slack
訳 大隈典子
エッセンシャル発生生物学 改訂第2版
羊土社:2007 - ↑ 島崎琢也, 岡野栄之
哺乳類の神経幹細胞,
蛋白質 核酸 酵素 : 2008, 53(4);311-7 - ↑
Reynolds, B.A., Tetzlaff, W., & Weiss, S. (1992).
A multipotent EGF-responsive striatal embryonic progenitor cell produces neurons and astrocytes. The Journal of neuroscience : the official journal of the Society for Neuroscience, 12(11), 4565-74. [PubMed:1432110] [WorldCat] - ↑
Gensburger, C., Labourdette, G., & Sensenbrenner, M. (1987).
Brain basic fibroblast growth factor stimulates the proliferation of rat neuronal precursor cells in vitro. FEBS letters, 217(1), 1-5. [PubMed:3595842] [WorldCat] [DOI] - ↑
Louvi, A., & Artavanis-Tsakonas, S. (2006).
Notch signalling in vertebrate neural development. Nature reviews. Neuroscience, 7(2), 93-102. [PubMed:16429119] [WorldCat] [DOI] - ↑
Mizutani, K., Yoon, K., Dang, L., Tokunaga, A., & Gaiano, N. (2007).
Differential Notch signalling distinguishes neural stem cells from intermediate progenitors. Nature, 449(7160), 351-5. [PubMed:17721509] [WorldCat] [DOI] - ↑
Dong, Z., Yang, N., Yeo, S.Y., Chitnis, A., & Guo, S. (2012).
Intralineage directional Notch signaling regulates self-renewal and differentiation of asymmetrically dividing radial glia. Neuron, 74(1), 65-78. [PubMed:22500631] [PMC] [WorldCat] [DOI] - ↑
Tsunekawa, Y., Britto, J.M., Takahashi, M., Polleux, F., Tan, S.S., & Osumi, N. (2012).
Cyclin D2 in the basal process of neural progenitors is linked to non-equivalent cell fates. The EMBO journal, 31(8), 1879-92. [PubMed:22395070] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1
Zhao, C., Deng, W., & Gage, F.H. (2008).
Mechanisms and functional implications of adult neurogenesis. Cell, 132(4), 645-60. [PubMed:18295581] [WorldCat] [DOI] - ↑
Ehninger, D., & Kempermann, G. (2008).
Neurogenesis in the adult hippocampus. Cell and tissue research, 331(1), 243-50. [PubMed:17938969] [WorldCat] [DOI] - ↑
Lledo, P.M., Alonso, M., & Grubb, M.S. (2006).
Adult neurogenesis and functional plasticity in neuronal circuits. Nature reviews. Neuroscience, 7(3), 179-93. [PubMed:16495940] [WorldCat] [DOI] - ↑
Bracko, O., Singer, T., Aigner, S., Knobloch, M., Winner, B., Ray, J., ..., & Jessberger, S. (2012).
Gene expression profiling of neural stem cells and their neuronal progeny reveals IGF2 as a regulator of adult hippocampal neurogenesis. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(10), 3376-87. [PubMed:22399759] [PMC] [WorldCat] [DOI] - ↑
Basak, O., Giachino, C., Fiorini, E., Macdonald, H.R., & Taylor, V. (2012).
Neurogenic subventricular zone stem/progenitor cells are Notch1-dependent in their active but not quiescent state. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(16), 5654-66. [PubMed:22514327] [PMC] [WorldCat] [DOI]