古川 貴久
大阪大学蛋白質研究所 分子発生学教室
DOI:10.14931/bsd.3184 原稿受付日:2013年1月24日 原稿完成日:2015年3月29日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
英語名:cell lineage 独:Zelllinie 仏:lignée cellulaire
細胞系譜は、一個の受精卵が分裂して成体になるまでの細胞の系図である。線虫のように、明確な細胞系譜に沿った発生様式を示す生物もあるが、発生のステージごとにどの種類の細胞が分化してくるかは各前駆細胞ごとに明確に決まっていない場合もある。
細胞系譜とは
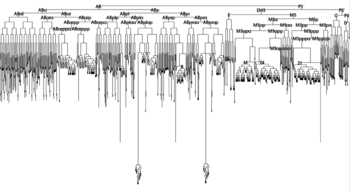
細胞系譜は、一個の受精卵が分裂して成体になるまでの細胞の系図である。この系図を用いて、胚発生の因果関係を表す。例えば、線虫 (C. elegans)の胚は、最初の1個の細胞(受精卵)が分裂すると、2個の細胞はABとP1と名付けられ、さらに4細胞期には、ABはABaとABpに、P1はP2とEMSと2つの娘細胞に分裂する。それぞれの細胞は、将来が運命づけられており、成体のどの器官になるか決定されている。EMS細胞は、2つの娘細胞に分裂すると、一方のMS細胞は筋肉などになり、もうひとつのE細胞は腸の元祖細胞となって腸のすべての細胞を作り出すが、別の組織にはならない。
細胞系譜に沿った発生・分化
受精卵が成体の各器官を正しく構成する仕組みは、細胞間の相互作用によってコントロールされる。例えば線虫において上述のP2細胞が、シグナル分子のWntタンパク質を発現し、EMS細胞のWnt受容体に作用して、EMS細胞はP2と接触した場所に基づいて極性化し、有糸分裂紡錘体の向きを制御する。その結果、P2に近い娘細胞がE細胞になり、遠い娘細胞がMS細胞になる。このように、発生学の顕微手術で発生の仕組みを調べ、遺伝子クローニングと配列決定で分子機構を明らかにすることによって、発生の機構の解明が飛躍的に進歩している。線虫に関しては、すべての細胞系譜が明らかになっており、明確な細胞系譜に沿った発生様式を示す(図1)。
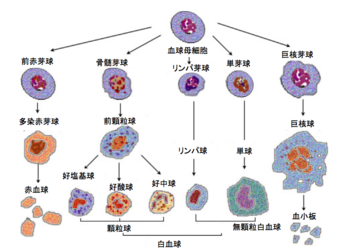
脊椎動物の血球系などでも特定の細胞種を生み出す細胞系譜特異的な前駆細胞(lineage-specific progenitor cell)が存在する(図2)。
明確な細胞系譜によらない発生・分化
一方、哺乳類の中枢神経系の細胞分化に関しては、神経細胞とグリア細胞が同一の前駆細胞から分化してくるという一元説(一元論)[2]と、両者が異なる前駆細胞(細胞系譜特異的な前駆細胞)に由来するという二元説(二元論)[3]が19世紀より提唱され議論されてきた。後者には、発生の比較的初期から神経前駆細胞とグリア前駆細胞の二種類が存在するというHisが提唱した二元説と比較的後期に二種類存在するとした新二元説が知られている。
近年では、網膜においてレトロウイルス[4]や蛍光物質[5]などを用いた細胞系譜解析(cell lineage analysis)により、神経細胞とグリア細胞が多能性の共通前駆細胞(multipotential common progenitor cell)から分化することが明らかとなり、引き続き脳の細胞系譜に関しても同様の結果[6] [7]が報告されたことから、一元説が支持されるようになった。最近の遺伝子組換えマウスを用いた大脳皮質の細胞系譜解析からも一元説が支持されている[8]。
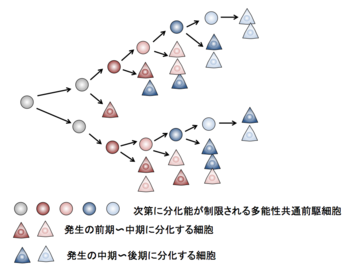
発生過程において、多能性共通前駆細胞は、発生の比較的早期には主に神経細胞を後期には主にグリア細胞を生み出すというステージによる分化細胞の種類の違いがある。この現象に関しては、多能性共通前駆細胞が時間経過とともに次第に多分化能を喪失し、発生後期のステージではグリア細胞のみが分化する状態になると考えられている[9]。発生のステージごとにどの種類の細胞が分化してくるかは各前駆細胞ごとに明確に決まっているわけではないが、ステージごとに分化してくる細胞の種類の傾向は存在し、神経細胞は主に前期〜中期にグリア細胞は主に後期に分化してくることが知られている(図3)。
関連項目
参考文献
- ↑
Greig, L.C., Woodworth, M.B., Galazo, M.J., Padmanabhan, H., & Macklis, J.D. (2013).
Molecular logic of neocortical projection neuron specification, development and diversity. Nature reviews. Neuroscience, 14(11), 755-69. [PubMed:24105342] [PMC] [WorldCat] [DOI] - ↑ Schaper, A.
Die frühesten Differnzierungsvorgänge im Centralnervensystem.
Arch. Entwickl. Mech. Orig. 1897 5:81-132. - ↑ His W
Die Neuroblastern und deren Entstehung in embryonalen Mark.
Arch. Anat. Physiol. 1889 5: 249-300. - ↑
Turner, D.L., & Cepko, C.L. (1987).
A common progenitor for neurons and glia persists in rat retina late in development. Nature, 328(6126), 131-6. [PubMed:3600789] [WorldCat] [DOI] - ↑
Wetts, R., & Fraser, S.E. (1988).
Multipotent precursors can give rise to all major cell types of the frog retina. Science (New York, N.Y.), 239(4844), 1142-5. [PubMed:2449732] [WorldCat] [DOI] - ↑
Walsh, C., & Cepko, C.L. (1988).
Clonally related cortical cells show several migration patterns. Science (New York, N.Y.), 241(4871), 1342-5. [PubMed:3137660] [WorldCat] [DOI] - ↑
Williams, B.P., Read, J., & Price, J. (1991).
The generation of neurons and oligodendrocytes from a common precursor cell. Neuron, 7(4), 685-93. [PubMed:1931054] [WorldCat] [DOI] - ↑
Gao, P., Postiglione, M.P., Krieger, T.G., Hernandez, L., Wang, C., Han, Z., ..., & Shi, S.H. (2014).
Deterministic progenitor behavior and unitary production of neurons in the neocortex. Cell, 159(4), 775-88. [PubMed:25417155] [PMC] [WorldCat] [DOI] - ↑
Cepko, C.L., Austin, C.P., Yang, X., Alexiades, M., & Ezzeddine, D. (1996).
Cell fate determination in the vertebrate retina. Proceedings of the National Academy of Sciences of the United States of America, 93(2), 589-95. [PubMed:8570600] [PMC] [WorldCat] [DOI]