Wnt
太田 訓正、河野 利恵
熊本大学 大学院生命科学研究部
DOI:10.14931/bsd.111 原稿受付日:2012年10月9日 原稿完成日:2013年3月25日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
| wnt | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||
| Symbol | wnt | ||||||||
| Pfam | PF00110 | ||||||||
| InterPro | IPR005817 | ||||||||
| PROSITE | PDOC00219 | ||||||||
| |||||||||
同義語: Wingless-type MMTV integration site family
Wntは分泌性糖タンパク質である。7回膜貫通型受容体Frizzled(Fz)、共役受容体として機能する1回膜貫通型受容体LRP5/LRP6、チロシンキナーゼ活性を有する1回膜貫通型受容体であるRorやRYKと結合し、β-カテニン経路と平面内細胞極性(planar cell polarity, PCP)経路、カルシウム経路の3種類の経路を活性化させる。β-カテニン経路は、転写促進因子として機能するβ-カテニンのタンパク質レベルを調節することにより、シグナル伝達が制御され細胞の増殖や分化を制御する。PCP経路ではWntがFzと結合し、その情報はdishevelled (Dvl)に伝達され、RhoやRacの低分子量Gタンパク質が活性化される。カルシウム経路はホスホリパーゼC-β(PLC-β)を介して細胞内にカルシウムを動員し、タンパク質リン酸化酵素を活性化する。PCP経路とカルシウム経路は細胞骨格を調節し、細胞の極性や運動を制御していると考えられる。
研究の歴史
Wntシグナル研究はショウジョウバエの遺伝学的解析から開始された。1973年にインドのShope博士が羽のないショウジョウバエの変異体wingless(wg)を見いだした。このハエでは、複眼や胸部の剛毛、中腸などにも異常が認められ、胚では分節形成の異常が観察された。分節の形成に関わる分節遺伝子の中でdishevelled(dsh), shaggy, armadillo, pangolinがwinglessと遺伝学的に関連することが示された。Dishevelledは哺乳動物のDvlに、ShaggyはプロテインキナーゼGSK-3β(glycogen synthase kinase-3β)に、Pangolinは転写因子Tcf(T-cell factor)に相当することが明らかになり、Wntシグナルは進化的に保存されていると考えられるようになった。
哺乳動物におけるWntシグナル研究は、癌ウイルス研究に端を発した。1982年、後にノーベル賞を受賞することになるVarnus博士とその当時彼の研究室にいたNusse博士による、マウス乳癌の原因遺伝子int-1のクローニングにさかのぼる[1]。ショウジョウバエにおけるint-1遺伝子のホモログがwinglessという形態形成に重要な役割を果たす遺伝子であったことから、この2つの遺伝子名にちなんでint-1はWnt-1(wingless+int-1, 発音は[wint])と呼ばれるようになった。
ファミリー
これまで、Wnt遺伝子は哺乳動物において19種類が同定されている[2]。種々の発生段階において固有の空間的・時間的発現があり、それぞれの特異的な機能を発揮すると考えられる。ヒトWnt遺伝子ファミリーは独立した遺伝子座に存在するが、Wnt3とWnt9Bは17q21、Wnt3AとWnt9Aは1q42、Wnt2とWnt16は7q31の同一染色体上に存在する。さらに、Wnt1とWnt10Bは12q13、Wnt6とWnt10は2q35にそれぞれ隣接して存在し、これらの遺伝子の発現は協調的に調節される可能性がある。
- Wnt1
- Wnt2, Wnt2B
- Wnt3, Wnt3A
- Wnt4
- Wnt5A, Wnt5B
- Wnt6
- Wnt7A, Wnt7B
- Wnt8A, Wnt8B
- Wnt9A, Wnt9B
- Wnt10A
- Wnt10B, Wnt11
- Wnt16
構造
分子量約4万の分泌性糖タンパク質で、小胞体内において膜結合型アシル基転移酵素のporcupineによってパルミトイル化の脂質修飾を受け、小胞体膜に結合する[3]。小胞体膜にアンカーされたWntはアスパラギン結合型糖鎖修飾を受けた後、小胞体から輸送されて細胞外に分泌される。
機能
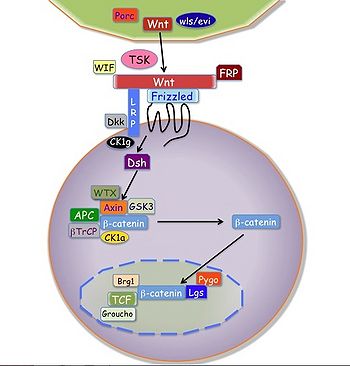
APC: adenomatous polyposis coil, βTrCP: beta-transducin repeat containing E3 ubiquitin protein ligase, Brg: SWI/SNF related, matrix associated, actin dependent regulator of chromatin, CK: casein kinase, Dkk: dickkopf homolog, Dsh: dishevelled, FRP: frizzled-related protein, GSK: glycogen synthase kinase, Lgs: legless, LRP: low-density lipoprotein receptor-related protein, Porc: Porcupine, Pygo: pygopus, TCF: T-cell factor, TSK: tsukushi, WIF: WNT inhibitory factor, wls/evi: wntless/evenness interrupted, WTX: Wilms tumor gene on X chromosome
受容体
Wnt受容体として10種類の7回膜貫通型受容体Frizzled(Fz)、共役受容体として機能する1回膜貫通型受容体LRP5/6(low-density lipoprotein receptor-related protein 5/6)、チロシンキナーゼ活性を有する1回膜貫通型受容体であるRorやRYKがWntの受容体として機能することが報告されており、これらはWntシグナルによる細胞応答の多様性を説明するものである。Wntフィールドをリードしてきたスタンフォード大学のNusse博士の研究室が管理する便利なウェブサイトがあるので参照されたい。
情報伝達系
WntはWnt(wingless)が細胞膜受容体に結合した後に引き起こされる細胞内でのシグナル伝達に関しては、ショウジョウバエの遺伝学の成果などを中心にその基本骨格が明らかにされてきた。Wntにより制御されるシグナル伝達経路は、β-カテニン経路とPCP(planar cell polarity, 平面内細胞極性)経路、カルシウム経路の少なくとも3種類あると考えられる[4]。
β-カテニン経路
古くから知られており、canonical(古典的)経路とも呼ばれる(図)。
転写促進因子として機能するβ-カテニンのタンパク質レベルを調節することにより、シグナル伝達が制御される。Wntの非存在下ではAxinと癌抑制遺伝子産物APC(adenomatous polyposis coli)の複合体中で、β-カテニンはカゼインキナーゼIα(casein kinase Iα; CKIα)とGSK-3βによるリン酸化とユビキチン化による分解が促進され、β-カテニンの細胞内レベルは低く保たれている。WntがFzと共役受容体のLRP5/6に結合するとDvlを介してGSK-3βにシグナルが伝達され、β-カテニンのリン酸化と分解が抑制される。細胞質に蓄積したβ-カテニンは核内に移行した後、転写因子Tcf/Lef(T-cell factor/lymphoid enhancer binding factor)と複合体を形成してcyclin D1やc-mycなどの遺伝子発現を促進することによって、細胞の増殖や分化を制御する。
β-カテニン非依存性経路
non-canonical(非古典的)経路とも呼ばれる。
PCP経路
PCP経路ではWntがFzと結合し、その情報はDvlに伝達され、RhoやRacの低分子量Gタンパク質が活性化される。ショウジョウバエの羽の細胞には1本ずつの毛が遠位方向に向かって生えているが、Fzの遺伝子変異では毛の向きが変わってしまうことがわかり、Fzがかかわる平面極性制御シグナルをPCPシグナルとよぶようになった。同様な表現型を示すものとして、Fmi (Flamingo), Stbm (Stramismus), Dsh (Dishevelled), Pk (Prickle), Dgo (Diego)が同定され、これらはコアPCPタンパク質とよばれている。脊椎動物においても、Fz6遺伝子ノックアウトマウスでは体表の毛のパターンが乱れ、Stbm, Fmi, Fz, Dshの相同遺伝子の変異は内耳の蝸牛管の感覚受容細胞が生やす繊毛の束の方向をばらばらにしてしまう。さらに、アフリカツメガエルやゼブラフィッシュにおいて、コアPCPタンパクの遺伝子機能欠損・変異により原腸形成が阻害され、体長が前後に伸びることができない表現型を示す。
カルシウム経路
カルシウム経路はホスホリパーゼC-β(PLC-β)を介して細胞内にカルシウムを動員し、カルモデュリン依存性タンパク質リン酸化酵素(CaMK)とCa2+/リン脂質依存性タンパク質リン酸化酵素 (Cキナーゼ)を活性化する。WntシグナルはPCP経路とカルシウム経路を介して細胞骨格を調節し、細胞の極性や運動を制御していると考えられる。
その他の経路
上記のシグナル伝達に加えて、Ror2がWnt5aと結合し、Cdc42とJNKを介してアフリカツメガエルの原腸形成における細胞運動を制御したり、filamin Aと結合することによりアクチンを再構成し、細胞運動を促進することから、Ror2がWnt5aの受容体として機能して、β-カテニン非依存性経路の活性化に関与する可能性が高い。
β-カテニン非依存性経路の機能
β-カテニン非依存性経路の機能として、β-カテニン経路を抑制することが知られている。その抑制メカニズムとして、Wnt5aがCaMKを介してTGF-β-activated kinase1(TAK1)とNemo-like kinase(NLK)を活性化し、NLKがTcfをリン酸化することによりDNAとの結合を抑制すること、Wnt5aがユビキチンリガーゼSiah2の発現を介してユビキチン化によるβ-カテニンの分解を促進する。さらに、Wnt5aは細胞膜上でWnt3aとFzとの結合において競合することにより、Wnt3aによるβ-カテニン経路の活性化を阻害する。
神経系における働き
神経軸索ガイダンス
脊椎動物の脊髄の背側にある交連神経細胞は、最初は神経管の外縁近くを腹側に向けて軸索を伸ばし、運動神経円柱の近くで腹側正中部の底板(floor plate)に向けて方向を転換して軸索を伸長する。底板の腹側を交叉した後、吻側に高く尾側に低い濃度勾配を形成するWnt4とその受容体Fz3により、交連神経は吻側に進行方向を転換して軸索を伸長する[5]。
ショウジョウバエの正中線は正中線グリア細胞(midline glia)とよばれる非神経細胞群から構成され、グリア細胞に発現する分泌因子Netrinにより、Netrinの受容体であるFrazzledを発現する交連神経細胞に対して誘引的に作用する。交連神経細胞は、正中線を交叉するときに体節の前側を投射する交連神経(anterior commissure)あるいは体節の後ろ側を投射する交連神経(posterior commissure)という前後2つの交連神経束のいずれかを選択して交叉する。この選択はWnt5とその受容体であるDerailedによって制御されている[6]。
シナプス形成
マウスWnt7aは小脳の顆粒神経細胞に発現している。Wnt7a欠失マウスにおいて、顆粒神経細胞にシナプス形成する苔状線維中のシナプシンIの発現が著しく低下しており、またWnt7aが培養した苔状線維に対してシナプシンIのクラスタリングを促進した。これらの結果から、Wnt7aが苔状線維の顆粒神経細胞へのシナプス形成において、顆粒神経から苔状線維に対して逆行性の促進因子として働くと考えられた[7]。
幹細胞の維持と再生
魚類・両生類・鳥類において、網膜幹細胞は網膜の最もレンズに近い領域(網膜辺縁部)に特異的に存在し、生涯にわたって増殖能をもち、分化した網膜神経細胞を生み出すことができる。網膜辺縁部に近接する網膜先端部ではWnt2bが発現しており、網膜辺縁部の幹細胞のもつ増殖能・未分化性を維持している[8]。
成熟した脊椎動物の網膜中心部領域は、すでに細胞周期から逸脱し最終分化を終えた細胞から構成されており、ここでは増殖する細胞は観察されない。しかし、網膜組織に細胞障害を与えるような条件下では、すでに分裂を終了した網膜グリア細胞であるミュラーグリア細胞が分裂するようになる。このような増殖を開始したミュラーグリア細胞ではWntシグナルの活性が誘導されていることから、Wntシグナルは網膜の再生を促進する重要なファクターであることが考えられる[9]。
毛様体形成
毛様体は血管に富んだ眼球の膜状組織である中膜の一つで、前方は虹彩に、後方は脈絡膜に連続している。水晶体の赤道部に相当する部位にある輪状の組織で、前方の内面には70-90個の毛様体突起とよばれるひだが放射状に並んでいる。Tsukushiはスモール・ロイシンリッチ・プロテオグリカンファミリーに属する分泌型タンパク質で、11.5日目マウス胚から網膜辺縁部に発現が観察され、その発現は成体まで持続する。TsukushiはFz4のN末端に位置するシステインリッチドメイン(Wnt結合部位)への結合をWnt2bと競合することによりWntシグナルを細胞外領域で調整し、毛様体形成に関与している[10]。
参考文献
- ↑
Nusse, R., & Varmus, H.E. (1982).
Many tumors induced by the mouse mammary tumor virus contain a provirus integrated in the same region of the host genome. Cell, 31(1), 99-109. [PubMed:6297757] [WorldCat] [DOI] - ↑
Katoh, Y., & Katoh, M. (2005).
Identification and characterization of rat Wnt6 and Wnt10a genes in silico. International journal of molecular medicine, 15(3), 527-31. [PubMed:15702249] [WorldCat] - ↑
Takada, R., Satomi, Y., Kurata, T., Ueno, N., Norioka, S., Kondoh, H., ..., & Takada, S. (2006).
Monounsaturated fatty acid modification of Wnt protein: its role in Wnt secretion. Developmental cell, 11(6), 791-801. [PubMed:17141155] [WorldCat] [DOI] - ↑
Kikuchi, A., Yamamoto, H., & Sato, A. (2009).
Selective activation mechanisms of Wnt signaling pathways. Trends in cell biology, 19(3), 119-29. [PubMed:19208479] [WorldCat] [DOI] - ↑
Lyuksyutova, A.I., Lu, C.C., Milanesio, N., King, L.A., Guo, N., Wang, Y., ..., & Zou, Y. (2003).
Anterior-posterior guidance of commissural axons by Wnt-frizzled signaling. Science (New York, N.Y.), 302(5652), 1984-8. [PubMed:14671310] [WorldCat] [DOI] - ↑
Yoshikawa, S., McKinnon, R.D., Kokel, M., & Thomas, J.B. (2003).
Wnt-mediated axon guidance via the Drosophila Derailed receptor. Nature, 422(6932), 583-8. [PubMed:12660735] [WorldCat] [DOI] - ↑
Hall, A.C., Lucas, F.R., & Salinas, P.C. (2000).
Axonal remodeling and synaptic differentiation in the cerebellum is regulated by WNT-7a signaling. Cell, 100(5), 525-35. [PubMed:10721990] [WorldCat] [DOI] - ↑
Kubo, F., Takeichi, M., & Nakagawa, S. (2003).
Wnt2b controls retinal cell differentiation at the ciliary marginal zone. Development (Cambridge, England), 130(3), 587-98. [PubMed:12490564] [WorldCat] [DOI] - ↑
Osakada, F., Ooto, S., Akagi, T., Mandai, M., Akaike, A., & Takahashi, M. (2007).
Wnt signaling promotes regeneration in the retina of adult mammals. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(15), 4210-9. [PubMed:17428999] [PMC] [WorldCat] [DOI] - ↑
Ohta, K., Ito, A., Kuriyama, S., Lupo, G., Kosaka, M., Ohnuma, S., ..., & Tanaka, H. (2011).
Tsukushi functions as a Wnt signaling inhibitor by competing with Wnt2b for binding to transmembrane protein Frizzled4. Proceedings of the National Academy of Sciences of the United States of America, 108(36), 14962-7. [PubMed:21856951] [PMC] [WorldCat] [DOI]