「興奮性シナプス」の版間の差分
Seiichirosakai (トーク | 投稿記録) 細編集の要約なし |
細編集の要約なし |
||
| (4人の利用者による、間の25版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/hippocampus-sak 酒井 誠一郎]</font><br> | |||
''独立行政法人理化学研究所 脳科学総合研究センター''<br> | |||
<font size="+1">[https://researchmap.jp/7000022535 八尾 寛]</font><br> | |||
''東北大学名誉教授''<br> | |||
DOI:<selfdoi /> 原稿受付日:2013年7月16日 原稿完成日:2013年10月3日<br> | |||
担当編集委員:[http://researchmap.jp/haruokasai 河西 春郎](東京大学 大学院医学系研究科)<br> | |||
</div> | |||
英:excitatory synapse、独:exzitatorische Synapse、仏:synapses excitatrices | |||
{{box|text= | |||
興奮性[[シナプス]]とは、シナプス伝達によってシナプス後細胞を[[脱分極]]させ、[[活動電位]]の発火を促進するシナプス結合のことである。興奮性シナプスを形成するシナプス前細胞は、[[興奮性ニューロン]]と呼ばれる。 | |||
}} | |||
==興奮性シナプスとは== | |||
興奮性シナプスとは、シナプス後細胞の活動電位発生を促進させるシナプスのことである。興奮性のシナプス伝達によってシナプス後細胞が脱分極し、膜電位が[[閾値]]を超えると活動電位が発生する。 [[抑制性シナプス]]は、逆にシナプス後細胞の発火を抑える作用をする。興奮性シナプスを形成する[[シナプス前]]細胞を興奮性ューロン、抑制性シナプスを形成するシナプス前細胞を[[抑制性ニューロン]]と呼ぶ。 | |||
シナプスは、[[ギャップ結合]]を介して電気シグナルを直接伝える[[電気シナプス]]と[[神経伝達物質]]を介して伝達を行う[[化学シナプス]]に分類される。いずれもシナプス前細胞の興奮をシナプス後細胞へと伝達するが、興奮性シナプスといった場合には興奮性の化学シナプスのことを指すことが多い。 | |||
興奮性の化学シナプスでは、[[シナプス前終末]]から放出された神経伝達物質がシナプス後膜上の[[受容体]]に結合することでシナプス後細胞が脱分極する。神経細胞から放出され、作用する物質としての神経伝達物質の種類は100種類以上にも及ぶが、哺乳類の中枢神経系では[[グルタミン酸]]が、末梢神経系では[[アセチルコリン]]と[[ノルアドレナリン]]が主な興奮性神経伝達物質として用いられている(表1)。同じ神経伝達物質でも、シナプス後膜上の受容体の種類が違えばその作用も異なる。例えばアセチルコリンは、[[ニコチン受容体]]に結合するとシナプス後細胞を興奮させるが、[[ムスカリン受容体]]はサブタイプによって興奮作用を示すものと抑制作用を示すものがある<ref><pubmed> 6113545 </pubmed></ref> <ref><pubmed> 9647869 </pubmed></ref>。 | |||
{| class="wikitable" | |||
|+ 表. 主な興奮性伝達物質と興奮性ニューロンの分布 | |||
|- | |||
| colspan="2" | '''末梢神経系''' | |||
|- | |||
| [[アセチルコリン]] || 運動神経、[[交感神経]][[節前線維]]、[[副交感神経]] | |||
|- | |||
| [[ノルアドレナリン]] || 交感神経節後線維 | |||
|- | |||
| colspan="2" | '''中枢神経系''' | |||
|- | |||
| [[グルタミン酸]] || 中枢神経全般 | |||
|- | |||
| colspan="2" | (以下は脳の広範囲に投射し、神経機能を調節) | |||
|- | |||
| アセチル[[コリン]] || [[前脳基底部]]、[[中脳]][[橋被蓋]] | |||
|- | |||
| [[ドーパミン]] || [[黒質]]緻密部、[[中脳腹側被蓋野]]など | |||
|- | |||
| ノルアドレナリン || [[青斑核]]、[[外側被蓋]] | |||
|- | |||
| [[アドレナリン]] || [[孤束核]]、背側[[縫線核]] | |||
|- | |||
| [[セロトニン]] || [[縫線核]] | |||
|- | |||
|} | |||
==構造== | ==構造== | ||
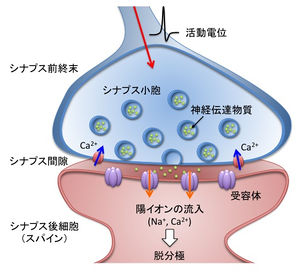
[[ファイル:興奮性シナプス.jpg|thumb|300 px|'''図1.興奮性シナプスの構造とシナプス伝達課程''']] | |||
興奮性の化学シナプスの基本的な構造は、神経伝達物質を内包する[[シナプス小胞]]がシナプス前終末に集積し、[[シナプス間隙]]を挟んで[[シナプス伝達物質|伝達物質]][[受容体]]の並ぶシナプス後膜と相対している(図1)。シナプス前終末には神経伝達が放出される[[アクティブゾーン]]があり、直径30-50 nmのシナプス小胞とともに、伝達物質の[[開口放出]]に必要な[[電位依存性カルシウムチャネル]]や[[SNAREタンパク質]]が集積している<ref><pubmed> 16336742 </pubmed></ref>。シナプス間隙はシナプス前終末と後細胞間の12-20 nmの隙間であり、開口放出された神経伝達物資はシナプス間隙を拡散してシナプス後膜上の受容体に結合する。 | |||
シナプス後膜の直下にはシナプスの構造タンパク質や調節タンパク質が集積した[[シナプス後肥厚]](postsynaptic [[density]]; [[PSD]])と呼ばれる構造がある。興奮性シナプスはシナプス後肥厚が発達し、電子顕微鏡像において顕著に観察される<ref><pubmed> 13829103 </pubmed></ref>。 | |||
興奮性シナプスの形態は、脳の多くの領域で見られるボタン状シナプスの他、[[網膜神経回路|網膜]]の[[リボンシナプス]]や、[[脳幹]]や[[毛様体神経節]]で見られる[[杯状シナプス]]など多岐にわたる<ref><pubmed> 16932936 </pubmed></ref>。ボタン状シナプスは、[[樹状突起]]に1 μm以下の間隔で密に並んだ[[スパイン]]と呼ばれる微細な突起にシナプスを形成している。多くの場合、単一のボタン状シナプスの入力による脱分極は大きくないが、一つの神経細胞に数千から数万も存在するスパインへのシナプス入力の加算によってシナプス後細胞で活動電位が発生する。アクティブゾーンに特殊な構造を持つリボンシナプス<ref><pubmed> 12575947 </pubmed></ref>や単一シナプスに複数のアクティブゾーンを持つ杯状シナプス<ref><pubmed> 12486149 </pubmed></ref>は、一度に多数のシナプス小胞が開口放出され、シナプス後細胞を強く興奮させる。 | |||
==シナプス伝達過程== | |||
[[ファイル:PPF<P.jpg|thumb|250 px|'''図2.シナプス可塑性の例'''<br>(a)[[海馬]]苔状線維(MF)-CA3シナプスで記録したPPF。短い時間間隔で連続刺激を行うと、1回目の応答(fEPSP)と比較して2回目の応答が増加している。<br>(b)MF-CA3シナプスのLTP。100 Hz・100回の高頻度電気刺激を行うと、その後30分以上にわたってシナプス伝達が増強される。]] | |||
シナプス前細胞で発生した活動電位は[[軸索]]を伝播し、シナプス前終末に到達する。シナプス前終末では、活動電位による脱分極で[[電位依存性カルシウムチャネル]]が開き、[[カルシウムイオン]]が細胞内に流入する。カルシウムイオンが引き金となってアクティブゾーンに係留されていたシナプス小胞が[[細胞膜]]に融合し、シナプス小胞に内包されていた神経伝達物質がシナプス間隙に開口放出される。 | |||
開口放出された神経伝達物質はシナプス間隙を拡散し、シナプス後細胞膜上の受容体に結合する。[[イオンチャネル共役型受容体]]の場合は、神経伝達物質の結合によって即座に[[イオンチャネル]]が開き、[[ナトリウム]]や[[カルシウム]]といった陽イオンが細胞内に流入することでシナプス後細胞が脱分極する。[[代謝活性型受容体]]の場合は、受容体への神経伝達物質結合によって[[GTP結合蛋白|Gタンパク質]]を介した細胞内シグナルが働き、受容体とは別に存在する[[カリウムチャネル]]等の開口状態が変化することで遅い時間スケールでの脱分極が起こる。 | |||
== 電気生理 | ==電気生理== | ||
興奮性シナプスにおいて神経伝達物質がイオンチャネル共役型受容体に結合すると陽イオンの[[wikipedia:ja:コンダクタンス|コンダクタンス]]が増加する。[[静止膜電位]]付近では、これら受容体の[[反転電位]]より細胞の[[膜電位]]は低いので、細胞外の陽イオンがシナプス後細胞に流入し膜電位は脱分極する。この膜電位変化を興奮性[[シナプス後電位]](excitatory postsynaptic potential; EPSP)という。このとき電流は細胞の内側に向かって流れ、この内向きの電流を興奮性[[シナプス後電流]](excitatory postsynaptic current; EPSC)と呼ぶ。また、細胞膜を横切って電流が流れることで細胞外電場にも変化が生じるので、興奮性[[シナプス後場電位]](field EPSP; fEPSP)として観測することができる。 | |||
代謝活性型受容体では、カリウムコンダクタンスの低下による[[遅いシナプス後電位]]と細胞膜の電気抵抗の増加が観察される。 | |||
== | ==シナプス可塑性== | ||
興奮性シナプス、特に脳内のシナプスは、活動依存的に[[短期可塑性]]および[[長期可塑性]]を示し、動的な神経ネットワークを構築している。 | |||
===短期可塑性=== | |||
代表的なものとして、paired pulse facilitation(PPF)およびpaired pulse depression(PPD)が挙げられる。これはシナプス前細胞を連続して刺激した際に、1回目のシナプス伝達と比較して2回目のシナプス伝達が促通(facilitation)または抑圧(depression)される現象である。短期可塑性のメカニズムには、シナプス前終末へのカルシウム流入と開口放出確率の変化、およびシナプス小胞プールの大きさが関与しているとされている<ref><pubmed> 11826273 </pubmed></ref>。 | |||
== | === 長期可塑性 === | ||
高頻度刺激で誘発される[[長期増強]](long-term potentiation; LTP)および低頻度刺激で誘発される[[長期抑圧]](long-term depression; LTD)があり、数十分以上の時間わたってシナプス伝達強度が変化する<ref><pubmed> 15450156 </pubmed></ref>。また、シナプス前細胞-後細胞の発火タイミング依存的にLTPもしくはLTDが生じる[[スパイクタイミング依存性シナプス可塑性]](spike timing dependent plasticity; STDP)と呼ばれる現象が様々なシナプスで報告されている<ref><pubmed> 1681645 </pubmed></ref>。 | |||
長期可塑性ではタンパク質[[リン酸化]]・[[脱リン酸化]]や[[wj:転写|転写]]・[[wj:翻訳 (生物学)|翻訳]]等の機構により長期的にシナプス伝達が変化するが、[[開口放出]]が変化する場合や伝達物質受容体が変化する場合など、可塑性の発現機構はシナプスの種類や刺激パターンによって多様である<ref><pubmed> 16261180 </pubmed></ref><ref><pubmed> 17292975 </pubmed></ref>。長期可塑性に伴って樹状突起の[[スパイン]]形態が変化が生じることも報告されており<ref><pubmed> 20138375 </pubmed></ref>、シナプスの機能と形態が共に変化することで神経ネットワークの構築と改変が行われている。 | |||
==関連項目== | |||
*[[興奮性ニューロン]] | *[[興奮性ニューロン]] | ||
*[[シナプス]] | *[[シナプス]] | ||
*[[神経伝達物質]] | *[[神経伝達物質]] | ||
*[[抑制性シナプス]] | *[[抑制性シナプス]] | ||
*[[シナプス後肥厚]] | |||
*[[長期増強]] | |||
*[[長期抑圧]] | |||
== 参考文献 | ==参考文献== | ||
<references/> | |||
2021年9月8日 (水) 18:35時点における最新版
酒井 誠一郎
独立行政法人理化学研究所 脳科学総合研究センター
八尾 寛
東北大学名誉教授
DOI:10.14931/bsd.3607 原稿受付日:2013年7月16日 原稿完成日:2013年10月3日
担当編集委員:河西 春郎(東京大学 大学院医学系研究科)
英:excitatory synapse、独:exzitatorische Synapse、仏:synapses excitatrices
興奮性シナプスとは
興奮性シナプスとは、シナプス後細胞の活動電位発生を促進させるシナプスのことである。興奮性のシナプス伝達によってシナプス後細胞が脱分極し、膜電位が閾値を超えると活動電位が発生する。 抑制性シナプスは、逆にシナプス後細胞の発火を抑える作用をする。興奮性シナプスを形成するシナプス前細胞を興奮性ューロン、抑制性シナプスを形成するシナプス前細胞を抑制性ニューロンと呼ぶ。
シナプスは、ギャップ結合を介して電気シグナルを直接伝える電気シナプスと神経伝達物質を介して伝達を行う化学シナプスに分類される。いずれもシナプス前細胞の興奮をシナプス後細胞へと伝達するが、興奮性シナプスといった場合には興奮性の化学シナプスのことを指すことが多い。
興奮性の化学シナプスでは、シナプス前終末から放出された神経伝達物質がシナプス後膜上の受容体に結合することでシナプス後細胞が脱分極する。神経細胞から放出され、作用する物質としての神経伝達物質の種類は100種類以上にも及ぶが、哺乳類の中枢神経系ではグルタミン酸が、末梢神経系ではアセチルコリンとノルアドレナリンが主な興奮性神経伝達物質として用いられている(表1)。同じ神経伝達物質でも、シナプス後膜上の受容体の種類が違えばその作用も異なる。例えばアセチルコリンは、ニコチン受容体に結合するとシナプス後細胞を興奮させるが、ムスカリン受容体はサブタイプによって興奮作用を示すものと抑制作用を示すものがある[1] [2]。
| 末梢神経系 | |
| アセチルコリン | 運動神経、交感神経節前線維、副交感神経 |
| ノルアドレナリン | 交感神経節後線維 |
| 中枢神経系 | |
| グルタミン酸 | 中枢神経全般 |
| (以下は脳の広範囲に投射し、神経機能を調節) | |
| アセチルコリン | 前脳基底部、中脳橋被蓋 |
| ドーパミン | 黒質緻密部、中脳腹側被蓋野など |
| ノルアドレナリン | 青斑核、外側被蓋 |
| アドレナリン | 孤束核、背側縫線核 |
| セロトニン | 縫線核 |
構造
興奮性の化学シナプスの基本的な構造は、神経伝達物質を内包するシナプス小胞がシナプス前終末に集積し、シナプス間隙を挟んで伝達物質受容体の並ぶシナプス後膜と相対している(図1)。シナプス前終末には神経伝達が放出されるアクティブゾーンがあり、直径30-50 nmのシナプス小胞とともに、伝達物質の開口放出に必要な電位依存性カルシウムチャネルやSNAREタンパク質が集積している[3]。シナプス間隙はシナプス前終末と後細胞間の12-20 nmの隙間であり、開口放出された神経伝達物資はシナプス間隙を拡散してシナプス後膜上の受容体に結合する。
シナプス後膜の直下にはシナプスの構造タンパク質や調節タンパク質が集積したシナプス後肥厚(postsynaptic density; PSD)と呼ばれる構造がある。興奮性シナプスはシナプス後肥厚が発達し、電子顕微鏡像において顕著に観察される[4]。
興奮性シナプスの形態は、脳の多くの領域で見られるボタン状シナプスの他、網膜のリボンシナプスや、脳幹や毛様体神経節で見られる杯状シナプスなど多岐にわたる[5]。ボタン状シナプスは、樹状突起に1 μm以下の間隔で密に並んだスパインと呼ばれる微細な突起にシナプスを形成している。多くの場合、単一のボタン状シナプスの入力による脱分極は大きくないが、一つの神経細胞に数千から数万も存在するスパインへのシナプス入力の加算によってシナプス後細胞で活動電位が発生する。アクティブゾーンに特殊な構造を持つリボンシナプス[6]や単一シナプスに複数のアクティブゾーンを持つ杯状シナプス[7]は、一度に多数のシナプス小胞が開口放出され、シナプス後細胞を強く興奮させる。
シナプス伝達過程
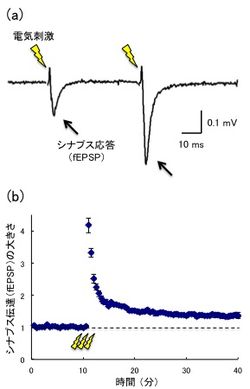
(a)海馬苔状線維(MF)-CA3シナプスで記録したPPF。短い時間間隔で連続刺激を行うと、1回目の応答(fEPSP)と比較して2回目の応答が増加している。
(b)MF-CA3シナプスのLTP。100 Hz・100回の高頻度電気刺激を行うと、その後30分以上にわたってシナプス伝達が増強される。
シナプス前細胞で発生した活動電位は軸索を伝播し、シナプス前終末に到達する。シナプス前終末では、活動電位による脱分極で電位依存性カルシウムチャネルが開き、カルシウムイオンが細胞内に流入する。カルシウムイオンが引き金となってアクティブゾーンに係留されていたシナプス小胞が細胞膜に融合し、シナプス小胞に内包されていた神経伝達物質がシナプス間隙に開口放出される。
開口放出された神経伝達物質はシナプス間隙を拡散し、シナプス後細胞膜上の受容体に結合する。イオンチャネル共役型受容体の場合は、神経伝達物質の結合によって即座にイオンチャネルが開き、ナトリウムやカルシウムといった陽イオンが細胞内に流入することでシナプス後細胞が脱分極する。代謝活性型受容体の場合は、受容体への神経伝達物質結合によってGタンパク質を介した細胞内シグナルが働き、受容体とは別に存在するカリウムチャネル等の開口状態が変化することで遅い時間スケールでの脱分極が起こる。
電気生理
興奮性シナプスにおいて神経伝達物質がイオンチャネル共役型受容体に結合すると陽イオンのコンダクタンスが増加する。静止膜電位付近では、これら受容体の反転電位より細胞の膜電位は低いので、細胞外の陽イオンがシナプス後細胞に流入し膜電位は脱分極する。この膜電位変化を興奮性シナプス後電位(excitatory postsynaptic potential; EPSP)という。このとき電流は細胞の内側に向かって流れ、この内向きの電流を興奮性シナプス後電流(excitatory postsynaptic current; EPSC)と呼ぶ。また、細胞膜を横切って電流が流れることで細胞外電場にも変化が生じるので、興奮性シナプス後場電位(field EPSP; fEPSP)として観測することができる。
代謝活性型受容体では、カリウムコンダクタンスの低下による遅いシナプス後電位と細胞膜の電気抵抗の増加が観察される。
シナプス可塑性
興奮性シナプス、特に脳内のシナプスは、活動依存的に短期可塑性および長期可塑性を示し、動的な神経ネットワークを構築している。
短期可塑性
代表的なものとして、paired pulse facilitation(PPF)およびpaired pulse depression(PPD)が挙げられる。これはシナプス前細胞を連続して刺激した際に、1回目のシナプス伝達と比較して2回目のシナプス伝達が促通(facilitation)または抑圧(depression)される現象である。短期可塑性のメカニズムには、シナプス前終末へのカルシウム流入と開口放出確率の変化、およびシナプス小胞プールの大きさが関与しているとされている[8]。
長期可塑性
高頻度刺激で誘発される長期増強(long-term potentiation; LTP)および低頻度刺激で誘発される長期抑圧(long-term depression; LTD)があり、数十分以上の時間わたってシナプス伝達強度が変化する[9]。また、シナプス前細胞-後細胞の発火タイミング依存的にLTPもしくはLTDが生じるスパイクタイミング依存性シナプス可塑性(spike timing dependent plasticity; STDP)と呼ばれる現象が様々なシナプスで報告されている[10]。
長期可塑性ではタンパク質リン酸化・脱リン酸化や転写・翻訳等の機構により長期的にシナプス伝達が変化するが、開口放出が変化する場合や伝達物質受容体が変化する場合など、可塑性の発現機構はシナプスの種類や刺激パターンによって多様である[11][12]。長期可塑性に伴って樹状突起のスパイン形態が変化が生じることも報告されており[13]、シナプスの機能と形態が共に変化することで神経ネットワークの構築と改変が行われている。
関連項目
参考文献
- ↑
Hartzell, H.C. (1981).
Mechanisms of slow postsynaptic potentials. Nature, 291(5816), 539-44. [PubMed:6113545] [WorldCat] [DOI] - ↑
Caulfield, M.P., & Birdsall, N.J. (1998).
International Union of Pharmacology. XVII. Classification of muscarinic acetylcholine receptors. Pharmacological reviews, 50(2), 279-90. [PubMed:9647869] [WorldCat] - ↑
Brunger, A.T. (2005).
Structure and function of SNARE and SNARE-interacting proteins. Quarterly reviews of biophysics, 38(1), 1-47. [PubMed:16336742] [WorldCat] [DOI] - ↑
GRAY, E.G. (1959).
Axo-somatic and axo-dendritic synapses of the cerebral cortex: an electron microscope study. Journal of anatomy, 93, 420-33. [PubMed:13829103] [PMC] [WorldCat] - ↑
Rollenhagen, A., & Lübke, J.H. (2006).
The morphology of excitatory central synapses: from structure to function. Cell and tissue research, 326(2), 221-37. [PubMed:16932936] [WorldCat] [DOI] - ↑
Parsons, T.D., & Sterling, P. (2003).
Synaptic ribbon. Conveyor belt or safety belt? Neuron, 37(3), 379-82. [PubMed:12575947] [WorldCat] [DOI] - ↑
Sätzler, K., Söhl, L.F., Bollmann, J.H., Borst, J.G., Frotscher, M., Sakmann, B., & Lübke, J.H. (2002).
Three-dimensional reconstruction of a calyx of Held and its postsynaptic principal neuron in the medial nucleus of the trapezoid body. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(24), 10567-79. [PubMed:12486149] [PMC] [WorldCat] - ↑
Zucker, R.S., & Regehr, W.G. (2002).
Short-term synaptic plasticity. Annual review of physiology, 64, 355-405. [PubMed:11826273] [WorldCat] [DOI] - ↑
Malenka, R.C., & Bear, M.F. (2004).
LTP and LTD: an embarrassment of riches. Neuron, 44(1), 5-21. [PubMed:15450156] [WorldCat] [DOI] - ↑
van Voorst Vader, P.C., Lier, J.G., Woest, T.E., Coenraads, P.J., & Nater, J.P. (1991).
Patch tests with house dust mite antigens in atopic dermatitis patients: methodological problems. Acta dermato-venereologica, 71(4), 301-5. [PubMed:1681645] [WorldCat] - ↑
Nicoll, R.A., & Schmitz, D. (2005).
Synaptic plasticity at hippocampal mossy fibre synapses. Nature reviews. Neuroscience, 6(11), 863-76. [PubMed:16261180] [WorldCat] [DOI] - ↑
Raymond, C.R. (2007).
LTP forms 1, 2 and 3: different mechanisms for the "long" in long-term potentiation. Trends in neurosciences, 30(4), 167-75. [PubMed:17292975] [WorldCat] [DOI] - ↑
Kasai, H., Fukuda, M., Watanabe, S., Hayashi-Takagi, A., & Noguchi, J. (2010).
Structural dynamics of dendritic spines in memory and cognition. Trends in neurosciences, 33(3), 121-9. [PubMed:20138375] [WorldCat] [DOI]