馴化・脱馴化
小倉 明彦
大阪大学 大学院生命機能研究科 生命機能専攻
DOI:10.14931/bsd.6992 原稿受付日:2016年3月8日 原稿完成日:2016年月日
担当編集委員:藤田 一郎(大阪大学 大学院生命機能研究科)
英語名:habituation and dishabituation
馴化または馴れとは、軟体動物アメフラシの示す防御反射が、非侵害的な刺激の繰り返しによって低下する現象。脱馴化または脱馴れとは、いったん馴化を示した防御反射が、侵害的な刺激の負荷によって再び現れる現象。記憶・学習の研究史において、学習の祖型(プロトタイプ)とみなされて細胞レベルの解明が進み、一つの画期をもたらした。
馴化
現象
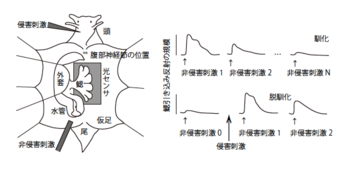
軟体動物アメフラシ (Aplysia sp.[1]) は、温帯域の潮だまり(タイド・プール)に生息する動物で、無刺激時、水管から水を取り入れ、鰓(えら)を広げて呼吸しているが、体表(水管や仮足)に刺激を受けると、水管や鰓をすばやく外套腔内に引き込む防御反射を示す。これを水管引き込み反射(siphon withdrawal reflex; SWR)や鰓引き込み反射 (gill withdrawal reflex; GWR) とよぶ。
しかし、周期的に打ち寄せる波のように、刺激が非侵害的で一定間隔で反復されるようなものであると、しだいに防御反射は弱化し、やがてほとんど示されなくなる(図1)。この現象を馴化(habituation)とよぶ[2]。ヒトの行動について日常用語でいう「馴れ」と行動表現上似ているため、この現象も「馴れ(慣れ)」の語でよぶ研究者も多いが、機構的にも相同かどうかはわからないので、本稿ではあえて別語を用いる。
アメフラシの神経系は、1920年代から仏ミシェル・パシャ海洋研究所 (L’Institut de Biologie Marine Michel Pacha) のAngelique Arvanitaki (1901-1983) らによって、解剖学的・生理学的に詳しく研究されており、腹部神経節のいくつかの大型ニューロンについての同定(個体の別を問わず、同じ位置に同じ性質・機能をもつ細胞があると確認され、名づけが行われること)もなされていた[3]。また、パリのマレイ研究所 (L’Institut Marey de Paris) のLadislav Tauc (1926-1999) によってGWRにかかわる神経回路の同定もなされていた[4]。
1962年、米ニューヨーク大学の研修医Eric Richard Kandel (1929-) はパリにTaucを訪ねてアメフラシの生理学研究技術を学び、以後ニューヨーク大学、コロンビア大学においてこれを発展させて、馴化、および後述の脱馴化の機構を分子レベルにまで掘り下げた。その業績によりKandelは2000年度のノーベル医学・生理学賞を受賞した[5]。
細胞機構
SWRやGWRは、脊椎動物の肢屈曲反射の反射弓などと同様、感覚ニューロンと運動ニューロンとの間の単シナプス反射である。体表の触覚ニューロン(TS)の細胞体は腹部神経節にあり、たとえばL28と名づけられた細胞などが代表的である(もちろん他にも多数ある)。TSはその軸索膨大部(ボタン)で、同じく腹部神経節内で鰓牽引筋の運動ニューロンL7(もちろん他にもある)と接触し、グルタミン酸作動性の興奮性シナプス結合をつくっている(図2)。
馴化は、このシナプスで、反復刺激による伝達の弱化として起こる。L7から細胞内記録を行いながら、体表への非侵害的刺激(水の吹きかけ)を行うとEPSPが記録されるが、反復によって次第に振幅は縮小する。また、TSの電気刺激によるL7の誘発EPSPも、反復によって縮小する[6]。TSの細胞内記録を行うと、パルス刺激によって誘発されるTSの活動電位は、Ca2+依存性のプラトー相の持続時間が反復刺激によってしだいに短縮していく。TSの細胞体での現象がボタンでも同様に起こっているとするなら、これによって伝達物質放出の漸減を説明できる。一方、L7への伝達物質直接投与による誘発脱分極の振幅は変わらない[7]。
TS活動電位のプラトー相の持続時間は、Kチャネルの活性によって決まるから、Kチャネルの活性化が起きていると考えられる[8]。
長期化
非侵害刺激によるSWRやGWRの縮小は、刺激を中止すると効果は数時間内に消えてしまう。しかし、適当な間隔をおきながら馴化訓練を繰り返すと、持続時間は次第に延長する[9]。このとき電子顕微鏡観察すると、感覚ニューロンのボタンの放出帯(active zone)の長さや vesicle数が減少していた[10]。そうした個々のボタンでの調節に加えて、ボタン数自体の減少も見出された[11]。また、短期の馴化が感覚ニューロン(シナプス前細胞)側のみの変化であるのに対し、長期馴化には運動ニューロン(シナプス後細胞)側の変化もみられた[12]。これらの変化は、単独でも伝達の減弱を説明できるので、そのうちのいずれが正しいのか、いずれもそれぞれ正しいのかは、決着していない。
未解明の問題
上述のように、TSの活動電位短縮は細胞体での観測結果であり、シナプス前部位(軸索膨大部(ボタン))で同じ現象が起きている保証はない。これは1980年代にはかなり「痛い」指摘で、真正面から答えるのは現在でも難しいが(パッチクランプ法では、電極内液=細胞内液の組成は実験者が決めるので、結果も解釈も実験者に依存してしまう)、たとえばCaイメージングによって、活動電位に伴うボタン内Ca2+濃度上昇の規模が縮小していることが確かめられた[13]ことなどから、おそらく正しいものと考えられている。
活性化するKチャネルの本体がどの種のKチャネルかは、未確定である。後述の脱馴化がS型Kチャネル(の不活性化)によることから、馴化がS型Kチャネル(の活性化)によっているなら、シナリオが一続きになって好都合で、それを主張する報告はある[14]。しかし、伝達物質放出の減少には、Kチャネル活性化による活動電位の短縮より、むしろ電位依存性Caチャネルの不活性化によるCa2+流入の減少によるところが大きいという見解も有力である[15]。もしそうなら、馴化と脱馴化は、機能的には鏡像的でも、機構的には鏡像的ではないことになる。
調節の標的がCaチャネルであれKチャネルであれ、その調節機構についても不明な部分が残されている。現象生起の時間経過からは、Ca2+などの細胞内リガンドによる速い調節よりも、リン酸化・脱リン酸化を含むタンパク修飾による、遅い調節の可能性が高い。すると、その調節装置を活性化する信号は何かが問題になる。腹部神経節にはFMRFアミド(神経ペプチド)を含む抑制性介在ニューロンが含まれている。FMRFアミドを運動ニューロンに投与すると、ホスホリパーゼA2の活性化とアラキドン酸の生成が起こる。アラキドン酸ないしその代謝物は、逆行性伝達物質としてシナプス後細胞からシナプス前細胞に達し、Caチャネル、Kチャネルを調節するという見解があり[16]、一定の支持をえている。
ただし、外因的に投与したFMRFアミドがこの作用を示すとしても、個体が馴化する際にFMRFアミドとアラキドン酸がこのシナプスで放出されている証拠はない。また、FMRFアミドが馴化の誘因だとして、それがなぜ刺激の初期には放出されず、反復後にはじめて放出されるのか、未詳である(そちらこそ馴化の本質であろう)。
脱馴化
現象
非侵害的刺激の反復によってGWRが馴化したあと、侵害的な刺激(たとえば頭部への刺突、電撃など)を加えると、GWRは再び増大する[6]。これを馴化の解除とみて「脱馴化」または「脱・慣れ」(dishabituation)とよぶ(図1)。
馴化は入力刺激特異的だが(GWRを水管刺激に馴化させても仮足刺激には馴化しない)、脱馴化は非特異的である。また、侵害刺激はあらかじめ馴化していないナイーブ個体のGWRも(SWRも)強化する。そこで、鋭敏化(sensitization)という表現もなされる。しかし、馴化した反射の再強化である脱馴化と、非特異的な防御反射の強化である鋭敏化とは、定義上異なるだけでなく、機構的にも異なる可能性がある[17]。
細胞機構
侵害刺激の情報は、セロトニン作動性介在ニューロンによって、触覚ニューロン-運動ニューロン間のシナプスに届けられる。具体的には、触覚ニューロンの軸
索膨大部(ボタン)上にシナプス前促通(presynaptic facilitation)をかける(図2)。
詳述すると、ボタン膜上のセロトニン受容体はGタンパク共役型で、セロトニンの結合でアデニル酸シクラーゼ(AC)を活性化し、ボタン細胞質でATPを環状AMP(cAMP)に変換する。cAMP濃度の上昇は、cAMP依存性蛋白質キナーゼ(PKA)を活性化し、PKAはKチャネルの一種をリン酸化して不活性化する(セロトニンで調節されるという意味でS型Kチャネルとよぶ)[18]。Kチャネルは、活動電位の終了に関わるので、その不活性化はボタン膜活動電位のプラトー相を延長し、その結果伝達物質の放出量は増して、鰓牽引筋運動ニューロンのEPSPは増大・延長する。
長期化
この脱馴化も、1回では短期可塑性にとどまる。しかし馴化の場合と同様、これを繰り返すことで、持続時間が漸増する。つまり、長期化が起こる[19]。これにも、前述の長期馴化の場合と同様、各ボタンレベルの変化(小胞の増加、放出帯の延長)[20]と、ボタン数自体の変化(増加)[21]が提唱されている。構造変化であれば、当然ながらタンパク合成に依存し、骨格分子[22]、接着分子[23]などの合成が伴うはずで、そうした報告もある。しかし、これらが長期化の原因か結果かと問うならば、むしろ結果であろう。原因分子の特定は難しい。短期の脱馴化の機構(cAMP、PKA、CREB [PKAによるリン酸化で活性化する転写因子])との分離が難しいためである。
未解明の問題
長期脱馴化には繰り返しが必要だが、その機構は未解明である。短期脱馴化(鋭敏化)と同じ信号によっているが、長期化には信号量の蓄積が必要、ということだろうか。もしそうなら、じゅうぶん強い短期脱馴化は長期化を導くはずであるが、実際そうはならない。では違う信号によっているのだろうか。もしそうなら、短期脱馴化なしに長期脱馴化だけを起こすような条件や分子が見つかってもよいが、その報告はない。
哺乳類の記憶の長期化(固定)に繰り返しが重要なことは、日常の体験からも知れるが、この繰り返しの意義についても未解明な点が多い。アメフラシの長期脱馴化で最近、1回目の脱馴化刺激時と2回目の脱馴化刺激時では、細胞応答が異なるという報告がなされた[24]。哺乳類脳における繰り返し依存的な構造可塑性[25]との異同に関心がもたれる。
原理的な問題
動物の記憶を、「経験による行動の変化」と定義するなら、馴化・脱馴化も記憶の範疇に入る。しかし、アメフラシのGWRは、腹部神経節内に生得的に(つまり事前に)組み込まれていた「馴化した状態」と「脱馴化した状態」の2状態間の切替えとみることもできる。アメフラシのGWRとほぼ同時期に解析されたDaniel L. Alkonらのミノウミウシ走光性抑制反応[26]も同様で、ウミウシが生得的に備えている2つの行動パターン間の切替えであった。
これに対して、哺乳類の記憶研究者は、記憶の定義の重要な要素として「生得的ではない行動の獲得」を考える。実験者がマウスに迷路を走らせるとき、マウスの脳内にその迷路があらかじめビルトインされているはずはない。にもかかわらずマウスがそれを記憶できるのは、神経系内に前もって存在しなかった新たな情報流路が形成される(流路変化の機構が既存シナプスでの伝達強化・弱化の総和であれ、シナプスの新生・廃止などの構造的変化であれ)からこそ可能だ、と考えるのである。これは、アメフラシGWRの馴化のようなあらかじめ準備された行動間の切替えとは様相が異なる。
もちろん、アメフラシやウミウシは非生得的な行動を獲得できない、ということはない。アメフラシに迷路学習や味覚条件づけを行うことも可能である。しかし、その学習の獲得が、反射の制御である馴化・脱馴化と同じであるかどうかはわからない。むしろ、それとは質的に異なる、たとえばシナプス新生や廃止の過程が含まれている可能性がある。
参考文献
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 6.0 6.1 引用エラー: 無効な
<ref>タグです。「re2」という名前の注釈に対するテキストが指定されていません - ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 引用エラー: 無効な
<ref>タグです。「re12」という名前の注釈に対するテキストが指定されていません - ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 引用エラー: 無効な
<ref>タグです。「re9」という名前の注釈に対するテキストが指定されていません - ↑ 引用エラー: 無効な
<ref>タグです。「re10」という名前の注釈に対するテキストが指定されていません - ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.