高親和性ニューロトロフィン受容体
武井 延之
新潟大学 脳研究所 基礎神経科学部門 腫瘍病態学分野
DOI:10.14931/bsd.9306 原稿受付日:2020年8月7日 原稿完成日:2020年8月12日
担当編集委員:山形 方人(ハーバード大学・脳科学センター)
同義語:高親和性神経成長因子受容体
類義語:Trk受容体
英:high-affinity neurotrophin receptor
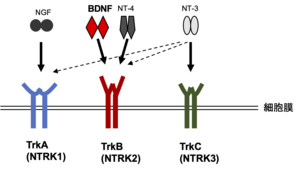
高親和性ニューロトロフィン受容体とはニューロトロフィンファミリー(神経成長因子 (nerve growth factor, NGF)、脳由来神経栄養因子 (brain-derived neurotrophic factor, BDNF)、ニューロトロフィン-3 (neurotrophin-3, NT-3)、ニューロトロフィン-4 (neurotrophin-4, NT-4)からなる)の受容体であり、TrkA, TrkB, TrkCがある。低親和性神経栄養因子受容体(p75)が全てのニューロトロフィンと結合するのに対し、TrkAにはNGFが、TrkBにはBDNFとNT-4が、TrkCにはNT-3がそれぞれ高親和性に結合、作用する。またTrkA, BはNT-3とも低親和性に結合する。ニューロトロフィンの結合によって、神経細胞の分化、生存維持、神経可塑性といった多様な細胞応答を引き起こす受容体である。
高親和性ニューロトロフィン受容体とは
結合実験から神経成長因子の受容体には高親和性(Kd=10-11)のものと低親和性(Kd=10-9)のものの存在が示唆されていた。低親和性受容体、p75は先にクローニングされていたが高親和性受容体は不明であった。
Trk(トラックと読む)は大腸癌で見出されたトロポミオシンと受容体型チロシンキナーゼ様の分子の融合遺伝子として同定された癌遺伝子trkの遺伝子産物で、tropomyosin receptor kinaseとして1986年にクローニングされていた[1]。受容体型チロシンキナーゼと示唆されていたが、同定時にはリガンドは不明であった。Trkが神経系に高発現していることがわかり、1991年になってTrkA, B, Cが相次いでニューロトロフィンの受容体と同定された[2]。TrkA(遺伝子名としてはNTRK1)にはNGFが、TrkB (NTRK2)にはBDNFとNT-4が、TrkC (NTRK3)にはNT-3がそれぞれ高親和性に結合、作用する(図1)。
分子構造
TrkはROR(Receptor tyrosine kinase-like orphan receptor, Trkに類似したキナーゼとしてPCRでクローニングされた)と約50%のホモロジーを持ち、MuSK(muscle-specific kinase)などとともにNTRKスーパーファミリーと分類され、進化的にもよく保存されている[3]。
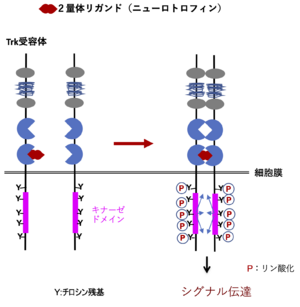
TrkはA,B,Cともアミノ酸約800個からなり、糖鎖付加を受けて分子量140-145kDaの成熟分子となる。EGF受容体やインシュリン受容体と同じく受容体型チロシンキナーゼであり、細胞内にキナーゼドメインを持つ。細胞外には2つのシステインリッチクラスターとそれに挟まれた3つのロイシンリッチリピート、さらに2つのイムノグロブリン様ドメインがある。2つ目のイムノグロブリン様ドメインにリガンドである各ニューロトロフィンが結合する。2量体リガンドが結合するとTrk自体も2量体化し、細胞内ドメインのチロシン残基を相互にリン酸化する。このリン酸化チロシンに種々の分子が結合し、細胞内にシグナルを伝達する(図2)[4][5]。TrkAの結晶構造を図3に示す。
Trkにはスプライスバリアントが複数存在するが、TrkB, TrkCにはキナーゼドメインを欠失した短いタイプ(truncated型)があり、このタイプの受容体はリガンドと結合はするが、シグナルを伝えることはできない。そのためドミナントネガティブとして働くが、それ以外の働きも示されている[7]。
分布
TrkA, B, Cとも末梢神経系の神経細胞に広く発現している。脳内ではTrkB, Cは幅広く分布し、ほとんどの神経細胞に発現している。一方、TrkAの発現はほぼ前脳基底野のアセチルコリン作働性神経細胞に限られておりNGFの作用も限定されている。末梢神経での細胞内局在は主にシナプス終末に存在し、ニューロトロフィンの標的由来/逆行性作用を受けている。TrkAは中枢でも逆行性作用が主と考えられており前シナプスに局在しているのに対し、TrkBは主に後シナプス部位に局在して、前シナプスから活動依存的に放出されるBDNFを受容して機能している[8]。
生化学的機能
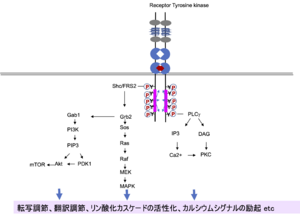
受容体型チロシンキナーゼに共通の仕組みとして、リガンドの結合によって受容体分子が2量体化し、キナーゼドメインによって相手側のチロシン残基がリン酸化される。リン酸化チロシンにアダプター分子が結合し、リン酸化カスケードが駆動され、様々なシグナルが細胞内に伝わる(図4)[9][10]。Trkの特徴として、下流シグナルも含めて、活性化の時間経過がEGF受容体などに比べて長く持続することが知られている。TrkAではリン酸化したY496(ヒトの場合、以下同じ。TrkBはY532、TrkCはY516)にShcあるいはFRS2が結合し、Ras-MAPK系とPI3K-Akt系が活性化される(図4)。
ShcあるいはFRS2を介してGrb2-Sosから、癌遺伝子rasの産物で、低分子GTP結合蛋白質であるRasを活性化する。さらにRaf、MEK(MAPキナーゼキナーゼ, MAPKKとも呼ばれる)を介しErk1, 2 (Extracellular regulated kinase 1, 2、あるいはmitogen activated protein kinase (MAPK)とも呼ばれる)を活性化する経路であり、転写調節などを中心として多くの細胞応答を引き起こす。
Grb2からGab1を介して、脂質キナーゼであるphosphatidilyinositol 3-OH kinase (PI3キナーゼ, PI3K)を活性化する。PI3Kはホスファチジルイノシトール4,5-ビスホスフェート (PIP2)からPIP3を産生し、PDK1-Aktを活性化するシグナルを伝える。アポトーシスの抑制に作用しているとともに、mTORを活性化し翻訳調節などの細胞内代謝を制御している。
もう一つの経路はホスホリパーゼCγ (phospholipase Cγ)PLCγの系で、TrkAではリン酸化したY791(TrkBではY833、TrkCではY834)にPLC&gammaが自身のSH2ドメインを介して結合し活性化され、PIP2からイノシトール3リン酸(IP3)とジアシルグリセロール(DG)を産生する。IP3は細胞内カルシウム貯蔵部位からカルシウムを放出させることによってカルシウムシグナルを駆動させ、ジアシルグリセロールはプロテインキナーゼC (protein kinase C, PKC)を活性化させる。どちらも細胞内情報系として様々な重要な働きをしている。
生理的機能
Trkの生理的機能としてではなくニューロトロフィン(NGF, BDNF, NT-3)の生理作用として多くの総説があるので参照されたい[11][12][13]。
各種Trkの発現は末梢神経系に幅広く見られ、末梢神経細胞の分化、生存維持に必須の役割をはたしている。そのためTrkノックアウトマウスは生後まもなく死亡する。表現型としてはリガンドであるニューロトロフィンのノックアウトより重篤である。このため、中枢神経系で研究はコンディショナルノックアウトを用いる必要がある。中枢神経系での機能としては、BDNF-TrkB系が神経可塑性に特に重要であることが示されている。TrkB自体の関与としては、活動依存性に神経細胞の膜表面に移行して(やはり活動依存性に発現、放出が増強されるBDNFとともに)、神経活動とリンクして働くことがわかっている[14]。またBDNF-TrkBは中枢性の摂食/代謝にも関与している[15]。TrkCは広く発現しているものの、NT-3の中枢作用はあまり認められていない。TrkCはシナプス形成に関与する「シナプスオーガナイザー」の働きがあることも報告されており[16]、Trkはニューロトロフィン受容体としての働き以外にも機能がある可能性もある。
疾患との関連
遺伝性感覚ニューロパチーの患者においてNTRK1(ヒトTrkAをコード)のloss of function変異を認めている[17]。感覚神経にTrkAが発現していることから関与が強く示唆されている。またNTRK2(TrkB)のloss of function変異では摂食異常、肥満、発達遅滞が認められいる[18]。これも動物実験の結果と一致している[15] (13)。疾患に関して近年最も注目を集めているのはNTRK融合遺伝子である。Trkのキナーゼドメインと他の分子との融合遺伝子が癌のドライバーとなることが多くの癌種で明らかになっている [19]。Trk発見の経緯も癌における融合遺伝子によることから、驚くことではないが、シークエンス技術の向上により多く見出されるようになってきた。Trk阻害剤が抗癌剤として開発されており、日本でもエヌトレクチニブが抗癌剤として承認されている。副作用として認知障害や運動失調が報告されており、Trkの正常作用を考えるとうなずける。
阻害剤とアゴニスト
これまでTrk阻害剤としてK252aが広く使われていたが、K252aは実際はTrk特異性は高くなく、cAMP依存性タンパク質リン酸化酵素(protein kinase A, PKA)やPKCを阻害するし、カルシウム/カルモジュリン依存性キナーゼ (CaMK)に対するIC50は一桁低い。抗癌剤として開発された阻害剤は正常なTrkにも作用すると思われるが、癌研究以外ではあまり使われていない。これらはキナーゼ阻害剤であるため、キナーゼの構造の似ている各Trkに対する特異性/選択性はない[19]。各Trkの働きを個別に阻害するためにはTrk-Fc(あるいはTrk-IgG)と言われる各Trkの細胞外ドメインとIgGのFcドメインの融合タンパク質が用いられる。
アゴニスト、特にTrkBのアゴニストとして低分子の7,8-DHFやLM22A-4などが報告されている[20]が、完全なコンセンサスが得られているとは言い難い。
リソース
抗体
Trkに対する抗体が市販されている。免疫染色、ウエスタンブロット、免疫沈降などに利用可。またリン酸化Trkに対する抗体も市販されているが、リン酸化サイトは各Trk間(その他の受容体型チロシンキナーゼでも)で良く保存されているので、特異性には問題がある。
遺伝子改変マウス
各Trkのトランスジェニック、及びノックアウトマウスが作成されている。ノックアウトマウスに関してはジャクソン研究所で全種購入可能。TrkBに関してはコンディショナルノックアウトも作成されている。またtruncated TrkBトランスジェニックマウスも報告されている。大抵のマウスは作成者より入手可能。
関連項目
参考文献
- ↑
Martin-Zanca, D., Hughes, S.H., & Barbacid, M. (1986).
A human oncogene formed by the fusion of truncated tropomyosin and protein tyrosine kinase sequences. Nature, 319(6056), 743-8. [PubMed:2869410] [WorldCat] [DOI] - ↑
Lamballe, F., Klein, R., & Barbacid, M. (1991).
The trk family of oncogenes and neurotrophin receptors. Princess Takamatsu symposia, 22, 153-70. [PubMed:1844238] - ↑
Green, J.L., Kuntz, S.G., & Sternberg, P.W. (2008).
Ror receptor tyrosine kinases: orphans no more. Trends in cell biology, 18(11), 536-44. [PubMed:18848778] [PMC] [WorldCat] [DOI] - ↑
Barbacid, M. (1994).
The Trk family of neurotrophin receptors. Journal of neurobiology, 25(11), 1386-403. [PubMed:7852993] [WorldCat] [DOI] - ↑
Barbacid, M. (1995).
Structural and functional properties of the TRK family of neurotrophin receptors. Annals of the New York Academy of Sciences, 766, 442-58. [PubMed:7486690] [WorldCat] [DOI] - ↑
Robertson, A.G., Banfield, M.J., Allen, S.J., Dando, J.A., Mason, G.G., Tyler, S.J., ..., & Dawbarn, D. (2001).
Identification and structure of the nerve growth factor binding site on TrkA. Biochemical and biophysical research communications, 282(1), 131-41. [PubMed:11263982] [WorldCat] [DOI] - ↑
Deinhardt, K., & Chao, M.V. (2014).
Trk receptors. Handbook of experimental pharmacology, 220, 103-19. [PubMed:24668471] [WorldCat] [DOI] - ↑
Nawa, H., & Takei, N. (2001).
BDNF as an anterophin; a novel neurotrophic relationship between brain neurons. Trends in neurosciences, 24(12), 683-4; discussion 684-5. [PubMed:11718853] [WorldCat] [DOI] - ↑
Chao, M.V. (2003).
Neurotrophins and their receptors: a convergence point for many signalling pathways. Nature reviews. Neuroscience, 4(4), 299-309. [PubMed:12671646] [WorldCat] [DOI] - ↑
Huang, E.J., & Reichardt, L.F. (2003).
Trk receptors: roles in neuronal signal transduction. Annual review of biochemistry, 72, 609-42. [PubMed:12676795] [WorldCat] [DOI] - ↑
Bibel, M., & Barde, Y.A. (2000).
Neurotrophins: key regulators of cell fate and cell shape in the vertebrate nervous system. Genes & development, 14(23), 2919-37. [PubMed:11114882] [WorldCat] [DOI] - ↑
Park, H., & Poo, M.M. (2013).
Neurotrophin regulation of neural circuit development and function. Nature reviews. Neuroscience, 14(1), 7-23. [PubMed:23254191] [WorldCat] [DOI] - ↑ 武井延之、那波宏之 (2004)
ニューロトロフィンによる脳機能の調節―細胞応答から行動変容までー
生化学 76:111-123 - ↑
Andreska, T., Lüningschrör, P., & Sendtner, M. (2020).
Regulation of TrkB cell surface expression-a mechanism for modulation of neuronal responsiveness to brain-derived neurotrophic factor. Cell and tissue research. [PubMed:32556728] [WorldCat] [DOI] - ↑ 15.0 15.1
Takei, N., Furukawa, K., Hanyu, O., Sone, H., & Nawa, H. (2014).
A possible link between BDNF and mTOR in control of food intake. Frontiers in psychology, 5, 1093. [PubMed:25309497] [PMC] [WorldCat] [DOI] - ↑
Naito, Y., Lee, A.K., & Takahashi, H. (2017).
Emerging roles of the neurotrophin receptor TrkC in synapse organization. Neuroscience research, 116, 10-17. [PubMed:27697534] [WorldCat] [DOI] - ↑
Indo, Y., Tsuruta, M., Hayashida, Y., Karim, M.A., Ohta, K., Kawano, T., ..., & Matsuda, I. (1996).
Mutations in the TRKA/NGF receptor gene in patients with congenital insensitivity to pain with anhidrosis. Nature genetics, 13(4), 485-8. [PubMed:8696348] [WorldCat] [DOI] - ↑
Yeo, G.S., Connie Hung, C.C., Rochford, J., Keogh, J., Gray, J., Sivaramakrishnan, S., ..., & Farooqi, I.S. (2004).
A de novo mutation affecting human TrkB associated with severe obesity and developmental delay. Nature neuroscience, 7(11), 1187-9. [PubMed:15494731] [WorldCat] [DOI] - ↑ 19.0 19.1
Cocco, E., Scaltriti, M., & Drilon, A. (2018).
NTRK fusion-positive cancers and TRK inhibitor therapy. Nature reviews. Clinical oncology, 15(12), 731-747. [PubMed:30333516] [PMC] [WorldCat] [DOI] - ↑
Josephy-Hernandez, S., Jmaeff, S., Pirvulescu, I., Aboulkassim, T., & Saragovi, H.U. (2017).
Neurotrophin receptor agonists and antagonists as therapeutic agents: An evolving paradigm. Neurobiology of disease, 97(Pt B), 139-155. [PubMed:27546056] [WorldCat] [DOI]