「Notchリガンド」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 7行目: | 7行目: | ||
==Notchシグナル伝達(概要)== | ==Notchシグナル伝達(概要)== | ||
[[Notch]]シグナル伝達は進化的に保存されたシグナル伝達経路であり、様々な発生過程や組織の恒常性を制御し、幹細胞の維持に重要な役割を果たしている。Notchシグナルは隣接細胞間の相互作用によって伝達される。[[細胞膜]]上に発現したNotchレセプターが、隣接細胞上に発現したNotchリガンド(Delta, Jagged)と相互作用することによってシグナルが伝達される。細胞間相互作用によって、隣接細胞間で同じ細胞運命をたどることを抑制することを側方抑制(lateral inhibition)という。Notchシグナルを介した側方抑制により、様々な組織構築過程におけるパターン形成が行われている。また、Notchシグナルは[[細胞増殖]]、[[細胞分化]]、[[細胞死]]を制御することによって、組織構築を制御している<ref name=ref1><pubmed></pubmed></ref> <ref name=ref10><pubmed></pubmed></ref> <ref name=ref15><pubmed></pubmed></ref>。 | [[Notch]]シグナル伝達は進化的に保存されたシグナル伝達経路であり、様々な発生過程や組織の恒常性を制御し、幹細胞の維持に重要な役割を果たしている。Notchシグナルは隣接細胞間の相互作用によって伝達される。[[細胞膜]]上に発現したNotchレセプターが、隣接細胞上に発現したNotchリガンド(Delta, Jagged)と相互作用することによってシグナルが伝達される。細胞間相互作用によって、隣接細胞間で同じ細胞運命をたどることを抑制することを側方抑制(lateral inhibition)という。Notchシグナルを介した側方抑制により、様々な組織構築過程におけるパターン形成が行われている。また、Notchシグナルは[[細胞増殖]]、[[細胞分化]]、[[細胞死]]を制御することによって、組織構築を制御している<ref name=ref1><pubmed>16921404</pubmed></ref> <ref name=ref10><pubmed>19379690</pubmed></ref> <ref name=ref15><pubmed>16429119</pubmed></ref>。 | ||
== 構造== | == 構造== | ||
| 16行目: | 16行目: | ||
#'''DSLモチーフ:DSL(Delta/Serrate/LAG-2)motif'''<br>リガンドタンパク質のN末端側、細胞外ドメインにあるモチーフ。 | #'''DSLモチーフ:DSL(Delta/Serrate/LAG-2)motif'''<br>リガンドタンパク質のN末端側、細胞外ドメインにあるモチーフ。 | ||
#'''DOSドメイン:DOS(Delta and OSM-11-like)domain'''<br>特殊化された[[EGF]]リピート。DSLドメインとDOSドメインは両方ともNotchレセプターとの相互作用に関与する。 | #'''DOSドメイン:DOS(Delta and OSM-11-like)domain'''<br>特殊化された[[EGF]]リピート。DSLドメインとDOSドメインは両方ともNotchレセプターとの相互作用に関与する。 | ||
#'''EGFリピート:EGF([[Epidermal growth factor]] (EGF))- like repeat'''<br>NotchレセプターのEGFリピート同様、[[カルシウムイオン]]が結合するものとしないものとがある。EGFリピートの最初の二つのリピートはDSLリガンドがNotchと結合するために必要なドメインである<ref name=ref21><pubmed></pubmed></ref> <ref name=ref25><pubmed></pubmed></ref>。 | #'''EGFリピート:EGF([[Epidermal growth factor]] (EGF))- like repeat'''<br>NotchレセプターのEGFリピート同様、[[カルシウムイオン]]が結合するものとしないものとがある。EGFリピートの最初の二つのリピートはDSLリガンドがNotchと結合するために必要なドメインである<ref name=ref21><pubmed>17028337</pubmed></ref> <ref name=ref25><pubmed>10551863</pubmed></ref>。 | ||
#'''Cysteine-rich ドメイン:Cysteine-rich domain | #'''Cysteine-rich ドメイン:Cysteine-rich domain | ||
#'''膜貫通ドメイン:trans-membrane domain(TMD) | #'''膜貫通ドメイン:trans-membrane domain(TMD) | ||
| 32行目: | 32行目: | ||
#'''trans-activation'''<br>隣接細胞間でおこるtrans-activationは非常によく研究されており、発生過程や成体における幹細胞の維持を制御している。隣接細胞が膜表面上に提示するNotchリガンド(Delta, Jagged)とNotchレセプターが相互作用することによって、Notchレセプターの分解が段階的に進行し、Notchの細胞内ドメインが細胞膜上から核内へと輸送され標的遺伝子の[[プロモーター]]上に結合することで、シグナルが伝達される(詳しくは[[Notch]]の頁参照)。 | #'''trans-activation'''<br>隣接細胞間でおこるtrans-activationは非常によく研究されており、発生過程や成体における幹細胞の維持を制御している。隣接細胞が膜表面上に提示するNotchリガンド(Delta, Jagged)とNotchレセプターが相互作用することによって、Notchレセプターの分解が段階的に進行し、Notchの細胞内ドメインが細胞膜上から核内へと輸送され標的遺伝子の[[プロモーター]]上に結合することで、シグナルが伝達される(詳しくは[[Notch]]の頁参照)。 | ||
#'''cis-inhibition'''<ref name=ref5><pubmed></pubmed></ref> <ref name=ref29><pubmed></pubmed></ref><br>同一細胞内におけるNotchレセプターとリガンドとの相互作用は、隣接細胞間でおこるtrans-activationとは異なり、Notchシグナルに対して抑制的に働くことから、cis-inhibitionと呼ばれる<ref name=ref6><pubmed></pubmed></ref> <ref name=ref7><pubmed></pubmed></ref> <ref name=ref8><pubmed></pubmed></ref> <ref name=ref9><pubmed></pubmed></ref> <ref name=ref11><pubmed></pubmed></ref> <ref name=ref16><pubmed></pubmed></ref> <ref name=ref24><pubmed></pubmed></ref>。Cis-inhibitionの詳細な機序は不明な点が多いが、同一細胞内においてNotchとリガンドが相互作用することによって、Notchレセプターが細胞内にトラップされる。それによって膜表面上へと発現するNotchレセプターの数が減少することで、隣接細胞間におけるNotchシグナル伝達に抑制的に働くと考えられている。また、cis-inhibitionは一部のNotchシグナル依存的な発生過程に寄与していることが報告されている<ref name=ref4><pubmed></pubmed></ref> <ref name=ref7 /> <ref name=ref8 /> <ref name=ref9 />。 | #'''cis-inhibition'''<ref name=ref5><pubmed>17761886</pubmed></ref> <ref name=ref29><pubmed>18344021</pubmed></ref><br>同一細胞内におけるNotchレセプターとリガンドとの相互作用は、隣接細胞間でおこるtrans-activationとは異なり、Notchシグナルに対して抑制的に働くことから、cis-inhibitionと呼ばれる<ref name=ref6><pubmed>17006545</pubmed></ref> <ref name=ref7><pubmed>9778511</pubmed></ref> <ref name=ref8><pubmed>9655817</pubmed></ref> <ref name=ref9><pubmed>9281342</pubmed></ref> <ref name=ref11><pubmed>16144902</pubmed></ref> <ref name=ref16><pubmed>9108365</pubmed></ref> <ref name=ref24><pubmed> 12050162</pubmed></ref>。Cis-inhibitionの詳細な機序は不明な点が多いが、同一細胞内においてNotchとリガンドが相互作用することによって、Notchレセプターが細胞内にトラップされる。それによって膜表面上へと発現するNotchレセプターの数が減少することで、隣接細胞間におけるNotchシグナル伝達に抑制的に働くと考えられている。また、cis-inhibitionは一部のNotchシグナル依存的な発生過程に寄与していることが報告されている<ref name=ref4><pubmed>9310319</pubmed></ref> <ref name=ref7 /> <ref name=ref8 /> <ref name=ref9 />。 | ||
===Dll1タンパク質のオシレーション(発現振動)=== | ===Dll1タンパク質のオシレーション(発現振動)=== | ||
哺乳動物の神経発生過程および体節形成過程においてDll1遺伝子は転写活性レベルおよびタンパク質レベルで発現振動している<ref name=ref26><pubmed></pubmed></ref> <ref name=ref27><pubmed></pubmed></ref>。Dll1の発現は[[bHLH]]型[[抑制性]][[転写因子]][[Hes]]([[Hes1]], [[Hes7]])によって制御されている。Hes遺伝子が自身のネガティブフィードバックにより発現振動を示すため、Hesによる抑制を受けるDll1の発現も振動する。Dll1の発現振動は、神経発生過程では[[神経幹細胞]]の維持に寄与しておりDll1の発現振動がなくなると幹細胞の維持が障害される<ref name=ref26 /> <ref name=ref27 />。体節形成過程ではDll1の発現振動がなくなると時計遺伝子Hesの発現振動がなくなり体節形成および体軸の骨格異常が引き起こされる27。 | 哺乳動物の神経発生過程および体節形成過程においてDll1遺伝子は転写活性レベルおよびタンパク質レベルで発現振動している<ref name=ref26><pubmed>26728556</pubmed></ref> <ref name=ref27><pubmed>18400163</pubmed></ref>。Dll1の発現は[[bHLH]]型[[抑制性]][[転写因子]][[Hes]]([[Hes1]], [[Hes7]])によって制御されている。Hes遺伝子が自身のネガティブフィードバックにより発現振動を示すため、Hesによる抑制を受けるDll1の発現も振動する。Dll1の発現振動は、神経発生過程では[[神経幹細胞]]の維持に寄与しておりDll1の発現振動がなくなると幹細胞の維持が障害される<ref name=ref26 /> <ref name=ref27 />。体節形成過程ではDll1の発現振動がなくなると時計遺伝子Hesの発現振動がなくなり体節形成および体軸の骨格異常が引き起こされる27。 | ||
==DSLリガンドの活性を制御する修飾== | ==DSLリガンドの活性を制御する修飾== | ||
DLSリガンドはタンパクの[[翻訳]]後、様々な修飾を受ける。この修飾過程によって、リガンドの活性が制御されていることが報告されている。 | DLSリガンドはタンパクの[[翻訳]]後、様々な修飾を受ける。この修飾過程によって、リガンドの活性が制御されていることが報告されている。 | ||
===糖鎖修飾=== | ===糖鎖修飾=== | ||
Notchの糖鎖修飾(glycosylation)はリガンドの結合能を改変することで、リガンド活性を制御する上で重要な修飾である<ref name=ref20><pubmed></pubmed></ref> <ref name=ref22><pubmed></pubmed></ref> <ref name=ref28><pubmed></pubmed></ref>。DSLリガンドおよびNotchレセプターのEGFリピート中にはO-fucoseやO-glucoseによって修飾される保存された配列があり、これらの糖タンパク質による修飾はNotchシグナルを調整することが報告されている。 | Notchの糖鎖修飾(glycosylation)はリガンドの結合能を改変することで、リガンド活性を制御する上で重要な修飾である<ref name=ref20><pubmed>18272537</pubmed></ref> <ref name=ref22><pubmed>17584081</pubmed></ref> <ref name=ref28><pubmed>17964136</pubmed></ref>。DSLリガンドおよびNotchレセプターのEGFリピート中にはO-fucoseやO-glucoseによって修飾される保存された配列があり、これらの糖タンパク質による修飾はNotchシグナルを調整することが報告されている。 | ||
糖転移酵素(グリコシルトランスフェラーゼ) | 糖転移酵素(グリコシルトランスフェラーゼ) | ||
| 48行目: | 48行目: | ||
===ユビキチン修飾=== | ===ユビキチン修飾=== | ||
DSLリガンドのユビキチン修飾(ubiquitination)は、リガンドのシグナル活性と細胞膜上の発現を制御する<ref name=ref3><pubmed></pubmed></ref> <ref name=ref12><pubmed></pubmed></ref> <ref name=ref13><pubmed></pubmed></ref> <ref name=ref17><pubmed></pubmed></ref>。これらのリガンドのE3 ligaseは、Neuralized(Neur)やMind bomb(Mib)である。DSLリガンドのユビキチン修飾は、リガンドのエンドサイトーシスを促進することで、Notchシグナルの活性化を制御する(哺乳動物においてはMibのみがその活性を有する)。 | DSLリガンドのユビキチン修飾(ubiquitination)は、リガンドのシグナル活性と細胞膜上の発現を制御する<ref name=ref3><pubmed>16425217</pubmed></ref> <ref name=ref12><pubmed>16488590</pubmed></ref> <ref name=ref13><pubmed>12676105</pubmed></ref> <ref name=ref17><pubmed>17547700</pubmed></ref>。これらのリガンドのE3 ligaseは、Neuralized(Neur)やMind bomb(Mib)である。DSLリガンドのユビキチン修飾は、リガンドのエンドサイトーシスを促進することで、Notchシグナルの活性化を制御する(哺乳動物においてはMibのみがその活性を有する)。 | ||
またエンドサイトーシスだけではなく、ユビキチン修飾によってDSLリガンドの細胞内輸送や分解も制御されている。 | またエンドサイトーシスだけではなく、ユビキチン修飾によってDSLリガンドの細胞内輸送や分解も制御されている。 | ||
| 55行目: | 55行目: | ||
DeltaやJaggedといったNotchリガンドはNotchシグナルを活性化させる役割を果たすため、これらの因子の欠損によって様々な疾患が引き起こされることが知られている。 | DeltaやJaggedといったNotchリガンドはNotchシグナルを活性化させる役割を果たすため、これらの因子の欠損によって様々な疾患が引き起こされることが知られている。 | ||
*Alagille syndrome(Jagged1遺伝子における変異)<ref name=ref14><pubmed></pubmed></ref> <ref name=ref19><pubmed></pubmed></ref> | *Alagille syndrome(Jagged1遺伝子における変異)<ref name=ref14><pubmed>9207788</pubmed></ref> <ref name=ref19><pubmed> 9207787</pubmed></ref> | ||
*Spondylocostal dysostosis(Dll3遺伝子における変異)<ref name=ref2><pubmed></pubmed></ref> | *Spondylocostal dysostosis(Dll3遺伝子における変異)<ref name=ref2><pubmed>10742114</pubmed></ref> | ||
*Curb tumor angiogenesis(Dll4遺伝子における変異)<ref name=ref18><pubmed></pubmed></ref> <ref name=ref23><pubmed></pubmed></ref><br> | *Curb tumor angiogenesis(Dll4遺伝子における変異)<ref name=ref18><pubmed>17183313</pubmed></ref> <ref name=ref23><pubmed>17183323</pubmed></ref><br> | ||
など | など | ||
==参考文献== | ==参考文献== | ||
<references /> | <references /> | ||
2016年5月10日 (火) 11:21時点における版
下條 博美、影山 龍一郎
京都大学
DOI:10.14931/bsd.7114 原稿受付日:2016年5月6日 原稿完成日:2016年月日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
Notchシグナル伝達(概要)
Notchシグナル伝達は進化的に保存されたシグナル伝達経路であり、様々な発生過程や組織の恒常性を制御し、幹細胞の維持に重要な役割を果たしている。Notchシグナルは隣接細胞間の相互作用によって伝達される。細胞膜上に発現したNotchレセプターが、隣接細胞上に発現したNotchリガンド(Delta, Jagged)と相互作用することによってシグナルが伝達される。細胞間相互作用によって、隣接細胞間で同じ細胞運命をたどることを抑制することを側方抑制(lateral inhibition)という。Notchシグナルを介した側方抑制により、様々な組織構築過程におけるパターン形成が行われている。また、Notchシグナルは細胞増殖、細胞分化、細胞死を制御することによって、組織構築を制御している[1] [2] [3]。
構造
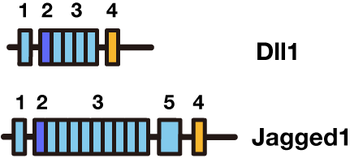
Notchリガンドは1回膜貫通型タンパク質である。ショウジョウバエから哺乳動物までNotchリガンドは多様性に富むが、共通した構造(モチーフ)を持っている。
- DSLモチーフ:DSL(Delta/Serrate/LAG-2)motif
リガンドタンパク質のN末端側、細胞外ドメインにあるモチーフ。 - DOSドメイン:DOS(Delta and OSM-11-like)domain
特殊化されたEGFリピート。DSLドメインとDOSドメインは両方ともNotchレセプターとの相互作用に関与する。 - EGFリピート:EGF(Epidermal growth factor (EGF))- like repeat
NotchレセプターのEGFリピート同様、カルシウムイオンが結合するものとしないものとがある。EGFリピートの最初の二つのリピートはDSLリガンドがNotchと結合するために必要なドメインである[4] [5]。 - Cysteine-rich ドメイン:Cysteine-rich domain
- 膜貫通ドメイン:trans-membrane domain(TMD)
Notchリガンドの分類
Notchリガンドは、Cysteine-richドメインの有無(Jagged/Serrateは有り、Deltaは無し)、DOSドメインの有無によって分類される。
- 古典的なDSLリガンド
ショウジョウバエSerrate、Delta、哺乳動物Jagged1、Jagged2、Dll1はこのタイプに属する。線虫にはこのタイプのリガンドはない。DSLドメイン、DOSドメイン、EGFリピート、TMD(transmembrane domain:細胞膜貫通ドメイン)を有する。また、Serrate、JaggedにはCystein-richドメインがある。 - SL/EGFリガンド
哺乳動物Dll3、Dll4はこのタイプ。また線虫のAPX1、LAG2、ARG1、DSL1-7はこのタイプに属する。DSLドメインとEGFリピートを共通して有する。 - DOSリガンド
哺乳動物mDLK1,2および線虫DOS1-3、OSM7,11はこのタイプ。DOSドメインを有する。
機能
trans-activationとcis-inhibition
Notchレセプターとリガンドとの相互作用は、隣接細胞間での相互作用で、シグナルを伝達する際に起こるtrans-activationと、同一細胞内でのレセプターとリガンドの相互作用によって起こるcis-inhibitionとがある。
- trans-activation
隣接細胞間でおこるtrans-activationは非常によく研究されており、発生過程や成体における幹細胞の維持を制御している。隣接細胞が膜表面上に提示するNotchリガンド(Delta, Jagged)とNotchレセプターが相互作用することによって、Notchレセプターの分解が段階的に進行し、Notchの細胞内ドメインが細胞膜上から核内へと輸送され標的遺伝子のプロモーター上に結合することで、シグナルが伝達される(詳しくはNotchの頁参照)。 - cis-inhibition[6] [7]
同一細胞内におけるNotchレセプターとリガンドとの相互作用は、隣接細胞間でおこるtrans-activationとは異なり、Notchシグナルに対して抑制的に働くことから、cis-inhibitionと呼ばれる[8] [9] [10] [11] [12] [13] [14]。Cis-inhibitionの詳細な機序は不明な点が多いが、同一細胞内においてNotchとリガンドが相互作用することによって、Notchレセプターが細胞内にトラップされる。それによって膜表面上へと発現するNotchレセプターの数が減少することで、隣接細胞間におけるNotchシグナル伝達に抑制的に働くと考えられている。また、cis-inhibitionは一部のNotchシグナル依存的な発生過程に寄与していることが報告されている[15] [9] [10] [11]。
Dll1タンパク質のオシレーション(発現振動)
哺乳動物の神経発生過程および体節形成過程においてDll1遺伝子は転写活性レベルおよびタンパク質レベルで発現振動している[16] [17]。Dll1の発現はbHLH型抑制性転写因子Hes(Hes1, Hes7)によって制御されている。Hes遺伝子が自身のネガティブフィードバックにより発現振動を示すため、Hesによる抑制を受けるDll1の発現も振動する。Dll1の発現振動は、神経発生過程では神経幹細胞の維持に寄与しておりDll1の発現振動がなくなると幹細胞の維持が障害される[16] [17]。体節形成過程ではDll1の発現振動がなくなると時計遺伝子Hesの発現振動がなくなり体節形成および体軸の骨格異常が引き起こされる27。
DSLリガンドの活性を制御する修飾
DLSリガンドはタンパクの翻訳後、様々な修飾を受ける。この修飾過程によって、リガンドの活性が制御されていることが報告されている。
糖鎖修飾
Notchの糖鎖修飾(glycosylation)はリガンドの結合能を改変することで、リガンド活性を制御する上で重要な修飾である[18] [19] [20]。DSLリガンドおよびNotchレセプターのEGFリピート中にはO-fucoseやO-glucoseによって修飾される保存された配列があり、これらの糖タンパク質による修飾はNotchシグナルを調整することが報告されている。
糖転移酵素(グリコシルトランスフェラーゼ)
- OFUT1(ショウジョウバエ)、Pofut1(哺乳類):o-fucose
- Rumi(ショウジョウバエ):o-glucose
- Fringe(beta-1,3-N-acetylglucosaminyltransferase): N-acetylglucosamine, FringeによるNotch修飾は、Delta-likeリガンドの活性には影響するが、Serrate-likeリガンドの活性には影響しない。
ユビキチン修飾
DSLリガンドのユビキチン修飾(ubiquitination)は、リガンドのシグナル活性と細胞膜上の発現を制御する[21] [22] [23] [24]。これらのリガンドのE3 ligaseは、Neuralized(Neur)やMind bomb(Mib)である。DSLリガンドのユビキチン修飾は、リガンドのエンドサイトーシスを促進することで、Notchシグナルの活性化を制御する(哺乳動物においてはMibのみがその活性を有する)。
またエンドサイトーシスだけではなく、ユビキチン修飾によってDSLリガンドの細胞内輸送や分解も制御されている。
Notchリガンド関連疾患
DeltaやJaggedといったNotchリガンドはNotchシグナルを活性化させる役割を果たすため、これらの因子の欠損によって様々な疾患が引き起こされることが知られている。
- Alagille syndrome(Jagged1遺伝子における変異)[25] [26]
- Spondylocostal dysostosis(Dll3遺伝子における変異)[27]
- Curb tumor angiogenesis(Dll4遺伝子における変異)[28] [29]
など
参考文献
- ↑
Bray, S.J. (2006).
Notch signalling: a simple pathway becomes complex. Nature reviews. Molecular cell biology, 7(9), 678-89. [PubMed:16921404] [WorldCat] [DOI] - ↑
Kopan, R., & Ilagan, M.X. (2009).
The canonical Notch signaling pathway: unfolding the activation mechanism. Cell, 137(2), 216-33. [PubMed:19379690] [PMC] [WorldCat] [DOI] - ↑
Louvi, A., & Artavanis-Tsakonas, S. (2006).
Notch signalling in vertebrate neural development. Nature reviews. Neuroscience, 7(2), 93-102. [PubMed:16429119] [WorldCat] [DOI] - ↑
Parks, A.L., Stout, J.R., Shepard, S.B., Klueg, K.M., Dos Santos, A.A., Parody, T.R., ..., & Muskavitch, M.A. (2006).
Structure-function analysis of delta trafficking, receptor binding and signaling in Drosophila. Genetics, 174(4), 1947-61. [PubMed:17028337] [PMC] [WorldCat] [DOI] - ↑
Shimizu, K., Chiba, S., Kumano, K., Hosoya, N., Takahashi, T., Kanda, Y., ..., & Hirai, H. (1999).
Mouse jagged1 physically interacts with notch2 and other notch receptors. Assessment by quantitative methods. The Journal of biological chemistry, 274(46), 32961-9. [PubMed:10551863] [WorldCat] [DOI] - ↑
Fiúza, U.M., & Arias, A.M. (2007).
Cell and molecular biology of Notch. The Journal of endocrinology, 194(3), 459-74. [PubMed:17761886] [WorldCat] [DOI] - ↑
Zolkiewska, A. (2008).
ADAM proteases: ligand processing and modulation of the Notch pathway. Cellular and molecular life sciences : CMLS, 65(13), 2056-68. [PubMed:18344021] [PMC] [WorldCat] [DOI] - ↑
Glittenberg, M., Pitsouli, C., Garvey, C., Delidakis, C., & Bray, S. (2006).
Role of conserved intracellular motifs in Serrate signalling, cis-inhibition and endocytosis. The EMBO journal, 25(20), 4697-706. [PubMed:17006545] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1
Jacobsen, T.L., Brennan, K., Arias, A.M., & Muskavitch, M.A. (1998).
Cis-interactions between Delta and Notch modulate neurogenic signalling in Drosophila. Development (Cambridge, England), 125(22), 4531-40. [PubMed:9778511] [WorldCat] - ↑ 10.0 10.1
Klein, T., & Arias, A.M. (1998).
Interactions among Delta, Serrate and Fringe modulate Notch activity during Drosophila wing development. Development (Cambridge, England), 125(15), 2951-62. [PubMed:9655817] [WorldCat] - ↑ 11.0 11.1
Klein, T., Brennan, K., & Arias, A.M. (1997).
An intrinsic dominant negative activity of serrate that is modulated during wing development in Drosophila. Developmental biology, 189(1), 123-34. [PubMed:9281342] [WorldCat] [DOI] - ↑
Ladi, E., Nichols, J.T., Ge, W., Miyamoto, A., Yao, C., Yang, L.T., ..., & Weinmaster, G. (2005).
The divergent DSL ligand Dll3 does not activate Notch signaling but cell autonomously attenuates signaling induced by other DSL ligands. The Journal of cell biology, 170(6), 983-92. [PubMed:16144902] [PMC] [WorldCat] [DOI] - ↑
Micchelli, C.A., Rulifson, E.J., & Blair, S.S. (1997).
The function and regulation of cut expression on the wing margin of Drosophila: Notch, Wingless and a dominant negative role for Delta and Serrate. Development (Cambridge, England), 124(8), 1485-95. [PubMed:9108365] [WorldCat] - ↑
Sakamoto, K., Yamaguchi, S., Ando, R., Miyawaki, A., Kabasawa, Y., Takagi, M., ..., & Katsube, K. (2002).
The nephroblastoma overexpressed gene (NOV/ccn3) protein associates with Notch1 extracellular domain and inhibits myoblast differentiation via Notch signaling pathway. The Journal of biological chemistry, 277(33), 29399-405. [PubMed:12050162] [WorldCat] [DOI] - ↑
de Celis, J.F., & Bray, S. (1997).
Feed-back mechanisms affecting Notch activation at the dorsoventral boundary in the Drosophila wing. Development (Cambridge, England), 124(17), 3241-51. [PubMed:9310319] [WorldCat] - ↑ 16.0 16.1
Shimojo, H., Isomura, A., Ohtsuka, T., Kori, H., Miyachi, H., & Kageyama, R. (2016).
Oscillatory control of Delta-like1 in cell interactions regulates dynamic gene expression and tissue morphogenesis. Genes & development, 30(1), 102-16. [PubMed:26728556] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1
Shimojo, H., Ohtsuka, T., & Kageyama, R. (2008).
Oscillations in notch signaling regulate maintenance of neural progenitors. Neuron, 58(1), 52-64. [PubMed:18400163] [WorldCat] [DOI] - ↑
Okajima, T., Matsuura, A., & Matsuda, T. (2008).
Biological functions of glycosyltransferase genes involved in O-fucose glycan synthesis. Journal of biochemistry, 144(1), 1-6. [PubMed:18272537] [WorldCat] [DOI] - ↑
Rampal, R., Luther, K.B., & Haltiwanger, R.S. (2007).
Notch signaling in normal and disease States: possible therapies related to glycosylation. Current molecular medicine, 7(4), 427-45. [PubMed:17584081] [WorldCat] [DOI] - ↑
Stanley, P. (2007).
Regulation of Notch signaling by glycosylation. Current opinion in structural biology, 17(5), 530-5. [PubMed:17964136] [PMC] [WorldCat] [DOI] - ↑
Chitnis, A. (2006).
Why is delta endocytosis required for effective activation of notch? Developmental dynamics : an official publication of the American Association of Anatomists, 235(4), 886-94. [PubMed:16425217] [PMC] [WorldCat] [DOI] - ↑
Le Borgne, R. (2006).
Regulation of Notch signalling by endocytosis and endosomal sorting. Current opinion in cell biology, 18(2), 213-22. [PubMed:16488590] [WorldCat] [DOI] - ↑
Le Borgne, R., & Schweisguth, F. (2003).
Notch signaling: endocytosis makes delta signal better. Current biology : CB, 13(7), R273-5. [PubMed:12676105] [WorldCat] [DOI] - ↑
Nichols, J.T., Miyamoto, A., & Weinmaster, G. (2007).
Notch signaling--constantly on the move. Traffic (Copenhagen, Denmark), 8(8), 959-69. [PubMed:17547700] [WorldCat] [DOI] - ↑
Li, L., Krantz, I.D., Deng, Y., Genin, A., Banta, A.B., Collins, C.C., ..., & Spinner, N.B. (1997).
Alagille syndrome is caused by mutations in human Jagged1, which encodes a ligand for Notch1. Nature genetics, 16(3), 243-51. [PubMed:9207788] [WorldCat] [DOI] - ↑
Oda, T., Elkahloun, A.G., Pike, B.L., Okajima, K., Krantz, I.D., Genin, A., ..., & Chandrasekharappa, S.C. (1997).
Mutations in the human Jagged1 gene are responsible for Alagille syndrome. Nature genetics, 16(3), 235-42. [PubMed:9207787] [WorldCat] [DOI] - ↑
Bulman, M.P., Kusumi, K., Frayling, T.M., McKeown, C., Garrett, C., Lander, E.S., ..., & Turnpenny, P.D. (2000).
Mutations in the human delta homologue, DLL3, cause axial skeletal defects in spondylocostal dysostosis. Nature genetics, 24(4), 438-41. [PubMed:10742114] [WorldCat] [DOI] - ↑
Noguera-Troise, I., Daly, C., Papadopoulos, N.J., Coetzee, S., Boland, P., Gale, N.W., ..., & Thurston, G. (2006).
Blockade of Dll4 inhibits tumour growth by promoting non-productive angiogenesis. Nature, 444(7122), 1032-7. [PubMed:17183313] [WorldCat] [DOI] - ↑
Ridgway, J., Zhang, G., Wu, Y., Stawicki, S., Liang, W.C., Chanthery, Y., ..., & Yan, M. (2006).
Inhibition of Dll4 signalling inhibits tumour growth by deregulating angiogenesis. Nature, 444(7122), 1083-7. [PubMed:17183323] [WorldCat] [DOI]