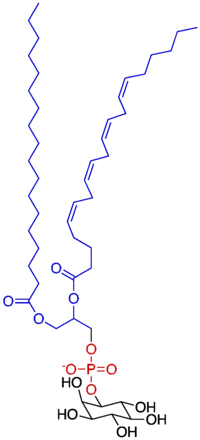
ホスファチジルイノシトール
伊集院 壮、竹縄 忠臣
神戸大学大学院 医学研究科 医科学 神戸大学 大学院医学研究科
DOI:10.14931/bsd.463 原稿受付日:2012年2月1日 原稿完成日:2012年2月10日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:phosphatidylinositol 英略語:PI, PtdIns
同義語:イノシトールリン酸
ホスファチジルイノシトール(ホスホイノシタイド)は細胞性粘菌から哺乳類にいたるまで広く存在するリン脂質である。ホスファチジルイノシトールは7種類のイノシトール環を持つリン脂質の総称であり、細胞膜、ゴルジ体膜、エンドソームなど細胞膜の構成成分である。シグナル伝達のセカンドメッセンジャー産生を介してシグナル伝達を行うのに加えて、多くのタンパク質と結合して、これらのタンパク質を膜に局在させる働きを持つ。ホスファチジルイノシトールはキナーゼやホスファターゼによって精巧な代謝制御を受けており、これは細胞増殖、細胞内物質輸送、細胞骨格制御に必須である。また、この代謝異常は癌や糖尿病など多くの疾患の原因となる。
| ホスファチジルイノシトール | |
|---|---|
| |
別称 PI, PtdIns | |
| Properties | |
| Molar mass | 886.56 g/mol, neutral with fatty acid composition - 18:0, 20:4 |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
構造と種類
ホスファチジルイノシトールは正確には1,2-ジアシル-sn-グリセロ-3-ホスホリル-1-myo-イノシトールという名称の脂質であり、脂肪酸部分とイノシトール環部分からなる。脂肪酸部分は二つのアシル基からなり、組成は1-ステアロイル-2-アラキドノイル型が多い。 ホスファチジルイノシトールのイノシトール環の1-3個のヒドロキシル基にリン酸基がエステル結合した分子(ホスホイノシタイド)も生体内には見いだされる。ほ乳類の含有するホスホイノシタイドは、リン酸機の個数によって、PI(ホスファチジルイノシトール)、PIP(ホスファチジルイノシトール一リン酸)、PIP2(ホスファチジルイノシトール二リン酸)とPIP3(ホスファチジルイノシトール三リン酸)から成り、このうちPIP、PIP2とPIP3のことを総称して(ポリ)ホスホイノシチドと呼ぶ。ホスファチジルイノシトールというと狭義にはリン酸化されていないPIのみを指すが、広義にはリン酸化されたホスホイノシタイドも含める事がある。
ホスホイノシタイドはそのリン酸基に位置によってさらに分類される。PIPにはPI(3)P(ホスファチジルイノシトール-3-一リン酸)、PI(4)P(ホスファチジルイノシトール-4-一リン酸)、PI(5)P(ホスファチジルイノシトール-5-一リン酸)の3種類が、PIP2にはPI(3,4)P2(ホスファチジルイノシトール-3,4-二リン酸)、PI(3,5)P2(ホスファチジルイノシトール-3,5-二リン酸)PI(4,5)P2(ホスファチジルイノシトール-4,5-ビスリン酸)の3種類が存在する。PI(3,4,5)P3はイノシトール環の3、4、5位の3カ所にリン酸基が入ったもので1種類のみ存在する(図1)。
ホスファチジルイノシトールが見つかって60年以上が経過しているが、1988年のCantleyによるPI3キナーゼの同定によって、現在は7種類のホスホイノシタイドが見つかっている[1]。ホスホイノシタイドは全リン脂質量の0.1%〜1%を占めているが、これはホスファチジルイノシトールが5%〜10%を占めるのに比べると非常に少ない。
特にホスホイノシチドには様々な生理活性が知られており、本項目ではそれを含めて解説する。
ホスファチジルイノシトールの機能
ホスファチジルイノシトールの機能は大きく四つに分類される[2]。
セカンドメッセンジャー産生の基質
細胞内情報伝達経路におけるセカンドメッセンジャー物質産生の基質としての機能する。PI(4,5)P2からホスホリパーゼC (PLC)によってジアシルグリセロール (DG)とイノシトール3リン酸 (IP3)が産生され、小胞体からのカルシウム放出を促進するのがこの例に当たる。
物質輸送と膜変形
細胞内の物質輸送の調節に関わる[3]。ホスファチジルイノシトールは、種類によって局在がきわめて限られている。細胞内小胞輸送に直接関与する多くの分子がホスファチジルイノシトール結合ドメインを介して、エンドソームやゴルジ体など細胞の特定のコンパートメントに集まる結果、小胞輸送が活発になると考えられている。これらの分子の中には細胞膜や小胞膜の大きさや曲率を認識する機能を持ち、膜の形態そのものを変形させる活性を持っている場合も多い[4][5]。これが細胞内の膜輸送において重要な機能である。
細胞骨格制御
ホスファチジルイノシトールはアクチニンやゲルソリンなどのアクチン細胞骨格制御分子と静電的に結合し、アクチン重合をコントロールしていることが知られている。また、Rac1-GEFであるTiam1と結合し、ラメリポジア構造の形成を促進する作用を持つ[6]。
細胞内シグナル伝達経路の制御
細胞内シグナル伝達経路の制御に関わる。AktやBtkなど多くのシグナル伝達分子やタンパクリン酸化酵素が脂質結合ドメインを持っており、ホスファチジルイノシトールとの結合によってキナーゼ活性が制御されている例も見られる。後述のPI3キナーゼシグナル伝達経路はアポトーシスの抑制やタンパク質合成などの細胞の生存に不可欠なものであることが明らかとなっている[7]。
さらに、ホスファチジルイノシトールの代謝異常は多くの重大かつ重篤な疾患と密接に関連していることも明らかとなっている。PI(3,4,5)P3の代謝異常は癌や糖尿病の患者に多く認められている。これは癌細胞の増殖や浸潤転移、インスリンによる骨格筋や脂肪細胞への糖取込みにおいてPI(3,4,5)P3が必要であることに起因している。また、PI(4,5)P2の代謝異常がダウン症やLowe症候群などの遺伝性疾患患者に認められている[8]。
個々のホスホイノシチドの生合成経路と機能
7種類のホスホイノシチドはそれぞれに特異的な機能を有している[9]。
PI(3)P
生合成
PI(3)Pは酵母から哺乳類まで保存されたホスファチジルイノシトールであり、主に初期エンドソームやエンドソーム中にさらに小さな小胞が存在するmulti-vesicular endosome (MVE)と呼ばれる構造に存在するが、細胞膜、クラスリン被覆小胞や核にも存在することが知られている[10]。 PI(3)Pの生合成はPIがリン酸化される経路とPI(3,5)P2が脱リン酸化される経路が存在する。細胞膜やクラスリン被覆小胞ではPIがクラスIIのPI3キナーゼによってリン酸化されPI(3)Pが産生される。細胞膜ではPI(3)Pは恒常的には存在しておらず、増殖因子などの刺激依存的に一過的に産生されている。一方、エンドソームに局在するPI(3)Pは主にクラスIIIのPI3キナーゼであるVps34によって産生される。Vps34はPIのみを基質としてPI(3)Pを産生する酵素である。エンドソームにはSACファミリーのホスファターゼであるFig4/SAC3によってPI(3,5)P2が脱リン酸化されてPI(3)Pが産生される経路も存在し、エンドソームでの小胞輸送を制御している。一方、myotubularinファミリーのホスファターゼであるMTM1やMTMR2はPI(3)Pを脱リン酸化して細胞内PI(3)P量を調節する役割を担っている[11]。
機能
PI(3)Pはエンドソームの融合に重要である。PI(3)PはFYVEドメインやphoxドメインを持つ分子をエンドソームに局在させる[1]。例えば、EEA1はそのFYVEドメインでPI(3)Pと結合し、一方でRab5 GTPaseを結合してエンドソーム融合を促進する。実際細胞内のPI(3)Pを取り除くと、初期エンドソームを介したタンパク質の輸送が遅くなったり、増殖因子受容体のリソソームへの取込みが阻害されたりする。インスリンシグナルにおけるグルコーストランスポーターGLUT4の細胞膜への移行にもPI(3)Pが正の役割を果たしていることが明らかとなっている。最近、PI(3)Pがアミノ酸飢餓などによって誘導されるオートファジー構造(オートプァゴソーム)の形成に積極的な働きをすることが明らかとなった。この構造は細胞における病原体の感染防御に必要であるが、Vps34とAtg6, Bif-1などの分子が結合してこの構造の形成が促進され、同時にPI(3)Pが産生される。PI(3)Pはオートファゴソームの形成に直接関与しているだけでなく、オートファジー形成を促進するmTORの活性化も制御している。mTORはがんや糖尿病と密接な関係があるが、PI(3)Pとこれらの病気の関係は明らかになっていない。
PI(4)P
生合成
PI(4)PはPIのイノシトール環の4位にPI4キナーゼによってリン酸化されて生成される。PI(4)Pは細胞膜、ゴルジ体、小胞体、エンドソームに局在しており、神経細胞のシナプス小胞にも多く存在する。PI4キナーゼは酵母に3種類、哺乳類に4種類存在している。哺乳類のPI4Kはその酵素学的性質からタイプIからタイプIIIに分別されるが、現在ではタイプIの分子はPI3キナーゼであることが明らかとなっている。タイプIIはPI4KIIαとPI4KIIβの二つの分子からなりアデノシンによって活性が阻害される性質を持つ。タイプIIのPI4キナーゼは形質膜におけるPI(4)P産生に関与しているが、ゴルジ体やエンドソームにも存在し、細胞膜への小胞輸送に関係していることが明らかになっている。一方、タイプIII PI4キナーゼはPI3キナーゼ阻害剤であるワートマニンによって活性が阻害される分子である。PI4KIIIαは小胞体と核周辺部に局在しているが、形質膜でのPI4P量を調節することが知られている。一方、PI4KIIIβは主にゴルジ体に存在し、形質膜への物質輸送を制御することが知られている[12]。
機能
PI(4)PはPI(4,5)P2産生の基質であり、ホスホリパーゼCによるPI(4,5)P2の加水分解によるイノシトール3リン酸産生、カルシウム動員およびシグナル伝達制御を間接的に制御している。PI4KIIIαは細胞内のPI(4)PやPI(4,5)P2量を一定に保つ役割を担っている。一方で、PI(4)P自身に結合するエフェクター分子の機能を調節する役割も担っている。AP-1、GGA1やepsinRなどのアダプターや小胞の被覆分子、OSBP、CERT、FAPP1、FAPP2のような脂質を運搬する分子がPI(4)Pのエフェクター分子として知られている。これらのエフェクター分子は小胞体やゴルジ体からの輸送に関係しているものが多く、PI(4)Pは小胞体やゴルジ体の細胞膜へこれらの分子を局在させるための目印として機能していると思われる。
PI(5)P
生合成
PI(5)Pはホスホイノシチドの中で一番最近同定されたものであり、その生合成メカニズムは明らかとなっていない。現在のところPI(3,5)P2がmyotubularinファミリーホスファターゼによって脱リン酸化されて生成されると考えられている[13]。
機能
PI(5)Pの機能はほとんど分かっていないが、後期エンドソームから細胞膜へのエクソサイトーシスに必要であると示唆されている。脂肪細胞でのグルコーストランスポーターGLUT4の細胞膜への移行をPI(5)Pが促進することが明らかとなっている。
PI(3,4)P2
生合成
主にPI(3,4,5)P3の5位が5-ホスファターゼによって脱リン酸化されて産生される。
機能
TAPP1,TAPP2のPHドメインはPI(3,4)P2と特異的に結合することが知られているが、AktやPDK1などのシグナル伝達分子のPHドメインも結合することが知られている。TAPP1はアクチン細胞骨格制御との関与が示唆されているが、PI(3,4)P2自身の機能はあまり明らかとなっていなかった。しかし、最近PI(3,4)P2がグルタミン酸による神経細胞死を起こすことが明らかとなった。
PI(3,5)P2
生合成
PI(3,5)P2は酵母ではFab1がPI(3)Pの5位をリン酸化することによって産生される[14]。
機能
酵母での合成酵素Fab1は液胞の形成に必要である。一方、哺乳動物ではホモログであるPIKfyveが同じ作用を担っており、その発現抑制によってエンドソームの形態異常が認められるようになる。PI(3,5)P2はESCRT-III複合体のVps24, Svp1p,Ent3pと結合し、MVEやオートファジー形成を促進する。また、浸透圧ショックによってPI(3,5)P2量が増減することも知られている。
PI(4,5)P2
生合成
PI(4,5)P2はPIからホスファチジルイノシトール4キナーゼ(PI4K)およびホスファチジルイノシトール1リン酸5キナーゼ(PIP5K)によって産生され、ホスホリパーゼCの基質となる脂質である。また、PI(3,4,5)P3がPTENによって脱リン酸化されてできる経路も存在する。PI3キナーゼによってPI(3,4,5)P3を産生する際の基質となる。
機能
PI(4,5)P2はビンキュリンなどのアクチン重合調節タンパク質、細胞接着分子、クラスリン、キネシンに結合する。また、イオンチャンネルであるTransient receptor potentialチャネルC (TRPC)の細胞質領域に結合してその活性を負に調節して、細胞外からのナトリウムやカルシウムの流入を抑制している。カリウムチャンネルKir2.1の細胞質領域にある塩基性アミノ酸とも結合し、チャネルを開く活性を持つ。アンデルセン症候群やバーター症候群の患者ではこの分子にPI(4,5)P2に結合できない変異を持つ場合がある。
PI(3,4,5)P3
生合成
PI(3,4,5)P3はPI3キナーゼによってPI(4,5)P2から産生される。
機能
Akt,Btk,PDK1などのPHドメインと結合して、これらの分子を細胞膜に局在させる働きを持つ。これらの分子はPI3キナーゼシグナル伝達経路の活性化を起こす。PI3キナーゼシグナルについての詳細は後述する。
ポリホスホイノシチド結合ドメイン
ポリホスホイノシチド結合分子は現在300以上の分子で見つかっており、ポリホスホイノシチド結合ドメインとしてPHドメインやBARドメインなどが同定されている(表)。
| 結合ポリホスホイノシタイド | 結合ドメイン | 分子 |
| PI(3)P | FYVE | Fab1p |
| Hrs | ||
| Pikfyve | ||
| EEA1 | ||
| PX | p40phox | |
| PI(3)P,PI(3,5)P2 | PX | SNX1 |
| PI(4)P | PH | FAPP1 |
| CERT | ||
| AP-1 | ||
| PI(5)P | PHD finger | ING2 |
| PI(3,4)P2 | PH | TAPP1,2 |
| Akt | ||
| PDK1 | ||
| PI(3,4)P2,PI(3,5)P2 | ENTH/ANTH | Hip1 |
| PI(3,4)P2 | PX | p47phox |
| PI(3,5)P2 | Vps24p | |
| Ent3p | ||
| PI(4,5)P2 | ENTH/ANTH | epsin1 |
| PH | Dynamin2 | |
| PLCδ1 | ||
| α-actinin | ||
| PI(4,5)P2, PI(3,4,5)P3 | I-BAR | IRSp53 |
| EFC/F-BAR | FBP17, CIP4 | |
| BAR | Amphyphysin1 | |
| PI(3,4)P2, PI(3,4,5)P3 | PH | GRP1 |
| PI(3,4,5)P3 | PH | Btk |
| PI(3,4)P2, PI(3,4,5)P3 | PH | Akt |
| PDK1 |
これらの分子がポリホスホイノシチドと結合する様式は、静電的結合および脂質結合ドメインと脂質の特異的結合の二つに分類される。
静電的結合はポリホスホイノシチドが持つ負の電荷とアルギニン、リジンなどの塩基性アミノ酸が持つ正の電荷との静電気的な相互作用によるものである。例えばBARドメインは両親媒性ヘリックス構造をとり、片側に塩基性アミノ酸がかたよって配向しているが、この部分に負の電荷を持ったポリホスホイノシタイドが結合することが明らかとなっている。このBARドメインは膜の曲率を認識していることから、細胞膜のある特定の部分にのみ局在できることも明らかになっている。また、細胞骨格制御分子であるアクチニンとPI(4,5)P2との相互作用などもこれにあてはまる。
一方、ポリホスホイノシチドに特異的に結合するドメインはPHドメインで最初に同定され、現在では100種類以上の分子がなんらかの脂質特異的結合ドメインを持つことが明らかとなっている。しかし、同じPHドメインファミリーでもポリホスホイノシチドに対する特異性は異なる場合も多い。例えばGRP1のPHドメインはPI(3,4,5)P3に特異的に結合するが、一方OSBP1のPHドメインはPI(4)Pにのみ結合する。ドメイン内のわずかなアミノ酸の違いがこのような結合特異性の違いを産むことが分かっている。そのドメイン内には塩基性のアミノ酸が並んでいる部分があり、そこで特定のポリホスホイノシチドと結合していることが多い。ドメイン全体として脂肪酸部分を含むポリホスホイノシチドがちょうど入り込むポケットのような構造をとっている。この構造がドメインを介した結合が静電的結合より特異的な原因である。
ホスファチジルイノシトールキナーゼ
ホスファチジルイノシトールのリン酸化酵素の総称。イノシトール環へのリン酸化の部位によって3-キナーゼ、4-キナーゼ、5-キナーゼに分類され、全部で約15種類存在する(図2)。それぞれの分子が細胞内の特定のコンパートメントでホスファチジルイノシトールの産生を行っている。
ホスファチジルイノシトール3キナーゼとPI3キナーゼシグナル伝達経路
PI 3キナーゼは基質特異性によって3種類に分類される。
PI 3キナーゼの中でもClass I PI3キナーゼはPI(4,5)P2からPI(3,4,5)P3を産生する酵素である。調節サブユニット(p85やp101など)と活性サブユニット(p110)の二つのサブユニットから構成される。上皮成長因子(EGF)や血小板由来成長因子(PDGF)などの増殖因子やリゾホスファチジン酸などによって受容体型チロシンキナーゼやGタンパク質共役型受容体が活性化されると、調節サブユニットがチロシンリン酸化された受容体に結合し、構造変化を起こすことによって活性サブユニットと結合できるようになる。刺激依存的に活性化されたPI3キナーゼは細胞膜においてPI(4,5)P2をリン酸化し、PI(3,4,5)P3を産生させる[3]。産生されたPI(3,4,5)P3はAktのPHドメインと結合し、Aktを細胞膜へ局在させる。その結果、AktはPDK1やMTORC2によってリン酸化されて、そのタンパク質リン酸化酵素活性が活性化される。
Aktの下流にはp70 S6キナーゼ,GSK3,FoxOなどタンパク質合成を促進する分子、糖代謝、脂質代謝やアポトーシス抑制を制御する分子が存在している。従って、PI(3,4,5)P3産生やPI3キナーゼシグナル伝達経路に異常がある場合、これらの基本的生命現象の劇的な変化に伴い、さまざまな疾患を引き起こす。骨格筋や脂肪組織におけるインスリン産生やインスリン抵抗性の惹起はPI3キナーゼシグナルの低下を引き起こし、血中からの糖取込みの欠失の結果、高血糖症、糖尿病を引き起こす。また、PI3キナーゼの亢進による過増殖は細胞のがん化を引き起こす。実際、がん細胞では90%以上の割合でPI3キナーゼシグナル分子に変異が認められる。特に、PI(3,4,5)P3ホスファターゼPTENには多くの変異が認められることが明らかとなっている。そのため、PI3キナーゼシグナル伝達経路を調節する分子はがんや糖尿病治療の創薬における標的分子としての期待が集まっている[7][15]。
Vps34(Class III PI 3キナーゼ)はPIだけを基質とする酵素で、ゴルジ体やエンドソームでPI(3)Pを産生する。哺乳類から線虫に至るまで保存されている。線虫やショウジョウバエでは、この酵素がインスリンシグナル依存的な生存や寿命をコントロールしていることが知られている。
Class II PI 3キナーゼはPIとPI(4)Pから、それぞれPI(3)PとPI(3,4)P2を産生する。
その他のホスファチジルイノシトールキナーゼ
PI 4-キナーゼ(PI4K IIα,IIβ,IIIα,IIIβ)はPIの4位をリン酸化する分子でトランスゴルジでのPI4P産生を行う。
PIP 4-キナーゼ(PIP4Kα,β,γ)はPI(5)PからPI(4,5)P2を産生する。αとβは形質膜にγは小胞体に局在する。
PIP 5キナーゼは(PIP5Kα,β,γ)は形質膜でPI(4)PからPI(4,5)P2を産生する。
PIKfyveはエンドソームでPI(3)Pの5位をリン酸化してPI(3,5)P2を産生する。
ホスファチジルイノシトールホスファターゼ
ホスファチジルイノシトールの脱リン酸化酵素の総称。全部で50種類以上の分子からなり、その基質特異性と脱リン酸化するリン酸基の位置によって分類される。多くのポリホスホイノシチドホスファターゼ分子が、遺伝性疾患、がん、糖尿病など重篤な疾患の原因遺伝子として知られている。ポリホスホイノシチドホスファターゼはその基質特異性と脱リン酸化部位によって分類される(図3)。
通常、ポリホスホイノシチドホスファターゼが脱リン酸化するリン酸基は一ヶ所であり、3−ホスファターゼ、4−ホスファターゼ、5−ホスファターゼのいずれかに分類される。例えば、3-ホスファターゼはPI(3)P, PI(3,4)P2, PI(3,5)P2, PI(3,4,5)P3を脱リン酸化して、それぞれPI, PI(3)P, PI(4)P, PI(3,4)P2を産生する。中にはSAC1の様に、3-ホスファターゼ活性と4-ホスファターゼ活性の2種類以上の活性を同時に有するものも存在する。 さらに基質となるホスファチジルイノシトールの中でも、その基質特異性の強さは異なり、多くのポリホスホイノシチドホスファターゼはそのうち一部だけを基質とし得る。例えば、PTENはPI(3,4,5)P3の3位の脱リン酸化活性が高いため、PI(3,4,5)P3の3-ホスファターゼと呼ばれている。一方、SHIP1はPI(3,4,5)P3の5位を脱リン酸化するため、PI(3,4,5)P3 5-ホスファターゼと呼ばれる。
ホスファチジルイノシトールホスファターゼはその活性部位の構造から2つに分類される。
PTEN, Myotubularin, 4-ホスファターゼとSAC1ドメインを持つホスファターゼは活性部位がCX5RT/Sというアミノ酸配列を有し、タンパク質チロシン脱リン酸化酵素と相同性を持つ。3−ホスファターゼと4-ホスファターゼはほぼこちらに分類される。
一方、SHIP2やSKIPなどの5−ホスファターゼは活性部位がおよそ300アミノ酸程度からなり、その活性中心がGDXNXRとPAWXDRI/VLWというイノシトール3リン酸(IP3)やイノシトール4リン酸(IP4)などを脱リン酸化するイノシトールポリリン酸脱リン酸化酵素と共通した配列を持つ。
多くの分子が疾患と関連しており[16]、疾患治療のターゲット分子としての需要性も高まっている。
PTEN
PTENはPI(3,4,5)P3の3位を脱リン酸化する酵素であり、PI3キナーゼシグナル伝達経路を制御する。粘菌から哺乳動物に至るまで広く存在している[17]。当初、タンパク質チロシンリン酸化酵素として単離されたが、1998年に前濱らによってPI(3,4,5)P3の脱リン酸化酵素であることが明らかとなった[18]。現在までに非常に多くの研究がなされているが、ヒトのがんにおいてp53に次いで変異が認められる遺伝子であることが分かっている。また、Cowden病やBannayan-Zonana症候群など多くの遺伝性癌症候群で変異や欠失が認められている。運動する細胞では後ろ側に局在していることが知られており、PI(3,4,5)P3の局在とも逆相関の関係であることが知られている。
Myotubularinファミリー分子
MTM1(myotubularin)は、筋細管ミオパシー患者で変異が認められる遺伝子として単離された。ヒトでは全部で14種類のmyotubularinファミリー分子が見つかっており、うち8種類がPI(3)PとPI(3,5)P2に対するホスファターゼ活性を有する。これらのポリホスホイノシチドは主にエンドソームに局在していることから、Myotubularinによってエンドソームを介した細胞内の膜輸送が制御されていると考えられる。MTMR2は神経変性疾患であるCharcot-Marie-Tooth病の原因遺伝子としても知られている[11]。
SACドメインホスファターゼ
SAC1, SAC2, Fig4/SAC3の3種類のホスファターゼが存在する。SAC1はPI(3)P, PI(4)P, PI(5)P, PI(3,5)P2いずれをも基質とすることができるが、細胞内ではこの中でPI(4)Pの量が圧倒的に多いことから実質的にPI(4)Pホスファターゼである。ヒトのSAC1は被覆小胞の構成分子であるCOP1, COP2と結合して小胞体とゴルジ体を行き来しており、状況に応じてこれらの場所におけるPI(4)P量を調節している。増殖因子刺激が入ることによって分泌が増えている時、SAC1はCOP1と結合して小胞体に移行し、ゴルジ体のPI(4)P量を高くキープし分泌作用を促進させる。一方、quiescentな状態ではゴルジ体のPI(4)Pは必要ないため、SAC1はゴルジ体に移行してPI(4)Pの脱リン酸化を行う。一方、SAC3/FIG4は酵母でフェロモンに応答して発現が制御される遺伝子として単離されたが、哺乳動物では筋肉の萎縮などを伴うCharcot-Marie-tooth病の患者で変異が認められる遺伝子であることも明らかとなっている。
PI(3,4)P2 4-ホスファターゼ
Inositol polyphosphate-4-phosphatase B (INPP4B)は前立腺がんのがん抑制遺伝子であることが知られており、破骨細胞の活性化に関与していることが明らかとなっている[19]。INPP4Aに関しては以前からその変異がプルキンエ神経細胞死を引き起こすことが分かっていたが、その欠失によってグルタミン酸による神経細胞死が顕著に誘導され、マウスでは行動異常が誘発されることが明らかとなった[20]。
OCRL
OCRLは約20万人に1人の割合で見られる発達障害であるLowe症候群の原因遺伝子である。Lowe症候群は白内障や認知障害など多くの症状を伴う疾患である。OCRLはPI(4,5)P2を特異的な基質とする5−ホスファターゼである。OCRLはクラスリン被覆小胞に局在しており、トランスゴルジと初期エンドソーム間の小胞輸送をコントロールしている。OCRLによって産生されたPI(4)PはAP1, OSBP, CERTなどのエフェクター分子と結合して、ステロールやタンパク質の輸送を促進する。一方、PI(4,5)P2は細胞膜からのクラスリン被覆小胞によるエンドサイトーシスを促進する。OCRLはPI(4)PとPI(4,5)P2量を間接的に調節することによって細胞内の小胞輸送をコントロールしていると考えられている[21]。
Synaptojanin
Synaptojanin1,2はN末端にSAC1ドメインを、C末端に5−ホスファターゼドメインという、二つのポリホスホイノシチドホスファターゼを一つの分子内に有する分子である。当初はPI(3,4,5)P3ホスファターゼとして単離されたが、現在PI(4,5)P2を二段階に脱リン酸化してPIに戻す分子であると考えられている。Synaptojaninはプロリンに富んだアミノ酸配列を有しており、Grb2などアダプタータンパク質に存在するSH3ドメインと結合する。Synaptojanin1は神経細胞に非常に多く発現する分子で、神経細胞間に神経伝達物質を放出するシナプス小胞の循環を行う。ダウン症の原因遺伝子の一つでもあることが明らかとなっている。一方、Synaptojanin2は細胞膜からの上皮増殖因子やトランスフェリン受容体の細胞内への取込みを制御している。
SHIP1,2
SHIP1,2はリン酸化チロシンに結合するSH2ドメインを持つPI(3,4,5)P3 5-ホスファターゼであり、同時にプロリンに富んだ配列を介してNckなどのアダプター分子と結合している。SHIP1は血球系の細胞に多く発現し免疫応答をコントロールしており、SHIP2はインスリンシグナルを制御している。
INPP5E
PI(4,5)P2とPI(3,4,5)P3だけを基質とし、脂肪酸を持たないIP3やIP4を脱リン酸化できない唯一の分子である。最近、行動異常を引き起こすJoubert症候群の原因遺伝子であることが明らかとなった[22]。
SKIP
骨格筋におけるインスリン依存的な糖代謝をコントロールするPI(3,4,5)P3 5-ホスファターゼである。糖尿病におけるインスリン抵抗性との関連が示唆されている[23]。
このようにポリホスホイノシチドホスファターゼの多くがホスファターゼドメイン以外の機能ドメインを介して他のタンパク質と結合している。このため、細胞内の特定な部分に局在する場合が多く、それぞれの分子が非常に特異的な機能を担っていると考えられている。ポリホスホイノシタイドホスファターゼがキナーゼと比べて、多くの種類の分子が存在する理由である。
参考文献
- ↑ 1.0 1.1
Auger, K.R., Serunian, L.A., Soltoff, S.P., Libby, P., & Cantley, L.C. (1989).
PDGF-dependent tyrosine phosphorylation stimulates production of novel polyphosphoinositides in intact cells. Cell, 57(1), 167-75. [PubMed:2467744] [WorldCat] [DOI] - ↑
Balla, T., Szentpetery, Z., & Kim, Y.J. (2009).
Phosphoinositide signaling: new tools and insights. Physiology (Bethesda, Md.), 24, 231-44. [PubMed:19675354] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1
Vicinanza, M., D'Angelo, G., Di Campli, A., & De Matteis, M.A. (2008).
Function and dysfunction of the PI system in membrane trafficking. The EMBO journal, 27(19), 2457-70. [PubMed:18784754] [PMC] [WorldCat] [DOI] - ↑
Suetsugu, S., Toyooka, K., & Senju, Y. (2010).
Subcellular membrane curvature mediated by the BAR domain superfamily proteins. Seminars in cell & developmental biology, 21(4), 340-9. [PubMed:19963073] [WorldCat] [DOI] - ↑
Itoh, T., & Takenawa, T. (2009).
Mechanisms of membrane deformation by lipid-binding domains. Progress in lipid research, 48(5), 298-305. [PubMed:19481110] [WorldCat] [DOI] - ↑
Saarikangas, J., Zhao, H., & Lappalainen, P. (2010).
Regulation of the actin cytoskeleton-plasma membrane interplay by phosphoinositides. Physiological reviews, 90(1), 259-89. [PubMed:20086078] [WorldCat] [DOI] - ↑ 7.0 7.1
Engelman, J.A., Luo, J., & Cantley, L.C. (2006).
The evolution of phosphatidylinositol 3-kinases as regulators of growth and metabolism. Nature reviews. Genetics, 7(8), 606-19. [PubMed:16847462] [WorldCat] [DOI] - ↑
Sinclair, R.J., & Burton, H. (1991).
Neuronal activity in the primary somatosensory cortex in monkeys (Macaca mulatta) during active touch of textured surface gratings: responses to groove width, applied force, and velocity of motion. Journal of neurophysiology, 66(1), 153-69. [PubMed:1919664] [WorldCat] [DOI] - ↑
Sasaki, T., Sasaki, J., Sakai, T., Takasuga, S., & Suzuki, A. (2007).
The physiology of phosphoinositides. Biological & pharmaceutical bulletin, 30(9), 1599-604. [PubMed:17827706] [WorldCat] [DOI] - ↑
Falasca, M., & Maffucci, T. (2009).
Rethinking phosphatidylinositol 3-monophosphate. Biochimica et biophysica acta, 1793(12), 1795-803. [PubMed:19852987] [WorldCat] [DOI] - ↑ 11.0 11.1
Robinson, F.L., & Dixon, J.E. (2006).
Myotubularin phosphatases: policing 3-phosphoinositides. Trends in cell biology, 16(8), 403-12. [PubMed:16828287] [WorldCat] [DOI] - ↑
D'Angelo, G., Vicinanza, M., Di Campli, A., & De Matteis, M.A. (2008).
The multiple roles of PtdIns(4)P -- not just the precursor of PtdIns(4,5)P2. Journal of cell science, 121(Pt 12), 1955-63. [PubMed:18525025] [WorldCat] [DOI] - ↑
Lecompte, O., Poch, O., & Laporte, J. (2008).
PtdIns5P regulation through evolution: roles in membrane trafficking? Trends in biochemical sciences, 33(10), 453-60. [PubMed:18774718] [WorldCat] [DOI] - ↑
Michell, R.H., Heath, V.L., Lemmon, M.A., & Dove, S.K. (2006).
Phosphatidylinositol 3,5-bisphosphate: metabolism and cellular functions. Trends in biochemical sciences, 31(1), 52-63. [PubMed:16364647] [WorldCat] [DOI] - ↑
Asano, T., Fujishiro, M., Kushiyama, A., Nakatsu, Y., Yoneda, M., Kamata, H., & Sakoda, H. (2007).
Role of phosphatidylinositol 3-kinase activation on insulin action and its alteration in diabetic conditions. Biological & pharmaceutical bulletin, 30(9), 1610-6. [PubMed:17827708] [WorldCat] [DOI] - ↑
McCrea, H.J., & De Camilli, P. (2009).
Mutations in phosphoinositide metabolizing enzymes and human disease. Physiology (Bethesda, Md.), 24, 8-16. [PubMed:19196647] [PMC] [WorldCat] [DOI] - ↑
Suzuki, A., Nakano, T., Mak, T.W., & Sasaki, T. (2008).
Portrait of PTEN: messages from mutant mice. Cancer science, 99(2), 209-13. [PubMed:18201277] [WorldCat] [DOI] - ↑
Maehama, T., & Dixon, J.E. (1998).
The tumor suppressor, PTEN/MMAC1, dephosphorylates the lipid second messenger, phosphatidylinositol 3,4,5-trisphosphate. The Journal of biological chemistry, 273(22), 13375-8. [PubMed:9593664] [WorldCat] [DOI] - ↑
Ferron, M., Boudiffa, M., Arsenault, M., Rached, M., Pata, M., Giroux, S., ..., & Vacher, J. (2011).
Inositol polyphosphate 4-phosphatase B as a regulator of bone mass in mice and humans. Cell metabolism, 14(4), 466-77. [PubMed:21982707] [PMC] [WorldCat] [DOI] - ↑
Sasaki, J., Kofuji, S., Itoh, R., Momiyama, T., Takayama, K., Murakami, H., ..., & Sasaki, T. (2010).
The PtdIns(3,4)P(2) phosphatase INPP4A is a suppressor of excitotoxic neuronal death. Nature, 465(7297), 497-501. [PubMed:20463662] [WorldCat] [DOI] - ↑
Ooms, L.M., Horan, K.A., Rahman, P., Seaton, G., Gurung, R., Kethesparan, D.S., & Mitchell, C.A. (2009).
The role of the inositol polyphosphate 5-phosphatases in cellular function and human disease. The Biochemical journal, 419(1), 29-49. [PubMed:19272022] [WorldCat] [DOI] - ↑
Jacoby, M., Cox, J.J., Gayral, S., Hampshire, D.J., Ayub, M., Blockmans, M., ..., & Schurmans, S. (2009).
INPP5E mutations cause primary cilium signaling defects, ciliary instability and ciliopathies in human and mouse. Nature genetics, 41(9), 1027-31. [PubMed:19668215] [WorldCat] [DOI] - ↑
Ijuin, T., Yu, Y.E., Mizutani, K., Pao, A., Tateya, S., Tamori, Y., ..., & Takenawa, T. (2008).
Increased insulin action in SKIP heterozygous knockout mice. Molecular and cellular biology, 28(17), 5184-95. [PubMed:18573875] [PMC] [WorldCat] [DOI]