マイネルト基底核
高田 則雄
慶應義塾大学 医学部 精神・神経科学教室
DOI:10.14931/bsd.3497 原稿受付日:2013年3月15日 原稿完成日:2019年2月19日
担当編集委員:渡辺 雅彦 (北海道大学大学院医学研究院 解剖学分野 解剖発生学教室)
羅:nucleus basalis meynerti 英:Nucleus basalis of Meynert 独:Nucleus basalis Meynert 仏:Noyau basal de Meynert
| 脳: マイネルト基底核 | |
|---|---|
| 名称 | |
| 日本語 | マイネルト基底核 |
| ラテン語 | nucleus basalis meynerti |
| 関連情報 | |
| NeuroNames | hier-257 |
| MeSH | Basal+nucleus+of+Meynert |
| グレイの解剖学 | 書籍中の説明(英語) |
英略称:NBM
同義語:マイネルト核
構造
位置
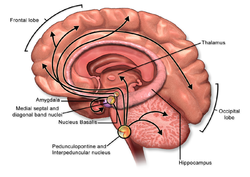
前脳基底部に存在するコリン作動性神経核は吻部から尾部へ向かって順にCh1(内側中隔核)、Ch2(Broca対角帯垂直亜核)、Ch3(Broca対角帯水平亜核)、Ch4(無名質-基底核複合体)と命名されている[9] [10]。マイネルト基底核はCh4を構成し、淡蒼球と内包との境界に位置する。なおCh4にはマイネルト基底核の他に無名質なども含まれる。ラットの場合、無名質はマイネルト基底核よりも吻側で、前交連の腹側に存在する[11]。
細胞構築
マイネルト基底核を構成するコリン作動性神経細胞の細胞体は中型から大型(直径18~43 μm)であり、形状は楕円形あるいは紡錘形である[12]。樹状突起は多極性である[12]。ラットでは左右の脳半球それぞれのCh4に7000から9000個のコリン作動性神経細胞が存在する[13]。ラットを用いた研究によると、前頭前皮質へ投射するマイネルト基底核の神経細胞の内19%がコリン作動性であり、52%がGABA作動性、15%がグルタミン酸作動性である[14]。
出力
マイネルト基底核の神経細胞は大脳皮質全域および扁桃体へ投射する[3]。大脳皮質へのコリン作動性投射の多くは無髄線維である[15]。大脳皮質におけるコリン作動性入力の7~8割はマイネルト基底核からの投射であり[16][17][12]、残りの2~3割は大脳皮質に散在する双極性介在神経細胞(GABAおよびVIPを含む[18])からと考えられている。
マイネルト基底核からのコリン作動性軸索は大脳皮質の全層に投射している[19]。このコリン作動性軸索の単位体積当たりの長さをラットの大脳皮質の層毎に比較すると、前頭葉では差が見られない(12.6~13.5 m/mm3)が頭頂葉や後頭葉では差がある[19]。例えば頭頂葉の第一層では投射線維の長さが12.8 m/mm3に対して、第2/3層や第4層では7.3~8.1 m/mm3と短い[19]。投射線維の長さを大脳皮質の領域間で比較すると前頭皮質(13.0 m/mm3)は頭頂葉(9.9 m/mm3)や後頭葉(11.0 m/mm3)よりも長い[19]。これらのコリン作動性軸索投射には軸索長さ10 μm当たり4つ程度の軸索瘤(平均直径0.57 μm)が存在する[19] [13]。軸索瘤の内16%はシナプス性結合を形成し、残りの84%は非シナプス性(non-synaptic)に拡散伝達(diffuse transmission)を行う[13]。コリン作動性のシナプス数は大脳皮質に存在するシナプス1500個当り1つと想定されている[13]。なお、マイネルト基底核の軸索投射は大脳皮質の神経細胞だけでなく血管にも直接投射すると示唆されている[3]。
入力
マイネルト基底核の神経細胞(コリン作動性およびGABA作動性)へは脳幹網様体賦活系からの軸索投射がある。この投射は視床下部の内側前脳束を上行しており、種々の伝達物質(ドーパミン、アセチルコリン、セロトニン、ノルアドレナリン、グルタミン酸)を含む神経線維によって構成されている[20]。これらの内でマイネルト基底核のコリン作動性神経細胞へ直接投射しているのは青斑核のノルアドレナリン神経と背側縫線核のセロトニン神経、網様体のグルタミン酸神経である[21]。マイネルト基底核のコリン作動性神経細胞に対してグルタミン酸とノルアドレナリンは興奮性に作用し、セロトニンは抑制性に作用する[20]。GABA作動性神経細胞はノルアドレナリンやアセチルコリンに対する応答性の違いからいくつかに分類されている[21]。多くのGABA神経細胞はノルアドレナリンによって興奮するが、抑制されるものも存在する[21]。
生理機能
脳波制御
電気刺激などによってマイネルト基底核を活性化させると大脳皮質において細胞外アセチルコリン濃度が増す[22]と共に、大脳皮質脳波の徐波成分(デルタ波)が減少し、速波成分(シータ波とガンマ波)が増える[23]。この脳波の変化はムスカリン性アセチルコリン受容体への拮抗薬によって抑制される[24]。なお、マイネルト基底核のコリン作動性神経細胞は、覚醒時やREM睡眠時に発火活動が亢進しているが[23]、非コリン作動性神経細胞の活動には一定の傾向は見られていない[23]。
皮質可塑性
音刺激やヒゲ刺激などの末梢感覚への刺激と、マイネルト基底核への電気刺激とを同時に繰り返し与えると、その末梢刺激に対する大脳皮質の神経細胞応答が増大する[25] [26]。具体的には、末梢刺激に対して大脳皮質神経細胞での抑制性シナプス後電流(IPSC)が減少すると共に、興奮性シナプス後電流(EPSP)が増大する[27]。その他、マイネルト基底核による皮質可塑性の発現には大脳皮質グリア細胞の細胞内Ca2+濃度上昇が必要との報告もある[28]。これらのシナプス可塑性の誘導には、大脳皮質におけるムスカリン受容体の活性化が必要である。なお記憶障害を主症状とするアルツハイマー病患者の脳ではマイネルト基底核の神経細胞が脱落する[29]。
血流制御
電気刺激やグルタミン酸の局所投与によってマイネルト基底核を活性化させると大脳皮質の血流が増大する[30] [31]。マイネルト基底核が大脳皮質へ放出したアセチルコリンがムスカリン性受容体を介して神経細胞やグリア細胞、脳血管へ作用することで血流が増大すると考えられている[32]。ただしアストロサイトの細胞体におけるカルシウム上昇は、マイネルト基底核の活性化による大脳皮質血流上昇には関与しないことが、イノシトール三リン酸受容体2型をノックアウトした遺伝子改変マウスを用いた研究によって示されている[33][34]。
関連語
参考文献
- ↑
Kitt, C.A., Höhmann, C., Coyle, J.T., & Price, D.L. (1994).
Cholinergic innervation of mouse forebrain structures. The Journal of comparative neurology, 341(1), 117-29. [PubMed:8006218] [WorldCat] [DOI] - ↑
Sarter, M., Parikh, V., & Howe, W.M. (2009).
Phasic acetylcholine release and the volume transmission hypothesis: time to move on. Nature reviews. Neuroscience, 10(5), 383-90. [PubMed:19377503] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2
Luiten, P.G., Gaykema, R.P., Traber, J., & Spencer, D.G. (1987).
Cortical projection patterns of magnocellular basal nucleus subdivisions as revealed by anterogradely transported Phaseolus vulgaris leucoagglutinin. Brain research, 413(2), 229-50. [PubMed:3300852] [WorldCat] [DOI] - ↑
Henny, P., & Jones, B.E. (2008).
Projections from basal forebrain to prefrontal cortex comprise cholinergic, GABAergic and glutamatergic inputs to pyramidal cells or interneurons. The European journal of neuroscience, 27(3), 654-70. [PubMed:18279318] [PMC] [WorldCat] [DOI] - ↑
Wenk, G.L. (1997).
The nucleus basalis magnocellularis cholinergic system: one hundred years of progress. Neurobiology of learning and memory, 67(2), 85-95. [PubMed:9075237] [WorldCat] [DOI] - ↑
Steriade, M. (2004).
Acetylcholine systems and rhythmic activities during the waking--sleep cycle. Progress in brain research, 145, 179-96. [PubMed:14650916] [WorldCat] [DOI] - ↑
Rasmusson, D.D. (2000).
The role of acetylcholine in cortical synaptic plasticity. Behavioural brain research, 115(2), 205-18. [PubMed:11000421] [WorldCat] [DOI] - ↑
Sato, A., Sato, Y., & Uchida, S. (2004).
Activation of the intracerebral cholinergic nerve fibers originating in the basal forebrain increases regional cerebral blood flow in the rat's cortex and hippocampus. Neuroscience letters, 361(1-3), 90-3. [PubMed:15135901] [WorldCat] [DOI] - ↑ <pubmed>6320048</pubmed>
- ↑
Zaborszky, L., Buhl, D.L., Pobalashingham, S., Bjaalie, J.G., & Nadasdy, Z. (2005).
Three-dimensional chemoarchitecture of the basal forebrain: spatially specific association of cholinergic and calcium binding protein-containing neurons. Neuroscience, 136(3), 697-713. [PubMed:16344145] [PMC] [WorldCat] [DOI] - ↑
Mesulam, M.M., Mufson, E.J., Wainer, B.H., & Levey, A.I. (1983).
Central cholinergic pathways in the rat: an overview based on an alternative nomenclature (Ch1-Ch6). Neuroscience, 10(4), 1185-201. [PubMed:6320048] [WorldCat] [DOI] - ↑ 12.0 12.1 12.2 Larry L. Butcher
, 36 Cholinergic Neurons and Networks, George Paxinos editor, The Rat Nervous System Second Edition
Academic Press:1994 - ↑ 13.0 13.1 13.2 13.3
Descarries, L., Mechawar, N., Aznavour, N., & Watkins, K.C. (2004).
Structural determinants of the roles of acetylcholine in cerebral cortex. Progress in brain research, 145, 45-58. [PubMed:14650905] [WorldCat] [DOI] - ↑
Henny, P., & Jones, B.E. (2008).
Projections from basal forebrain to prefrontal cortex comprise cholinergic, GABAergic and glutamatergic inputs to pyramidal cells or interneurons. The European journal of neuroscience, 27(3), 654-70. [PubMed:18279318] [PMC] [WorldCat] [DOI] - ↑ Wainer BH, Mesulam M-M
Ascending cholinergic pathways in the rat brain. In: Steriade M, Biesold D, editors. Brain cholinergic systems
Oxford University Press:1990, p.65-119. - ↑ Sharon L. Juliano, S. Essie Jacobs
Thre Rore of Acetylcholine in Barrel Cortex
Plenum Press:1995 - ↑
Johnston, M.V., McKinney, M., & Coyle, J.T. (1981).
Neocortical cholinergic innervation: a description of extrinsic and intrinsic components in the rat. Experimental brain research, 43(2), 159-72. [PubMed:6265265] [WorldCat] [DOI] - ↑
Bayraktar, T., Staiger, J.F., Acsady, L., Cozzari, C., Freund, T.F., & Zilles, K. (1997).
Co-localization of vasoactive intestinal polypeptide, gamma-aminobutyric acid and choline acetyltransferase in neocortical interneurons of the adult rat. Brain research, 757(2), 209-17. [PubMed:9200749] [WorldCat] [DOI] - ↑ 19.0 19.1 19.2 19.3 19.4
Mechawar, N., Cozzari, C., & Descarries, L. (2000).
Cholinergic innervation in adult rat cerebral cortex: a quantitative immunocytochemical description. The Journal of comparative neurology, 428(2), 305-18. [PubMed:11064369] [WorldCat] [DOI] - ↑ 20.0 20.1 有田秀穂
脳内物質のシステム神経生理学
中外医学社:2006 - ↑ 21.0 21.1 21.2 Jones BE, Muhlethaler M
Cholinergic and GABAergic neurons of the basal forebrain : role in cortical activation. In: Lydic R, Baghdoyan HA, editors. Handbook of behavioral state control
’’London CRC Press’’:1999, p.213-233. - ↑
Kurosawa, M., Sato, A., & Sato, Y. (1989).
Stimulation of the nucleus basalis of Meynert increases acetylcholine release in the cerebral cortex in rats. Neuroscience letters, 98(1), 45-50. [PubMed:2565563] [WorldCat] [DOI] - ↑ 23.0 23.1 23.2
Jones, B.E. (2003).
Arousal systems. Frontiers in bioscience : a journal and virtual library, 8, s438-51. [PubMed:12700104] [WorldCat] [DOI] - ↑
Metherate, R., Cox, C.L., & Ashe, J.H. (1992).
Cellular bases of neocortical activation: modulation of neural oscillations by the nucleus basalis and endogenous acetylcholine. The Journal of neuroscience : the official journal of the Society for Neuroscience, 12(12), 4701-11. [PubMed:1361197] [WorldCat] - ↑
Kilgard, M.P., & Merzenich, M.M. (1998).
Cortical map reorganization enabled by nucleus basalis activity. Science (New York, N.Y.), 279(5357), 1714-8. [PubMed:9497289] [WorldCat] [DOI] - ↑
Rasmusson, D.D., & Dykes, R.W. (1988).
Long-term enhancement of evoked potentials in cat somatosensory cortex produced by co-activation of the basal forebrain and cutaneous receptors. Experimental brain research, 70(2), 276-86. [PubMed:3384031] [WorldCat] [DOI] - ↑
Froemke, R.C., Merzenich, M.M., & Schreiner, C.E. (2007).
A synaptic memory trace for cortical receptive field plasticity. Nature, 450(7168), 425-9. [PubMed:18004384] [WorldCat] [DOI] - ↑
Takata, N., Mishima, T., Hisatsune, C., Nagai, T., Ebisui, E., Mikoshiba, K., & Hirase, H. (2011).
Astrocyte calcium signaling transforms cholinergic modulation to cortical plasticity in vivo. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(49), 18155-65. [PubMed:22159127] [PMC] [WorldCat] [DOI] - ↑
Whitehouse, P.J., Price, D.L., Struble, R.G., Clark, A.W., Coyle, J.T., & Delon, M.R. (1982).
Alzheimer's disease and senile dementia: loss of neurons in the basal forebrain. Science (New York, N.Y.), 215(4537), 1237-9. [PubMed:7058341] [WorldCat] [DOI] - ↑
Biesold, D., Inanami, O., Sato, A., & Sato, Y. (1989).
Stimulation of the nucleus basalis of Meynert increases cerebral cortical blood flow in rats. Neuroscience letters, 98(1), 39-44. [PubMed:2565562] [WorldCat] [DOI] - ↑
Hamel, E. (2004).
Cholinergic modulation of the cortical microvascular bed. Progress in brain research, 145, 171-8. [PubMed:14650915] [WorldCat] [DOI] - ↑
Lecrux, C., Kocharyan, A., Sandoe, C.H., Tong, X.K., & Hamel, E. (2012).
Pyramidal cells and cytochrome P450 epoxygenase products in the neurovascular coupling response to basal forebrain cholinergic input. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism, 32(5), 896-906. [PubMed:22293985] [PMC] [WorldCat] [DOI] - ↑
Takata, N., Nagai, T., Ozawa, K., Oe, Y., Mikoshiba, K., & Hirase, H. (2013).
Cerebral blood flow modulation by Basal forebrain or whisker stimulation can occur independently of large cytosolic Ca2+ signaling in astrocytes. PloS one, 8(6), e66525. [PubMed:23785506] [PMC] [WorldCat] [DOI] - ↑
Nizar, K., Uhlirova, H., Tian, P., Saisan, P.A., Cheng, Q., Reznichenko, L., ..., & Devor, A. (2013).
In vivo stimulus-induced vasodilation occurs without IP3 receptor activation and may precede astrocytic calcium increase. The Journal of neuroscience : the official journal of the Society for Neuroscience, 33(19), 8411-22. [PubMed:23658179] [PMC] [WorldCat] [DOI]