「小胞体ストレス」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の6版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">浅田 梨絵、[http://researchmap.jp/kazu0321 今泉 和則]</font><br> | <font size="+1">浅田 梨絵、[http://researchmap.jp/kazu0321 今泉 和則]</font><br> | ||
''広島大学 医歯薬学総合研究科''<br> | ''広島大学 医歯薬学総合研究科''<br> | ||
DOI XXXX/XXXX 原稿受付日:2012年3月21日 原稿完成日:2013年月日<br> | |||
担当編集委員:[http://researchmap.jp/ | 担当編集委員:[http://researchmap.jp/ryosuketakahashi 高橋 良輔](京都大学 大学院医学研究科)<br> | ||
</div> | </div> | ||
| 11行目: | 11行目: | ||
{{box|text= | {{box|text= | ||
小胞体ストレスとは、[[ | 小胞体ストレスとは、[[wikipedia:JA:小胞体|小胞体]]内腔に[[wikipedia:JA:タンパク質構造|高次構造]]の異常な[[wikipedia:JA:タンパク質|タンパク質]]や正常な修飾を受けていないタンパク質が蓄積した状態のことである。このようなタンパク質は、折りたたみ不全タンパク質(unfolded protein)と呼ばれ、小胞体内の[[カルシウム]]枯渇、細胞への[[酸化ストレス]]、変異タンパク質の発現、低[[wikipedia:JA:グルコース|グルコース]]状態や[[wikipedia:JA:低酸素|低酸素]]状態など、様々な生理的[[ストレス]]によって生じる<ref><pubmed> 14729177 </pubmed></ref><ref><pubmed> 18650916 </pubmed></ref>。またストレス要因がなくとも、[[分泌]]細胞のように小胞体の処理能力を超えるタンパク質が小胞体内に輸送される場合にも生じる。小胞体ストレスは細胞にダメージを与えるため、細胞にはこれを回避するシステムが備わっており、小胞体[[ストレス応答]](Unfolded protein response; UPR)と呼ばれる<ref><pubmed> 15603751 </pubmed></ref><ref><pubmed> 12438433 </pubmed></ref><ref><pubmed> 12438434 </pubmed></ref>。小胞体ストレス応答が正常に機能しない場合や、回避能力を超える過度の小胞体ストレスが負荷された場合、[[アポトーシス]]により細胞は死に至る<ref><pubmed> 10638761 </pubmed></ref><ref><pubmed> 10650002 </pubmed></ref>。 | ||
}} | }} | ||
| 17行目: | 17行目: | ||
[[Image:図1. 小胞体ストレス応答.jpg|thumb|right|300px|'''図1.小胞体ストレス応答''']] | [[Image:図1. 小胞体ストレス応答.jpg|thumb|right|300px|'''図1.小胞体ストレス応答''']] | ||
小胞体ストレス応答は、[[ | 小胞体ストレス応答は、[[wikipedia:JA:酵母|酵母]]から[[wikipedia:JA:哺乳類|哺乳類]]まで広く保存されたシステムである。小胞体ストレスが発生すると、細胞は以下の3つの応答を示す。 | ||
#小胞体内に新たなタンパク質が輸送されないように[[mRNA]]の[[ | #小胞体内に新たなタンパク質が輸送されないように[[wikipedia:JA:mRNA|mRNA]]の[[wikipedia:JA:翻訳|翻訳]]を抑制する<ref><pubmed> 11106749 </pubmed></ref> | ||
#タンパク質の折りたたみ効率を上げるように小胞体分子[[ | #タンパク質の折りたたみ効率を上げるように小胞体分子[[wikipedia:JA:シャペロン|シャペロン]]の[[wikipedia:JA:転写|転写]]を誘導する<ref><pubmed> 10866666 </pubmed></ref><ref><pubmed> 9837962 </pubmed></ref> | ||
#折りたたみ不全タンパク質自体を分解する[[ | #折りたたみ不全タンパク質自体を分解する[[wikipedia:Endoplasmic-reticulum-associated protein degradation|小胞体関連分解]] (ER-associated degradation; ERAD)を活性化する<ref><pubmed> 10893258 </pubmed></ref><ref><pubmed> 10847680 </pubmed></ref> | ||
哺乳細胞において、折りたたみ不全タンパク質の小胞体内への蓄積は主に3つの小胞体ストレスセンサー([[ | 哺乳細胞において、折りたたみ不全タンパク質の小胞体内への蓄積は主に3つの小胞体ストレスセンサー([[wikipedia:EIF2AK3|PERK]]<ref><pubmed> 9930704 </pubmed></ref>、[[wikipedia:IRE1|IRE1]]<ref><pubmed> 10650002 </pubmed></ref><ref><pubmed> 11069889 </pubmed></ref>、[[wikipedia:ATF6|ATF6]]<ref><pubmed> 10866666 </pubmed></ref><ref><pubmed> 9837962 </pubmed></ref>)によって感知され、上述の応答が各ストレスセンサーから発信されるシグナルによって引き起こされる。以下に各ストレスセンサーの経路について述べる。 | ||
=== PERK(PKR-like endoplasmic reticulum kinase)経路 === | === PERK(PKR-like endoplasmic reticulum kinase)経路 === | ||
小胞体膜貫通型キナーゼであるPERKは、小胞体ストレスを感知するとオリゴマーを形成し、自己[[リン酸化]]によって活性化する。活性化したPERKは翻訳開始因子の一つである[[ | 小胞体膜貫通型キナーゼであるPERKは、小胞体ストレスを感知するとオリゴマーを形成し、自己[[リン酸化]]によって活性化する。活性化したPERKは翻訳開始因子の一つである[[wikipedia:EIF2A|eIF2α]](eukaryotic initiation factor 2α)をリン酸化する。このリン酸化によってeIF2αは翻訳開始複合体を形成することができず、結果として細胞内のmRNAの翻訳が抑制される<ref><pubmed> 9930704 </pubmed></ref>。全般的に翻訳が抑制される中で、転写因子[[wikipedia:ATF4|ATF4]]は翻訳量が増加する<ref><pubmed> 11106749 </pubmed></ref>。ATF4の標的遺伝子には抗酸化反応やアポトーシス、PERK経路の負の制御に関連した遺伝子が存在する。 | ||
=== IRE1 (Inositol requiring 1) 経路 === | === IRE1 (Inositol requiring 1) 経路 === | ||
PERKと同じく小胞体膜貫通型キナーゼであるIRE1は、小胞体ストレスを感知するとダイマーを形成し、自己リン酸化によって立体構造を変化させ活性化する。活性化したIRE1は細胞質側に存在する[[ | PERKと同じく小胞体膜貫通型キナーゼであるIRE1は、小胞体ストレスを感知するとダイマーを形成し、自己リン酸化によって立体構造を変化させ活性化する。活性化したIRE1は細胞質側に存在する[[wikipedia:JA:RNase|RNase]]ドメインによって基質である[[wikipedia:JA:転写因子|転写因子]][[wikipedia:XBP1|XBP1]] (X-box binding protein 1) mRNA (unspliced XBP1 mRNA)の[[wikipedia:JA:スプライシング|スプライシング]]を行う<ref><pubmed> 11779465 </pubmed></ref><ref><pubmed> 11779464 </pubmed></ref><ref><pubmed> 11780124 </pubmed></ref>。スプライシングされたXBP1 mRNA (spliced XBP1 mRNA)の翻訳産物は、転写因子としての活性を持ったものであり、ERAD関連遺伝子や、小胞体分子シャペロン、酸化還元酵素、小胞体膜合成関連遺伝子の転写を促進する<ref><pubmed> 14559994 </pubmed></ref><ref><pubmed> 19247368 </pubmed></ref><ref><pubmed> 15345222 </pubmed></ref>。 | ||
=== ATF6 (Activating transcription factor 6) 経路 === | === ATF6 (Activating transcription factor 6) 経路 === | ||
[[CREB]] / ATFファミリーに属する膜結合型転写因子であるATF6は、小胞体ストレスを感知すると[[ | [[CREB]] / ATFファミリーに属する膜結合型転写因子であるATF6は、小胞体ストレスを感知すると[[wikipedia:JA:ゴルジ装置|ゴルジ装置]]へ輸送され<ref><pubmed> 9837962 </pubmed></ref><ref><pubmed> 10564271 </pubmed></ref>、[[wikipedia:JA:Membrane-bound transcription factor peptidase, site 1|プロテアーゼS1P]](site-1 protease)と[[wikipedia:Membrane-bound_transcription_factor_peptidase,_site_2|S2P]]によって膜内切断を受ける<ref><pubmed> 11163209 </pubmed></ref>。その後、DNA結合能を有する[[wikipedia:JA:bZIP domain|bZIPドメイン]]を含んだ断片が核内へ移行し、転写因子として機能する。標的遺伝子には、小胞体分子シャペロン、ERAD関連遺伝子、そしてXBP1がある<ref><pubmed> 11779464 </pubmed></ref>。 | ||
これらに加え、ATF6と構造的に類似するOASISファミリー([[ | これらに加え、ATF6と構造的に類似するOASISファミリー([[wikipedia:CREB3|LUMAN]]/CREB3<ref><pubmed> 15845366 </pubmed></ref><ref><pubmed> 16940180 </pubmed></ref>、[[wikipedia:CREB3L1|OASIS]]/CREB3L1<ref><pubmed> 15665855 </pubmed></ref>、[[wikipedia:CREB3L2|BBF2H7]]/CREB3L2<ref><pubmed> 17178827 </pubmed></ref>、[[wikipedia:CREB3L3|CREBH]]CREBH/CREB3L3<ref><pubmed> 11353085 </pubmed></ref>、[[wikipedia:CREB3L4|CREB4]]/AIbZIP/CREB3L4<ref><pubmed> 15938716 </pubmed></ref><ref><pubmed> 16236796 </pubmed></ref>)が小胞体ストレスセンサーとして知られている。これら5つのストレスセンサーは3つの主要ストレスセンサー(PERK、IRE1、ATF6)がユビキタスに発現しているのに対し、それぞれが特徴的な組織分布を示す。また転写ターゲットも主要センサーとは異なる。 | ||
== 小胞体ストレスと疾患 == | == 小胞体ストレスと疾患 == | ||
| 46行目: | 46行目: | ||
[[Image:図2. パーキンソン病.jpg|thumb|right|300px|'''図2.パーキンソン病''']] | [[Image:図2. パーキンソン病.jpg|thumb|right|300px|'''図2.パーキンソン病''']] | ||
[[パーキンソン病]]は[[黒質]][[ドーパミン]]神経が選択的に変性する神経変性疾患のひとつである。家族性パーキンソン病のひとつである常染色体劣性家族性パーキンソン病では[[Parkin]]遺伝子が欠損することによって神経細胞死が起こり疾患につながる<ref><pubmed> 10888878 </pubmed></ref><ref><pubmed> 10973942 </pubmed></ref>。Parkinは[[ユビキチンリガーゼ]]の一種で、これまでに10種類以上の基質タンパク質が報告されている。その中でもパーキンソン病の発症に関わる因子としてPeal受容体がある。[[Peal受容体]]は[[エンドセリン]]受容体Bと約50%の相同性をもつ[[Gタンパク質共役受容体]]であるが、その[[リガンド]]はまだ同定されていない。Peal受容体は複数回膜を貫通するタンパク質で小胞体内の折りたたみが難しいタンパク質のひとつであると考えられている。折りたたまれないでミスフォールドされたPeal受容体はParkinによって[[ユビキチン]]化され、ERADによって分解される。Parkinが欠損する患者ではミスフォールド化したPeal受容体がERADの系で分解されず、ミスフォールドのまま小胞体に蓄積し小胞体ストレスを引き起こすことが示唆されている<ref><pubmed> 11439185 </pubmed></ref>。Peal受容体は中枢神経系では[[オリゴデンドロサイト]]に広く分布しているが、神経細胞では黒質ドーパミンニューロンに発現している。パーキンソン病で障害を受けやすい黒質ドーパミンニューロンがPeal受容体を発現していることは、本疾患で小胞体ストレスが発症に密接に関わる重要な根拠になっている。 また、パーキンソン病患者の神経細胞内レビー小体の構成成分である[[α-シヌクレイン]](α-Syn)はリン酸化修飾を受けており、これによって小胞体―[[ゴルジ装置]]間輸送が抑制される<ref><pubmed> 16794039 </pubmed></ref><ref><pubmed> 18162536 </pubmed></ref>。その結果、小胞体内に未成熟なタンパク質が蓄積して小胞体ストレスを誘発する<ref><pubmed> 17986870 </pubmed></ref>。パーキンソン病は[[ | [[パーキンソン病]]は[[黒質]][[ドーパミン]]神経が選択的に変性する神経変性疾患のひとつである。家族性パーキンソン病のひとつである常染色体劣性家族性パーキンソン病では[[Parkin]]遺伝子が欠損することによって神経細胞死が起こり疾患につながる<ref><pubmed> 10888878 </pubmed></ref><ref><pubmed> 10973942 </pubmed></ref>。Parkinは[[ユビキチンリガーゼ]]の一種で、これまでに10種類以上の基質タンパク質が報告されている。その中でもパーキンソン病の発症に関わる因子としてPeal受容体がある。[[Peal受容体]]は[[エンドセリン]]受容体Bと約50%の相同性をもつ[[Gタンパク質共役受容体]]であるが、その[[リガンド]]はまだ同定されていない。Peal受容体は複数回膜を貫通するタンパク質で小胞体内の折りたたみが難しいタンパク質のひとつであると考えられている。折りたたまれないでミスフォールドされたPeal受容体はParkinによって[[ユビキチン]]化され、ERADによって分解される。Parkinが欠損する患者ではミスフォールド化したPeal受容体がERADの系で分解されず、ミスフォールドのまま小胞体に蓄積し小胞体ストレスを引き起こすことが示唆されている<ref><pubmed> 11439185 </pubmed></ref>。Peal受容体は中枢神経系では[[オリゴデンドロサイト]]に広く分布しているが、神経細胞では黒質ドーパミンニューロンに発現している。パーキンソン病で障害を受けやすい黒質ドーパミンニューロンがPeal受容体を発現していることは、本疾患で小胞体ストレスが発症に密接に関わる重要な根拠になっている。 また、パーキンソン病患者の神経細胞内レビー小体の構成成分である[[α-シヌクレイン]](α-Syn)はリン酸化修飾を受けており、これによって小胞体―[[ゴルジ装置]]間輸送が抑制される<ref><pubmed> 16794039 </pubmed></ref><ref><pubmed> 18162536 </pubmed></ref>。その結果、小胞体内に未成熟なタンパク質が蓄積して小胞体ストレスを誘発する<ref><pubmed> 17986870 </pubmed></ref>。パーキンソン病は[[wikipedia:ja:ミトコンドリア|ミトコンドリア]]の機能障害も生じているが、α-Synによる一連の反応はミトコンドリアの機能障害の発生前に起こることが示唆されている<ref><pubmed> 18562315 </pubmed></ref>。 | ||
===ポリグルタミン病 === | ===ポリグルタミン病 === | ||
| 52行目: | 52行目: | ||
[[Image:図3. ポリグルタミン病.jpg|thumb|right|300px|'''図3.ポリグルタミン病''']] | [[Image:図3. ポリグルタミン病.jpg|thumb|right|300px|'''図3.ポリグルタミン病''']] | ||
[[ポリグルタミン病]]は、原因遺伝子の翻訳領域内にあるポリグルタミンをコードする[[CAGリピート]]が異常に伸張することによって発症する一群の優性遺伝神経変性疾患である。この中には[[ハンチントン舞踏病]]、[[球脊髄性筋萎縮症]]、[[Machado-Joseph病]]、[[脊髄小脳変性症]]などが含まれる。ポリグルタミンを培養細胞に強制発現させると、細胞質内に凝集し始める。過剰なポリグルタミンを分解するために[[プロテアソーム]]が活性化するが、大量のポリグルタミンの処理に伴ってプロテアソーム活性が減弱し、結果的に小胞体ストレス応答に必要なERADが障害され小胞体ストレスが惹起される<ref><pubmed> 12050113 </pubmed></ref>。ERADが障害されて細胞死に至る過程にはIRE1-[[ | [[ポリグルタミン病]]は、原因遺伝子の翻訳領域内にあるポリグルタミンをコードする[[CAGリピート]]が異常に伸張することによって発症する一群の優性遺伝神経変性疾患である。この中には[[ハンチントン舞踏病]]、[[球脊髄性筋萎縮症]]、[[Machado-Joseph病]]、[[脊髄小脳変性症]]などが含まれる。ポリグルタミンを培養細胞に強制発現させると、細胞質内に凝集し始める。過剰なポリグルタミンを分解するために[[プロテアソーム]]が活性化するが、大量のポリグルタミンの処理に伴ってプロテアソーム活性が減弱し、結果的に小胞体ストレス応答に必要なERADが障害され小胞体ストレスが惹起される<ref><pubmed> 12050113 </pubmed></ref>。ERADが障害されて細胞死に至る過程にはIRE1-[[wikipedia:TRAF2|TRAF2]]-[[wikipedia:Ask1|Ask1]]-[[wikipedia:JNK|JNK]]経路が関わり、Ask1をノックアウトした細胞ではポリグルタミンによる細胞死が抑制される。 | ||
===アルツハイマー病 === | ===アルツハイマー病 === | ||
| 58行目: | 58行目: | ||
[[Image:図4. アルツハイマー病.jpg|thumb|right|300px|'''図4.アルツハイマー病''']] | [[Image:図4. アルツハイマー病.jpg|thumb|right|300px|'''図4.アルツハイマー病''']] | ||
[[アルツハイマー病]]患者の脳では、不溶化した[[アミロイドβ]](Aβ)が神経細胞の間隙に蓄積してできた[[ | [[アルツハイマー病]]患者の脳では、不溶化した[[アミロイドβ]](Aβ)が神経細胞の間隙に蓄積してできた[[老人班]]と、神経細胞内に細線維が束をなして凝集する[[神経原線維変化]][[リンクの名前]]が特徴的な病理変化として観察される。病変が見られる領域、特に[[大脳皮質]][[連合野]]および[[海馬]]・[[扁桃体]]などの[[辺縁系]]の神経細胞は死滅脱落し、さらに進行すると脳の萎縮につながる。家族性アルツハイマー病(FAD)の原因遺伝子として[[アミロイド前駆体タンパク質]](APP)、[[プレセニリン]]1(PS1)、プレセニリン2(PS2)が同定されている。このうちPS1変異で起こるケースが大半を占めている。変異PS1は小胞体ストレスセンサーの活性化を阻害することで小胞体ストレス感受性を亢進させて神経を細胞死に導く<ref><pubmed> 10587643 </pubmed></ref><ref><pubmed> 11331887 </pubmed></ref>。 一方、孤発性アルツハイマー病(SAD)はPERK-eIF2α経路<ref><pubmed> 16691116 </pubmed></ref><ref><pubmed> 19264902 </pubmed></ref>や[[ユビキチンリガーゼ]][[wikipedia:HRD1|HRD1]]などがその発症に関わることが示唆されている<ref><pubmed> 20237263 </pubmed></ref>。 | ||
===筋萎縮性側索硬化症 === | ===筋萎縮性側索硬化症 === | ||
| 67行目: | 67行目: | ||
神経系疾患のみならず、[[ | 神経系疾患のみならず、[[wikipedia:JA:糖尿病|糖尿病]]、[[wikipedia:JA:肥満|肥満]]、[[wikipedia:JA:骨代謝疾患|骨代謝疾患]]、[[wikipedia:JA:癌|癌]]など様々な疾患と小胞体ストレスの関わりが報告されており、疾患を理解する上で小胞体ストレスとその応答系の全貌解明が望まれる。 | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2013年9月11日 (水) 10:00時点における版
英語名:endoplasmic reticulum stress 独:endoplasmic reticulum-Belastung 仏:stress du reticulum de l'endoplasmic
同義語:ERストレス
小胞体ストレスとは、小胞体内腔に高次構造の異常なタンパク質や正常な修飾を受けていないタンパク質が蓄積した状態のことである。このようなタンパク質は、折りたたみ不全タンパク質(unfolded protein)と呼ばれ、小胞体内のカルシウム枯渇、細胞への酸化ストレス、変異タンパク質の発現、低グルコース状態や低酸素状態など、様々な生理的ストレスによって生じる[1][2]。またストレス要因がなくとも、分泌細胞のように小胞体の処理能力を超えるタンパク質が小胞体内に輸送される場合にも生じる。小胞体ストレスは細胞にダメージを与えるため、細胞にはこれを回避するシステムが備わっており、小胞体ストレス応答(Unfolded protein response; UPR)と呼ばれる[3][4][5]。小胞体ストレス応答が正常に機能しない場合や、回避能力を超える過度の小胞体ストレスが負荷された場合、アポトーシスにより細胞は死に至る[6][7]。
小胞体ストレス応答
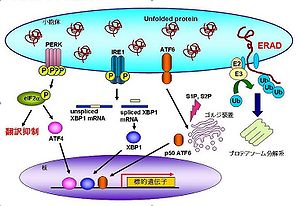
小胞体ストレス応答は、酵母から哺乳類まで広く保存されたシステムである。小胞体ストレスが発生すると、細胞は以下の3つの応答を示す。
- 小胞体内に新たなタンパク質が輸送されないようにmRNAの翻訳を抑制する[8]
- タンパク質の折りたたみ効率を上げるように小胞体分子シャペロンの転写を誘導する[9][10]
- 折りたたみ不全タンパク質自体を分解する小胞体関連分解 (ER-associated degradation; ERAD)を活性化する[11][12]
哺乳細胞において、折りたたみ不全タンパク質の小胞体内への蓄積は主に3つの小胞体ストレスセンサー(PERK[13]、IRE1[14][15]、ATF6[16][17])によって感知され、上述の応答が各ストレスセンサーから発信されるシグナルによって引き起こされる。以下に各ストレスセンサーの経路について述べる。
PERK(PKR-like endoplasmic reticulum kinase)経路
小胞体膜貫通型キナーゼであるPERKは、小胞体ストレスを感知するとオリゴマーを形成し、自己リン酸化によって活性化する。活性化したPERKは翻訳開始因子の一つであるeIF2α(eukaryotic initiation factor 2α)をリン酸化する。このリン酸化によってeIF2αは翻訳開始複合体を形成することができず、結果として細胞内のmRNAの翻訳が抑制される[18]。全般的に翻訳が抑制される中で、転写因子ATF4は翻訳量が増加する[19]。ATF4の標的遺伝子には抗酸化反応やアポトーシス、PERK経路の負の制御に関連した遺伝子が存在する。
IRE1 (Inositol requiring 1) 経路
PERKと同じく小胞体膜貫通型キナーゼであるIRE1は、小胞体ストレスを感知するとダイマーを形成し、自己リン酸化によって立体構造を変化させ活性化する。活性化したIRE1は細胞質側に存在するRNaseドメインによって基質である転写因子XBP1 (X-box binding protein 1) mRNA (unspliced XBP1 mRNA)のスプライシングを行う[20][21][22]。スプライシングされたXBP1 mRNA (spliced XBP1 mRNA)の翻訳産物は、転写因子としての活性を持ったものであり、ERAD関連遺伝子や、小胞体分子シャペロン、酸化還元酵素、小胞体膜合成関連遺伝子の転写を促進する[23][24][25]。
ATF6 (Activating transcription factor 6) 経路
CREB / ATFファミリーに属する膜結合型転写因子であるATF6は、小胞体ストレスを感知するとゴルジ装置へ輸送され[26][27]、プロテアーゼS1P(site-1 protease)とS2Pによって膜内切断を受ける[28]。その後、DNA結合能を有するbZIPドメインを含んだ断片が核内へ移行し、転写因子として機能する。標的遺伝子には、小胞体分子シャペロン、ERAD関連遺伝子、そしてXBP1がある[29]。
これらに加え、ATF6と構造的に類似するOASISファミリー(LUMAN/CREB3[30][31]、OASIS/CREB3L1[32]、BBF2H7/CREB3L2[33]、CREBHCREBH/CREB3L3[34]、CREB4/AIbZIP/CREB3L4[35][36])が小胞体ストレスセンサーとして知られている。これら5つのストレスセンサーは3つの主要ストレスセンサー(PERK、IRE1、ATF6)がユビキタスに発現しているのに対し、それぞれが特徴的な組織分布を示す。また転写ターゲットも主要センサーとは異なる。
小胞体ストレスと疾患
小胞体ストレスが関わる神経系疾患について下に示す。
パーキンソン病
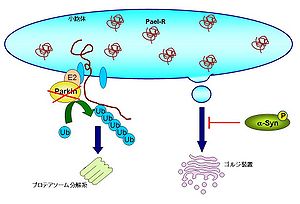
パーキンソン病は黒質ドーパミン神経が選択的に変性する神経変性疾患のひとつである。家族性パーキンソン病のひとつである常染色体劣性家族性パーキンソン病ではParkin遺伝子が欠損することによって神経細胞死が起こり疾患につながる[37][38]。Parkinはユビキチンリガーゼの一種で、これまでに10種類以上の基質タンパク質が報告されている。その中でもパーキンソン病の発症に関わる因子としてPeal受容体がある。Peal受容体はエンドセリン受容体Bと約50%の相同性をもつGタンパク質共役受容体であるが、そのリガンドはまだ同定されていない。Peal受容体は複数回膜を貫通するタンパク質で小胞体内の折りたたみが難しいタンパク質のひとつであると考えられている。折りたたまれないでミスフォールドされたPeal受容体はParkinによってユビキチン化され、ERADによって分解される。Parkinが欠損する患者ではミスフォールド化したPeal受容体がERADの系で分解されず、ミスフォールドのまま小胞体に蓄積し小胞体ストレスを引き起こすことが示唆されている[39]。Peal受容体は中枢神経系ではオリゴデンドロサイトに広く分布しているが、神経細胞では黒質ドーパミンニューロンに発現している。パーキンソン病で障害を受けやすい黒質ドーパミンニューロンがPeal受容体を発現していることは、本疾患で小胞体ストレスが発症に密接に関わる重要な根拠になっている。 また、パーキンソン病患者の神経細胞内レビー小体の構成成分であるα-シヌクレイン(α-Syn)はリン酸化修飾を受けており、これによって小胞体―ゴルジ装置間輸送が抑制される[40][41]。その結果、小胞体内に未成熟なタンパク質が蓄積して小胞体ストレスを誘発する[42]。パーキンソン病はミトコンドリアの機能障害も生じているが、α-Synによる一連の反応はミトコンドリアの機能障害の発生前に起こることが示唆されている[43]。
ポリグルタミン病
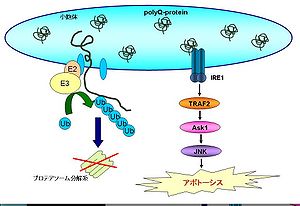
ポリグルタミン病は、原因遺伝子の翻訳領域内にあるポリグルタミンをコードするCAGリピートが異常に伸張することによって発症する一群の優性遺伝神経変性疾患である。この中にはハンチントン舞踏病、球脊髄性筋萎縮症、Machado-Joseph病、脊髄小脳変性症などが含まれる。ポリグルタミンを培養細胞に強制発現させると、細胞質内に凝集し始める。過剰なポリグルタミンを分解するためにプロテアソームが活性化するが、大量のポリグルタミンの処理に伴ってプロテアソーム活性が減弱し、結果的に小胞体ストレス応答に必要なERADが障害され小胞体ストレスが惹起される[44]。ERADが障害されて細胞死に至る過程にはIRE1-TRAF2-Ask1-JNK経路が関わり、Ask1をノックアウトした細胞ではポリグルタミンによる細胞死が抑制される。
アルツハイマー病
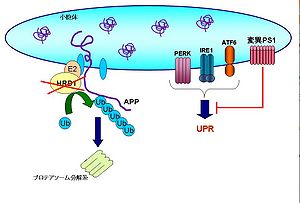
アルツハイマー病患者の脳では、不溶化したアミロイドβ(Aβ)が神経細胞の間隙に蓄積してできた老人班と、神経細胞内に細線維が束をなして凝集する神経原線維変化リンクの名前が特徴的な病理変化として観察される。病変が見られる領域、特に大脳皮質連合野および海馬・扁桃体などの辺縁系の神経細胞は死滅脱落し、さらに進行すると脳の萎縮につながる。家族性アルツハイマー病(FAD)の原因遺伝子としてアミロイド前駆体タンパク質(APP)、プレセニリン1(PS1)、プレセニリン2(PS2)が同定されている。このうちPS1変異で起こるケースが大半を占めている。変異PS1は小胞体ストレスセンサーの活性化を阻害することで小胞体ストレス感受性を亢進させて神経を細胞死に導く[45][46]。 一方、孤発性アルツハイマー病(SAD)はPERK-eIF2α経路[47][48]やユビキチンリガーゼHRD1などがその発症に関わることが示唆されている[49]。
筋萎縮性側索硬化症
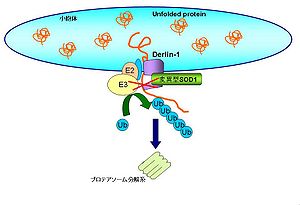
筋萎縮性側索硬化症(ALS)は、運動ニューロンの選択的神経細胞死が起こる疾患である。家族性ALSの原因遺伝子のひとつにSOD1の変異が知られている。変異型SOD1はERADの構成因子であるDerlin-1と特異的に結合し、ERAD経路を阻害する。その結果、ERAD経路により分解されないタンパク質が小胞体内に蓄積して小胞体ストレスを引き起こす[50]。
神経系疾患のみならず、糖尿病、肥満、骨代謝疾患、癌など様々な疾患と小胞体ストレスの関わりが報告されており、疾患を理解する上で小胞体ストレスとその応答系の全貌解明が望まれる。
参考文献
- ↑
Rutkowski, D.T., & Kaufman, R.J. (2004).
A trip to the ER: coping with stress. Trends in cell biology, 14(1), 20-8. [PubMed:14729177] [WorldCat] - ↑
Zhang, K., & Kaufman, R.J. (2008).
From endoplasmic-reticulum stress to the inflammatory response. Nature, 454(7203), 455-62. [PubMed:18650916] [PMC] [WorldCat] [DOI] - ↑
Schröder, M., & Kaufman, R.J. (2005).
ER stress and the unfolded protein response. Mutation research, 569(1-2), 29-63. [PubMed:15603751] [WorldCat] [DOI] - ↑
Ron, D. (2002).
Translational control in the endoplasmic reticulum stress response. The Journal of clinical investigation, 110(10), 1383-8. [PubMed:12438433] [PMC] [WorldCat] [DOI] - ↑
Kaufman, R.J. (2002).
Orchestrating the unfolded protein response in health and disease. The Journal of clinical investigation, 110(10), 1389-98. [PubMed:12438434] [PMC] [WorldCat] [DOI] - ↑
Nakagawa, T., Zhu, H., Morishima, N., Li, E., Xu, J., Yankner, B.A., & Yuan, J. (2000).
Caspase-12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyloid-beta. Nature, 403(6765), 98-103. [PubMed:10638761] [WorldCat] [DOI] - ↑
Urano, F., Wang, X., Bertolotti, A., Zhang, Y., Chung, P., Harding, H.P., & Ron, D. (2000).
Coupling of stress in the ER to activation of JNK protein kinases by transmembrane protein kinase IRE1. Science (New York, N.Y.), 287(5453), 664-6. [PubMed:10650002] [WorldCat] [DOI] - ↑
Harding, H.P., Novoa, I., Zhang, Y., Zeng, H., Wek, R., Schapira, M., & Ron, D. (2000).
Regulated translation initiation controls stress-induced gene expression in mammalian cells. Molecular cell, 6(5), 1099-108. [PubMed:11106749] [WorldCat] [DOI] - ↑
Li, M., Baumeister, P., Roy, B., Phan, T., Foti, D., Luo, S., & Lee, A.S. (2000).
ATF6 as a transcription activator of the endoplasmic reticulum stress element: thapsigargin stress-induced changes and synergistic interactions with NF-Y and YY1. Molecular and cellular biology, 20(14), 5096-106. [PubMed:10866666] [PMC] [WorldCat] [DOI] - ↑
Yoshida, H., Haze, K., Yanagi, H., Yura, T., & Mori, K. (1998).
Identification of the cis-acting endoplasmic reticulum stress response element responsible for transcriptional induction of mammalian glucose-regulated proteins. Involvement of basic leucine zipper transcription factors. The Journal of biological chemistry, 273(50), 33741-9. [PubMed:9837962] [WorldCat] [DOI] - ↑
Ng, D.T., Spear, E.D., & Walter, P. (2000).
The unfolded protein response regulates multiple aspects of secretory and membrane protein biogenesis and endoplasmic reticulum quality control. The Journal of cell biology, 150(1), 77-88. [PubMed:10893258] [PMC] [WorldCat] [DOI] - ↑
Travers, K.J., Patil, C.K., Wodicka, L., Lockhart, D.J., Weissman, J.S., & Walter, P. (2000).
Functional and genomic analyses reveal an essential coordination between the unfolded protein response and ER-associated degradation. Cell, 101(3), 249-58. [PubMed:10847680] [WorldCat] [DOI] - ↑
Harding, H.P., Zhang, Y., & Ron, D. (1999).
Protein translation and folding are coupled by an endoplasmic-reticulum-resident kinase. Nature, 397(6716), 271-4. [PubMed:9930704] [WorldCat] [DOI] - ↑
Urano, F., Wang, X., Bertolotti, A., Zhang, Y., Chung, P., Harding, H.P., & Ron, D. (2000).
Coupling of stress in the ER to activation of JNK protein kinases by transmembrane protein kinase IRE1. Science (New York, N.Y.), 287(5453), 664-6. [PubMed:10650002] [WorldCat] [DOI] - ↑
Tirasophon, W., Lee, K., Callaghan, B., Welihinda, A., & Kaufman, R.J. (2000).
The endoribonuclease activity of mammalian IRE1 autoregulates its mRNA and is required for the unfolded protein response. Genes & development, 14(21), 2725-36. [PubMed:11069889] [PMC] [WorldCat] [DOI] - ↑
Li, M., Baumeister, P., Roy, B., Phan, T., Foti, D., Luo, S., & Lee, A.S. (2000).
ATF6 as a transcription activator of the endoplasmic reticulum stress element: thapsigargin stress-induced changes and synergistic interactions with NF-Y and YY1. Molecular and cellular biology, 20(14), 5096-106. [PubMed:10866666] [PMC] [WorldCat] [DOI] - ↑
Yoshida, H., Haze, K., Yanagi, H., Yura, T., & Mori, K. (1998).
Identification of the cis-acting endoplasmic reticulum stress response element responsible for transcriptional induction of mammalian glucose-regulated proteins. Involvement of basic leucine zipper transcription factors. The Journal of biological chemistry, 273(50), 33741-9. [PubMed:9837962] [WorldCat] [DOI] - ↑
Harding, H.P., Zhang, Y., & Ron, D. (1999).
Protein translation and folding are coupled by an endoplasmic-reticulum-resident kinase. Nature, 397(6716), 271-4. [PubMed:9930704] [WorldCat] [DOI] - ↑
Harding, H.P., Novoa, I., Zhang, Y., Zeng, H., Wek, R., Schapira, M., & Ron, D. (2000).
Regulated translation initiation controls stress-induced gene expression in mammalian cells. Molecular cell, 6(5), 1099-108. [PubMed:11106749] [WorldCat] [DOI] - ↑
Shen, X., Ellis, R.E., Lee, K., Liu, C.Y., Yang, K., Solomon, A., ..., & Kaufman, R.J. (2001).
Complementary signaling pathways regulate the unfolded protein response and are required for C. elegans development. Cell, 107(7), 893-903. [PubMed:11779465] [WorldCat] [DOI] - ↑
Yoshida, H., Matsui, T., Yamamoto, A., Okada, T., & Mori, K. (2001).
XBP1 mRNA is induced by ATF6 and spliced by IRE1 in response to ER stress to produce a highly active transcription factor. Cell, 107(7), 881-91. [PubMed:11779464] [WorldCat] [DOI] - ↑
Calfon, M., Zeng, H., Urano, F., Till, J.H., Hubbard, S.R., Harding, H.P., ..., & Ron, D. (2002).
IRE1 couples endoplasmic reticulum load to secretory capacity by processing the XBP-1 mRNA. Nature, 415(6867), 92-6. [PubMed:11780124] [WorldCat] [DOI] - ↑
Lee, A.H., Iwakoshi, N.N., & Glimcher, L.H. (2003).
XBP-1 regulates a subset of endoplasmic reticulum resident chaperone genes in the unfolded protein response. Molecular and cellular biology, 23(21), 7448-59. [PubMed:14559994] [PMC] [WorldCat] [DOI] - ↑
Liu, Y., Adachi, M., Zhao, S., Hareyama, M., Koong, A.C., Luo, D., ..., & Shinomura, Y. (2009).
Preventing oxidative stress: a new role for XBP1. Cell death and differentiation, 16(6), 847-57. [PubMed:19247368] [PMC] [WorldCat] [DOI] - ↑
Shaffer, A.L., Shapiro-Shelef, M., Iwakoshi, N.N., Lee, A.H., Qian, S.B., Zhao, H., ..., & Staudt, L.M. (2004).
XBP1, downstream of Blimp-1, expands the secretory apparatus and other organelles, and increases protein synthesis in plasma cell differentiation. Immunity, 21(1), 81-93. [PubMed:15345222] [WorldCat] [DOI] - ↑
Yoshida, H., Haze, K., Yanagi, H., Yura, T., & Mori, K. (1998).
Identification of the cis-acting endoplasmic reticulum stress response element responsible for transcriptional induction of mammalian glucose-regulated proteins. Involvement of basic leucine zipper transcription factors. The Journal of biological chemistry, 273(50), 33741-9. [PubMed:9837962] [WorldCat] [DOI] - ↑
Haze, K., Yoshida, H., Yanagi, H., Yura, T., & Mori, K. (1999).
Mammalian transcription factor ATF6 is synthesized as a transmembrane protein and activated by proteolysis in response to endoplasmic reticulum stress. Molecular biology of the cell, 10(11), 3787-99. [PubMed:10564271] [PMC] [WorldCat] [DOI] - ↑
Ye, J., Rawson, R.B., Komuro, R., Chen, X., Davé, U.P., Prywes, R., ..., & Goldstein, J.L. (2000).
ER stress induces cleavage of membrane-bound ATF6 by the same proteases that process SREBPs. Molecular cell, 6(6), 1355-64. [PubMed:11163209] [WorldCat] [DOI] - ↑
Yoshida, H., Matsui, T., Yamamoto, A., Okada, T., & Mori, K. (2001).
XBP1 mRNA is induced by ATF6 and spliced by IRE1 in response to ER stress to produce a highly active transcription factor. Cell, 107(7), 881-91. [PubMed:11779464] [WorldCat] [DOI] - ↑
DenBoer, L.M., Hardy-Smith, P.W., Hogan, M.R., Cockram, G.P., Audas, T.E., & Lu, R. (2005).
Luman is capable of binding and activating transcription from the unfolded protein response element. Biochemical and biophysical research communications, 331(1), 113-9. [PubMed:15845366] [WorldCat] [DOI] - ↑
Liang, G., Audas, T.E., Li, Y., Cockram, G.P., Dean, J.D., Martyn, A.C., ..., & Lu, R. (2006).
Luman/CREB3 induces transcription of the endoplasmic reticulum (ER) stress response protein Herp through an ER stress response element. Molecular and cellular biology, 26(21), 7999-8010. [PubMed:16940180] [PMC] [WorldCat] [DOI] - ↑
Kondo, S., Murakami, T., Tatsumi, K., Ogata, M., Kanemoto, S., Otori, K., ..., & Imaizumi, K. (2005).
OASIS, a CREB/ATF-family member, modulates UPR signalling in astrocytes. Nature cell biology, 7(2), 186-94. [PubMed:15665855] [WorldCat] [DOI] - ↑
Kondo, S., Saito, A., Hino, S., Murakami, T., Ogata, M., Kanemoto, S., ..., & Imaizumi, K. (2007).
BBF2H7, a novel transmembrane bZIP transcription factor, is a new type of endoplasmic reticulum stress transducer. Molecular and cellular biology, 27(5), 1716-29. [PubMed:17178827] [PMC] [WorldCat] [DOI] - ↑
Omori, Y., Imai, J., Watanabe, M., Komatsu, T., Suzuki, Y., Kataoka, K., ..., & Sugano, S. (2001).
CREB-H: a novel mammalian transcription factor belonging to the CREB/ATF family and functioning via the box-B element with a liver-specific expression. Nucleic acids research, 29(10), 2154-62. [PubMed:11353085] [PMC] [WorldCat] [DOI] - ↑
Nagamori, I., Yabuta, N., Fujii, T., Tanaka, H., Yomogida, K., Nishimune, Y., & Nojima, H. (2005).
Tisp40, a spermatid specific bZip transcription factor, functions by binding to the unfolded protein response element via the Rip pathway. Genes to cells : devoted to molecular & cellular mechanisms, 10(6), 575-94. [PubMed:15938716] [WorldCat] [DOI] - ↑
Stirling, J., & O'hare, P. (2006).
CREB4, a transmembrane bZip transcription factor and potential new substrate for regulation and cleavage by S1P. Molecular biology of the cell, 17(1), 413-26. [PubMed:16236796] [PMC] [WorldCat] [DOI] - ↑
Shimura, H., Hattori, N., Kubo, S.i., Mizuno, Y., Asakawa, S., Minoshima, S., ..., & Suzuki, T. (2000).
Familial Parkinson disease gene product, parkin, is a ubiquitin-protein ligase. Nature genetics, 25(3), 302-5. [PubMed:10888878] [WorldCat] [DOI] - ↑
Imai, Y., Soda, M., & Takahashi, R. (2000).
Parkin suppresses unfolded protein stress-induced cell death through its E3 ubiquitin-protein ligase activity. The Journal of biological chemistry, 275(46), 35661-4. [PubMed:10973942] [WorldCat] [DOI] - ↑
Imai, Y., Soda, M., Inoue, H., Hattori, N., Mizuno, Y., & Takahashi, R. (2001).
An unfolded putative transmembrane polypeptide, which can lead to endoplasmic reticulum stress, is a substrate of Parkin. Cell, 105(7), 891-902. [PubMed:11439185] [WorldCat] [DOI] - ↑
Cooper, A.A., Gitler, A.D., Cashikar, A., Haynes, C.M., Hill, K.J., Bhullar, B., ..., & Lindquist, S. (2006).
Alpha-synuclein blocks ER-Golgi traffic and Rab1 rescues neuron loss in Parkinson's models. Science (New York, N.Y.), 313(5785), 324-8. [PubMed:16794039] [PMC] [WorldCat] [DOI] - ↑
Gitler, A.D., Bevis, B.J., Shorter, J., Strathearn, K.E., Hamamichi, S., Su, L.J., ..., & Lindquist, S. (2008).
The Parkinson's disease protein alpha-synuclein disrupts cellular Rab homeostasis. Proceedings of the National Academy of Sciences of the United States of America, 105(1), 145-50. [PubMed:18162536] [PMC] [WorldCat] [DOI] - ↑
Ding, W.X., & Yin, X.M. (2008).
Sorting, recognition and activation of the misfolded protein degradation pathways through macroautophagy and the proteasome. Autophagy, 4(2), 141-50. [PubMed:17986870] [WorldCat] [DOI] - ↑
Sugeno, N., Takeda, A., Hasegawa, T., Kobayashi, M., Kikuchi, A., Mori, F., ..., & Itoyama, Y. (2008).
Serine 129 phosphorylation of alpha-synuclein induces unfolded protein response-mediated cell death. The Journal of biological chemistry, 283(34), 23179-88. [PubMed:18562315] [WorldCat] [DOI] - ↑
Nishitoh, H., Matsuzawa, A., Tobiume, K., Saegusa, K., Takeda, K., Inoue, K., ..., & Ichijo, H. (2002).
ASK1 is essential for endoplasmic reticulum stress-induced neuronal cell death triggered by expanded polyglutamine repeats. Genes & development, 16(11), 1345-55. [PubMed:12050113] [PMC] [WorldCat] [DOI] - ↑
Katayama, T., Imaizumi, K., Sato, N., Miyoshi, K., Kudo, T., Hitomi, J., ..., & Tohyama, M. (1999).
Presenilin-1 mutations downregulate the signalling pathway of the unfolded-protein response. Nature cell biology, 1(8), 479-85. [PubMed:10587643] [WorldCat] [DOI] - ↑
Imaizumi, K., Katayama, T., & Tohyama, M. (2001).
Presenilin and the UPR. Nature cell biology, 3(5), E104. [PubMed:11331887] [WorldCat] [DOI] - ↑
Unterberger, U., Höftberger, R., Gelpi, E., Flicker, H., Budka, H., & Voigtländer, T. (2006).
Endoplasmic reticulum stress features are prominent in Alzheimer disease but not in prion diseases in vivo. Journal of neuropathology and experimental neurology, 65(4), 348-57. [PubMed:16691116] [WorldCat] [DOI] - ↑
Hoozemans, J.J., van Haastert, E.S., Nijholt, D.A., Rozemuller, A.J., Eikelenboom, P., & Scheper, W. (2009).
The unfolded protein response is activated in pretangle neurons in Alzheimer's disease hippocampus. The American journal of pathology, 174(4), 1241-51. [PubMed:19264902] [PMC] [WorldCat] [DOI] - ↑
Kaneko, M., Koike, H., Saito, R., Kitamura, Y., Okuma, Y., & Nomura, Y. (2010).
Loss of HRD1-mediated protein degradation causes amyloid precursor protein accumulation and amyloid-beta generation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(11), 3924-32. [PubMed:20237263] [PMC] [WorldCat] [DOI] - ↑
Nishitoh, H., Kadowaki, H., Nagai, A., Maruyama, T., Yokota, T., Fukutomi, H., ..., & Ichijo, H. (2008).
ALS-linked mutant SOD1 induces ER stress- and ASK1-dependent motor neuron death by targeting Derlin-1. Genes & development, 22(11), 1451-64. [PubMed:18519638] [PMC] [WorldCat] [DOI]