「サブスタンスP」の版間の差分
細 →参考文献 |
細編集の要約なし |
||
| (2人の利用者による、間の6版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/read0051173 鈴木 秀典]</font><br> | <font size="+1">[http://researchmap.jp/read0051173 鈴木 秀典]</font><br> | ||
''日本医科大学大学院医学研究科 薬理学分野''<br> | ''日本医科大学大学院医学研究科 薬理学分野''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2015年8月4日 原稿完成日:2015年月日<br> | ||
担当編集委員:[http://researchmap.jp/wadancnp 和田 圭司](国立研究開発法人国立精神・神経医療研究センター)<br> | 担当編集委員:[http://researchmap.jp/wadancnp 和田 圭司](国立研究開発法人国立精神・神経医療研究センター)<br> | ||
</div> | </div> | ||
英語名:substance | 英語名:substance P 英略語:SP | ||
同義語:P物質 | 同義語:P物質 | ||
{{box|text= | {{box|text= サブスタンスPは、11個のアミノ酸からなる神経ペプチドである。類似の構造を持つペプチドと共に、タキキニンtachykininsと総称される。サブスタンスPに高親和性を持つNK1受容体を介して、様々な細胞内情報伝達系を活性化し、複数のイオンチャネルを修飾する。サブスタンスPおよびNK1受容体は、神経細胞だけでなく、末梢の非神経細胞にも発現している。従って痛覚、神経原性炎症、情動、報酬系等、広範囲な生理機能と疾患病態に関与している。}} | ||
{{chembox | {{chembox | ||
| 80行目: | 80行目: | ||
== ファミリー == | == ファミリー == | ||
サブスタンスPは[[タキキニン]]ファミリーに属している。同じファミリーには、[[ニューロキニンA]]([[neurokinin A]]; [[NKA]])、[[ニューロキニンB]]([[neurokinin B]]; [[NKB]])、[[ヘモキニン-1]]([[hemokinin-1]]; [[HK-1]])などが含まれ、そのC末端に共通のアミノ酸配列、-Phe-X-Gly-Leu-Met-NH<sub>2</sub>を持っている。サブスタンスP、ニューロキニンA、ニューロキニンBは[[哺乳類]]でアミノ酸全配列が共通であるが、ヘモキニン-1は[[ヒト]]と[[マウス]]/ラット間で配列に違いがある(表1)。ヒトでは、[[Tac1]] | サブスタンスPは[[タキキニン]]ファミリーに属している。同じファミリーには、[[ニューロキニンA]]([[neurokinin A]]; [[NKA]])、[[ニューロキニンB]]([[neurokinin B]]; [[NKB]])、[[ヘモキニン-1]]([[hemokinin-1]]; [[HK-1]])などが含まれ、そのC末端に共通のアミノ酸配列、-Phe-X-Gly-Leu-Met-NH<sub>2</sub>を持っている。サブスタンスP、ニューロキニンA、ニューロキニンBは[[哺乳類]]でアミノ酸全配列が共通であるが、ヘモキニン-1は[[ヒト]]と[[マウス]]/ラット間で配列に違いがある(表1)。ヒトでは、[[Tac1]]遺伝子から選択的スプライシングによって、α, β, γ, δTac1 [[mRNA]][[スプライスバリアント]]が生成され、それぞれのmRNAから[[翻訳]]された前駆体タンパク質がプロッセッシングを受け、サブスタンスPが切り出される。 | ||
ニューロキニンAもTac1遺伝子に由来するが、β, γTac1 mRNAから翻訳される。ニューロキニンBはTac3遺伝子、HK-1は、C末端にタキキニン共通のアミノ酸配列を持つエンドキニンAおよびBと共にTac4遺伝子にコードされている<ref name=ref3><pubmed>24382888</pubmed></ref>。 | |||
[[ファイル:Tachikinin.jpg|サムネイル|右|350px|'''図. ヒトタキキニン前駆体の構造'''<br>SP: サブスタンスP、NPK: ニューロペプチドK、NKA: ニューロキニンA、NPγ: ニューロペプチドγ、NKB: ニューロキニンB、EKA: エンドキニンA、 | [[ファイル:Tachikinin.jpg|サムネイル|右|350px|'''図. ヒトタキキニン前駆体の構造'''<br>SP: サブスタンスP、NPK: ニューロペプチドK、NKA: ニューロキニンA、NPγ: ニューロペプチドγ、NKB: ニューロキニンB、EKA: エンドキニンA、 | ||
| 114行目: | 114行目: | ||
== 受容体 == | == 受容体 == | ||
哺乳類の[[タキキニン受容体]]は[[Gタンパク質共役型受容体]]で、中西らによって[[NK1 | 哺乳類の[[タキキニン受容体]]は[[Gタンパク質共役型受容体]]で、中西らによって[[NK1]]、[[NK2]]、[[NK3]]の3種類がクローニングされ、それぞれSP、ニューロキニンA、ニューロキニンBが高い親和性を持っている<ref name=ref4><pubmed>1851606</pubmed></ref>。NK1受容体の[[細胞内情報伝達]]経路は当初考えられていた以上に多岐に亘っている<ref name=ref3 />。[[Ca2+/リン脂質依存性タンパク質リン酸化酵素|Ca<sup>2+</sup>/リン脂質依存性タンパク質リン酸化酵素]]([[protein kinase C]], [[PKC]])、[[cAMP依存性タンパク質リン酸化酵素]]([[protein kinase A]], [[PKA]])、[[ホスホリパーゼA2]]([[phospholipase A2]])の活性化だけでなく、[[Rho]]-[[ROCK]]経路を介した[[ミオシン軽鎖キナーゼ]]([[myosin light chain kinase]])の[[リン酸化]]や[[上皮成長因子受容体]]([[epidermal growth factor receptor]], [[EGFR]])の[[トランス活性化]]を介した[[分裂促進因子活性化タンパク質キナーゼ]]([[mitogen-activated protein kinase]]、 [[MAPK]])の活性化も報告されている<ref name=ref5><pubmed>10846186</pubmed></ref>。HK-1はサブスタンスPと同様にNK1受容体に対して[[親和性]]が高く、サブスタンスPとほぼ同等の[[Ki]]を示している<ref name=ref6><pubmed>12383518</pubmed></ref>。HK-1に固有の高親和性受容体は見いだされていない。 | ||
== 発現 == | == 発現 == | ||
タキキニンの神経系における発現分布に関しては、サブスタンスPとニューロキニンAは[[中枢神経系]]および[[末梢神経系]]ニューロンに、ニューロキニンBは脊髄および[[大脳]]を含む中枢神経系のニューロンに発現している。タキキニンは従来神経細胞由来と考えられてきたが、現在は神経細胞だけでなく、末梢の非神経細胞にも発現していることが分かっている。例えば、サブスタンスPは[[wikipedia:ja:血管内皮細胞|血管内皮細胞]]や種々の[[wikipedia:ja:免疫細胞|免疫細胞]]、[[wikipedia:ja:線維芽細胞|線維芽細胞]]、ニューロキニンBは[[wikipedia:ja:胎盤組織|胎盤組織]]<ref name=ref3 />、HK-1は[[心]]、[[肺]]、[[骨格筋]]、[[皮膚]]などの末梢組織に主に分布している<ref name=ref6 /> <ref name=ref7><pubmed>12716968</pubmed></ref>。HK-1はマウス[[wikipedia:ja:pre-B細胞|pre-B細胞]]の成熟に対し[[自己分泌]]分子として働く他、[[wikipedia:ja:T細胞|T細胞]]の成熟や女性[[wikipedia:ja:生殖器|生殖器]]機能にも関与している<ref name=ref8><pubmed>14723970</pubmed></ref>。 | タキキニンの神経系における発現分布に関しては、サブスタンスPとニューロキニンAは[[中枢神経系]]および[[末梢神経系]]ニューロンに、ニューロキニンBは脊髄および[[大脳]]を含む中枢神経系のニューロンに発現している。タキキニンは従来神経細胞由来と考えられてきたが、現在は神経細胞だけでなく、末梢の非神経細胞にも発現していることが分かっている。例えば、サブスタンスPは[[wikipedia:ja:血管内皮細胞|血管内皮細胞]]や種々の[[wikipedia:ja:免疫細胞|免疫細胞]]、[[wikipedia:ja:線維芽細胞|線維芽細胞]]、ニューロキニンBは[[wikipedia:ja:胎盤組織|胎盤組織]]<ref name=ref3 />、HK-1は[[心]]、[[肺]]、[[骨格筋]]、[[皮膚]]などの末梢組織に主に分布している<ref name=ref6 /> <ref name=ref7><pubmed>12716968</pubmed></ref>。HK-1はマウス[[wikipedia:ja:pre-B細胞|pre-B細胞]]の成熟に対し[[自己分泌]]分子として働く他、[[wikipedia:ja:T細胞|T細胞]]の成熟や女性[[wikipedia:ja:生殖器|生殖器]]機能にも関与している<ref name=ref8><pubmed>14723970</pubmed></ref>。 | ||
タキキニン受容体の組織分布に関しては、NK1受容体は中枢神経系([[海馬]]、[[扁桃体]]、[[青斑核]]、[[嗅球]]、[[線条体]]、[[孤束核]]、[[側坐核]]、脊髄など)と末梢組織(膀胱、副腎、腸管など)、NK2受容体は末梢組織(膀胱、輸精管、腸管など)、NK3受容体は中枢神経系(視床下部、[[大脳皮質]]、嗅球、孤束核、脊髄など)に分布している<ref name=ref9><pubmed>7814667</pubmed></ref> <ref name=ref10><pubmed>8788251</pubmed></ref>。 | |||
== 機能 == | == 機能 == | ||
ニューロンにおいて、様々なチャネルの修飾機構が報告されている。[[前脳基底野]]細胞では、[[Gq/11]]および[[ホスホリパーゼCβ-1]]([[PLCβ-1]])を細胞内情報伝達系として、サブスタンスPは[[内向き整流性カリウムチャネル]]を抑制し、脱分極をおこす<ref name=ref11><pubmed>8890327</pubmed></ref>。[[ラット]][[上頸神経節]]細胞では、サブスタンスPが電位非依存性に[[N型カルシウムチャネル]]を抑制するが<ref name=ref12><pubmed>19858358</pubmed></ref>、チャネルを構成する[[CaVβサブユニット | ニューロンにおいて、様々なチャネルの修飾機構が報告されている。[[前脳基底野]]細胞では、[[Gq/11]]および[[ホスホリパーゼCβ-1]]([[PLCβ-1]])を細胞内情報伝達系として、サブスタンスPは[[内向き整流性カリウムチャネル]]を抑制し、脱分極をおこす<ref name=ref11><pubmed>8890327</pubmed></ref>。[[ラット]][[上頸神経節]]細胞では、サブスタンスPが電位非依存性に[[N型カルシウムチャネル]]を抑制するが<ref name=ref12><pubmed>19858358</pubmed></ref>、チャネルを構成する[[CaVβサブユニット]]の種類によっては、サブスタンスPが[[N電流]]を増強する報告もある<ref name=ref13><pubmed>7678964</pubmed></ref>。ラット[[舌下運動神経]]およびラット[[延髄]][[pre-Bötzinger複合体]][[吸気ニューロン]]では、サブスタンスPは[[two-pore domainカリウムチャネル]]1つである[[TASK-1]]を抑制する<ref name=ref14><pubmed>10719894</pubmed></ref> <ref name=ref15><pubmed>20335463</pubmed></ref> <ref name=ref16><pubmed>19321769</pubmed></ref>。TASK-1を介した[[リーク電流]]は、これらのニューロンにおいて[[静止膜電位]]の形成やリズムの制御に関わっている。Von EulerとGaddumが見出したサブスタンスPによる血圧下降作用は、血管内皮細胞のNK1受容体刺激を介して産生された[[一酸化窒素]]によって、細動脈平滑筋が弛緩したことによると考えられている<ref name=ref17><pubmed> 2479442</pubmed></ref>。 | ||
==不活化機構== | ==不活化機構== | ||
[[ネプリライシン]]([[neprilysin]] | [[ネプリライシン]]([[neprilysin]])EC 3.4.24.11、別名[[エンケファリナーゼ]]([[enkephalinase]])、[[アミノペプチダーゼN]]([[aminopeptidase N]] EC 3.4.11.2)や[[ペプチジルジペプチダーゼA]] ([[peptidyl dipeptidase A]] EC 3.4.15.1、別名[[アンギオテンシン変換酵素]] ([[angiotensin converting enzyme]])など複数の酵素で分解されて不活性化される<ref name=ref1><pubmed>7682720</pubmed></ref><ref name=ref2><pubmed>7529113</pubmed></ref>。 | ||
== 疾患との関連 == | == 疾患との関連 == | ||
=== 疼痛 === | === 疼痛 === | ||
サブスタンスPは侵害刺激を伝える[[一次求心性ニューロン]]の一部に含まれ、サブスタンスP陽性細胞は[[後根神経細胞]]の約30%を占める<ref name=ref18><pubmed>9581756</pubmed></ref>。サブスタンスP陽性細胞の約80%に[[TRPV1受容体]]が発現している<ref name=ref19><pubmed>10103088</pubmed></ref>。[[神経成長因子]]([[NGF]])を過剰発現させた[[トランスジェニックマウス]]では脊髄後角でサブスタンスPの発現が増加し、[[痛覚過敏]](hyperalgesia)を示す<ref name=ref20><pubmed>10199622</pubmed></ref> | サブスタンスPは侵害刺激を伝える[[一次求心性ニューロン]]の一部に含まれ、サブスタンスP陽性細胞は[[後根神経細胞]]の約30%を占める<ref name=ref18><pubmed>9581756</pubmed></ref>。サブスタンスP陽性細胞の約80%に[[TRPV1受容体]]が発現している<ref name=ref19><pubmed>10103088</pubmed></ref>。[[神経成長因子]]([[NGF]])を過剰発現させた[[トランスジェニックマウス]]では脊髄後角でサブスタンスPの発現が増加し、[[痛覚過敏]](hyperalgesia)を示す<ref name=ref20><pubmed>10199622</pubmed></ref>。NK1とNK2受容体は一次求心性ニューロンと脊髄後角ニューロンに発現している。従って、神経刺激等によって一次求心性神経末端で放出されたサブスタンスPは、後角ニューロンに作用するだけでなく、自己あるいは[[傍分泌]]様式で一次求心性ニューロン自身のNK1受容体に作用し、共発現しているTRPV1の活性を増強させ、痛覚過敏に関与すると考えられている<ref name=ref21><pubmed>17978048</pubmed></ref>。 | ||
NK1受容体[[遺伝子欠失マウス|遺伝子ホモ欠失マウス]]では、通常の痛覚反応はあるが、強い侵害刺激に対する反応が減弱している<ref name=ref22><pubmed>9537323</pubmed></ref>。神経障害によって、通常では[[触覚]]を伝達する[[Aβ線維]]においてサブスタンスPが発現してくることから<ref name=ref23><pubmed>21872992</pubmed></ref>、この変化も[[神経障害性疼痛]]の発症機序の一部に関与していると考えられる。 | |||
脊髄後角のNK1発現ニューロンは高次脳部位へ投射し、[[脳幹]]の下行性経路を介して脊髄の興奮性を制御する<ref name=ref24><pubmed>12402039</pubmed></ref>。一方、[[青斑核]]を起始とする下行性[[ノルアドレナリン]]含有神経は[[痛覚抑制系]]として作用しているが、青斑核細胞はNK1受容体を発現しており、サブスタンスPの青斑核への局所投与は一過性の鎮痛をおこす<ref name=ref25><pubmed>22188400</pubmed></ref>。現在のところ、[[鎮痛薬]]として臨床応用されているタキキニン受容体拮抗薬はない。 | |||
=== 神経原性炎症 === | === 神経原性炎症 === | ||
サブスタンスPおよびニューロキニンAは[[三叉神経節]]、[[後根神経節]]や[[迷走神経]][[節状神経節]]などの一次知覚ニューロンの一部に含まれており、これらのニューロンの末梢側および中枢側神経終末から放出される。一次求心性神経における[[活動電位]]の逆行性伝導や末梢側終末に発現するTRPV1の活性化などに伴って、末梢側神経終末から放出されたサブスタンスPやニューロキニンAは、細動脈の拡張、[[wikipedia:ja:血漿|血漿]]成分の血管外漏出、顆粒球の浸潤などを含む、[[神経原性炎症]]を惹起すると考えられている<ref name=ref3 /> <ref name=ref26><pubmed>22837035</pubmed></ref>。Tac-1欠損マウスでは、神経原性炎症が抑制される<ref name=ref27><pubmed>9537322</pubmed></ref>。[[wikipedia:ja:好中球|好中球]]、[[wikipedia:ja:マクロファージ|マクロファージ]]、[[wikipedia:ja:樹状細胞|樹状細胞]]および[[wikipedia:ja:Tリンパ球|Tリンパ球]] | サブスタンスPおよびニューロキニンAは[[三叉神経節]]、[[後根神経節]]や[[迷走神経]][[節状神経節]]などの一次知覚ニューロンの一部に含まれており、これらのニューロンの末梢側および中枢側神経終末から放出される。一次求心性神経における[[活動電位]]の逆行性伝導や末梢側終末に発現するTRPV1の活性化などに伴って、末梢側神経終末から放出されたサブスタンスPやニューロキニンAは、細動脈の拡張、[[wikipedia:ja:血漿|血漿]]成分の血管外漏出、顆粒球の浸潤などを含む、[[神経原性炎症]]を惹起すると考えられている<ref name=ref3 /> <ref name=ref26><pubmed>22837035</pubmed></ref>。Tac-1欠損マウスでは、神経原性炎症が抑制される<ref name=ref27><pubmed>9537322</pubmed></ref>。[[wikipedia:ja:好中球|好中球]]、[[wikipedia:ja:マクロファージ|マクロファージ]]、[[wikipedia:ja:樹状細胞|樹状細胞]]および[[wikipedia:ja:Tリンパ球|Tリンパ球]]には、サブスタンスPおよびNK1受容体が発現していることが報告されており、サブスタンスP刺激によって炎症を促進する[[サイトカイン]]などが放出され、炎症反応が起きると考えられている。 | ||
=== 化学療法誘発性嘔気・嘔吐 === | === 化学療法誘発性嘔気・嘔吐 === | ||
脳幹部にある[[孤束核]]は迷走神経の求心性入力および他の脳部位からの入力を受けて情報を統合し、[[嘔吐反射]] | 脳幹部にある[[孤束核]]は迷走神経の求心性入力および他の脳部位からの入力を受けて情報を統合し、[[嘔吐反射]]の遠心路に関連する部位に出力している。NK1受容体は孤束核に分布しており、サブスタンスPは孤束核ニューロンの自発発火を増強するが、この効果はNK1受容体拮抗薬で抑制される<ref name=ref28><pubmed>10214984</pubmed></ref>。孤束核は、[[制吐薬]]としてのNK1受容体拮抗薬の主な標的と考えられている<ref name=ref29><pubmed>19454547</pubmed></ref>。中枢作用に加えて、腸管の迷走神経終末に分布する末梢のNK1受容体も治療効果に関与していると考えられている<ref name=ref29 />。[[wikipedia:ja:シスプラチン|シスプラチン]]等の[[wikipedia:ja:抗がん薬|抗がん薬]]で誘発される嘔気嘔吐を抑制する効果に関して、[[セロトニン]][[5-HT3受容体|5-HT<sub>3</sub>受容体]]拮抗薬と[[ステロイド]]を組み合わせた治療法に比べ、非ペプチド性経口NK1受容体拮抗薬[[wikipedia:Aprepitant|aprepitant]]を加えた3薬併用療法の優位性が認められており<ref name=ref30><pubmed>14746859</pubmed></ref>、現在臨床応用されている。 | ||
=== 精神疾患 === | === 精神疾患 === | ||
上位中枢神経系において[[情動]] | 上位中枢神経系において[[情動]]や[[不安恐怖反応]]に関与すると考えられている[[中隔野]]、[[海馬]]、[[扁桃体]]、[[視床下部]]、あるいは[[中脳中心灰白質]]にNK1とNK3受容体が豊富に存在している<ref name=ref9 /> <ref name=ref10 />。 | ||
ラットに[[拘束ストレス]]を負荷したり、[[高架台]]に乗せると、[[扁桃体内側核]] | ラットに[[拘束ストレス]]を負荷したり、[[高架台]]に乗せると、[[扁桃体内側核]]のサブスタンスP放出が上昇し、同部位へNK1受容体拮抗薬を微量投与すると、[[不安関連行動]]が減弱する<ref name=ref31><pubmed>15024126</pubmed></ref>。新生仔に[[母仔分離ストレス]]を与えると[[扁桃体前部基底外側核]]においてNK1受容体の[[細胞内取り込み]](internalization)がおきることから、内因性サブスタンスP放出の増加が示唆される<ref name=ref32><pubmed>9733503</pubmed></ref>。一方、抗不安薬をラットに投与すると海馬と中脳中心灰白質においてサブスタンスPの合成が減少する<ref name=ref33><pubmed>7518054</pubmed></ref>。NK1受容体遺伝子ホモ欠失マウスでは、[[高架式十字迷路]]試験において、不安関連行動および血清[[コルチゾール]]上昇の減少が観察され、伴って[[背側縫線核]]セロトニンニューロンの発火頻度が増加する<ref name=ref34><pubmed>11172050</pubmed></ref>。[[居住者-侵入者試験]]では[[攻撃性]]が減少する<ref name=ref22 />。不安及び[[うつ症状]]に対するNK1拮抗薬の臨床応用に関しては、まだ上市されている薬物はない。 | ||
サブスタンスP- | サブスタンスP-NK1神経系は[[薬物依存]]や[[報酬系]]にも関わっている。[[オピオイド]]の報酬効果に関しては、[[条件付け場所嗜好性試験]]において、NK1受容体遺伝子ホモ欠失マウスでは[[モルヒネ]]による場所嗜好性の獲得が抑制され、離脱症状の一部も減少する<ref name=ref35><pubmed>10821273</pubmed></ref>。[[コカイン]]や食物の嗜好性は影響を受けないという<ref name=ref35 />。ラットにおける[[ヘロイン]]の自己投与や消費の動機付けがNK1受容体拮抗薬で抑制される<ref name=ref36><pubmed>23303056</pubmed></ref>。またヘロインの投与で[[前頭前野]]と[[側坐核]]でNK1受容体の増加が見られている<ref name=ref36 />。 | ||
[[アルコール]] | [[アルコール]]に関しては、NK1受容体遺伝子ホモ欠失マウスでは自発的アルコール摂取の増加が抑制され、[[アルコール依存症]]患者ではNK1受容体拮抗薬の投与でアルコールに対する欲求が改善している<ref name=ref37><pubmed>18276852</pubmed></ref>。健常者を対象にした[[機能的磁気共鳴撮像法]]による研究では、[[報酬予測]]時の側坐核の脳活動([[BOLD信号]])が、NK1受容体拮抗薬の単回投与により[[プラセボ]]と比較して有意に減少することが観察される<ref name=ref38><pubmed>23406545</pubmed></ref>。 | ||
=== 性腺機能不全症 === | === 性腺機能不全症 === | ||
ニューロキニンBおよびNK3の遺伝子変異(機能欠損)による[[家族性低ゴナドトロピン性性腺機能不全症]]が報告されている<ref name=ref39><pubmed>19079066</pubmed></ref>。視床下部において、[[弓状核]]の[[キスペプチン]](kisspeptin)含有ニューロンは、視索前核の[[性腺刺激ホルモン放出ホルモン]]([[GnRH]]) | |||
[[正中隆起]]の[[性腺刺激ホルモン放出ホルモン]]([[GnRH]])含有ニューロンを直接神経支配し、GnRHのパルス状の放出に関与している。このkisspeptinを含有する漏斗・弓状核細胞の一群では、ニューロキニンBおよび[[ダイノルフィン]]を含有し、NK3受容体も発現している。ニューロキニンBは自己あるいは傍分泌によってキスペプチン分泌を刺激しているので、ニューロキニンBあるいはNK3の機能欠損によって、キスペプチン含有ニューロンの機能不全とそれに起因する正中隆起細胞からのGnRH分泌障害が起きると考えられている<ref name=ref40><pubmed>24615662</pubmed></ref>。 | |||
==関連項目== | ==関連項目== | ||
| 159行目: | 161行目: | ||
== 参考文献 == | == 参考文献 == | ||
<references / > | |||
2015年8月26日 (水) 17:18時点における版
鈴木 秀典
日本医科大学大学院医学研究科 薬理学分野
DOI:10.14931/bsd.6219 原稿受付日:2015年8月4日 原稿完成日:2015年月日
担当編集委員:和田 圭司(国立研究開発法人国立精神・神経医療研究センター)
英語名:substance P 英略語:SP
同義語:P物質
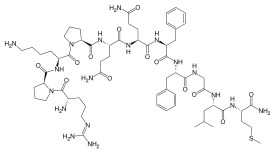
サブスタンスPは、11個のアミノ酸からなる神経ペプチドである。類似の構造を持つペプチドと共に、タキキニンtachykininsと総称される。サブスタンスPに高親和性を持つNK1受容体を介して、様々な細胞内情報伝達系を活性化し、複数のイオンチャネルを修飾する。サブスタンスPおよびNK1受容体は、神経細胞だけでなく、末梢の非神経細胞にも発現している。従って痛覚、神経原性炎症、情動、報酬系等、広範囲な生理機能と疾患病態に関与している。
| サブスタンスP | |
|---|---|
| |
| Identifiers | |
| 33507-63-0 | |
| ChEMBL | ChEMBL235363 |
| ChemSpider | 33558 |
| |
| 2098 | |
| MeSH | Substance+P |
| PubChem | 36511 |
| UNII | 675VGV5J1D |
| Properties | |
| Molar mass | 1347.63 g/mol |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
| タキキニン前駆体1 (TAC1) | |
|---|---|
| Identifiers | |
| Symbol | TAC1 |
| Alt. symbols | TAC2, NKNA |
| Entrez | 6863 |
| HUGO | 11517 |
| OMIM | 162320 |
| RefSeq | NM_003182 |
| UniProt | P20366 |
| Other data | |
| Locus | Chr. 7 q21-q22 |
サブスタンスPとは
サブスタンスPとはウマの脳および腸管に存在し、血圧を下降させ、平滑筋を収縮させる物質として、1931年にvon EulerとGaddumによって見出された[1]。1971年に単離され、11個のアミノ酸からなる神経ペプチドであることが明らかになった。1974年に大塚らによって[2]、サブスタンスPが新生ラット脊髄ニューロンに対して興奮性作用を持つことが報告され、ペプチド性物質が哺乳類において神経伝達物質として機能している可能性が初めて示された。サブスタンスPは一次求心性ニューロンの一部に含まれ、刺激に応じて脊髄後角において神経終末のシナプス小胞から放出され、脊髄ニューロンに時間経過の遅い脱分極をひきおこす。
ファミリー
サブスタンスPはタキキニンファミリーに属している。同じファミリーには、ニューロキニンA(neurokinin A; NKA)、ニューロキニンB(neurokinin B; NKB)、ヘモキニン-1(hemokinin-1; HK-1)などが含まれ、そのC末端に共通のアミノ酸配列、-Phe-X-Gly-Leu-Met-NH2を持っている。サブスタンスP、ニューロキニンA、ニューロキニンBは哺乳類でアミノ酸全配列が共通であるが、ヘモキニン-1はヒトとマウス/ラット間で配列に違いがある(表1)。ヒトでは、Tac1遺伝子から選択的スプライシングによって、α, β, γ, δTac1 mRNAスプライスバリアントが生成され、それぞれのmRNAから翻訳された前駆体タンパク質がプロッセッシングを受け、サブスタンスPが切り出される。
ニューロキニンAもTac1遺伝子に由来するが、β, γTac1 mRNAから翻訳される。ニューロキニンBはTac3遺伝子、HK-1は、C末端にタキキニン共通のアミノ酸配列を持つエンドキニンAおよびBと共にTac4遺伝子にコードされている[3]。
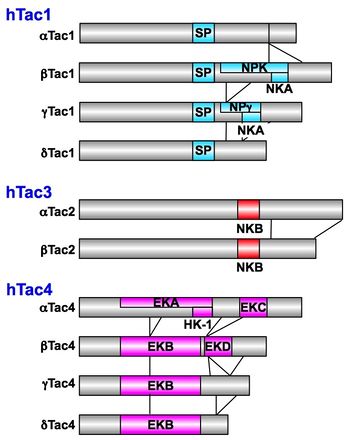
SP: サブスタンスP、NPK: ニューロペプチドK、NKA: ニューロキニンA、NPγ: ニューロペプチドγ、NKB: ニューロキニンB、EKA: エンドキニンA、 EKB: エンドキニンB、EKC: エンドキニンC、EKD: エンドキニンD、HK−1: ヘモキニン-1
サブスタンスP、ニューロキニンA、ニューロキニンBのC末端のそれぞれ6、7、8個以上のアミノ酸を含むペプチドは、受容体に対し、完全長のペプチドとほぼ同等の活性を示すが、N末端フラグメントやC末端のアミド基を除いたサブスタンスP free acidは活性がない[4]。
| タキキニン | 配列 | 遺伝子 | mRNAスプライスバリアント |
| サブスタンスP | Arg-Pro-Lys-Pro-Gln-Gln-Phe-Phe-Gly-Leu-Met-NH2 | Tac1 | α、β、γ、δTac1 |
| ニューロキニンA | His-Lys-Thr-Asp-Ser-Phe-Val-Gly-Leu-Met-NH2 | β、γTac1 | |
| ニューロキニンB | Asp-Met-His-Asp-Phe-Phe-Val-Gly-Leu-Met-NH2 | Tac3 | α、βTac3 |
| マウス・ヘモキニン-1 | Arg-Ser-Arg-Thr-Arg-Gln-Phe-Tyr-Gly-Leu-Met-NH2 | Tac4 | Tac4 |
| ヒト・ヘモキニン-1 | Thr-Gly-Lys-Ala-Ser-Gln-Phe-Phe- Gly-Leu-Met-NH2 | αTac4 | |
| ヒト・エンドキニンA | –Gly-Lys-Ala-Ser-Gln-Phe-Phe-Gly-Leu-Met-NH2 | αTac4 | |
| ヒト・エンドキニンB | β、γ、δTac4 |
注)ヒト・エンドキニンAとBはそれぞれ全長47、41アミノ酸の内、C末端の10アミノ酸のみ示している。赤字は共通配列。
受容体
哺乳類のタキキニン受容体はGタンパク質共役型受容体で、中西らによってNK1、NK2、NK3の3種類がクローニングされ、それぞれSP、ニューロキニンA、ニューロキニンBが高い親和性を持っている[5]。NK1受容体の細胞内情報伝達経路は当初考えられていた以上に多岐に亘っている[3]。Ca2+/リン脂質依存性タンパク質リン酸化酵素(protein kinase C, PKC)、cAMP依存性タンパク質リン酸化酵素(protein kinase A, PKA)、ホスホリパーゼA2(phospholipase A2)の活性化だけでなく、Rho-ROCK経路を介したミオシン軽鎖キナーゼ(myosin light chain kinase)のリン酸化や上皮成長因子受容体(epidermal growth factor receptor, EGFR)のトランス活性化を介した分裂促進因子活性化タンパク質キナーゼ(mitogen-activated protein kinase、 MAPK)の活性化も報告されている[6]。HK-1はサブスタンスPと同様にNK1受容体に対して親和性が高く、サブスタンスPとほぼ同等のKiを示している[7]。HK-1に固有の高親和性受容体は見いだされていない。
発現
タキキニンの神経系における発現分布に関しては、サブスタンスPとニューロキニンAは中枢神経系および末梢神経系ニューロンに、ニューロキニンBは脊髄および大脳を含む中枢神経系のニューロンに発現している。タキキニンは従来神経細胞由来と考えられてきたが、現在は神経細胞だけでなく、末梢の非神経細胞にも発現していることが分かっている。例えば、サブスタンスPは血管内皮細胞や種々の免疫細胞、線維芽細胞、ニューロキニンBは胎盤組織[3]、HK-1は心、肺、骨格筋、皮膚などの末梢組織に主に分布している[7] [8]。HK-1はマウスpre-B細胞の成熟に対し自己分泌分子として働く他、T細胞の成熟や女性生殖器機能にも関与している[9]。
タキキニン受容体の組織分布に関しては、NK1受容体は中枢神経系(海馬、扁桃体、青斑核、嗅球、線条体、孤束核、側坐核、脊髄など)と末梢組織(膀胱、副腎、腸管など)、NK2受容体は末梢組織(膀胱、輸精管、腸管など)、NK3受容体は中枢神経系(視床下部、大脳皮質、嗅球、孤束核、脊髄など)に分布している[10] [11]。
機能
ニューロンにおいて、様々なチャネルの修飾機構が報告されている。前脳基底野細胞では、Gq/11およびホスホリパーゼCβ-1(PLCβ-1)を細胞内情報伝達系として、サブスタンスPは内向き整流性カリウムチャネルを抑制し、脱分極をおこす[12]。ラット上頸神経節細胞では、サブスタンスPが電位非依存性にN型カルシウムチャネルを抑制するが[13]、チャネルを構成するCaVβサブユニットの種類によっては、サブスタンスPがN電流を増強する報告もある[14]。ラット舌下運動神経およびラット延髄pre-Bötzinger複合体吸気ニューロンでは、サブスタンスPはtwo-pore domainカリウムチャネル1つであるTASK-1を抑制する[15] [16] [17]。TASK-1を介したリーク電流は、これらのニューロンにおいて静止膜電位の形成やリズムの制御に関わっている。Von EulerとGaddumが見出したサブスタンスPによる血圧下降作用は、血管内皮細胞のNK1受容体刺激を介して産生された一酸化窒素によって、細動脈平滑筋が弛緩したことによると考えられている[18]。
不活化機構
ネプリライシン(neprilysin)EC 3.4.24.11、別名エンケファリナーゼ(enkephalinase)、アミノペプチダーゼN(aminopeptidase N EC 3.4.11.2)やペプチジルジペプチダーゼA (peptidyl dipeptidase A EC 3.4.15.1、別名アンギオテンシン変換酵素 (angiotensin converting enzyme)など複数の酵素で分解されて不活性化される[4][19]。
疾患との関連
疼痛
サブスタンスPは侵害刺激を伝える一次求心性ニューロンの一部に含まれ、サブスタンスP陽性細胞は後根神経細胞の約30%を占める[20]。サブスタンスP陽性細胞の約80%にTRPV1受容体が発現している[21]。神経成長因子(NGF)を過剰発現させたトランスジェニックマウスでは脊髄後角でサブスタンスPの発現が増加し、痛覚過敏(hyperalgesia)を示す[22]。NK1とNK2受容体は一次求心性ニューロンと脊髄後角ニューロンに発現している。従って、神経刺激等によって一次求心性神経末端で放出されたサブスタンスPは、後角ニューロンに作用するだけでなく、自己あるいは傍分泌様式で一次求心性ニューロン自身のNK1受容体に作用し、共発現しているTRPV1の活性を増強させ、痛覚過敏に関与すると考えられている[23]。
NK1受容体遺伝子ホモ欠失マウスでは、通常の痛覚反応はあるが、強い侵害刺激に対する反応が減弱している[24]。神経障害によって、通常では触覚を伝達するAβ線維においてサブスタンスPが発現してくることから[25]、この変化も神経障害性疼痛の発症機序の一部に関与していると考えられる。
脊髄後角のNK1発現ニューロンは高次脳部位へ投射し、脳幹の下行性経路を介して脊髄の興奮性を制御する[26]。一方、青斑核を起始とする下行性ノルアドレナリン含有神経は痛覚抑制系として作用しているが、青斑核細胞はNK1受容体を発現しており、サブスタンスPの青斑核への局所投与は一過性の鎮痛をおこす[27]。現在のところ、鎮痛薬として臨床応用されているタキキニン受容体拮抗薬はない。
神経原性炎症
サブスタンスPおよびニューロキニンAは三叉神経節、後根神経節や迷走神経節状神経節などの一次知覚ニューロンの一部に含まれており、これらのニューロンの末梢側および中枢側神経終末から放出される。一次求心性神経における活動電位の逆行性伝導や末梢側終末に発現するTRPV1の活性化などに伴って、末梢側神経終末から放出されたサブスタンスPやニューロキニンAは、細動脈の拡張、血漿成分の血管外漏出、顆粒球の浸潤などを含む、神経原性炎症を惹起すると考えられている[3] [28]。Tac-1欠損マウスでは、神経原性炎症が抑制される[29]。好中球、マクロファージ、樹状細胞およびTリンパ球には、サブスタンスPおよびNK1受容体が発現していることが報告されており、サブスタンスP刺激によって炎症を促進するサイトカインなどが放出され、炎症反応が起きると考えられている。
化学療法誘発性嘔気・嘔吐
脳幹部にある孤束核は迷走神経の求心性入力および他の脳部位からの入力を受けて情報を統合し、嘔吐反射の遠心路に関連する部位に出力している。NK1受容体は孤束核に分布しており、サブスタンスPは孤束核ニューロンの自発発火を増強するが、この効果はNK1受容体拮抗薬で抑制される[30]。孤束核は、制吐薬としてのNK1受容体拮抗薬の主な標的と考えられている[31]。中枢作用に加えて、腸管の迷走神経終末に分布する末梢のNK1受容体も治療効果に関与していると考えられている[31]。シスプラチン等の抗がん薬で誘発される嘔気嘔吐を抑制する効果に関して、セロトニン5-HT3受容体拮抗薬とステロイドを組み合わせた治療法に比べ、非ペプチド性経口NK1受容体拮抗薬aprepitantを加えた3薬併用療法の優位性が認められており[32]、現在臨床応用されている。
精神疾患
上位中枢神経系において情動や不安恐怖反応に関与すると考えられている中隔野、海馬、扁桃体、視床下部、あるいは中脳中心灰白質にNK1とNK3受容体が豊富に存在している[10] [11]。
ラットに拘束ストレスを負荷したり、高架台に乗せると、扁桃体内側核のサブスタンスP放出が上昇し、同部位へNK1受容体拮抗薬を微量投与すると、不安関連行動が減弱する[33]。新生仔に母仔分離ストレスを与えると扁桃体前部基底外側核においてNK1受容体の細胞内取り込み(internalization)がおきることから、内因性サブスタンスP放出の増加が示唆される[34]。一方、抗不安薬をラットに投与すると海馬と中脳中心灰白質においてサブスタンスPの合成が減少する[35]。NK1受容体遺伝子ホモ欠失マウスでは、高架式十字迷路試験において、不安関連行動および血清コルチゾール上昇の減少が観察され、伴って背側縫線核セロトニンニューロンの発火頻度が増加する[36]。居住者-侵入者試験では攻撃性が減少する[24]。不安及びうつ症状に対するNK1拮抗薬の臨床応用に関しては、まだ上市されている薬物はない。
サブスタンスP-NK1神経系は薬物依存や報酬系にも関わっている。オピオイドの報酬効果に関しては、条件付け場所嗜好性試験において、NK1受容体遺伝子ホモ欠失マウスではモルヒネによる場所嗜好性の獲得が抑制され、離脱症状の一部も減少する[37]。コカインや食物の嗜好性は影響を受けないという[37]。ラットにおけるヘロインの自己投与や消費の動機付けがNK1受容体拮抗薬で抑制される[38]。またヘロインの投与で前頭前野と側坐核でNK1受容体の増加が見られている[38]。
アルコールに関しては、NK1受容体遺伝子ホモ欠失マウスでは自発的アルコール摂取の増加が抑制され、アルコール依存症患者ではNK1受容体拮抗薬の投与でアルコールに対する欲求が改善している[39]。健常者を対象にした機能的磁気共鳴撮像法による研究では、報酬予測時の側坐核の脳活動(BOLD信号)が、NK1受容体拮抗薬の単回投与によりプラセボと比較して有意に減少することが観察される[40]。
性腺機能不全症
ニューロキニンBおよびNK3の遺伝子変異(機能欠損)による家族性低ゴナドトロピン性性腺機能不全症が報告されている[41]。視床下部において、弓状核のキスペプチン(kisspeptin)含有ニューロンは、視索前核の性腺刺激ホルモン放出ホルモン(GnRH)
正中隆起の性腺刺激ホルモン放出ホルモン(GnRH)含有ニューロンを直接神経支配し、GnRHのパルス状の放出に関与している。このkisspeptinを含有する漏斗・弓状核細胞の一群では、ニューロキニンBおよびダイノルフィンを含有し、NK3受容体も発現している。ニューロキニンBは自己あるいは傍分泌によってキスペプチン分泌を刺激しているので、ニューロキニンBあるいはNK3の機能欠損によって、キスペプチン含有ニューロンの機能不全とそれに起因する正中隆起細胞からのGnRH分泌障害が起きると考えられている[42]。
関連項目
参考文献
<references / >
- ↑
V Euler, U.S., & Gaddum, J.H. (1931).
An unidentified depressor substance in certain tissue extracts. The Journal of physiology, 72(1), 74-87. [PubMed:16994201] [PMC] [WorldCat] [DOI] - ↑
Konishi, S., & Otsuka, M. (1974).
Excitatory action of hypothalamic substance P on spinal motoneurones of newborn rats. Nature, 252(5485), 734-5. [PubMed:4373657] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2 3.3
Steinhoff, M.S., von Mentzer, B., Geppetti, P., Pothoulakis, C., & Bunnett, N.W. (2014).
Tachykinins and their receptors: contributions to physiological control and the mechanisms of disease. Physiological reviews, 94(1), 265-301. [PubMed:24382888] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1
Otsuka, M., & Yoshioka, K. (1993).
Neurotransmitter functions of mammalian tachykinins. Physiological reviews, 73(2), 229-308. [PubMed:7682720] [WorldCat] [DOI] - ↑
Nakanishi, S. (1991).
Mammalian tachykinin receptors. Annual review of neuroscience, 14, 123-36. [PubMed:1851606] [WorldCat] [DOI] - ↑
Castagliuolo, I., Valenick, L., Liu, J., & Pothoulakis, C. (2000).
Epidermal growth factor receptor transactivation mediates substance P-induced mitogenic responses in U-373 MG cells. The Journal of biological chemistry, 275(34), 26545-50. [PubMed:10846186] [WorldCat] [DOI] - ↑ 7.0 7.1
Kurtz, M.M., Wang, R., Clements, M.K., Cascieri, M.A., Austin, C.P., Cunningham, B.R., ..., & Liu, Q. (2002).
Identification, localization and receptor characterization of novel mammalian substance P-like peptides. Gene, 296(1-2), 205-12. [PubMed:12383518] [WorldCat] [DOI] - ↑
Page, N.M., Bell, N.J., Gardiner, S.M., Manyonda, I.T., Brayley, K.J., Strange, P.G., & Lowry, P.J. (2003).
Characterization of the endokinins: human tachykinins with cardiovascular activity. Proceedings of the National Academy of Sciences of the United States of America, 100(10), 6245-50. [PubMed:12716968] [PMC] [WorldCat] [DOI] - ↑
Patacchini, R., Lecci, A., Holzer, P., & Maggi, C.A. (2004).
Newly discovered tachykinins raise new questions about their peripheral roles and the tachykinin nomenclature. Trends in pharmacological sciences, 25(1), 1-3. [PubMed:14723970] [WorldCat] [DOI] - ↑ 10.0 10.1
Nakaya, Y., Kaneko, T., Shigemoto, R., Nakanishi, S., & Mizuno, N. (1994).
Immunohistochemical localization of substance P receptor in the central nervous system of the adult rat. The Journal of comparative neurology, 347(2), 249-74. [PubMed:7814667] [WorldCat] [DOI] - ↑ 11.0 11.1
Ding, Y.Q., Shigemoto, R., Takada, M., Ohishi, H., Nakanishi, S., & Mizuno, N. (1996).
Localization of the neuromedin K receptor (NK3) in the central nervous system of the rat. The Journal of comparative neurology, 364(2), 290-310. [PubMed:8788251] [WorldCat] [DOI] - ↑
Takano, K., Yasufuku-Takano, J., Kozasa, T., Singer, W.D., Nakajima, S., & Nakajima, Y. (1996).
Gq/11 and PLC-beta 1 mediate the substance P-induced inhibition of an inward rectifier K+ channel in brain neurons. Journal of neurophysiology, 76(3), 2131-6. [PubMed:8890327] [WorldCat] [DOI] - ↑
Mitra-Ganguli, T., Vitko, I., Perez-Reyes, E., & Rittenhouse, A.R. (2009).
Orientation of palmitoylated CaVbeta2a relative to CaV2.2 is critical for slow pathway modulation of N-type Ca2+ current by tachykinin receptor activation. The Journal of general physiology, 134(5), 385-96. [PubMed:19858358] [PMC] [WorldCat] [DOI] - ↑
Shapiro, M.S., & Hille, B. (1993).
Substance P and somatostatin inhibit calcium channels in rat sympathetic neurons via different G protein pathways. Neuron, 10(1), 11-20. [PubMed:7678964] [WorldCat] [DOI] - ↑
Talley, E.M., Lei, Q., Sirois, J.E., & Bayliss, D.A. (2000).
TASK-1, a two-pore domain K+ channel, is modulated by multiple neurotransmitters in motoneurons. Neuron, 25(2), 399-410. [PubMed:10719894] [WorldCat] [DOI] - ↑
Koizumi, H., Smerin, S.E., Yamanishi, T., Moorjani, B.R., Zhang, R., & Smith, J.C. (2010).
TASK channels contribute to the K+-dominated leak current regulating respiratory rhythm generation in vitro. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(12), 4273-84. [PubMed:20335463] [PMC] [WorldCat] [DOI] - ↑
Ptak, K., Yamanishi, T., Aungst, J., Milescu, L.S., Zhang, R., Richerson, G.B., & Smith, J.C. (2009).
Raphé neurons stimulate respiratory circuit activity by multiple mechanisms via endogenously released serotonin and substance P. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(12), 3720-37. [PubMed:19321769] [PMC] [WorldCat] [DOI] - ↑
Whittle, B.J., Lopez-Belmonte, J., & Rees, D.D. (1989).
Modulation of the vasodepressor actions of acetylcholine, bradykinin, substance P and endothelin in the rat by a specific inhibitor of nitric oxide formation. British journal of pharmacology, 98(2), 646-52. [PubMed:2479442] [PMC] [WorldCat] [DOI] - ↑
Suzuki, H., Yoshioka, K., Yanagisawa, M., Urayama, O., Kurihara, T., Hosoki, R., ..., & Otsuka, M. (1994).
Involvement of enzymatic degradation in the inactivation of tachykinin neurotransmitters in neonatal rat spinal cord. British journal of pharmacology, 113(1), 310-6. [PubMed:7529113] [PMC] [WorldCat] [DOI] - ↑
Snider, W.D., & McMahon, S.B. (1998).
Tackling pain at the source: new ideas about nociceptors. Neuron, 20(4), 629-32. [PubMed:9581756] [WorldCat] [DOI] - ↑
Guo, A., Vulchanova, L., Wang, J., Li, X., & Elde, R. (1999).
Immunocytochemical localization of the vanilloid receptor 1 (VR1): relationship to neuropeptides, the P2X3 purinoceptor and IB4 binding sites. The European journal of neuroscience, 11(3), 946-58. [PubMed:10103088] [WorldCat] [DOI] - ↑
McLeod, A.L., Ritchie, J., Cuello, A.C., Julien, J.P., Ribeiro-Da-Silva, A., & Henry, J.L. (1999).
Transgenic mice over-expressing substance P exhibit allodynia and hyperalgesia which are reversed by substance P and N-methyl-D-aspartate receptor antagonists. Neuroscience, 89(3), 891-9. [PubMed:10199622] [WorldCat] [DOI] - ↑
Zhang, H., Cang, C.L., Kawasaki, Y., Liang, L.L., Zhang, Y.Q., Ji, R.R., & Zhao, Z.Q. (2007).
Neurokinin-1 receptor enhances TRPV1 activity in primary sensory neurons via PKCepsilon: a novel pathway for heat hyperalgesia. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(44), 12067-77. [PubMed:17978048] [PMC] [WorldCat] [DOI] - ↑ 24.0 24.1
De Felipe, C., Herrero, J.F., O'Brien, J.A., Palmer, J.A., Doyle, C.A., Smith, A.J., ..., & Hunt, S.P. (1998).
Altered nociception, analgesia and aggression in mice lacking the receptor for substance P. Nature, 392(6674), 394-7. [PubMed:9537323] [WorldCat] [DOI] - ↑
Nitzan-Luques, A., Devor, M., & Tal, M. (2011).
Genotype-selective phenotypic switch in primary afferent neurons contributes to neuropathic pain. Pain, 152(10), 2413-26. [PubMed:21872992] [WorldCat] [DOI] - ↑
Suzuki, R., Morcuende, S., Webber, M., Hunt, S.P., & Dickenson, A.H. (2002).
Superficial NK1-expressing neurons control spinal excitability through activation of descending pathways. Nature neuroscience, 5(12), 1319-26. [PubMed:12402039] [WorldCat] [DOI] - ↑
Muto, Y., Sakai, A., Sakamoto, A., & Suzuki, H. (2012).
Activation of NK₁ receptors in the locus coeruleus induces analgesia through noradrenergic-mediated descending inhibition in a rat model of neuropathic pain. British journal of pharmacology, 166(3), 1047-57. [PubMed:22188400] [PMC] [WorldCat] [DOI] - ↑
Chiu, I.M., von Hehn, C.A., & Woolf, C.J. (2012).
Neurogenic inflammation and the peripheral nervous system in host defense and immunopathology. Nature neuroscience, 15(8), 1063-7. [PubMed:22837035] [PMC] [WorldCat] [DOI] - ↑
Cao, Y.Q., Mantyh, P.W., Carlson, E.J., Gillespie, A.M., Epstein, C.J., & Basbaum, A.I. (1998).
Primary afferent tachykinins are required to experience moderate to intense pain. Nature, 392(6674), 390-4. [PubMed:9537322] [WorldCat] [DOI] - ↑
Saito, R., Suehiro, Y., Ariumi, H., Migita, K., Hori, N., Hashiguchi, T., ..., & Kamiya, H. (1998).
Anti-emetic effects of a novel NK-1 receptor antagonist HSP-117 in ferrets. Neuroscience letters, 254(3), 169-72. [PubMed:10214984] [WorldCat] [DOI] - ↑ 31.0 31.1
Diemunsch, P., Joshi, G.P., & Brichant, J.F. (2009).
Neurokinin-1 receptor antagonists in the prevention of postoperative nausea and vomiting. British journal of anaesthesia, 103(1), 7-13. [PubMed:19454547] [WorldCat] [DOI] - ↑
de Wit, R., Herrstedt, J., Rapoport, B., Carides, A.D., Guoguang-Ma, J., Elmer, M., ..., & Horgan, K.J. (2004).
The oral NK(1) antagonist, aprepitant, given with standard antiemetics provides protection against nausea and vomiting over multiple cycles of cisplatin-based chemotherapy: a combined analysis of two randomised, placebo-controlled phase III clinical trials. European journal of cancer (Oxford, England : 1990), 40(3), 403-10. [PubMed:14746859] [WorldCat] - ↑
Ebner, K., Rupniak, N.M., Saria, A., & Singewald, N. (2004).
Substance P in the medial amygdala: emotional stress-sensitive release and modulation of anxiety-related behavior in rats. Proceedings of the National Academy of Sciences of the United States of America, 101(12), 4280-5. [PubMed:15024126] [PMC] [WorldCat] [DOI] - ↑
Kramer, M.S., Cutler, N., Feighner, J., Shrivastava, R., Carman, J., Sramek, J.J., ..., & Rupniak, N.M. (1998).
Distinct mechanism for antidepressant activity by blockade of central substance P receptors. Science (New York, N.Y.), 281(5383), 1640-5. [PubMed:9733503] [WorldCat] [DOI] - ↑
Brodin, E., Rosén, A., Schött, E., & Brodin, K. (1994).
Effects of sequential removal of rats from a group cage, and of individual housing of rats, on substance P, cholecystokinin and somatostatin levels in the periaqueductal grey and limbic regions. Neuropeptides, 26(4), 253-60. [PubMed:7518054] [WorldCat] [DOI] - ↑
Santarelli, L., Gobbi, G., Debs, P.C., Sibille, E.T., Blier, P., Hen, R., & Heath, M.J. (2001).
Genetic and pharmacological disruption of neurokinin 1 receptor function decreases anxiety-related behaviors and increases serotonergic function. Proceedings of the National Academy of Sciences of the United States of America, 98(4), 1912-7. [PubMed:11172050] [PMC] [WorldCat] [DOI] - ↑ 37.0 37.1
Murtra, P., Sheasby, A.M., Hunt, S.P., & De Felipe, C. (2000).
Rewarding effects of opiates are absent in mice lacking the receptor for substance P. Nature, 405(6783), 180-3. [PubMed:10821273] [WorldCat] [DOI] - ↑ 38.0 38.1
Barbier, E., Vendruscolo, L.F., Schlosburg, J.E., Edwards, S., Juergens, N., Park, P.E., ..., & Heilig, M. (2013).
The NK1 receptor antagonist L822429 reduces heroin reinforcement. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 38(6), 976-84. [PubMed:23303056] [PMC] [WorldCat] [DOI] - ↑
George, D.T., Gilman, J., Hersh, J., Thorsell, A., Herion, D., Geyer, C., ..., & Heilig, M. (2008).
Neurokinin 1 receptor antagonism as a possible therapy for alcoholism. Science (New York, N.Y.), 319(5869), 1536-9. [PubMed:18276852] [WorldCat] [DOI] - ↑
Saji, K., Ikeda, Y., Kim, W., Shingai, Y., Tateno, A., Takahashi, H., ..., & Suzuki, H. (2013).
Acute NK₁ receptor antagonist administration affects reward incentive anticipation processing in healthy volunteers. The international journal of neuropsychopharmacology, 16(7), 1461-71. [PubMed:23406545] [WorldCat] [DOI] - ↑
Topaloglu, A.K., Reimann, F., Guclu, M., Yalin, A.S., Kotan, L.D., Porter, K.M., ..., & Semple, R.K. (2009).
TAC3 and TACR3 mutations in familial hypogonadotropic hypogonadism reveal a key role for Neurokinin B in the central control of reproduction. Nature genetics, 41(3), 354-358. [PubMed:19079066] [PMC] [WorldCat] [DOI] - ↑
Skorupskaite, K., George, J.T., & Anderson, R.A. (2014).
The kisspeptin-GnRH pathway in human reproductive health and disease. Human reproduction update, 20(4), 485-500. [PubMed:24615662] [PMC] [WorldCat] [DOI]