「神経細胞極性」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の9版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | <div align="right"> | ||
<font size="+1">勝野 弘子、[http://researchmap.jp/read0056281 稲垣 直之 | <font size="+1">勝野 弘子、[http://researchmap.jp/read0056281 稲垣 直之]</font><br> | ||
''奈良先端科学技術大学院大学''<br> | '' 奈良先端科学技術大学院大学''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2016年3月10日 原稿完成日:2016年月日<br> | ||
担当編集委員:[http://researchmap.jp/ | 担当編集委員:[http://researchmap.jp/read0048432 定藤 規弘](自然科学研究機構生理学研究所 大脳皮質機能研究系)<br> | ||
</div> | </div> | ||
英語名:Cell polarity and neuronal polarization | |||
{{box|text= | {{box|text= | ||
細胞極性とは、細胞の構成成分や細胞内小器官などを細胞に非対称的に配置させることにより、その形態や機能に方向性を有することである。例えば、上皮細胞は頂端—基底(apical-basal)軸に沿った極性を持ち、細胞同士が強固に接着してシート構造を作ることで組織と外部環境とを[[隔離]]する役割を果たす。神経細胞もまた極性を持つ細胞であり、一本の長い[[軸索]]と複数の短い樹状突起を伸ばし、高度に発達した細胞極性を形成する。このような神経細胞の極性は、シグナルの入力、統合、出力といった情報処理機能に重要な役割を果たす。これまでに神経細胞の極性化に関与する数多くの分子が同定され、極性化を担う細胞内外のシグナルのクロストーク、対称性の破れ、神経突起伸長のメカニクス、軸索や樹状突起に特異的に存在する分子の細胞内局在メカニズムに関して解析が進みつつある。 | |||
}} | |||
==神経細胞の極性化の過程== | ==神経細胞の極性化の過程== | ||
===軸索と樹状突起=== | ===軸索と樹状突起=== | ||
典型的な神経細胞は、一本の長い軸索と複数本の短い樹状突起を持つ<ref name=ref1><pubmed> 8210176 </pubmed></ref> <ref name=ref2><pubmed> 17311006 </pubmed></ref>。軸索は直径がその先端まであまり変化しないが、樹状突起は先端にゆくにしたがい直径が細くなる。軸索は直角に枝分かれすることが多く、樹上突起はY字型に枝分かれすることが多い。また、軸索と樹状突起では、微小管の配向が異なる。成熟した神経細胞の軸索では、微小管のプラス端が突起の遠位に向かって配向するが、樹状突起ではプラス端が遠位に向かって配向した微小管とマイナス端が遠位に向かった微小管とが混在している<ref><pubmed> 2592416 </pubmed></ref>。さらに、軸索と樹状突起ではタンパク質の分布も異なり<ref name=ref1 />、非リン酸化TauやSynaptophysin、Synapsin-1は軸索特異的に、[[MAP2]] は樹状突起特異的に存在するため、軸索と樹状突起のマーカーとして用いられている。 | |||
===培養神経細胞における極性形成=== | ===培養神経細胞における極性形成=== | ||
[[Image:Tmaeno001.jpg|thumb|350px|'''図1. 培養海馬神経細胞の極性形成過程''' <br />培養海馬神経細胞の極性形成過程は5つのステージに分類される]] | [[Image:Tmaeno001.jpg|thumb|350px|'''図1. 培養海馬神経細胞の極性形成過程''' <br />培養海馬神経細胞の極性形成過程は5つのステージに分類される]] | ||
[[ラット]][[海馬]]から培養した神経細胞は、90%が極性の発達した[[興奮性]]の[[錐体細胞]]から構成されており、その均一性のため神経細胞の極性化の解析によく用いられてきた。この神経細胞は、培養条件下で外部からの刺激がなくとも自発的に細胞極性を形成することが知られており、その過程は5つのステージに分類されている(図1)<ref name=ref1 /> <ref><pubmed> 3282038 </pubmed></ref> | [[ラット]][[海馬]]から培養した神経細胞は、90%が極性の発達した[[興奮性]]の[[錐体細胞]]から構成されており、その均一性のため神経細胞の極性化の解析によく用いられてきた。この神経細胞は、培養条件下で外部からの刺激がなくとも自発的に細胞極性を形成することが知られており、その過程は5つのステージに分類されている(図1)<ref name=ref1 /> <ref><pubmed> 3282038 </pubmed></ref>。まず、神経細胞は培養開始数時間で葉状仮足を形成する(ステージ1)。その後、細胞体からminer processと呼ばれる数本の未成熟な神経突起が伸長する(ステージ2)。この時点では、各突起の長さはほぼ同じで、神経細胞は対称に見える。ステージ2の間、個々の未成熟な突起はダイナミックな伸長と退縮を繰り返し、培養1.5日後、これらの突起のうち一本が急激に伸長し、対称性が破れる(ステージ3)。その後、この突起は急激な伸長を続け、軸索特異的分子の集積とともに軸索へと[[分化]]する。さらに培養を続けると、培養4日後に残りの突起の伸長が始まる。これらの突起には樹状突起特異的分子が集積し、樹状突起へと分化する(ステージ4)。その後、軸索と樹状突起の間に[[シナプス]]が形成され、一連の神経細胞の極性化は終了する(ステージ5)。 | ||
===脳組織における極性形成過程=== | ===脳組織における極性形成過程=== | ||
[[Image:Tmaeno002.jpg|thumb|350px|'''図2. 脳組織内における神経細胞の極性形成過程''' <br />大脳皮質における(A)興奮性神経細胞と(B)抑制性神経細胞の極性形成過程]] | [[Image:Tmaeno002.jpg|thumb|350px|'''図2. 脳組織内における神経細胞の極性形成過程''' <br />大脳皮質における(A)興奮性神経細胞と(B)抑制性神経細胞の極性形成過程]] | ||
[[大脳皮質]] | [[大脳皮質]]の興奮性神経細胞は、[[脳室]]層(ventricular zone ; VZ)での前駆細胞の非対称分裂で生じ、脳表面に向かう移動の途中で極性化が起こる。これまで、興奮性神経細胞は移動時の先導突起(leading process ; LP)が樹状突起に、trailing process(TP)が軸索になると考えられていた<ref><pubmed> 20452947 </pubmed></ref> <ref><pubmed> 22715881 </pubmed></ref>。しかし最近になって、興奮性神経細胞の多くは中間帯まで移動すると減速し、先導突起とtrailing processを失い、培養海馬神経細胞と同様に、複数の短い神経突起の伸長と退縮を繰り返す現象が報告された(図2A)<ref><pubmed> 14602813 </pubmed></ref> <ref name=ref8><pubmed> 22267309 </pubmed></ref>。これらの神経細胞は、その後一本の突起を脳室に沿う接線方向に急激に伸長させ、軸索を形成する。一方、細胞体は脳表面に向かって別の突起を伸ばしながら移動し、最終的にL時型の軸索が生じる<ref name=ref8 />。 | ||
大脳皮質の[[抑制性神経細胞]]は、[[基底核原基]]で生じ、大脳皮質に向かって脳表面に接する接線方向に移動し、辺縁層(marginal zone)を経て大脳[[皮質板]](cortical plate)へと至る。[[抑制性]]神経細胞も興奮性神経細胞と同様に、大脳皮質板において先導突起とtrailing processを失い、複数の短い神経突起の伸長と退縮を繰り返した後、一本が急激に伸長して軸索を形成する(図2B)<ref><pubmed> 21068327 </pubmed></ref>。 | |||
==軸索の形成と伸長== | ==軸索の形成と伸長== | ||
| 41行目: | 34行目: | ||
===軸索伸長におけるアクチンの役割=== | ===軸索伸長におけるアクチンの役割=== | ||
神経細胞の極性形成には神経突起が伸長する必要があるが、その突起伸長には突起先端の[[成長円錐]] | 神経細胞の極性形成には神経突起が伸長する必要があるが、その突起伸長には突起先端の[[成長円錐]]が重要な役割を果たすと考えられている。成長円錐の先導端にはアクチン線維が豊富に存在しており、軸索伸長方向に重合しながら逆行性に移動し、アクチン線維の後方で脱重合することが知られている(図3)。このようなアクチン線維のターンオーバーはArp2/3やCofilinなどのアクチン結合タンパク質によって制御されており、これらの分子の活性は軸索伸長に関与する。また、逆行性移動するアクチン線維の力を成長円錐の推進力に変える機構として、クラッチメカニズムが提唱されており<ref><pubmed> 10934315 </pubmed></ref> <ref><pubmed> 3078414 </pubmed></ref>、これまでに[[細胞接着分子]][[L1]]-CAMとアクチン線維を連結するシューティン1<ref name=ref12><pubmed> 18519736 </pubmed></ref> <ref name=ref13><pubmed> 23453953 </pubmed></ref>やN-カドヘリンとアクチン線維を連結するカテニン(catenin)<ref><pubmed> 18524892 </pubmed></ref>、エズリン(ezrin)<ref><pubmed> 22219290 </pubmed></ref>等がクラッチ分子として機能することが報告されている。さらに最近、クラッチ分子シューティン1を介したアクチン線維とL1-CAMの連結を強めると軸索伸長が促進することが報告された<ref name=ref13 /> <ref name=ref16><pubmed> 26261183 </pubmed></ref>。 | ||
===軸索伸長における微小管の役割=== | ===軸索伸長における微小管の役割=== | ||
[[チューブリン]]は軸索に最も多く存在するタンパク質であり、突起先端におけるチューブリンの重合と微小管の安定化は軸索伸長において重要な因子である<ref><pubmed> 18268107 </pubmed></ref> | [[チューブリン]]は軸索に最も多く存在するタンパク質であり、突起先端におけるチューブリンの重合と微小管の安定化は軸索伸長において重要な因子である<ref><pubmed> 18268107 </pubmed></ref>。微小管の安定性は微小管結合タンパク質(MAPs)によって制御されており、MAP1BやMAP2が神経細胞の極性化に関与することが報告されている<ref name=ref18><pubmed> 19400726 </pubmed></ref>。また、CRMP-2やAPCは微小管の重合を促進することで、DOCK7はRac1を介して微小管の不安定化タンパク質スタスミンを不活性化することで軸索伸長に関与する<ref name=ref19><pubmed> 11477421 </pubmed></ref> <ref><pubmed> 12134159 </pubmed></ref>。 | ||
===軸索伸長と膜輸送=== | ===軸索伸長と膜輸送=== | ||
軸索の伸長のためには[[細胞膜]]の表面積を拡大させる必要があり、細胞内[[小胞輸送]]に関与する[[低分子量GTP結合タンパク質]][[Rab]]ファミリーが関与していると考えられている。これまでに、Rab5やRab8、Rab11などが軸索の形成や伸長に関わること<ref><pubmed> 17082457 </pubmed></ref> <ref><pubmed> 17267689 </pubmed></ref> <ref><pubmed> 22573681 </pubmed></ref> <ref><pubmed> 17046692 </pubmed></ref> | 軸索の伸長のためには[[細胞膜]]の表面積を拡大させる必要があり、細胞内[[小胞輸送]]に関与する[[低分子量GTP結合タンパク質]][[Rab]]ファミリーが関与していると考えられている。これまでに、Rab5やRab8、Rab11などが軸索の形成や伸長に関わること<ref><pubmed> 17082457 </pubmed></ref> <ref><pubmed> 17267689 </pubmed></ref> <ref><pubmed> 22573681 </pubmed></ref> <ref><pubmed> 17046692 </pubmed></ref>、Rab7、Rab11、Ran27などが突起伸長のシグナル伝達を担う分子を軸索先端へ輸送すること<ref><pubmed> 19460344 </pubmed></ref> <ref><pubmed> 19759314 </pubmed></ref> <ref><pubmed> 20810886 </pubmed></ref>、Ran11が神経突起伸長を調節するインテグリンの輸送に関与することが報告されている。また、Rab5、Rab7、Rab8、Rab10、Rab11はエンドサイトーシスによって回収された小胞膜の細胞膜のリサイクリングに関与すると考えられている。さらに最近、Rab33aが細胞体で新たに合成された膜成分の軸索輸送と成長円錐における膜融合を引き起こし、軸索伸長に関与することが報告された<ref><pubmed> 22972995 </pubmed></ref>。また、SNAREタンパク質やRab10、TC10Exo70複合体が成長円錐における小胞膜と細胞膜の融合に関与することも報告されている<ref><pubmed> 19846717 </pubmed></ref> <ref><pubmed> 21856246 </pubmed></ref>。 | ||
==神経細胞の極性化に関与する細胞外分子群== | ==神経細胞の極性化に関与する細胞外分子群== | ||
神経細胞は複数の神経突起のうち一本を軸索へと変化させる(図1、図2)。神経細胞の極性化に関与する細胞外分子には、拡散性シグナルと接着性シグナルがあり、拡散性シグナルには、軸索ガイダンスに関与するネトリンや[[セマフォリン]]3A([[Sema3A]])、ニューロトロフィン(NGF、BDNF、NT-3)、TGFβ、IGF-1、[[WNT|Wnt]]などが報告されている。接着性シグナルとしては、NgCAMやラミニン、[[TAG1]]などが軸索形成に関与する。 | |||
===神経極性に関与する拡散性シグナル=== | ===神経極性に関与する拡散性シグナル=== | ||
ネトリンは[[線虫]] | ネトリンは[[線虫]]のUNC-6のホモログであり、UNC-40(DCC)等の受容体に結合する<ref><pubmed> 16520734 </pubmed></ref>。線虫のUNC-6やUNC-40の変異体では、産卵口の筋肉の神経細胞の軸索形成が遅れ、軸索ガイダンスにも異常が生じる。また、反発性ガイダンス因子であるSema3Aは、cGMPの産生を介してcAMP/PKAを阻害し、PKA依存的な軸索形成を抑制して樹状突起形成を促進する<ref><pubmed> 21835341 </pubmed></ref>。NGF、BDNF、NT-3などのニューロトロフィンは、PI3-キナーゼ、Ras、cAMP、IP3などを介したシグナル伝達経路に関与しており、受容体であるTrkを阻害すると大脳皮質内を移動する神経細胞の極性形成に異常が生じる<ref><pubmed> 22087032 </pubmed></ref>。また、TGFβはPar6をリン酸化することで軸索形成に関与しており、TGFβの受容体であるTβR2をノックアウトしたマウスは、大脳皮質の神経細胞において軸索形成に異常を示す<ref><pubmed> 20603020 </pubmed></ref>。IGF-1に関しては、大脳皮質内の興奮性神経細胞に対する軸索形成作用が示唆されている<ref><pubmed> 17057708 </pubmed></ref>。また、Wntも軸索形成と極性化に関与しており、Wnt5Aは軸索形成を促進する<ref><pubmed> 16571624 </pubmed></ref> <ref><pubmed> 21557503 </pubmed></ref>。 | ||
===神経極性に関与する接着性シグナル=== | ===神経極性に関与する接着性シグナル=== | ||
軸索形成の方向性の決定には、ラミニンやL1-CAMといった細胞[[接着分子]]の方向性を持った刺激も関与する<ref><pubmed> 17482549 </pubmed></ref> <ref name=ref39><pubmed> 10414970 </pubmed></ref>。ラミニンやL1-CAMをストライプ状にコートした基質上に神経細胞を培養すると、ラミニンやL1- | 軸索形成の方向性の決定には、ラミニンやL1-CAMといった細胞[[接着分子]]の方向性を持った刺激も関与する<ref><pubmed> 17482549 </pubmed></ref> <ref name=ref39><pubmed> 10414970 </pubmed></ref>。ラミニンやL1-CAMをストライプ状にコートした基質上に神経細胞を培養すると、ラミニンやL1-CAMに接触した神経突起が優先的に軸索になる。また、ラミニンでコートしたマイクロビーズを用いてステージ2の培養海馬神経細胞の未成熟な神経突起を刺激すると、マイクロビーズ接触した突起先端にPIP3が濃縮し、突起が急速に伸長して軸索へと分化する<ref name=ref39 />。これらのことから、ラミニンやL1-CAMは接着性の細胞外シグナル分子として働き極性形成に関与すると考えられる。また、インテグリンはラミニンのレセプターとして知られており、神経細胞の発生過程の早い段階から発現がみられ、Integrin-linked kinase (ILK)を介して[[GSK3β]]を不活性化する。ILKを阻害すると軸索形成が抑制され、反対にILKの活性化型変異体を発現させると複数の軸索が形成される<ref><pubmed> 17490631 </pubmed></ref>。さらに最近、β1インテグリンはSADキナーゼを介して微小管を制御することで、神経極性に関与することも報告されている<ref><pubmed> 22430151 </pubmed></ref>。 | ||
==神経細胞の極性化を担う細胞内分子群== | ==神経細胞の極性化を担う細胞内分子群== | ||
| 62行目: | 55行目: | ||
神経細胞の極性化を担う細胞内シグナル伝達に関して、この十数年の間に、さまざまな細胞内分子群が同定されてきている(図4)<ref name=ref2 /> <ref name=ref18 />。 | 神経細胞の極性化を担う細胞内シグナル伝達に関して、この十数年の間に、さまざまな細胞内分子群が同定されてきている(図4)<ref name=ref2 /> <ref name=ref18 />。 | ||
=== | ===フォスファチジルイノシトール3-キナーゼ=== | ||
フォスファチジルイノシトール3-キナーゼ(PI3-キナーゼ)は、様々な受容体の下流で活性化され、様々な細胞の極性化に関与する。神経細胞においては、PI3-キナーゼの活性やその産物[[ホスファチジルイノシトール]]1,4,5 –三リン酸(PIP3)は、ステージ3の培養海馬神経細胞の軸索に局在する。また、未成熟な突起における局所的なPIP3の増加は、その突起の急激な伸長と軸索化を引き起こす<ref><pubmed> 15030394 </pubmed></ref>。一方、PI3-キナーゼの活性の阻害や、phosphatase and tensin homologue deleted on chromosome 10(PTEN)の過剰発現によるPIP3の産生阻害は、極性化を抑制される<ref><pubmed> 12526794</pubmed></ref>。PIP3の下流では、リン酸化酵素Aktが活性化され、別のリン酸化酵素[[glycogen synthase kinase 3]]β([[GSK3]]β)をリン酸化し、リン酸化されたGSK3βは不活性化する<ref><pubmed> 15652488 </pubmed></ref>。活性化型のGSK3βは[[collapsin response mediator protein]]-2([[CRMP-2]])をリン酸化し、不活性化する。活性化型の[[CRMP]]-2はチューブリンと結合して微小管の重合を促進することで軸索伸長に関与する分子であることから、PI3-キナーゼはAkt、GSK3βを経由して微小管のダイナミクスを制御し、細胞極性に関与すると考えられている<ref name=ref19 />。また、PIP3の下流では、[[Rho]]ファミリーGタンパク質である[[Cdc42]]や[[Rac1]]が活性化される。さらにその下流では、アクチンの重合を促進するArp2/3が活性化される。Arp2/3の活性を制御するWASPやWAVEを抑制すると軸索伸長が阻害されることから、PI3キナーゼは微小管だけでなく、アクチン線維のダイナミクスも制御することで極性形成に関与すると考えられる<ref><pubmed> 20484635 </pubmed></ref>。 | |||
その他に、PI3- | その他に、PI3-キナーゼと関連する分子としてSingle axon related 1(Singar1/Rufy3)が報告されている。Singar1の発現を抑制すると、PI3-キナーゼの活性依存的に軸索が過剰に形成される。また、Singar1を過剰発現すると過剰軸索の形成が抑制される。したがって、Singar1は過剰な軸索形成を抑制し、極性を安定させる分子と考えられる<ref><pubmed> 17439943 </pubmed></ref>。 | ||
===低分子量Gタンパク質とその関連分子=== | ===低分子量Gタンパク質とその関連分子=== | ||
[[Ras-related protein | [[Ras]]-related protein 1B(RAP1B)は、Rasスーパーファミリーに属する[[低分子量Gタンパク質]]で、培養海馬神経細胞の伸長する軸索に濃縮する。RAP1Bを過剰発現すると過剰に軸索が形成され、反対に発現を抑制すると軸索の形成が阻害される<ref><pubmed> 15286792 </pubmed></ref>。RAP1Bの発現抑制による軸索形成阻害は、Cdc42の活性化型により一部回復し、また、PI3-キナーゼの活性抑制による軸索形成阻害はRAP1Bの活性化型により一部回復する。したがって、RAP1BはPI3-キナーゼの下流かつ、Cdc42の上流で機能すると考えられている。 | ||
また、H-Ras、K-Ras、N-Ras、R-RasといったRasタンパク質は、PI3-キナーゼの上流で神経細胞の極性形成に関与する。Rasタンパク質を過剰発現すると過剰に軸索が形成され、[[ドミナントネガティブ]]変異体を発させると軸索の形成が阻害される<ref><pubmed> 16343426 </pubmed></ref> <ref><pubmed> 17107957 </pubmed></ref>。 | |||
Cdc42やRac1、[[RhoA]] | Cdc42やRac1、[[RhoA]]などのRhoファミリーGタンパク質は、神経細胞だけでなく、さまざまな細胞の形態形成に関与する。P21-activated kinase(Pak1)は、Cdc42やRac1の下流で活性化されるリン酸化酵素で<ref><pubmed> 17687038 </pubmed></ref>、海馬神経細胞の軸索に局在する。活性化型のPak1を過剰発現させると過剰な軸索が形成され、反対にPak1の発現を抑制すると軸索の形成が阻害される。さらに、Pak1はネトリンの下流でクラッチ分子シューティン1をリン酸化する。リン酸化されたシューティン1は、アクチン線維と細胞接着分子の間の連結を強めることで軸索形成を促進する<ref name=ref13 /> <ref name=ref16 />。さらにシューティン1の過剰発現は過剰軸索の形成を引き起こすことから<ref name=ref51><pubmed> 17030985 </pubmed></ref>、クラッチ分子の制御は軸索形成に関与すると考えられる。RhoAは下流のRhoキナーゼ/ROCKを活性化することで、CofilinやProfilinを介してアクチン線維のダイナミクス制御し、神経細胞の極性形成に関与する<ref><pubmed> 11276226 </pubmed></ref> <ref><pubmed> 14517206 </pubmed></ref>。 | ||
===cAMPとその関連分子=== | ===cAMPとその関連分子=== | ||
ニューロトロフィンによる刺激により産生された[[cAMP]]は[[Aキナーゼ]]([[PKA]])を活性化する。PKAは[[セリン]]/[[スレオニン]]キナーゼであるLKB1をリン酸化する<ref><pubmed> 7758115 </pubmed></ref>。培養神経細胞において、LKB1の過剰発現は過剰に軸索を形成し、発現抑制は軸索形成阻害を引き起こす。さらに、LKB1をノックアウトマウスでは、軸索形成に異常が生じることが確認されている<ref><pubmed> 17482548 </pubmed></ref>。リン酸化されたLKB1はSADキナーゼを活性化し、MAPsを活性化することで微小管の安定化に関与する。 | |||
===Parとその関連分子=== | ===Parとその関連分子=== | ||
Parタンパク質は線虫の受精卵の非対称分裂を制御する分子として同定された極性関連タンパク質であり、神経細胞の極性化にも関与すると考えられる<ref><pubmed> 21557502 </pubmed></ref>。Par3、Par6、リン酸化酵素アティピカルPKC(aPKC)の複合体は、海馬神経細胞の軸索に濃縮し、極性形成に関与する。また、Par3は、キネシン-2(KIF3)により軸索先端へと運ばれ<ref><pubmed> 15048131 </pubmed></ref>、Cdc42を介したRac1の活性化を引き起こす<ref><pubmed> 15723051 </pubmed></ref>。 | |||
Par1bはmicrotubule affinity-regulating kinase2(MARK2)とも呼ばれるリン酸化酵素で、Tauなどの微小管結合タンパク質をリン酸化する<ref><pubmed> 16717194 </pubmed></ref>。MARK2の発現抑制は過剰軸索の形成を引き起こし、MARK2の過剰発現は軸索形成を抑制する。また、MARK2は下流分子のGAKINのリン酸化を介して軸索形成を引き起こし、さらに樹状突起形成の抑制にも関与する<ref><pubmed> 20194617 </pubmed></ref> <ref><pubmed> 18045904 </pubmed></ref>。 | |||
==神経細胞の対称性の破れの細胞内メカニズム== | ==神経細胞の対称性の破れの細胞内メカニズム== | ||
[[Image:Tmaeno005.jpg|thumb|350px|'''図5. 神経細胞の対称性の破れの仕組み''' <br />(A)活性因子のポジティブフィードバックと抑制因子の伝達による対称性の破れのモデル <br />(B)活性因子の長さ依存的なポジティブフィードバックと枯渇による側方抑制を基にした対称性の破れのモデル]] | [[Image:Tmaeno005.jpg|thumb|350px|'''図5. 神経細胞の対称性の破れの仕組み''' <br />(A)活性因子のポジティブフィードバックと抑制因子の伝達による対称性の破れのモデル <br />(B)活性因子の長さ依存的なポジティブフィードバックと枯渇による側方抑制を基にした対称性の破れのモデル]] | ||
対称性の破れに関する研究は、古くから理論研究が先行しており、局所における活性物質のポジティブフィードバックによる自己増幅と、抑制物質のネガティブフィードバックによる側方抑制を導入した数理モデルが提唱されている<ref>''' Turing AM '''<br> The Chemical Basis of Morphogenesis.<br>'' Philos. Trans. R. Soc. London B Biol. Sci. '':1952</ref> <ref><pubmed> 10918306 </pubmed></ref>。これまで、PI3-キナーゼとその上流分子であるH-Rasとの間にポジティブフィードバックの関係が生じることから、活性依存的にH-Rasの突起先端への輸送が促進されるという仮定をしてモデルを立てパラメータを調節した場合や<ref><pubmed> 18158244 </pubmed></ref>、微小管が突起の長さ依存的に濃縮するという仮定を立てた場合に<ref><pubmed> 20493705 </pubmed></ref>、神経細胞の対称性の破れが起こることが報告されている。また、神経極性に関与するシグナル因子の相互作用解析から、活性因子であるPI3-キナーゼとその下流因子との間にポジティブフィードバックが働くことで軸索が伸長し、さらに軸索の成長円錐から抑制因子が他の未成熟な神経突起に伝達されることで側方抑制がかかるという極性形成モデルが提唱されている(図5A)<ref name=ref2 />。 | |||
最近、シューティン1の定量的な計測データに基づく対称性の破れの数理モデルが報告された(図5B)<ref name=ref66><pubmed> 20664640 </pubmed></ref>。シューティン1は①神経細胞の対称性が破れる時期に発現量が急激に増加する<ref name=ref51 />、②神経突起先端に濃縮すると突起を伸長させる<ref name=ref12 />、③長い突起により強く濃縮する<ref name=ref66 />ことがわかっている。そこで、①〜③の構成要素を定量的に数値化し、数理モデルを構築したところ、神経細胞は自発的な対称性の破れを引き起こした。このモデルから考えられる神経細胞が対称性を破る仕組みは、まず、シューティン1が細胞体から順行性に輸送され、突起先端に濃縮すると突起が伸長する。興味深いことに、ステージ2の未成熟な神経突起には、Waveと呼ばれる構造体がランダムに出現し、突起先端へ向かって移動する。Waveは突起先端へ到達すると急速な突起伸長を引き起こし、Waveが多く発生した突起は他の突起よりも軸索になりやすい<ref name=ref66 />。Waveはシューティン1を輸送しており<ref><pubmed> 26190109 </pubmed></ref>、先端で濃縮したシューティン1は逆行性に拡散するため、長い突起ほど、シューティン1が濃縮しやすくなる。これが引き金となって、さらにその突起にシューティンが濃縮しやすくなり、突起伸長が加速する(ポジティブフィードバック)。さらに、細胞内のシューティン1の量は限られているので、一本の突起にシューティン1が集まると他の突起に輸送される分が枯渇し、結果として他の突起の伸長が抑制され(側方抑制)、対称性が破れる。 | 最近、シューティン1の定量的な計測データに基づく対称性の破れの数理モデルが報告された(図5B)<ref name=ref66><pubmed> 20664640 </pubmed></ref>。シューティン1は①神経細胞の対称性が破れる時期に発現量が急激に増加する<ref name=ref51 />、②神経突起先端に濃縮すると突起を伸長させる<ref name=ref12 />、③長い突起により強く濃縮する<ref name=ref66 />ことがわかっている。そこで、①〜③の構成要素を定量的に数値化し、数理モデルを構築したところ、神経細胞は自発的な対称性の破れを引き起こした。このモデルから考えられる神経細胞が対称性を破る仕組みは、まず、シューティン1が細胞体から順行性に輸送され、突起先端に濃縮すると突起が伸長する。興味深いことに、ステージ2の未成熟な神経突起には、Waveと呼ばれる構造体がランダムに出現し、突起先端へ向かって移動する。Waveは突起先端へ到達すると急速な突起伸長を引き起こし、Waveが多く発生した突起は他の突起よりも軸索になりやすい<ref name=ref66 />。Waveはシューティン1を輸送しており<ref><pubmed> 26190109 </pubmed></ref>、先端で濃縮したシューティン1は逆行性に拡散するため、長い突起ほど、シューティン1が濃縮しやすくなる。これが引き金となって、さらにその突起にシューティンが濃縮しやすくなり、突起伸長が加速する(ポジティブフィードバック)。さらに、細胞内のシューティン1の量は限られているので、一本の突起にシューティン1が集まると他の突起に輸送される分が枯渇し、結果として他の突起の伸長が抑制され(側方抑制)、対称性が破れる。 | ||
2016年3月10日 (木) 11:32時点における版
勝野 弘子、稲垣 直之
奈良先端科学技術大学院大学
DOI:10.14931/bsd.7001 原稿受付日:2016年3月10日 原稿完成日:2016年月日
担当編集委員:定藤 規弘(自然科学研究機構生理学研究所 大脳皮質機能研究系)
英語名:Cell polarity and neuronal polarization
細胞極性とは、細胞の構成成分や細胞内小器官などを細胞に非対称的に配置させることにより、その形態や機能に方向性を有することである。例えば、上皮細胞は頂端—基底(apical-basal)軸に沿った極性を持ち、細胞同士が強固に接着してシート構造を作ることで組織と外部環境とを隔離する役割を果たす。神経細胞もまた極性を持つ細胞であり、一本の長い軸索と複数の短い樹状突起を伸ばし、高度に発達した細胞極性を形成する。このような神経細胞の極性は、シグナルの入力、統合、出力といった情報処理機能に重要な役割を果たす。これまでに神経細胞の極性化に関与する数多くの分子が同定され、極性化を担う細胞内外のシグナルのクロストーク、対称性の破れ、神経突起伸長のメカニクス、軸索や樹状突起に特異的に存在する分子の細胞内局在メカニズムに関して解析が進みつつある。
神経細胞の極性化の過程
軸索と樹状突起
典型的な神経細胞は、一本の長い軸索と複数本の短い樹状突起を持つ[1] [2]。軸索は直径がその先端まであまり変化しないが、樹状突起は先端にゆくにしたがい直径が細くなる。軸索は直角に枝分かれすることが多く、樹上突起はY字型に枝分かれすることが多い。また、軸索と樹状突起では、微小管の配向が異なる。成熟した神経細胞の軸索では、微小管のプラス端が突起の遠位に向かって配向するが、樹状突起ではプラス端が遠位に向かって配向した微小管とマイナス端が遠位に向かった微小管とが混在している[3]。さらに、軸索と樹状突起ではタンパク質の分布も異なり[1]、非リン酸化TauやSynaptophysin、Synapsin-1は軸索特異的に、MAP2 は樹状突起特異的に存在するため、軸索と樹状突起のマーカーとして用いられている。
培養神経細胞における極性形成
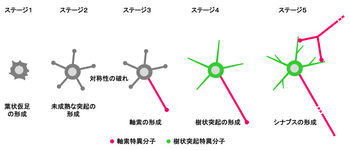
培養海馬神経細胞の極性形成過程は5つのステージに分類される
ラット海馬から培養した神経細胞は、90%が極性の発達した興奮性の錐体細胞から構成されており、その均一性のため神経細胞の極性化の解析によく用いられてきた。この神経細胞は、培養条件下で外部からの刺激がなくとも自発的に細胞極性を形成することが知られており、その過程は5つのステージに分類されている(図1)[1] [4]。まず、神経細胞は培養開始数時間で葉状仮足を形成する(ステージ1)。その後、細胞体からminer processと呼ばれる数本の未成熟な神経突起が伸長する(ステージ2)。この時点では、各突起の長さはほぼ同じで、神経細胞は対称に見える。ステージ2の間、個々の未成熟な突起はダイナミックな伸長と退縮を繰り返し、培養1.5日後、これらの突起のうち一本が急激に伸長し、対称性が破れる(ステージ3)。その後、この突起は急激な伸長を続け、軸索特異的分子の集積とともに軸索へと分化する。さらに培養を続けると、培養4日後に残りの突起の伸長が始まる。これらの突起には樹状突起特異的分子が集積し、樹状突起へと分化する(ステージ4)。その後、軸索と樹状突起の間にシナプスが形成され、一連の神経細胞の極性化は終了する(ステージ5)。
脳組織における極性形成過程
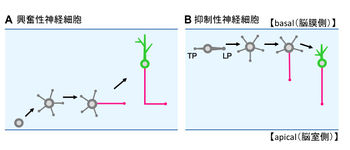
大脳皮質における(A)興奮性神経細胞と(B)抑制性神経細胞の極性形成過程
大脳皮質の興奮性神経細胞は、脳室層(ventricular zone ; VZ)での前駆細胞の非対称分裂で生じ、脳表面に向かう移動の途中で極性化が起こる。これまで、興奮性神経細胞は移動時の先導突起(leading process ; LP)が樹状突起に、trailing process(TP)が軸索になると考えられていた[5] [6]。しかし最近になって、興奮性神経細胞の多くは中間帯まで移動すると減速し、先導突起とtrailing processを失い、培養海馬神経細胞と同様に、複数の短い神経突起の伸長と退縮を繰り返す現象が報告された(図2A)[7] [8]。これらの神経細胞は、その後一本の突起を脳室に沿う接線方向に急激に伸長させ、軸索を形成する。一方、細胞体は脳表面に向かって別の突起を伸ばしながら移動し、最終的にL時型の軸索が生じる[8]。
大脳皮質の抑制性神経細胞は、基底核原基で生じ、大脳皮質に向かって脳表面に接する接線方向に移動し、辺縁層(marginal zone)を経て大脳皮質板(cortical plate)へと至る。抑制性神経細胞も興奮性神経細胞と同様に、大脳皮質板において先導突起とtrailing processを失い、複数の短い神経突起の伸長と退縮を繰り返した後、一本が急激に伸長して軸索を形成する(図2B)[9]。
軸索の形成と伸長
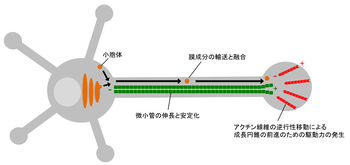
神経軸索の伸長と形成には、成長円錐でのアクチン線維の逆行性移動による駆動力の発生、シャフトでの微小管の重合と安定化、膜成分の輸送と供給が必要である。
神経細胞が軸索を伸長し極性を形成するためには、アクチン線維や微小管などの細胞骨格の構築と膜成分の供給が必要である(図3)。
軸索伸長におけるアクチンの役割
神経細胞の極性形成には神経突起が伸長する必要があるが、その突起伸長には突起先端の成長円錐が重要な役割を果たすと考えられている。成長円錐の先導端にはアクチン線維が豊富に存在しており、軸索伸長方向に重合しながら逆行性に移動し、アクチン線維の後方で脱重合することが知られている(図3)。このようなアクチン線維のターンオーバーはArp2/3やCofilinなどのアクチン結合タンパク質によって制御されており、これらの分子の活性は軸索伸長に関与する。また、逆行性移動するアクチン線維の力を成長円錐の推進力に変える機構として、クラッチメカニズムが提唱されており[10] [11]、これまでに細胞接着分子L1-CAMとアクチン線維を連結するシューティン1[12] [13]やN-カドヘリンとアクチン線維を連結するカテニン(catenin)[14]、エズリン(ezrin)[15]等がクラッチ分子として機能することが報告されている。さらに最近、クラッチ分子シューティン1を介したアクチン線維とL1-CAMの連結を強めると軸索伸長が促進することが報告された[13] [16]。
軸索伸長における微小管の役割
チューブリンは軸索に最も多く存在するタンパク質であり、突起先端におけるチューブリンの重合と微小管の安定化は軸索伸長において重要な因子である[17]。微小管の安定性は微小管結合タンパク質(MAPs)によって制御されており、MAP1BやMAP2が神経細胞の極性化に関与することが報告されている[18]。また、CRMP-2やAPCは微小管の重合を促進することで、DOCK7はRac1を介して微小管の不安定化タンパク質スタスミンを不活性化することで軸索伸長に関与する[19] [20]。
軸索伸長と膜輸送
軸索の伸長のためには細胞膜の表面積を拡大させる必要があり、細胞内小胞輸送に関与する低分子量GTP結合タンパク質Rabファミリーが関与していると考えられている。これまでに、Rab5やRab8、Rab11などが軸索の形成や伸長に関わること[21] [22] [23] [24]、Rab7、Rab11、Ran27などが突起伸長のシグナル伝達を担う分子を軸索先端へ輸送すること[25] [26] [27]、Ran11が神経突起伸長を調節するインテグリンの輸送に関与することが報告されている。また、Rab5、Rab7、Rab8、Rab10、Rab11はエンドサイトーシスによって回収された小胞膜の細胞膜のリサイクリングに関与すると考えられている。さらに最近、Rab33aが細胞体で新たに合成された膜成分の軸索輸送と成長円錐における膜融合を引き起こし、軸索伸長に関与することが報告された[28]。また、SNAREタンパク質やRab10、TC10Exo70複合体が成長円錐における小胞膜と細胞膜の融合に関与することも報告されている[29] [30]。
神経細胞の極性化に関与する細胞外分子群
神経細胞は複数の神経突起のうち一本を軸索へと変化させる(図1、図2)。神経細胞の極性化に関与する細胞外分子には、拡散性シグナルと接着性シグナルがあり、拡散性シグナルには、軸索ガイダンスに関与するネトリンやセマフォリン3A(Sema3A)、ニューロトロフィン(NGF、BDNF、NT-3)、TGFβ、IGF-1、Wntなどが報告されている。接着性シグナルとしては、NgCAMやラミニン、TAG1などが軸索形成に関与する。
神経極性に関与する拡散性シグナル
ネトリンは線虫のUNC-6のホモログであり、UNC-40(DCC)等の受容体に結合する[31]。線虫のUNC-6やUNC-40の変異体では、産卵口の筋肉の神経細胞の軸索形成が遅れ、軸索ガイダンスにも異常が生じる。また、反発性ガイダンス因子であるSema3Aは、cGMPの産生を介してcAMP/PKAを阻害し、PKA依存的な軸索形成を抑制して樹状突起形成を促進する[32]。NGF、BDNF、NT-3などのニューロトロフィンは、PI3-キナーゼ、Ras、cAMP、IP3などを介したシグナル伝達経路に関与しており、受容体であるTrkを阻害すると大脳皮質内を移動する神経細胞の極性形成に異常が生じる[33]。また、TGFβはPar6をリン酸化することで軸索形成に関与しており、TGFβの受容体であるTβR2をノックアウトしたマウスは、大脳皮質の神経細胞において軸索形成に異常を示す[34]。IGF-1に関しては、大脳皮質内の興奮性神経細胞に対する軸索形成作用が示唆されている[35]。また、Wntも軸索形成と極性化に関与しており、Wnt5Aは軸索形成を促進する[36] [37]。
神経極性に関与する接着性シグナル
軸索形成の方向性の決定には、ラミニンやL1-CAMといった細胞接着分子の方向性を持った刺激も関与する[38] [39]。ラミニンやL1-CAMをストライプ状にコートした基質上に神経細胞を培養すると、ラミニンやL1-CAMに接触した神経突起が優先的に軸索になる。また、ラミニンでコートしたマイクロビーズを用いてステージ2の培養海馬神経細胞の未成熟な神経突起を刺激すると、マイクロビーズ接触した突起先端にPIP3が濃縮し、突起が急速に伸長して軸索へと分化する[39]。これらのことから、ラミニンやL1-CAMは接着性の細胞外シグナル分子として働き極性形成に関与すると考えられる。また、インテグリンはラミニンのレセプターとして知られており、神経細胞の発生過程の早い段階から発現がみられ、Integrin-linked kinase (ILK)を介してGSK3βを不活性化する。ILKを阻害すると軸索形成が抑制され、反対にILKの活性化型変異体を発現させると複数の軸索が形成される[40]。さらに最近、β1インテグリンはSADキナーゼを介して微小管を制御することで、神経極性に関与することも報告されている[41]。
神経細胞の極性化を担う細胞内分子群
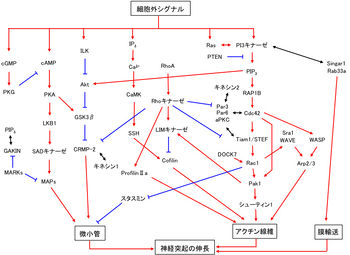
神経細胞の極性化を担う細胞内シグナル伝達に関して、この十数年の間に、さまざまな細胞内分子群が同定されてきている(図4)[2] [18]。
フォスファチジルイノシトール3-キナーゼ
フォスファチジルイノシトール3-キナーゼ(PI3-キナーゼ)は、様々な受容体の下流で活性化され、様々な細胞の極性化に関与する。神経細胞においては、PI3-キナーゼの活性やその産物ホスファチジルイノシトール1,4,5 –三リン酸(PIP3)は、ステージ3の培養海馬神経細胞の軸索に局在する。また、未成熟な突起における局所的なPIP3の増加は、その突起の急激な伸長と軸索化を引き起こす[42]。一方、PI3-キナーゼの活性の阻害や、phosphatase and tensin homologue deleted on chromosome 10(PTEN)の過剰発現によるPIP3の産生阻害は、極性化を抑制される[43]。PIP3の下流では、リン酸化酵素Aktが活性化され、別のリン酸化酵素glycogen synthase kinase 3β(GSK3β)をリン酸化し、リン酸化されたGSK3βは不活性化する[44]。活性化型のGSK3βはcollapsin response mediator protein-2(CRMP-2)をリン酸化し、不活性化する。活性化型のCRMP-2はチューブリンと結合して微小管の重合を促進することで軸索伸長に関与する分子であることから、PI3-キナーゼはAkt、GSK3βを経由して微小管のダイナミクスを制御し、細胞極性に関与すると考えられている[19]。また、PIP3の下流では、RhoファミリーGタンパク質であるCdc42やRac1が活性化される。さらにその下流では、アクチンの重合を促進するArp2/3が活性化される。Arp2/3の活性を制御するWASPやWAVEを抑制すると軸索伸長が阻害されることから、PI3キナーゼは微小管だけでなく、アクチン線維のダイナミクスも制御することで極性形成に関与すると考えられる[45]。
その他に、PI3-キナーゼと関連する分子としてSingle axon related 1(Singar1/Rufy3)が報告されている。Singar1の発現を抑制すると、PI3-キナーゼの活性依存的に軸索が過剰に形成される。また、Singar1を過剰発現すると過剰軸索の形成が抑制される。したがって、Singar1は過剰な軸索形成を抑制し、極性を安定させる分子と考えられる[46]。
低分子量Gタンパク質とその関連分子
Ras-related protein 1B(RAP1B)は、Rasスーパーファミリーに属する低分子量Gタンパク質で、培養海馬神経細胞の伸長する軸索に濃縮する。RAP1Bを過剰発現すると過剰に軸索が形成され、反対に発現を抑制すると軸索の形成が阻害される[47]。RAP1Bの発現抑制による軸索形成阻害は、Cdc42の活性化型により一部回復し、また、PI3-キナーゼの活性抑制による軸索形成阻害はRAP1Bの活性化型により一部回復する。したがって、RAP1BはPI3-キナーゼの下流かつ、Cdc42の上流で機能すると考えられている。
また、H-Ras、K-Ras、N-Ras、R-RasといったRasタンパク質は、PI3-キナーゼの上流で神経細胞の極性形成に関与する。Rasタンパク質を過剰発現すると過剰に軸索が形成され、ドミナントネガティブ変異体を発させると軸索の形成が阻害される[48] [49]。
Cdc42やRac1、RhoAなどのRhoファミリーGタンパク質は、神経細胞だけでなく、さまざまな細胞の形態形成に関与する。P21-activated kinase(Pak1)は、Cdc42やRac1の下流で活性化されるリン酸化酵素で[50]、海馬神経細胞の軸索に局在する。活性化型のPak1を過剰発現させると過剰な軸索が形成され、反対にPak1の発現を抑制すると軸索の形成が阻害される。さらに、Pak1はネトリンの下流でクラッチ分子シューティン1をリン酸化する。リン酸化されたシューティン1は、アクチン線維と細胞接着分子の間の連結を強めることで軸索形成を促進する[13] [16]。さらにシューティン1の過剰発現は過剰軸索の形成を引き起こすことから[51]、クラッチ分子の制御は軸索形成に関与すると考えられる。RhoAは下流のRhoキナーゼ/ROCKを活性化することで、CofilinやProfilinを介してアクチン線維のダイナミクス制御し、神経細胞の極性形成に関与する[52] [53]。
cAMPとその関連分子
ニューロトロフィンによる刺激により産生されたcAMPはAキナーゼ(PKA)を活性化する。PKAはセリン/スレオニンキナーゼであるLKB1をリン酸化する[54]。培養神経細胞において、LKB1の過剰発現は過剰に軸索を形成し、発現抑制は軸索形成阻害を引き起こす。さらに、LKB1をノックアウトマウスでは、軸索形成に異常が生じることが確認されている[55]。リン酸化されたLKB1はSADキナーゼを活性化し、MAPsを活性化することで微小管の安定化に関与する。
Parとその関連分子
Parタンパク質は線虫の受精卵の非対称分裂を制御する分子として同定された極性関連タンパク質であり、神経細胞の極性化にも関与すると考えられる[56]。Par3、Par6、リン酸化酵素アティピカルPKC(aPKC)の複合体は、海馬神経細胞の軸索に濃縮し、極性形成に関与する。また、Par3は、キネシン-2(KIF3)により軸索先端へと運ばれ[57]、Cdc42を介したRac1の活性化を引き起こす[58]。
Par1bはmicrotubule affinity-regulating kinase2(MARK2)とも呼ばれるリン酸化酵素で、Tauなどの微小管結合タンパク質をリン酸化する[59]。MARK2の発現抑制は過剰軸索の形成を引き起こし、MARK2の過剰発現は軸索形成を抑制する。また、MARK2は下流分子のGAKINのリン酸化を介して軸索形成を引き起こし、さらに樹状突起形成の抑制にも関与する[60] [61]。
神経細胞の対称性の破れの細胞内メカニズム
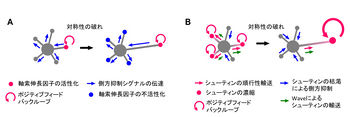
(A)活性因子のポジティブフィードバックと抑制因子の伝達による対称性の破れのモデル
(B)活性因子の長さ依存的なポジティブフィードバックと枯渇による側方抑制を基にした対称性の破れのモデル
対称性の破れに関する研究は、古くから理論研究が先行しており、局所における活性物質のポジティブフィードバックによる自己増幅と、抑制物質のネガティブフィードバックによる側方抑制を導入した数理モデルが提唱されている[62] [63]。これまで、PI3-キナーゼとその上流分子であるH-Rasとの間にポジティブフィードバックの関係が生じることから、活性依存的にH-Rasの突起先端への輸送が促進されるという仮定をしてモデルを立てパラメータを調節した場合や[64]、微小管が突起の長さ依存的に濃縮するという仮定を立てた場合に[65]、神経細胞の対称性の破れが起こることが報告されている。また、神経極性に関与するシグナル因子の相互作用解析から、活性因子であるPI3-キナーゼとその下流因子との間にポジティブフィードバックが働くことで軸索が伸長し、さらに軸索の成長円錐から抑制因子が他の未成熟な神経突起に伝達されることで側方抑制がかかるという極性形成モデルが提唱されている(図5A)[2]。
最近、シューティン1の定量的な計測データに基づく対称性の破れの数理モデルが報告された(図5B)[66]。シューティン1は①神経細胞の対称性が破れる時期に発現量が急激に増加する[51]、②神経突起先端に濃縮すると突起を伸長させる[12]、③長い突起により強く濃縮する[66]ことがわかっている。そこで、①〜③の構成要素を定量的に数値化し、数理モデルを構築したところ、神経細胞は自発的な対称性の破れを引き起こした。このモデルから考えられる神経細胞が対称性を破る仕組みは、まず、シューティン1が細胞体から順行性に輸送され、突起先端に濃縮すると突起が伸長する。興味深いことに、ステージ2の未成熟な神経突起には、Waveと呼ばれる構造体がランダムに出現し、突起先端へ向かって移動する。Waveは突起先端へ到達すると急速な突起伸長を引き起こし、Waveが多く発生した突起は他の突起よりも軸索になりやすい[66]。Waveはシューティン1を輸送しており[67]、先端で濃縮したシューティン1は逆行性に拡散するため、長い突起ほど、シューティン1が濃縮しやすくなる。これが引き金となって、さらにその突起にシューティンが濃縮しやすくなり、突起伸長が加速する(ポジティブフィードバック)。さらに、細胞内のシューティン1の量は限られているので、一本の突起にシューティン1が集まると他の突起に輸送される分が枯渇し、結果として他の突起の伸長が抑制され(側方抑制)、対称性が破れる。
これらの分子以外にも、極性形成に関連する分子群でポジティブフィードバックや側方抑制に働く可能性が考えられており、今後、数理モデルを基盤とした更なるモデルの正確性の向上により、相対性が破れる分子機構の詳細が明らかになることが期待される。
軸索・樹状突起特異的な分子の濃縮機構
極性関連分子の軸索や樹状突起への選択的な局在には、キネシンやダイニンなどの微小管依存的モータータンパク質が重要な役割を果たすと考えられている[68] [69]。神経細胞に発現するキネシンのモータードメインを神経細胞に発現させ、その局在解析から軸索特異的なキネシンモータードメインの濃縮が確認された[70] [71] [72]。また、軸索に特異的に濃縮するメカニズムとしてチューブリンの翻訳後修飾が提唱されたが[73]、それだけでは説明がつかないという報告もあり[74]、まだよくわかっていない。
関連項目
参考文献
- ↑ 1.0 1.1 1.2
Craig, A.M., & Banker, G. (1994).
Neuronal polarity. Annual review of neuroscience, 17, 267-310. [PubMed:8210176] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2
Arimura, N., & Kaibuchi, K. (2007).
Neuronal polarity: from extracellular signals to intracellular mechanisms. Nature reviews. Neuroscience, 8(3), 194-205. [PubMed:17311006] [WorldCat] [DOI] - ↑
Baas, P.W., Black, M.M., & Banker, G.A. (1989).
Changes in microtubule polarity orientation during the development of hippocampal neurons in culture. The Journal of cell biology, 109(6 Pt 1), 3085-94. [PubMed:2592416] [PMC] [WorldCat] [DOI] - ↑
Dotti, C.G., Sullivan, C.A., & Banker, G.A. (1988).
The establishment of polarity by hippocampal neurons in culture. The Journal of neuroscience : the official journal of the Society for Neuroscience, 8(4), 1454-68. [PubMed:3282038] [WorldCat] - ↑
Polleux, F., & Snider, W. (2010).
Initiating and growing an axon. Cold Spring Harbor perspectives in biology, 2(4), a001925. [PubMed:20452947] [PMC] [WorldCat] [DOI] - ↑
Cheng, P.L., & Poo, M.M. (2012).
Early events in axon/dendrite polarization. Annual review of neuroscience, 35, 181-201. [PubMed:22715881] [WorldCat] [DOI] - ↑
Tabata, H., & Nakajima, K. (2003).
Multipolar migration: the third mode of radial neuronal migration in the developing cerebral cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(31), 9996-10001. [PubMed:14602813] [PMC] [WorldCat] - ↑ 8.0 8.1
Hatanaka, Y., & Yamauchi, K. (2013).
Excitatory cortical neurons with multipolar shape establish neuronal polarity by forming a tangentially oriented axon in the intermediate zone. Cerebral cortex (New York, N.Y. : 1991), 23(1), 105-13. [PubMed:22267309] [WorldCat] [DOI] - ↑
Yamasaki, E., Tanaka, D.H., Yanagawa, Y., & Murakami, F. (2010).
Cortical GABAergic interneurons transiently assume a sea urchin-like nonpolarized shape before axon initiation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(45), 15221-7. [PubMed:21068327] [PMC] [WorldCat] [DOI] - ↑
Suter, D.M., & Forscher, P. (2000).
Substrate-cytoskeletal coupling as a mechanism for the regulation of growth cone motility and guidance. Journal of neurobiology, 44(2), 97-113. [PubMed:10934315] [WorldCat] - ↑
Mitchison, T., & Kirschner, M. (1988).
Cytoskeletal dynamics and nerve growth. Neuron, 1(9), 761-72. [PubMed:3078414] [WorldCat] [DOI] - ↑ 12.0 12.1
Shimada, T., Toriyama, M., Uemura, K., Kamiguchi, H., Sugiura, T., Watanabe, N., & Inagaki, N. (2008).
Shootin1 interacts with actin retrograde flow and L1-CAM to promote axon outgrowth. The Journal of cell biology, 181(5), 817-29. [PubMed:18519736] [PMC] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2
Toriyama, M., Kozawa, S., Sakumura, Y., & Inagaki, N. (2013).
Conversion of a signal into forces for axon outgrowth through Pak1-mediated shootin1 phosphorylation. Current biology : CB, 23(6), 529-34. [PubMed:23453953] [WorldCat] [DOI] - ↑
Bard, L., Boscher, C., Lambert, M., Mège, R.M., Choquet, D., & Thoumine, O. (2008).
A molecular clutch between the actin flow and N-cadherin adhesions drives growth cone migration. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(23), 5879-90. [PubMed:18524892] [PMC] [WorldCat] [DOI] - ↑
Marsick, B.M., San Miguel-Ruiz, J.E., & Letourneau, P.C. (2012).
Activation of ezrin/radixin/moesin mediates attractive growth cone guidance through regulation of growth cone actin and adhesion receptors. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(1), 282-96. [PubMed:22219290] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1
Kubo, Y., Baba, K., Toriyama, M., Minegishi, T., Sugiura, T., Kozawa, S., ..., & Inagaki, N. (2015).
Shootin1-cortactin interaction mediates signal-force transduction for axon outgrowth. The Journal of cell biology, 210(4), 663-76. [PubMed:26261183] [PMC] [WorldCat] [DOI] - ↑
Witte, H., Neukirchen, D., & Bradke, F. (2008).
Microtubule stabilization specifies initial neuronal polarization. The Journal of cell biology, 180(3), 619-32. [PubMed:18268107] [PMC] [WorldCat] [DOI] - ↑ 18.0 18.1
Barnes, A.P., & Polleux, F. (2009).
Establishment of axon-dendrite polarity in developing neurons. Annual review of neuroscience, 32, 347-81. [PubMed:19400726] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Inagaki, N., Chihara, K., Arimura, N., Ménager, C., Kawano, Y., Matsuo, N., ..., & Kaibuchi, K. (2001).
CRMP-2 induces axons in cultured hippocampal neurons. Nature neuroscience, 4(8), 781-2. [PubMed:11477421] [WorldCat] [DOI] - ↑
Fukata, Y., Itoh, T.J., Kimura, T., Ménager, C., Nishimura, T., Shiromizu, T., ..., & Kaibuchi, K. (2002).
CRMP-2 binds to tubulin heterodimers to promote microtubule assembly. Nature cell biology, 4(8), 583-91. [PubMed:12134159] [WorldCat] [DOI] - ↑
Shirane, M., & Nakayama, K.I. (2006).
Protrudin induces neurite formation by directional membrane trafficking. Science (New York, N.Y.), 314(5800), 818-21. [PubMed:17082457] [WorldCat] [DOI] - ↑
Liu, J., Lamb, D., Chou, M.M., Liu, Y.J., & Li, G. (2007).
Nerve growth factor-mediated neurite outgrowth via regulation of Rab5. Molecular biology of the cell, 18(4), 1375-84. [PubMed:17267689] [PMC] [WorldCat] [DOI] - ↑
Takano, T., Tomomura, M., Yoshioka, N., Tsutsumi, K., Terasawa, Y., Saito, T., ..., & Hisanaga, S. (2012).
LMTK1/AATYK1 is a novel regulator of axonal outgrowth that acts via Rab11 in a Cdk5-dependent manner. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(19), 6587-99. [PubMed:22573681] [PMC] [WorldCat] [DOI] - ↑
Deinhardt, K., Salinas, S., Verastegui, C., Watson, R., Worth, D., Hanrahan, S., ..., & Schiavo, G. (2006).
Rab5 and Rab7 control endocytic sorting along the axonal retrograde transport pathway. Neuron, 52(2), 293-305. [PubMed:17046692] [WorldCat] [DOI] - ↑
Arimura, N., Kimura, T., Nakamuta, S., Taya, S., Funahashi, Y., Hattori, A., ..., & Kaibuchi, K. (2009).
Anterograde transport of TrkB in axons is mediated by direct interaction with Slp1 and Rab27. Developmental cell, 16(5), 675-86. [PubMed:19460344] [WorldCat] [DOI] - ↑
Ascaño, M., Richmond, A., Borden, P., & Kuruvilla, R. (2009).
Axonal targeting of Trk receptors via transcytosis regulates sensitivity to neurotrophin responses. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(37), 11674-85. [PubMed:19759314] [PMC] [WorldCat] [DOI] - ↑
Eva, R., Dassie, E., Caswell, P.T., Dick, G., ffrench-Constant, C., Norman, J.C., & Fawcett, J.W. (2010).
Rab11 and its effector Rab coupling protein contribute to the trafficking of beta 1 integrins during axon growth in adult dorsal root ganglion neurons and PC12 cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(35), 11654-69. [PubMed:20810886] [PMC] [WorldCat] [DOI] - ↑
Nakazawa, H., Sada, T., Toriyama, M., Tago, K., Sugiura, T., Fukuda, M., & Inagaki, N. (2012).
Rab33a mediates anterograde vesicular transport for membrane exocytosis and axon outgrowth. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(37), 12712-25. [PubMed:22972995] [PMC] [WorldCat] [DOI] - ↑
Dupraz, S., Grassi, D., Bernis, M.E., Sosa, L., Bisbal, M., Gastaldi, L., ..., & Quiroga, S. (2009).
The TC10-Exo70 complex is essential for membrane expansion and axonal specification in developing neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(42), 13292-301. [PubMed:19846717] [PMC] [WorldCat] [DOI] - ↑
Wang, T., Liu, Y., Xu, X.H., Deng, C.Y., Wu, K.Y., Zhu, J., ..., & Luo, Z.G. (2011).
Lgl1 activation of rab10 promotes axonal membrane trafficking underlying neuronal polarization. Developmental cell, 21(3), 431-44. [PubMed:21856246] [WorldCat] [DOI] - ↑
Adler, C.E., Fetter, R.D., & Bargmann, C.I. (2006).
UNC-6/Netrin induces neuronal asymmetry and defines the site of axon formation. Nature neuroscience, 9(4), 511-8. [PubMed:16520734] [PMC] [WorldCat] [DOI] - ↑
Shelly, M., Cancedda, L., Lim, B.K., Popescu, A.T., Cheng, P.L., Gao, H., & Poo, M.M. (2011).
Semaphorin3A regulates neuronal polarization by suppressing axon formation and promoting dendrite growth. Neuron, 71(3), 433-46. [PubMed:21835341] [PMC] [WorldCat] [DOI] - ↑
Nakamuta, S., Funahashi, Y., Namba, T., Arimura, N., Picciotto, M.R., Tokumitsu, H., ..., & Kaibuchi, K. (2011).
Local application of neurotrophins specifies axons through inositol 1,4,5-trisphosphate, calcium, and Ca2+/calmodulin-dependent protein kinases. Science signaling, 4(199), ra76. [PubMed:22087032] [WorldCat] [DOI] - ↑
Yi, J.J., Barnes, A.P., Hand, R., Polleux, F., & Ehlers, M.D. (2010).
TGF-beta signaling specifies axons during brain development. Cell, 142(1), 144-57. [PubMed:20603020] [PMC] [WorldCat] [DOI] - ↑
Ozdinler, P.H., & Macklis, J.D. (2006).
IGF-I specifically enhances axon outgrowth of corticospinal motor neurons. Nature neuroscience, 9(11), 1371-81. [PubMed:17057708] [WorldCat] [DOI] - ↑
Prasad, B.C., & Clark, S.G. (2006).
Wnt signaling establishes anteroposterior neuronal polarity and requires retromer in C. elegans. Development (Cambridge, England), 133(9), 1757-66. [PubMed:16571624] [WorldCat] [DOI] - ↑
Yang, G.Y., & Luo, Z.G. (2011).
Implication of Wnt signaling in neuronal polarization. Developmental neurobiology, 71(6), 495-507. [PubMed:21557503] [WorldCat] [DOI] - ↑
Shelly, M., Cancedda, L., Heilshorn, S., Sumbre, G., & Poo, M.M. (2007).
LKB1/STRAD promotes axon initiation during neuronal polarization. Cell, 129(3), 565-77. [PubMed:17482549] [WorldCat] [DOI] - ↑ 39.0 39.1
Esch, T., Lemmon, V., & Banker, G. (1999).
Local presentation of substrate molecules directs axon specification by cultured hippocampal neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(15), 6417-26. [PubMed:10414970] [PMC] [WorldCat] - ↑
Guo, W., Jiang, H., Gray, V., Dedhar, S., & Rao, Y. (2007).
Role of the integrin-linked kinase (ILK) in determining neuronal polarity. Developmental biology, 306(2), 457-68. [PubMed:17490631] [WorldCat] [DOI] - ↑
Lei, W.L., Xing, S.G., Deng, C.Y., Ju, X.C., Jiang, X.Y., & Luo, Z.G. (2012).
Laminin/β1 integrin signal triggers axon formation by promoting microtubule assembly and stabilization. Cell research, 22(6), 954-72. [PubMed:22430151] [PMC] [WorldCat] [DOI] - ↑
Ménager, C., Arimura, N., Fukata, Y., & Kaibuchi, K. (2004).
PIP3 is involved in neuronal polarization and axon formation. Journal of neurochemistry, 89(1), 109-18. [PubMed:15030394] [WorldCat] [DOI] - ↑
Shi, S.H., Jan, L.Y., & Jan, Y.N. (2003).
Hippocampal neuronal polarity specified by spatially localized mPar3/mPar6 and PI 3-kinase activity. Cell, 112(1), 63-75. [PubMed:12526794] [WorldCat] [DOI] - ↑
Yoshimura, T., Kawano, Y., Arimura, N., Kawabata, S., Kikuchi, A., & Kaibuchi, K. (2005).
GSK-3beta regulates phosphorylation of CRMP-2 and neuronal polarity. Cell, 120(1), 137-49. [PubMed:15652488] [WorldCat] [DOI] - ↑
Tahirovic, S., Hellal, F., Neukirchen, D., Hindges, R., Garvalov, B.K., Flynn, K.C., ..., & Bradke, F. (2010).
Rac1 regulates neuronal polarization through the WAVE complex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(20), 6930-43. [PubMed:20484635] [PMC] [WorldCat] [DOI] - ↑
Mori, T., Wada, T., Suzuki, T., Kubota, Y., & Inagaki, N. (2007).
Singar1, a novel RUN domain-containing protein, suppresses formation of surplus axons for neuronal polarity. The Journal of biological chemistry, 282(27), 19884-93. [PubMed:17439943] [WorldCat] [DOI] - ↑
Schwamborn, J.C., & Püschel, A.W. (2004).
The sequential activity of the GTPases Rap1B and Cdc42 determines neuronal polarity. Nature neuroscience, 7(9), 923-9. [PubMed:15286792] [WorldCat] [DOI] - ↑
Yoshimura, T., Arimura, N., Kawano, Y., Kawabata, S., Wang, S., & Kaibuchi, K. (2006).
Ras regulates neuronal polarity via the PI3-kinase/Akt/GSK-3beta/CRMP-2 pathway. Biochemical and biophysical research communications, 340(1), 62-8. [PubMed:16343426] [WorldCat] [DOI] - ↑
Oinuma, I., Katoh, H., & Negishi, M. (2007).
R-Ras controls axon specification upstream of glycogen synthase kinase-3beta through integrin-linked kinase. The Journal of biological chemistry, 282(1), 303-18. [PubMed:17107957] [WorldCat] [DOI] - ↑
Jacobs, T., Causeret, F., Nishimura, Y.V., Terao, M., Norman, A., Hoshino, M., & Nikolić, M. (2007).
Localized activation of p21-activated kinase controls neuronal polarity and morphology. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(32), 8604-15. [PubMed:17687038] [PMC] [WorldCat] [DOI] - ↑ 51.0 51.1
Toriyama, M., Shimada, T., Kim, K.B., Mitsuba, M., Nomura, E., Katsuta, K., ..., & Inagaki, N. (2006).
Shootin1: A protein involved in the organization of an asymmetric signal for neuronal polarization. The Journal of cell biology, 175(1), 147-57. [PubMed:17030985] [PMC] [WorldCat] [DOI] - ↑
Aizawa, H., Wakatsuki, S., Ishii, A., Moriyama, K., Sasaki, Y., Ohashi, K., ..., & Yahara, I. (2001).
Phosphorylation of cofilin by LIM-kinase is necessary for semaphorin 3A-induced growth cone collapse. Nature neuroscience, 4(4), 367-73. [PubMed:11276226] [WorldCat] [DOI] - ↑
Da Silva, J.S., Medina, M., Zuliani, C., Di Nardo, A., Witke, W., & Dotti, C.G. (2003).
RhoA/ROCK regulation of neuritogenesis via profilin IIa-mediated control of actin stability. The Journal of cell biology, 162(7), 1267-79. [PubMed:14517206] [PMC] [WorldCat] [DOI] - ↑
Guo, S., & Kemphues, K.J. (1995).
par-1, a gene required for establishing polarity in C. elegans embryos, encodes a putative Ser/Thr kinase that is asymmetrically distributed. Cell, 81(4), 611-20. [PubMed:7758115] [WorldCat] [DOI] - ↑
Barnes, A.P., Lilley, B.N., Pan, Y.A., Plummer, L.J., Powell, A.W., Raines, A.N., ..., & Polleux, F. (2007).
LKB1 and SAD kinases define a pathway required for the polarization of cortical neurons. Cell, 129(3), 549-63. [PubMed:17482548] [WorldCat] [DOI] - ↑
Insolera, R., Chen, S., & Shi, S.H. (2011).
Par proteins and neuronal polarity. Developmental neurobiology, 71(6), 483-94. [PubMed:21557502] [PMC] [WorldCat] [DOI] - ↑
Nishimura, T., Kato, K., Yamaguchi, T., Fukata, Y., Ohno, S., & Kaibuchi, K. (2004).
Role of the PAR-3-KIF3 complex in the establishment of neuronal polarity. Nature cell biology, 6(4), 328-34. [PubMed:15048131] [WorldCat] [DOI] - ↑
Nishimura, T., Yamaguchi, T., Kato, K., Yoshizawa, M., Nabeshima, Y., Ohno, S., ..., & Kaibuchi, K. (2005).
PAR-6-PAR-3 mediates Cdc42-induced Rac activation through the Rac GEFs STEF/Tiam1. Nature cell biology, 7(3), 270-7. [PubMed:15723051] [WorldCat] [DOI] - ↑
Chen, Y.M., Wang, Q.J., Hu, H.S., Yu, P.C., Zhu, J., Drewes, G., ..., & Luo, Z.G. (2006).
Microtubule affinity-regulating kinase 2 functions downstream of the PAR-3/PAR-6/atypical PKC complex in regulating hippocampal neuronal polarity. Proceedings of the National Academy of Sciences of the United States of America, 103(22), 8534-9. [PubMed:16717194] [PMC] [WorldCat] [DOI] - ↑
Yoshimura, Y., Terabayashi, T., & Miki, H. (2010).
Par1b/MARK2 phosphorylates kinesin-like motor protein GAKIN/KIF13B to regulate axon formation. Molecular and cellular biology, 30(9), 2206-19. [PubMed:20194617] [PMC] [WorldCat] [DOI] - ↑
Terabayashi, T., Itoh, T.J., Yamaguchi, H., Yoshimura, Y., Funato, Y., Ohno, S., & Miki, H. (2007).
Polarity-regulating kinase partitioning-defective 1/microtubule affinity-regulating kinase 2 negatively regulates development of dendrites on hippocampal neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(48), 13098-107. [PubMed:18045904] [PMC] [WorldCat] [DOI] - ↑ Turing AM
The Chemical Basis of Morphogenesis.
Philos. Trans. R. Soc. London B Biol. Sci. :1952 - ↑
Meinhardt, H., & Gierer, A. (2000).
Pattern formation by local self-activation and lateral inhibition. BioEssays : news and reviews in molecular, cellular and developmental biology, 22(8), 753-60. [PubMed:10918306] [WorldCat] [DOI] - ↑
Fivaz, M., Bandara, S., Inoue, T., & Meyer, T. (2008).
Robust neuronal symmetry breaking by Ras-triggered local positive feedback. Current biology : CB, 18(1), 44-50. [PubMed:18158244] [WorldCat] [DOI] - ↑
Seetapun, D., & Odde, D.J. (2010).
Cell-length-dependent microtubule accumulation during polarization. Current biology : CB, 20(11), 979-88. [PubMed:20493705] [WorldCat] [DOI] - ↑ 66.0 66.1 66.2
Toriyama, M., Sakumura, Y., Shimada, T., Ishii, S., & Inagaki, N. (2010).
A diffusion-based neurite length-sensing mechanism involved in neuronal symmetry breaking. Molecular systems biology, 6, 394. [PubMed:20664640] [PMC] [WorldCat] [DOI] - ↑
Katsuno, H., Toriyama, M., Hosokawa, Y., Mizuno, K., Ikeda, K., Sakumura, Y., & Inagaki, N. (2015).
Actin Migration Driven by Directional Assembly and Disassembly of Membrane-Anchored Actin Filaments. Cell reports, 12(4), 648-60. [PubMed:26190109] [WorldCat] [DOI] - ↑
Hirokawa, N., Noda, Y., Tanaka, Y., & Niwa, S. (2009).
Kinesin superfamily motor proteins and intracellular transport. Nature reviews. Molecular cell biology, 10(10), 682-96. [PubMed:19773780] [WorldCat] [DOI] - ↑
Kapitein, L.C., Schlager, M.A., Kuijpers, M., Wulf, P.S., van Spronsen, M., MacKintosh, F.C., & Hoogenraad, C.C. (2010).
Mixed microtubules steer dynein-driven cargo transport into dendrites. Current biology : CB, 20(4), 290-9. [PubMed:20137950] [WorldCat] [DOI] - ↑
Setou, M., Nakagawa, T., Seog, D.H., & Hirokawa, N. (2000).
Kinesin superfamily motor protein KIF17 and mLin-10 in NMDA receptor-containing vesicle transport. Science (New York, N.Y.), 288(5472), 1796-802. [PubMed:10846156] [WorldCat] [DOI] - ↑
Jacobson, C., Schnapp, B., & Banker, G.A. (2006).
A change in the selective translocation of the Kinesin-1 motor domain marks the initial specification of the axon. Neuron, 49(6), 797-804. [PubMed:16543128] [WorldCat] [DOI] - ↑
Konishi, Y., & Setou, M. (2009).
Tubulin tyrosination navigates the kinesin-1 motor domain to axons. Nature neuroscience, 12(5), 559-67. [PubMed:19377471] [WorldCat] [DOI] - ↑
Hammond, J.W., Huang, C.F., Kaech, S., Jacobson, C., Banker, G., & Verhey, K.J. (2010).
Posttranslational modifications of tubulin and the polarized transport of kinesin-1 in neurons. Molecular biology of the cell, 21(4), 572-83. [PubMed:20032309] [PMC] [WorldCat] [DOI] - ↑
Nakata, T., Niwa, S., Okada, Y., Perez, F., & Hirokawa, N. (2011).
Preferential binding of a kinesin-1 motor to GTP-tubulin-rich microtubules underlies polarized vesicle transport. The Journal of cell biology, 194(2), 245-55. [PubMed:21768290] [PMC] [WorldCat] [DOI]