「Aキナーゼアンカータンパク質」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の5版が非表示) | |||
| 1行目: | 1行目: | ||
{{box|text= Aキナーゼアンカータンパク質(A-kinase anchoring proteins, AKAPs)はcAMP依存性タンパク質キナーゼ(Aキナーゼ)制御サブユニットに結合するタンパク質として機能的に定義される一群のタンパク質である。現在までに60を超えるタンパクがこの定義に当てはまることが確認されている <ref name=Omar2020><pubmed>33082006</pubmed></ref><ref name=Omar2020><pubmed>33082006</pubmed></ref>。機能で定義されるため、異なるAKAP間に遺伝子相同性は無く、多様な起源を持ったタンパク質群である。Aキナーゼ以外にも、さまざまなシグナル伝達酵素、細胞構成タンパク質と結合し、シグナル伝達効率化や、細胞内の局所的な反応等、細胞シグナル伝達の最適化を担っている。}} | {{box|text= Aキナーゼアンカータンパク質(A-kinase anchoring proteins, AKAPs)はcAMP依存性タンパク質キナーゼ(Aキナーゼ)制御サブユニットに結合するタンパク質として機能的に定義される一群のタンパク質である。現在までに60を超えるタンパクがこの定義に当てはまることが確認されている <ref name=Omar2020><pubmed>33082006</pubmed></ref><ref name=Omar2020><pubmed>33082006</pubmed></ref>。機能で定義されるため、異なるAKAP間に遺伝子相同性は無く、多様な起源を持ったタンパク質群である。Aキナーゼ以外にも、さまざまなシグナル伝達酵素、細胞構成タンパク質と結合し、シグナル伝達効率化や、細胞内の局所的な反応等、細胞シグナル伝達の最適化を担っている。}} | ||
== Aキナーゼアンカータンパク質とは == | == Aキナーゼアンカータンパク質とは == | ||
[[ファイル:Hoshi AKAP Fig1.png|サムネイル|'''図1. AKAPの細胞内局在'''<br>様々な細胞内小器官に局在する<ref name=Omar2020><pubmed>33082006</pubmed></ref>]] | [[ファイル:Hoshi AKAP Fig1.png|サムネイル|'''図1. AKAPの細胞内局在'''<br>様々な細胞内小器官に局在する<ref name=Omar2020><pubmed>33082006</pubmed></ref>]] | ||
初めてAキナーゼ制御サブユニットに結合するタンパク質が記載されたのは、1984年である。Charles S. Rubinは、後にAKAP75として知られることになるタンパク質を、カルモジュリン、Aキナーゼ制御サブユニットIIとともに分離し、報告した<ref name=Sarkar1984><pubmed>6086653</pubmed></ref>。その後、John D. Scottを含め多くのグループが精力的にさまざまなAキナーゼ結合タンパク質(AKAP)があることを示した。このタンパク質が単にAキナーゼに結合するだけでなく、さまざまな酵素、細胞骨格、細胞小器官の局在タンパクとも結合することを見出し、細胞内シグナルの区画化(compartmentalization)に深く関わっていることを明らかにした('''図1''')。 | |||
==サブタイプ== | ==サブタイプ== | ||
AKAPのタンパク質名は古典的なタンパク質精製時の命名法から、SDS-PAGE上の分子量を使ったので、同じタンパク質でも種によってAKAP番号が異なることがあるので混乱を招きやすい。一方、遺伝子名はAKAP1、AKAP2 などとなっているので、最近は、その明快さから遺伝子名をタンパク質名として使っている例も見受けられる。[例)遺伝子名:AKAP5、タンパク質名:AKAP75(ウシ)、AKAP79(ヒト)、AKAP150(齧歯類)] | |||
PKA結合タンパク質をAKAPと定義すると、AKAP | PKA結合タンパク質をAKAPと定義すると、AKAP を呼ばれるタンパク以外にも、例えば神経に多く発現しているMAP2もAKAPとして機能することが知られており、どこまでをAKAPと呼ぶか研究者により違いが見られる。そのため、この項では遺伝子名にAKAPとつけられた13種を'''表'''に示し要約する。より網羅的な一覧は文献<ref name=Omar2020><pubmed>33082006</pubmed></ref>を参照のこと。 | ||
[[ファイル:Hoshi AKAP Fig2.png|サムネイル|'''図2. AKAPの基本構造と、PKAの結合様式''']] | [[ファイル:Hoshi AKAP Fig2.png|サムネイル|'''図2. AKAPの基本構造と、PKAの結合様式''']] | ||
== 構造 == | == 構造 == | ||
AKAPは共通した起源タンパク質を持たないにも関わらず、1)Aキナーゼ結合部位、2)細胞局在部位、3)その他のシグナル酵素結合部位、4)制御対象タンパク質結合部位のモジュールから構成されるという特徴を共有する('''図2''')。細胞膜に局在するAKAP | AKAPは共通した起源タンパク質を持たないにも関わらず、1)Aキナーゼ結合部位、2)細胞局在部位、3)その他のシグナル酵素結合部位、4)制御対象タンパク質結合部位のモジュールから構成されるという特徴を共有する('''図2''')。細胞膜に局在するAKAP は、cAMPを生成するアデニールサイクラーゼと結合するものや(AKAP5, AKAP9)、cAMPを分解するフォスフォジエステレースを保持するもの(AKAP2, 6, 9, 12)があり、cAMPの分散を制限し局所的上昇の機序を担うと考えられている<ref name=Dessauer2009><pubmed>19684092</pubmed></ref><ref name=Omar2020><pubmed>33082006</pubmed></ref><ref name=Tasken2004><pubmed>14715913</pubmed></ref>。また、多くのAKAPはキナーゼとともにフォスファターゼを保持することが多く、対象タンパクのリン酸化、脱リン酸化を最適に調整して言えると考えられている。注意しなければならないのは、同定された結合酵素が全て同時に結合しているとは限らないこと、刺激によって異なる細胞部位を行き来することがあるなど、AKAPタンパク複合体がダイナミックに変化することである。 | ||
AKAPは各サブタイプ共通して、比較的相同性を持つ短いαヘリックスを介してAキナーゼの制御サブユニットの2量体領域(dimerization domain)と結合する<ref name=Falcone2025><pubmed>40199400</pubmed></ref><ref name=Gold2006><pubmed>17081989</pubmed></ref>('''図2''')。Aキナーゼの制御サブユニットにはRI, RIIの二種類があり、RIは細胞質にあって、細胞全体のAキナーゼ反応を担い、RIIは細胞小器官に局在し局所的なAキナーゼ反応を担う<ref name=Taylor2005><pubmed>16214430</pubmed></ref>。RIIの細胞小器官局在はAKAPによる。実際AKAPの多くはRII特異的に結合することが知られている<ref name=Omar2020><pubmed>33082006</pubmed></ref>。AKAPのPKA結合部位は比較的保存され、RI サブユニット特異性、もしくはRII サブユニット特異性のあるAKAPのサブグループ間ではAキナーゼの結合部位は比較的保存されている<ref name=Alto2003><pubmed>12672969</pubmed></ref><ref name=Falcone2025><pubmed>40199400</pubmed></ref><ref name=Wang2015><pubmed>25765284</pubmed></ref>。それらのAキナーゼ結合部位は、Aキナーゼの制御サブユニットの2量体領域を横断するように結合する<ref name=Falcone2025><pubmed>40199400</pubmed></ref><ref name=Gold2006><pubmed>17081989</pubmed></ref>('''図2''')。この保存されたαヘリックスのアミノ酸配列を利用し、それぞれ、AKAP結合競合ペプチドが開発された(RIにはRI-STAD <ref name=Wang2015><pubmed>25765284</pubmed></ref>、RIIにはAKAP-IS <ref name=Alto2003><pubmed>12672969</pubmed></ref>)。これらの競合ペプチドは、研究対象の細胞応答にAKAPが関与しているか、などの確認などに利用されている。 | |||
[[ファイル:Hoshi AKAP Fig3.png|サムネイル|'''図3. AKAPの細胞内局在'''<br>AKAP79/150タンパクの構造、チャンネル複合体例とその機能<br>枠は対象チャンネルへの主要作用酵素を示す。PKC: タンパク質キナーゼC、PKA: A-キナーゼ、PP2B: カルシニューリン。文献<ref name=Hall2007><pubmed>17279627</pubmed></ref><ref name=Hoshi2003><pubmed>12754513</pubmed></ref><ref name=Sanderson2012><pubmed>23100425</pubmed></ref>より作成]] | [[ファイル:Hoshi AKAP Fig3.png|サムネイル|'''図3. AKAPの細胞内局在'''<br>AKAP79/150タンパクの構造、チャンネル複合体例とその機能<br>枠は対象チャンネルへの主要作用酵素を示す。PKC: タンパク質キナーゼC、PKA: A-キナーゼ、PP2B: カルシニューリン。文献<ref name=Hall2007><pubmed>17279627</pubmed></ref><ref name=Hoshi2003><pubmed>12754513</pubmed></ref><ref name=Sanderson2012><pubmed>23100425</pubmed></ref>より作成]] | ||
==機能== | ==機能== | ||
複数タンパク質と結合する能力は、細胞入力―細胞出力など、作動経路全体を一つのタンパク質複合体として至近距離にまとめ、シグナル伝達の速度・特異性を促進する役割がある。細胞内局所に限局したシグナル伝達を行うことで、cAMPという、多くのシグナル伝達経路に共有される2次メッセンジャーの経路間での混線を防ぎ、特異性を増す枠組みと考えられる<ref name=Dessauer2009><pubmed>19684092</pubmed></ref>。また、多くの場合、特定のシグナル伝達に関与する複数の酵素をAKAPが繋ぎ止めたり、その酵素の標的タンパク質と共在させることで、伝達効率、特異性を高めていると考えられている<ref name=Omar2020><pubmed>33082006</pubmed></ref><ref name=Omar2020><pubmed>33082006</pubmed></ref>。また、場合により全くA―キナーゼが関与せず対象タンパクを修飾することや、AKAP係留シグナル酵素を異なる組み合わせで使うことによって複数の制御経路を同一AKAP複合体が担うことがある('''図3''')、<ref name=Hoshi2005><pubmed>16228013</pubmed></ref>。 | |||
{| class="wikitable" | {| class="wikitable" | ||
|+表. AKAPの一覧 | |+表. AKAPの一覧 | ||
! 遺伝子名 !! タンパク質名 !! | ! 遺伝子名 !! タンパク質名 !! 係留タンパク・酵素<ref name=Bucko2021><pubmed>32628872</pubmed></ref> !! 特徴 !! 関連した疾患 | ||
|- | |- | ||
! | ! AKAP1 | ||
| | | D-AKAP1 など || PP1, PP2B, RSK1, src etc. || ミトコンドリア機能<ref name=Merrill2014><pubmed>24412345</pubmed></ref> || 緑内障 <ref name=Edwards2020><pubmed>32312949</pubmed></ref>、乳がん <ref name=Bucko2021><pubmed>32628872</pubmed></ref> | ||
|- | |- | ||
! | ! AKAP2 | ||
| | | AKAP-KL など || mypT1, AQP0, etc. || 細胞骨格、形質膜 || | ||
|- | |- | ||
! | ! AKAP3 | ||
| | | AKAP110 など || PDE4A, Gα13, etc. || || | ||
|- | |- | ||
! | ! AKAP4 | ||
| AKAP4 など || | | AKAP4 など || ERK1/2, RhoA, etc || || | ||
|- | |- | ||
! | ! AKAP5 | ||
| AKAP75/79/150 など || | | AKAP75/79/150 など || AC, PKC, CaM, PP2B, PDZ proteins, Cav1.2, Kv7.2 TRPV1/4, etc || 形質膜、長期抑制現象(LTD)、M電流抑制 || 総合失調症、糖尿病 <ref name=Bucko2021><pubmed>32628872</pubmed></ref> | ||
|- | |- | ||
! | ! AKAP6 | ||
| | | mAKAP など || PKC, MEK5, ERK5, RSK3, PDE4D3 etc || 心筋(筋小胞体) || 不整脈 <ref name=Suryavanshi2018><pubmed>29370121</pubmed></ref>、心筋症<ref name=Bucko2021><pubmed>32628872</pubmed></ref> | ||
|- | |- | ||
! | ! AKAP7 | ||
| | | AKAP15/18 など || Cav, AQP2 etc || 心筋(形質膜) || 不整脈 <ref name=Suryavanshi2018><pubmed>29370121</pubmed></ref>、熱性痙攣<ref name=Bucko2021><pubmed>32628872</pubmed></ref> | ||
|- | |- | ||
! | ! AKAP8 | ||
| | | AKAP95 など || AMY-1, CASP3, RSK1 etc. || 核 || | ||
|- | |- | ||
! | ! AKAP9 | ||
| | | Yotiao/AKAP450 など || AC, PDE4D3, PKC, PP2A, tubulin, CK1, CaM, cyclin E, cdk2, Kv7.1 etc. || スプライシングバリアントによって細胞局在が異なる || QT延長症候群 <ref name=Bucko2021><pubmed>32628872</pubmed></ref> | ||
|- | |- | ||
! | ! AKAP10 | ||
| | | D-AKAP2 など || Rab4, Rab11 || || 不整脈 <ref name=Suryavanshi2018><pubmed>29370121</pubmed></ref> | ||
|- | |- | ||
! | ! AKAP11 | ||
| | | AKAP220 など || PP1, GSK3 β, IQGAP, actin etc || || 尿崩症<ref name=Bucko2021><pubmed>32628872</pubmed></ref> | ||
|- | |- | ||
! | ! AKAP12 | ||
| | | Gravin/AKAP250 など || CaM, PDE4D, PKC etc. || || 腎不全、前立腺癌、重症筋無力症<ref name=Bucko2021><pubmed>32628872</pubmed></ref> | ||
|- | |- | ||
! | ! AKAP13 | ||
| | | AKAP-lbc/HT31 など || RhoA, Gα12, MLTK || 細胞骨格 || 高血圧 <ref name=Suryavanshi2018><pubmed>29370121</pubmed></ref> | ||
|} | |} | ||
遺伝子名にAKAPと名前がついているものに限り、その他にも同様な機能を持つタンパク質は存在する。<br> | 遺伝子名にAKAPと名前がついているものに限り、その他にも同様な機能を持つタンパク質は存在する。<br> | ||
[[PP1]]: [[タンパク質脱リン酸化酵素1]] ([[protein phosphatase 1]]); [[PP2B]]: [[タンパク質脱リン酸化酵素2B]] ([[protein phosphatase 2B]] / [[カルシニューリン]]); [[RSK1]]: [[リボソームS6キナーゼ1]] ([[ribosomal S6 kinase 1]]); [[src]]: [[SRCプロトオンコジンチロシンキナーゼ]] ([[SRC proto-oncogene tyrosine kinase]]); [[mypT1]]: [[ミオシンリン酸化タンパク質T1]] ([[myosin phosphoprotein T1]]); [[AQP0]]: [[アクアポリン0]] ([[aquaporin 0]]); [[PDE4A]]: [[ホスホジエステラーゼ4A]] ([[phosphodiesterase 4A]]); [[Gα13]]: [[Gタンパク質アルファサブユニット13]] ([[G protein alpha subunit 13]]); [[ERK1]]/[[ERK2|2]]: [[細胞外シグナル制御キナーゼ1]]/[[細胞外シグナル制御キナーゼ2|2]] ([[extracellular signal-regulated kinase 1]]/[[extracellular signal-regulated kinase 2|2]]); [[RhoA]]: [[RhoA低分子GTP結合タンパク質]] ([[RhoA small GTPase]]); [[AC]]: [[アデニル酸シクラーゼse]]); [[PKC]]: [[プロテインキナーゼC]] ([[protein kinase C]]); [[CaM]]: [[カルモジュリン]] (calmodulin); [[PDZ proteins]]: [[PDZドメインタンパク質]] ([[PDZ domain proteins]]); [[Cav1.2]]: [[電位依存性カルシウムチャネル1.2]] ([[voltage-dependent calcium channel 1.2]]); [[Kv7.2]]: [[電位依存性カリウムチャネル7.2]] ([[voltage-gated potassium channel 7.2]]); [[TRPV1]]/[[ TRPV4|4]]: [[一過性受容体電位チャネルV1]]/[[一過性受容体電位チャネルV4|V4]] ([[transient receptor potential vanilloid channel 1]]/[[transient receptor potential vanilloid channel 4|4]]); [[MEK5]]: [[MAPキナーゼ]]/[[ERKキナーゼ5]] ([[MAP kinase]] / [[ERK kinase 5]]); [[ERK5]]: [[細胞外シグナル制御キナーゼ5]] ([[extracellular signal-regulated kinase 5]]); [[RSK3]]: [[リボソームS6キナーゼ3]] ([[ribosomal S6 Kinase 3]]); [[PDE4D3]]: [[ホスホジエステラーゼ4D3]] ([[phosphodiesterase 4D3]]); [[AQP2]]: [[アクアポリン2]] ([[aquaporin 2]]); [[AMY-1]]: [[ | [[PP1]]: [[タンパク質脱リン酸化酵素1]] ([[protein phosphatase 1]]); [[PP2B]]: [[タンパク質脱リン酸化酵素2B]] ([[protein phosphatase 2B]] / [[カルシニューリン]]); [[RSK1]]: [[リボソームS6キナーゼ1]] ([[ribosomal S6 kinase 1]]); [[src]]: [[SRCプロトオンコジンチロシンキナーゼ]] ([[SRC proto-oncogene tyrosine kinase]]); [[mypT1]]: [[ミオシンリン酸化タンパク質T1]] ([[myosin phosphoprotein T1]]); [[AQP0]]: [[アクアポリン0]] ([[aquaporin 0]]); [[PDE4A]]: [[ホスホジエステラーゼ4A]] ([[phosphodiesterase 4A]]); [[Gα13]]: [[Gタンパク質アルファサブユニット13]] ([[G protein alpha subunit 13]]); [[ERK1]]/[[ERK2|2]]: [[細胞外シグナル制御キナーゼ1]]/[[細胞外シグナル制御キナーゼ2|2]] ([[extracellular signal-regulated kinase 1]]/[[extracellular signal-regulated kinase 2|2]]); [[RhoA]]: [[RhoA低分子GTP結合タンパク質]] ([[RhoA small GTPase]]); [[AC]]: [[アデニル酸シクラーゼse]]); [[PKC]]: [[プロテインキナーゼC]] ([[protein kinase C]]); [[CaM]]: [[カルモジュリン]] (calmodulin); [[PDZ proteins]]: [[PDZドメインタンパク質]] ([[PDZ domain proteins]]); [[Cav1.2]]: [[電位依存性カルシウムチャネル1.2]] ([[voltage-dependent calcium channel 1.2]]); [[Kv7.2]]: [[電位依存性カリウムチャネル7.2]] ([[voltage-gated potassium channel 7.2]]); [[TRPV1]]/[[ TRPV4|4]]: [[一過性受容体電位チャネルV1]]/[[一過性受容体電位チャネルV4|V4]] ([[transient receptor potential vanilloid channel 1]]/[[transient receptor potential vanilloid channel 4|4]]); [[MEK5]]: [[MAPキナーゼ]]/[[ERKキナーゼ5]] ([[MAP kinase]] / [[ERK kinase 5]]); [[ERK5]]: [[細胞外シグナル制御キナーゼ5]] ([[extracellular signal-regulated kinase 5]]); [[RSK3]]: [[リボソームS6キナーゼ3]] ([[ribosomal S6 Kinase 3]]); [[PDE4D3]]: [[ホスホジエステラーゼ4D3]] ([[phosphodiesterase 4D3]]); [[AQP2]]: [[アクアポリン2]] ([[aquaporin 2]]); [[AMY-1]]: [[アミロイド前駆体タンパク質1]] ([[amyloid precursor protein 1]]); [[CASP3]]: [[カスパーゼ3]] ([[caspase 3]]); [[PP2A]]: [[タンパク質脱リン酸化酵素2A]] ([[protein phosphatase 2A]]); [[tubulin]]: [[チューブリン]]; [[CK1]]: [[カゼインキナーゼ1]] ([[casein kinase 1]]); [[cyclin E]]: [[サイクリンE]]; [[cdk2]]: [[サイクリン依存性キナーゼ2]] ([[cyclin-dependent kinase 2]]); [[Kv7.1]]: [[電位依存性カリウムチャネル7.1]] ([[voltage-gated potassium channel 7.1]]); [[Rab4]]: [[Rab4低分子GTP結合タンパク質]] ([[Rab4 small GTPase]]); [[Rab11]]: [[Rab11低分子GTP結合タンパク質]] ([[Rab11 small GTPase]]); [[GSK3β]]: [[グリコーゲン合成酵素キナーゼ3β]] ([[glycogen synthase kinase 3 β]]); [[IQGAP]]: [[IQモチーフGTPase活性化タンパク質]] ([[IQ motif-containing GTPase activating protein]]); actin: アクチン; [[Gα12]]: [[Gタンパク質αサブユニット12]] ([[G protein α subunit 12]]); [[MLTK]]: [[分裂活性化タンパク質キナーゼ・キナーゼ・キナーゼ20]] ([[mitogen-activated protein kinase kinase kinase 20]]) | ||
== 関連語 == | == 関連語 == | ||
2025年4月20日 (日) 21:13時点における版
Aキナーゼアンカータンパク質(A-kinase anchoring proteins, AKAPs)はcAMP依存性タンパク質キナーゼ(Aキナーゼ)制御サブユニットに結合するタンパク質として機能的に定義される一群のタンパク質である。現在までに60を超えるタンパクがこの定義に当てはまることが確認されている [1][1]。機能で定義されるため、異なるAKAP間に遺伝子相同性は無く、多様な起源を持ったタンパク質群である。Aキナーゼ以外にも、さまざまなシグナル伝達酵素、細胞構成タンパク質と結合し、シグナル伝達効率化や、細胞内の局所的な反応等、細胞シグナル伝達の最適化を担っている。
Aキナーゼアンカータンパク質とは
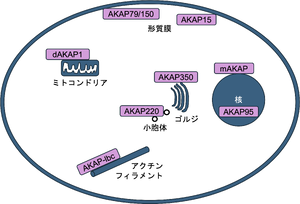
様々な細胞内小器官に局在する[1]
初めてAキナーゼ制御サブユニットに結合するタンパク質が記載されたのは、1984年である。Charles S. Rubinは、後にAKAP75として知られることになるタンパク質を、カルモジュリン、Aキナーゼ制御サブユニットIIとともに分離し、報告した[2]。その後、John D. Scottを含め多くのグループが精力的にさまざまなAキナーゼ結合タンパク質(AKAP)があることを示した。このタンパク質が単にAキナーゼに結合するだけでなく、さまざまな酵素、細胞骨格、細胞小器官の局在タンパクとも結合することを見出し、細胞内シグナルの区画化(compartmentalization)に深く関わっていることを明らかにした(図1)。
サブタイプ
AKAPのタンパク質名は古典的なタンパク質精製時の命名法から、SDS-PAGE上の分子量を使ったので、同じタンパク質でも種によってAKAP番号が異なることがあるので混乱を招きやすい。一方、遺伝子名はAKAP1、AKAP2 などとなっているので、最近は、その明快さから遺伝子名をタンパク質名として使っている例も見受けられる。[例)遺伝子名:AKAP5、タンパク質名:AKAP75(ウシ)、AKAP79(ヒト)、AKAP150(齧歯類)]
PKA結合タンパク質をAKAPと定義すると、AKAP を呼ばれるタンパク以外にも、例えば神経に多く発現しているMAP2もAKAPとして機能することが知られており、どこまでをAKAPと呼ぶか研究者により違いが見られる。そのため、この項では遺伝子名にAKAPとつけられた13種を表に示し要約する。より網羅的な一覧は文献[1]を参照のこと。
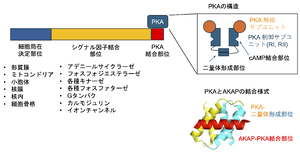
構造
AKAPは共通した起源タンパク質を持たないにも関わらず、1)Aキナーゼ結合部位、2)細胞局在部位、3)その他のシグナル酵素結合部位、4)制御対象タンパク質結合部位のモジュールから構成されるという特徴を共有する(図2)。細胞膜に局在するAKAP は、cAMPを生成するアデニールサイクラーゼと結合するものや(AKAP5, AKAP9)、cAMPを分解するフォスフォジエステレースを保持するもの(AKAP2, 6, 9, 12)があり、cAMPの分散を制限し局所的上昇の機序を担うと考えられている[3][1][4]。また、多くのAKAPはキナーゼとともにフォスファターゼを保持することが多く、対象タンパクのリン酸化、脱リン酸化を最適に調整して言えると考えられている。注意しなければならないのは、同定された結合酵素が全て同時に結合しているとは限らないこと、刺激によって異なる細胞部位を行き来することがあるなど、AKAPタンパク複合体がダイナミックに変化することである。
AKAPは各サブタイプ共通して、比較的相同性を持つ短いαヘリックスを介してAキナーゼの制御サブユニットの2量体領域(dimerization domain)と結合する[5][6](図2)。Aキナーゼの制御サブユニットにはRI, RIIの二種類があり、RIは細胞質にあって、細胞全体のAキナーゼ反応を担い、RIIは細胞小器官に局在し局所的なAキナーゼ反応を担う[7]。RIIの細胞小器官局在はAKAPによる。実際AKAPの多くはRII特異的に結合することが知られている[1]。AKAPのPKA結合部位は比較的保存され、RI サブユニット特異性、もしくはRII サブユニット特異性のあるAKAPのサブグループ間ではAキナーゼの結合部位は比較的保存されている[8][5][9]。それらのAキナーゼ結合部位は、Aキナーゼの制御サブユニットの2量体領域を横断するように結合する[5][6](図2)。この保存されたαヘリックスのアミノ酸配列を利用し、それぞれ、AKAP結合競合ペプチドが開発された(RIにはRI-STAD [9]、RIIにはAKAP-IS [8])。これらの競合ペプチドは、研究対象の細胞応答にAKAPが関与しているか、などの確認などに利用されている。
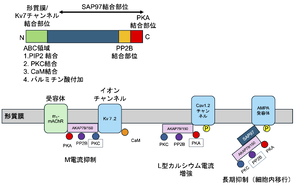
AKAP79/150タンパクの構造、チャンネル複合体例とその機能
枠は対象チャンネルへの主要作用酵素を示す。PKC: タンパク質キナーゼC、PKA: A-キナーゼ、PP2B: カルシニューリン。文献[10][11][12]より作成
機能
複数タンパク質と結合する能力は、細胞入力―細胞出力など、作動経路全体を一つのタンパク質複合体として至近距離にまとめ、シグナル伝達の速度・特異性を促進する役割がある。細胞内局所に限局したシグナル伝達を行うことで、cAMPという、多くのシグナル伝達経路に共有される2次メッセンジャーの経路間での混線を防ぎ、特異性を増す枠組みと考えられる[3]。また、多くの場合、特定のシグナル伝達に関与する複数の酵素をAKAPが繋ぎ止めたり、その酵素の標的タンパク質と共在させることで、伝達効率、特異性を高めていると考えられている[1][1]。また、場合により全くA―キナーゼが関与せず対象タンパクを修飾することや、AKAP係留シグナル酵素を異なる組み合わせで使うことによって複数の制御経路を同一AKAP複合体が担うことがある(図3)、[13]。
| 遺伝子名 | タンパク質名 | 係留タンパク・酵素[14] | 特徴 | 関連した疾患 |
|---|---|---|---|---|
| AKAP1 | D-AKAP1 など | PP1, PP2B, RSK1, src etc. | ミトコンドリア機能[15] | 緑内障 [16]、乳がん [14] |
| AKAP2 | AKAP-KL など | mypT1, AQP0, etc. | 細胞骨格、形質膜 | |
| AKAP3 | AKAP110 など | PDE4A, Gα13, etc. | ||
| AKAP4 | AKAP4 など | ERK1/2, RhoA, etc | ||
| AKAP5 | AKAP75/79/150 など | AC, PKC, CaM, PP2B, PDZ proteins, Cav1.2, Kv7.2 TRPV1/4, etc | 形質膜、長期抑制現象(LTD)、M電流抑制 | 総合失調症、糖尿病 [14] |
| AKAP6 | mAKAP など | PKC, MEK5, ERK5, RSK3, PDE4D3 etc | 心筋(筋小胞体) | 不整脈 [17]、心筋症[14] |
| AKAP7 | AKAP15/18 など | Cav, AQP2 etc | 心筋(形質膜) | 不整脈 [17]、熱性痙攣[14] |
| AKAP8 | AKAP95 など | AMY-1, CASP3, RSK1 etc. | 核 | |
| AKAP9 | Yotiao/AKAP450 など | AC, PDE4D3, PKC, PP2A, tubulin, CK1, CaM, cyclin E, cdk2, Kv7.1 etc. | スプライシングバリアントによって細胞局在が異なる | QT延長症候群 [14] |
| AKAP10 | D-AKAP2 など | Rab4, Rab11 | 不整脈 [17] | |
| AKAP11 | AKAP220 など | PP1, GSK3 β, IQGAP, actin etc | 尿崩症[14] | |
| AKAP12 | Gravin/AKAP250 など | CaM, PDE4D, PKC etc. | 腎不全、前立腺癌、重症筋無力症[14] | |
| AKAP13 | AKAP-lbc/HT31 など | RhoA, Gα12, MLTK | 細胞骨格 | 高血圧 [17] |
遺伝子名にAKAPと名前がついているものに限り、その他にも同様な機能を持つタンパク質は存在する。
PP1: タンパク質脱リン酸化酵素1 (protein phosphatase 1); PP2B: タンパク質脱リン酸化酵素2B (protein phosphatase 2B / カルシニューリン); RSK1: リボソームS6キナーゼ1 (ribosomal S6 kinase 1); src: SRCプロトオンコジンチロシンキナーゼ (SRC proto-oncogene tyrosine kinase); mypT1: ミオシンリン酸化タンパク質T1 (myosin phosphoprotein T1); AQP0: アクアポリン0 (aquaporin 0); PDE4A: ホスホジエステラーゼ4A (phosphodiesterase 4A); Gα13: Gタンパク質アルファサブユニット13 (G protein alpha subunit 13); ERK1/2: 細胞外シグナル制御キナーゼ1/2 (extracellular signal-regulated kinase 1/2); RhoA: RhoA低分子GTP結合タンパク質 (RhoA small GTPase); AC: アデニル酸シクラーゼse); PKC: プロテインキナーゼC (protein kinase C); CaM: カルモジュリン (calmodulin); PDZ proteins: PDZドメインタンパク質 (PDZ domain proteins); Cav1.2: 電位依存性カルシウムチャネル1.2 (voltage-dependent calcium channel 1.2); Kv7.2: 電位依存性カリウムチャネル7.2 (voltage-gated potassium channel 7.2); TRPV1/4: 一過性受容体電位チャネルV1/V4 (transient receptor potential vanilloid channel 1/4); MEK5: MAPキナーゼ/ERKキナーゼ5 (MAP kinase / ERK kinase 5); ERK5: 細胞外シグナル制御キナーゼ5 (extracellular signal-regulated kinase 5); RSK3: リボソームS6キナーゼ3 (ribosomal S6 Kinase 3); PDE4D3: ホスホジエステラーゼ4D3 (phosphodiesterase 4D3); AQP2: アクアポリン2 (aquaporin 2); AMY-1: アミロイド前駆体タンパク質1 (amyloid precursor protein 1); CASP3: カスパーゼ3 (caspase 3); PP2A: タンパク質脱リン酸化酵素2A (protein phosphatase 2A); tubulin: チューブリン; CK1: カゼインキナーゼ1 (casein kinase 1); cyclin E: サイクリンE; cdk2: サイクリン依存性キナーゼ2 (cyclin-dependent kinase 2); Kv7.1: 電位依存性カリウムチャネル7.1 (voltage-gated potassium channel 7.1); Rab4: Rab4低分子GTP結合タンパク質 (Rab4 small GTPase); Rab11: Rab11低分子GTP結合タンパク質 (Rab11 small GTPase); GSK3β: グリコーゲン合成酵素キナーゼ3β (glycogen synthase kinase 3 β); IQGAP: IQモチーフGTPase活性化タンパク質 (IQ motif-containing GTPase activating protein); actin: アクチン; Gα12: Gタンパク質αサブユニット12 (G protein α subunit 12); MLTK: 分裂活性化タンパク質キナーゼ・キナーゼ・キナーゼ20 (mitogen-activated protein kinase kinase kinase 20)
関連語
参考文献
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7
Omar, M.H., & Scott, J.D. (2020).
AKAP Signaling Islands: Venues for Precision Pharmacology. Trends in pharmacological sciences, 41(12), 933-946. [PubMed:33082006] [PMC] [WorldCat] [DOI] - ↑
Sarkar, D., Erlichman, J., & Rubin, C.S. (1984).
Identification of a calmodulin-binding protein that co-purifies with the regulatory subunit of brain protein kinase II. The Journal of biological chemistry, 259(15), 9840-6. [PubMed:6086653] [WorldCat] - ↑ 3.0 3.1
Dessauer, C.W. (2009).
Adenylyl cyclase--A-kinase anchoring protein complexes: the next dimension in cAMP signaling. Molecular pharmacology, 76(5), 935-41. [PubMed:19684092] [PMC] [WorldCat] [DOI] - ↑
Taskén, K., & Aandahl, E.M. (2004).
Localized effects of cAMP mediated by distinct routes of protein kinase A. Physiological reviews, 84(1), 137-67. [PubMed:14715913] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2
Falcone, J.I., Cleveland, K.H., Kang, M., Odle, B.J., Forbush, K.A., & Scott, J.D. (2025).
The evolution of AKAPs and emergence of PKA isotype selective anchoring determinants. The Journal of biological chemistry, 108480. [PubMed:40199400] [WorldCat] [DOI] - ↑ 6.0 6.1
Gold, M.G., Lygren, B., Dokurno, P., Hoshi, N., McConnachie, G., Taskén, K., ..., & Barford, D. (2006).
Molecular basis of AKAP specificity for PKA regulatory subunits. Molecular cell, 24(3), 383-95. [PubMed:17081989] [WorldCat] [DOI] - ↑
Taylor, S.S., Kim, C., Vigil, D., Haste, N.M., Yang, J., Wu, J., & Anand, G.S. (2005).
Dynamics of signaling by PKA. Biochimica et biophysica acta, 1754(1-2), 25-37. [PubMed:16214430] [WorldCat] [DOI] - ↑ 8.0 8.1
Alto, N.M., Soderling, S.H., Hoshi, N., Langeberg, L.K., Fayos, R., Jennings, P.A., & Scott, J.D. (2003).
Bioinformatic design of A-kinase anchoring protein-in silico: a potent and selective peptide antagonist of type II protein kinase A anchoring. Proceedings of the National Academy of Sciences of the United States of America, 100(8), 4445-50. [PubMed:12672969] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1
Wang, Y., Ho, T.G., Franz, E., Hermann, J.S., Smith, F.D., Hehnly, H., ..., & Kennedy, E.J. (2015).
PKA-type I selective constrained peptide disruptors of AKAP complexes. ACS chemical biology, 10(6), 1502-10. [PubMed:25765284] [PMC] [WorldCat] [DOI] - ↑
Hall, D.D., Davare, M.A., Shi, M., Allen, M.L., Weisenhaus, M., McKnight, G.S., & Hell, J.W. (2007).
Critical role of cAMP-dependent protein kinase anchoring to the L-type calcium channel Cav1.2 via A-kinase anchor protein 150 in neurons. Biochemistry, 46(6), 1635-46. [PubMed:17279627] [WorldCat] [DOI] - ↑
Hoshi, N., Zhang, J.S., Omaki, M., Takeuchi, T., Yokoyama, S., Wanaverbecq, N., ..., & Higashida, H. (2003).
AKAP150 signaling complex promotes suppression of the M-current by muscarinic agonists. Nature neuroscience, 6(6), 564-71. [PubMed:12754513] [PMC] [WorldCat] [DOI] - ↑
Sanderson, J.L., Gorski, J.A., Gibson, E.S., Lam, P., Freund, R.K., Chick, W.S., & Dell'Acqua, M.L. (2012).
AKAP150-anchored calcineurin regulates synaptic plasticity by limiting synaptic incorporation of Ca2+-permeable AMPA receptors. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(43), 15036-52. [PubMed:23100425] [PMC] [WorldCat] [DOI] - ↑
Hoshi, N., Langeberg, L.K., & Scott, J.D. (2005).
Distinct enzyme combinations in AKAP signalling complexes permit functional diversity. Nature cell biology, 7(11), 1066-73. [PubMed:16228013] [PMC] [WorldCat] [DOI] - ↑ 14.0 14.1 14.2 14.3 14.4 14.5 14.6 14.7
Bucko, P.J., & Scott, J.D. (2021).
Drugs That Regulate Local Cell Signaling: AKAP Targeting as a Therapeutic Option. Annual review of pharmacology and toxicology, 61, 361-379. [PubMed:32628872] [WorldCat] [DOI] - ↑
Merrill, R.A., & Strack, S. (2014).
Mitochondria: a kinase anchoring protein 1, a signaling platform for mitochondrial form and function. The international journal of biochemistry & cell biology, 48, 92-6. [PubMed:24412345] [PMC] [WorldCat] [DOI] - ↑
Edwards, G., Perkins, G.A., Kim, K.Y., Kong, Y., Lee, Y., Choi, S.H., ..., & Ju, W.K. (2020).
Loss of AKAP1 triggers Drp1 dephosphorylation-mediated mitochondrial fission and loss in retinal ganglion cells. Cell death & disease, 11(4), 254. [PubMed:32312949] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1 17.2 17.3
Suryavanshi, S.V., Jadhav, S.M., & McConnell, B.K. (2018).
Polymorphisms/Mutations in A-Kinase Anchoring Proteins (AKAPs): Role in the Cardiovascular System. Journal of cardiovascular development and disease, 5(1). [PubMed:29370121] [PMC] [WorldCat] [DOI]