カルシニューリン
野中美応
Centre for Cognitive and Neural Systems, The University of Edinburgh
DOI:10.14931/bsd.3058 原稿受付日:2013年1月8日 原稿完成日:2013年6月1日
担当編集委員:林康紀(理化学研究所)
英:Calcineurin 英略称:CaN, CN, caln, ccn1, cna1, calna1
同義語:Protein phosphatase 2B (PP2B), Protein phosphatase 3 (ppp3), calcium-dependent serine-threonine phosphatase
カルシニューリンは、脳神経系に豊富に発現するカルシウム・カルモジュリン依存的セリン-スレオニン脱リン酸化酵素である。PP1/PP2A/カルシニューリンスーパーファミリーに属する[1] 脳神経系においては、シナプス刺激などによるカルシウムにより活性化され、NFAT、ダイナミンI、Inhibitor-1(L-I)/DARPP-32、Tau、CRTC、GluA1、FMRP、Bcl-2、GABAA受容体といった多様な基質を脱リン酸化する。長期抑制・長期増強などのシナプス可塑性、ひいては記憶学習や、神経突起伸長・細胞内カルシウム・遺伝子発現調節・アポトーシスの制御に関わるとされている。
カルシニューリンとは
| Calcineurin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
Crystal structure of calcineurin in complex with AKAP79 peptide | |||||||||
| Identifiers | |||||||||
| Symbol | CaN, CN, PP2B, ppp3, caln, ccn1, cna1, calna1 | ||||||||
| Pfam | PF00149 | ||||||||
| Pfam clan | CL0163 | ||||||||
| SCOP | 1fjm | ||||||||
| SUPERFAMILY | 1fjm | ||||||||
| |||||||||
1978年にKleeらが初めて精製し[2]、ホスホジエステラーゼの調節サブユニットとして報告し、カルシニューリン(calcineurin)と名付けられたが、その後1982年にCohenらによって脱リン酸化酵素であると同定された[3]。哺乳類細胞においてCa2+により活性化される唯一の脱リン酸化酵素であり、脳神経系に豊富に発現する。進化的には、酵母からハエ・哺乳類に至るまで保存されている。
構造
ドメイン構造
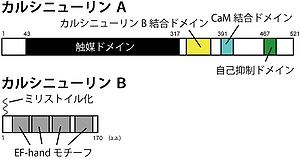
カルシニューリンは 触媒サブユニットであるカルシニューリン A (57-59 kDa)と、修飾サブユニットであるカルシニューリン B (19-20 kDa)からなる。それぞれ、3種(PPP3CA、PPP3CB、and PPP3CC)と2種(PPP3R1、PPP3R2)の遺伝子にコードされる(表)。
カルシニューリン A は、N末端より、触媒ドメイン・カルシニューリン B 結合ドメイン・カルモジュリン(CaM)結合ドメイン・自己抑制ドメイン(AID)からなる(図)。触媒ドメインはPP2Aと49%、PP1と39%という高い相同性を持つ。
カルシニューリン B はカルモジュリンと相同性があり、4つのCa2+結合ドメインであるEF-handを有し、N末端にミリストイル化を受ける(図)。カルシニューリン Bの1つのCa2+結合ドメインは高親和性で(Kd = 10-7 M)、その他は低親和性(Kd = 0.5 ~ 1 uM)であるが、カルモジュリンと異なり、カルシニューリン BはEGTA存在下でもカルシニューリン A に結合する[4]。
立体構造
1995年に、カルシニューリン(C末端のCaM結合ドメイン・AIDドメインを欠く)と FKBP12-FK506 との複合体の構造が発表された。 [5] [6]
発現分布
| ||||||||||||
| 遺伝子名はAllen Brain Atlasのin situハイブリダイゼーションデーターへリンクしている。 |
PPP3R2は精巣特異的発現とされているが、その他はubiquitousに発現する[1]。PPP3CCも精巣特異的とされていたが、脳における発現が確認されている。
マウス全脳のin situハイブリダイゼーションでPPP3CA, PPP3CB および PPP3R1は脳のほぼ全域における発現が確認されているが、特に大脳皮質・海馬・線条体に豊富に発現する。カルシニューリン A においては、ラット脳内ではPPP3CAの方がPPP3CBよりも豊富に発現しており、PPP3CAの酵素活性がほぼ9割を占める。
細胞内局在としては、主に細胞質に局在するが、NFATと共に核に移行し、また、精細胞においては主に核に局在するなど、核への分布も報告されている。脳の分画においては、細胞質およびシナプトソームに豊富に検出される。
酵素活性
調節機構
カルシニューリンの活性中心には、phosphataseコンセンサス配列であるDXH(X)n GDXXDR(X)m GNHD/E を含む。活性中心にはFe3+とZn2+(錯体)が含まれる。酵素の活性化には Calcineurin B とCa2+/カルモジュリンの結合を必要とする。CaMKなどのCa2+/カルモジュリン依存性リン酸化酵素との類似性から、Ca2+/カルモジュリンの結合により自己抑制ドメイン(AID)が外れるなどの構造変化に基づく活性化メカニズムが唱えられている。 カルモジュリンによる、Ca2+依存的な酵素活性化は協同的である。(ヒル係数 = 2.8 - 3)[4]
阻害剤
Cyclosporine A、FK506は、それぞれ Cyclophilin、FKBP (FK506-binding protein) のImmunophilinと結合し、カルシニューリン活性を阻害する。免疫系で抗原提示細胞からT細胞への活性化、特にIL-2、IL-4遺伝子発現調節を担う転写因子NFATを脱リン酸化して活性化することから[7]、cyclosporinA や FK506といったカルシニューリン阻害剤は免疫抑制剤として使用されてきた。その他、PP1、PP2Aの阻害剤であるオカダ酸も高い濃度(~4 uM)では、カルシニューリン活性を阻害する。
脳神経系における役割
長期可塑性
カルモジュリン存在下で活性化に必要なCa2+濃度は 数百nM (CaM濃度に依存) の領域であり、αCaMKIIなどのCa2+依存性酵素よりも親和性が高いためにLismanらによりLTDへの関与が示唆され[8]、それに合致する電気生理のデータも得られているが、必ずしもこの説を擁護する報告ばかりではない。以下は、LTDを引き起こすメカニズムの例である。[9]
- PP1の活性を抑制する I-1/DARPP-32 のPKAによるリン酸化サイト(PP1の抑制作用に必須)を脱リン酸化することにより、間接的にPP1の活性を制御する。
- GluA1のSer845の脱リン酸化(PKAと拮抗)によりLTDをひきおこす。
- NMDA型グルタミン酸受容体の脱感作を促進する。
転写制御
AKAP150 (ヒトAKAP79ホモログ) により、Ca2+チャネルの近傍にアンカリングされ[10]、カルシウム上昇に伴い、転写因子NFATcの脱リン酸化による核移行・転写活性化を促す。また、CREBのコファクターであるCRTCを脱リン酸化し、CREBの活性を増強する。
小胞の内在化
カルシニューリンはダイナミン I と結合し、エンドサイトーシス小胞を構成するタンパク質であるダイナミン、アンフィフィジン、シナプトジャニンらを脱リン酸化することでシナプス小胞のエンドサイトーシスを促進する[11]。 また、NMDA型グルタミン酸受容体依存的なAMPA型グルタミン酸受容体の内在化を担う。
脳神経疾患とのかかわり
統合失調症
カルシニューリン前脳特異的ノックアウトマウスは、ワーキングメモリー異常を含む、 統合失調症様の中間表現型を呈することが報告されている[12]。
ダウン症候群
カルシニューリンはregulator of Calcineurin 1(RCAN1)、別名Down syndrome critical region gene 1(DSCR1)と結合し[13]、転写制御・カルシウム動態制御を介してシナプス可塑性・シナプス形態・短期記憶・長期記憶を制御する[14]。
アルツハイマー病
カルシニューリンは直接、或いは間接的にGSK3βやTauのリン酸化状態を制御するとされる。 また、アストロサイトと神経細胞において、AβによるカルシニューリンとNFATのシグナリングに不調をきたすことが細胞毒性をひきおこす一因となる[15]。
関連項目
参考文献
- ↑ 1.0 1.1
Rusnak, F., & Mertz, P. (2000).
Calcineurin: form and function. Physiological reviews, 80(4), 1483-521. [PubMed:11015619] [WorldCat] [DOI] - ↑
Klee, C.B., & Krinks, M.H. (1978).
Purification of cyclic 3',5'-nucleotide phosphodiesterase inhibitory protein by affinity chromatography on activator protein coupled to Sepharose. Biochemistry, 17(1), 120-6. [PubMed:201280] [WorldCat] [DOI] - ↑
Stewart, A.A., Ingebritsen, T.S., Manalan, A., Klee, C.B., & Cohen, P. (1982).
Discovery of a Ca2+- and calmodulin-dependent protein phosphatase: probable identity with calcineurin (CaM-BP80). FEBS letters, 137(1), 80-4. [PubMed:6279434] [WorldCat] [DOI] - ↑ 4.0 4.1
Stemmer, P.M., & Klee, C.B. (1994).
Dual calcium ion regulation of calcineurin by calmodulin and calcineurin B. Biochemistry, 33(22), 6859-66. [PubMed:8204620] [WorldCat] [DOI] - ↑
Kissinger, C.R., Parge, H.E., Knighton, D.R., Lewis, C.T., Pelletier, L.A., Tempczyk, A., ..., & Moomaw, E.W. (1995).
Crystal structures of human calcineurin and the human FKBP12-FK506-calcineurin complex. Nature, 378(6557), 641-4. [PubMed:8524402] [WorldCat] [DOI] - ↑
Griffith, J.P., Kim, J.L., Kim, E.E., Sintchak, M.D., Thomson, J.A., Fitzgibbon, M.J., ..., & Navia, M.A. (1995).
X-ray structure of calcineurin inhibited by the immunophilin-immunosuppressant FKBP12-FK506 complex. Cell, 82(3), 507-22. [PubMed:7543369] [WorldCat] [DOI] - ↑
Crabtree, G.R., & Schreiber, S.L. (2009).
SnapShot: Ca2+-calcineurin-NFAT signaling. Cell, 138(1), 210, 210.e1. [PubMed:19596245] [PMC] [WorldCat] [DOI] - ↑
Lisman, J. (1989).
A mechanism for the Hebb and the anti-Hebb processes underlying learning and memory. Proceedings of the National Academy of Sciences of the United States of America, 86(23), 9574-8. [PubMed:2556718] [PMC] [WorldCat] [DOI] - ↑
Winder, D.G., & Sweatt, J.D. (2001).
Roles of serine/threonine phosphatases in hippocampal synaptic plasticity. Nature reviews. Neuroscience, 2(7), 461-74. [PubMed:11433371] [WorldCat] [DOI] - ↑
Coghlan, V.M., Perrino, B.A., Howard, M., Langeberg, L.K., Hicks, J.B., Gallatin, W.M., & Scott, J.D. (1995).
Association of protein kinase A and protein phosphatase 2B with a common anchoring protein. Science (New York, N.Y.), 267(5194), 108-11. [PubMed:7528941] [WorldCat] [DOI] - ↑
Marks, B., & McMahon, H.T. (1998).
Calcium triggers calcineurin-dependent synaptic vesicle recycling in mammalian nerve terminals. Current biology : CB, 8(13), 740-9. [PubMed:9651678] [WorldCat] [DOI] - ↑
Zeng, H., Chattarji, S., Barbarosie, M., Rondi-Reig, L., Philpot, B.D., Miyakawa, T., ..., & Tonegawa, S. (2001).
Forebrain-specific calcineurin knockout selectively impairs bidirectional synaptic plasticity and working/episodic-like memory. Cell, 107(5), 617-29. [PubMed:11733061] [WorldCat] [DOI] - ↑
Fuentes, J.J., Genescà, L., Kingsbury, T.J., Cunningham, K.W., Pérez-Riba, M., Estivill, X., & de la Luna, S. (2000).
DSCR1, overexpressed in Down syndrome, is an inhibitor of calcineurin-mediated signaling pathways. Human molecular genetics, 9(11), 1681-90. [PubMed:10861295] [WorldCat] [DOI] - ↑
Martin, K.R., Corlett, A., Dubach, D., Mustafa, T., Coleman, H.A., Parkington, H.C., ..., & Pritchard, M.A. (2012).
Over-expression of RCAN1 causes Down syndrome-like hippocampal deficits that alter learning and memory. Human molecular genetics, 21(13), 3025-41. [PubMed:22511596] [WorldCat] [DOI] - ↑
Reese, L.C., & Taglialatela, G. (2011).
A role for calcineurin in Alzheimer's disease. Current neuropharmacology, 9(4), 685-92. [PubMed:22654726] [PMC] [WorldCat] [DOI]
