知的障害関連遺伝子
近藤 有希子、松本 直通
横浜市立大学 大学院医学研究科
DOI:10.14931/bsd.1281 原稿受付日:2012年5月8日 原稿完成日:2012年5月23日
担当編集委員:加藤 忠史(独立行政法人理化学研究所 脳科学総合研究センター)
英語名: Human genes in relation to Intellectual Disability
英語略名: ID genes
知的障害(Intellectual Disability、以下IDと称す)は全人口のうち約2-3%に認めるといわれ、特徴的な身体所見や検査所見を伴う症候性IDと、ID以外に付随症状を伴わない非症候性IDに分類される。IDのうち約50-60%で遺伝的原因が解明されており、それらは染色体異常、ゲノム構造異常、単一遺伝子異常など多岐にわたる。マイクロアレイや次世代シーケンサーなど分子遺伝学検査の急速な進歩・普及により、現在ID関連遺伝子は約450遺伝子以上も報告され、そのうち症候性IDの原因として約400遺伝子、非症候性IDの原因として約50遺伝子が認知されている。またX連鎖性遺伝子は約22%(約100遺伝子)で、男性にIDの頻度が高い要因となっている。非症候性IDに対するエクソーム解析によって、常染色体上の関連遺伝子の同定が相次いでいる。高速かつ網羅的な解析が可能となることで、疾患の重症度に複数の遺伝子異常の関与も示唆され始めている。ID関連遺伝子の多くは、シナプス形成・機能に関連するタンパク質をコードし、さらに多くの関連遺伝子の同定が進むことで、ID発症メカニズムの詳細が明らかになると期待される。
概略

症候性XLIDの100症候群とその責任遺伝子75遺伝子を示す。(Greenwood Genetic Center, updated June 2011より改変引用)

左側に非症候性XLID (MRX)に関わる22遺伝子、右側に非症候性XLID (MRX)と症候性XLID (MRXS)の両方に関わる17遺伝子を示す。(Greenwood Genetic Center, updated July 2011より改変引用)
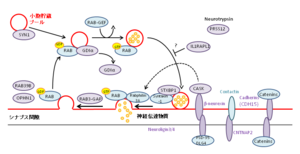
シナプス小胞形成から神経伝達物質の放出までの代表的な経路を示す。ID関連遺伝子がコードする分子は紫色で提示されている。(H. van Bokhoven, 2011より改変引用)

シナプス後肥厚形成、細胞骨格再構成、シグナル伝達、エピジェネティクスな転写制御に関わる代表的な経路を示す。図3と同様ID関連遺伝子がコードする分子は紫色で提示されている。(H. van Bokhoven , 2011より改変引用)
アメリカ精神医学会の定めている「精神疾患の診断・統計マニュアルDSM-IV-TR」の定義によると、IDは
- 明らかに平均以下の知的機能: 個別施行による知能検査で、およそ70またはそれ以下のIQ (幼児においては、明らかに平均以下の知的機能であるという臨床的判断による)
- 同時に、現在の適応機能 (すなわち、その文化圏でその年齢に対して期待される基準に適応する有能さ)の欠陥または不全が、以下のうち2つ以上の領域で存在: コミュニケーション、自己管理、家庭生活、社会的/対人的技能、地域社会資源の利用、自律性、発揮される学習能力、仕事、余暇、健康、安全、
- 発症は18歳以前である状態
としている。軽度(IQ 50-69)、中等度(IQ 35-49)、重度(IQ 20-34)、最重度(IQ 20以下)に分類される。
全人口に占めるIDの頻度は約2-3%、中等度~重度ID(IQ<50)は0.3-0.5%で、IDの約85%は軽症である。男女比は1.3:1で、男性が女性より多い。遺伝的な要因が同定されているのは約50-60%(中等度から重度で約65%、軽度で約20%)で、軽度IDは環境要因が大きいと推定されている[1]。
IDと、精神遅滞(mental retardation: MR)はほぼ同義語であるが、日本では1998年9月公布の精神薄弱の用語の整理のための関係法律の一部を改正する法律において、米国では2010年5月公布のRosa’s Lawにおいて、知的障害(Intellectual Disability)へ呼称を変更することが、法律に明記された。
IDは、症候性と非症候性に大別できる。症候性IDは、特徴的な身体所見、臨床経過および生化学的所見などから他の疾患と区別可能な場合をいう。染色体異常やゲノム構造異常による複数の遺伝子の欠失・重複、または単一遺伝子異常が原因であることが多い。一方非症候性IDは、他のIDをきたす疾患と区別されるような知能以外の特徴的な症状を伴わない場合をいい、単一遺伝子異常や環境要因が原因とされている。小児期にはID以外の身体的特徴が明らかでない場合もあり、両者の区別は時に困難である。
IDの遺伝学的原因
IDの最も頻度の高い原因は21トリソミーであり、21トリソミーも含む染色体異常はIDの約10%に認めるといわれている[2]。染色体異常には数的異常と転座や逆位などの質的構造異常が含まれ、複数の遺伝子の量的異常や構造異常により切断された遺伝子が原因となりうる。通常の染色体検査(核型検査)で正常と判断されたIDの約2.5%にサブテロメア(テロメアに隣接する約100~300 Kbの領域)構造異常を認めることも知られており、蛍光in situハイブリダイゼーション(FISH)法やmultiplex ligation-dependent probe amplification (MLPA) 法を用いて、サブテロメア領域の欠失・重複を検出することが可能である[1]。
また核型検査正常例のマイクロアレイスクリーニングで、数Kbから数Mbにわたる正常ヒトゲノムに認めないコピー数変化(copy number variation : CNV)をIDの約5-20%に認めるといわれており、CNV内の量的感受性遺伝子や近傍の遺伝子発現変化、切断点上の遺伝子破壊や再構成による融合遺伝子などが原因となりうる[2]。単一遺伝子異常には遺伝子全体もしくは部分欠失、重複、点変異などが含まれる。その多くは、症候性IDやX連鎖性ID(X-linked Intellectual Disability、以下XLIDと称す)に関連した染色体・ゲノム構造異常や家系による連鎖解析より単離されてきたが、遺伝子座位同定のみ判明し原因遺伝子が未同定のものも多い。
ID関連遺伝子の分類
ID関連遺伝子は現在450遺伝子以上報告され、そのうち症候性ID関連が約400遺伝子、非症候性ID関連が約50遺伝子である[1]。
X連鎖性遺伝子は約100遺伝子 (約22%)であり、XLIDが高頻度(男性の約1/600-1/1000人)でIDが男性に多いことをよく説明する[3]。XLIDも、非症候性 XLID (従来MRXと呼ばれた)と、症候性XLID (従来のMRXS)に分類される。症候性XLIDには現在150症候群以上が知られ、そのうち約80遺伝子が単離、約30症候群の遺伝子座位が同定されている(図1)。非症候性 XLIDでは45家系以上で遺伝子座位が同定され、現在約40遺伝子が単離されているが、そのうち約20遺伝子は同時に症候性XLIDの責任遺伝子でもある(図2)[1][3][4]。近年、常染色体に責任遺伝子を持つIDの報告が相次いでおり、相対的にXLIDの頻度は低下している[1][5][6][7][8]。
Najmabadiら(2011年)は、常染色体劣性遺伝形式を示す非症候性IDの136血族婚家系に対し、次世代シーケンサーを用いたエクソーム解析を行い、新規原因遺伝子として50遺伝子を同定したと報告している[8]。Awadallaら(2010年)やVissersら(2010年)は、家族歴のない非症候性ID例(自閉症や統合失調症を含む)において、エクソーム解析により常染色体上の遺伝子に多数の新生突然変異(de novo mutation)を報告しており、今後さらに常染色体上のID関連遺伝子の同定が進むと考えられる[5][6]。
ID関連遺伝子は、コードするタンパク質の機能別に、
- シナプス形成に関与するもの
- 細胞骨格に関与するもの
- シグナル伝達系群に関与するもの
- 遺伝子転写制御やエピジェネティクス機構に関与するもの
- 代謝系に関与するもの
などに分けられる。中でもシナプス形成・機能に関連する遺伝子は多い。また一症例に疾患関連CNVや関連遺伝子変異を同時に認める報告も相次いでおり、複数の遺伝子異常がID重症度と関連している可能性が示唆される[1][7][9]。Bokhoven(2011年)が提示したシナプス形成・機能に関与する分子群を示す(図3、4)。
IDの分子遺伝学的診断フローチャート
2011年2月に日本医学会より作成された「医療における遺伝学的検査・診断に関するガイドライン」によると、遺伝学的検査はその分析的妥当性、臨床的妥当性、臨床的有用性などを確認した上で、臨床的および遺伝医学的に有用と考えられる場合に実施するとされている。IDの診断は症候性、非症候性ともに、遺伝学的検査の結果のみにより行われるのではなく、臨床医学的な情報を含め、総合的に行われるべきであるが、遺伝学的検査を行うことで、診断の確定に有用なだけではなく、遺伝型と表現型の関係に関する情報から臨床経過の見通しや適切な予防法や治療法の選択、血縁者、次世代へ関わる情報提供が可能となる。また個々の症例の遺伝的背景が明らかになり、これが蓄積されることで、疾患全体の病態解明が進み、今後の新規治療法開発研究等にもつながることが期待される。遺伝学的検査は遺伝情報の取扱いと、被検者とその血縁者の最善の利益が十分考慮された上で実施されるべきであることは言うまでもない。
アメリカ神経学会(ANN)からの全般性発達障害(global developmental delay)/知的障害(Intellectual Disability)の評価を行うガイドライン(2003年)では、少なくとも三世代にわたる家系図、出生前後の病歴、特徴的な身体所見、画像所見、核型検査などの遺伝学的検査、代謝系の検査、行動などについての評価を段階的に行うことが勧められている[10]。そのなかで遺伝学的検査は3.5~10%に診断的意義を認め、形態異常が認められない症例でも行うべきであるとしている[11]。
遺伝学的検査は段階的に行うことが推奨される(既知の原因探索を除く)。まず染色体異常の検出方法として、Gバンド分染法による核型検査、FISH法が挙げられ、これらの検査では約数Mb~数十Kbレベルの構造異常が検出可能である。より微細なゲノム構造異常、CNVの検出方法として、マイクロアレイ解析、MLPA法、定量PCR法などがあり、これらの検査では数Kbレベルの構造異常を検出することができる。Michelsonら(2011年)の報告によると、核型検査での異常検出率は約4% (症候性は約19%)、サブテロメアFISHでの異常検出率は約3-6% (症候性が約5%)であった[10]。マイクロアレイ解析での異常検出率は約7% (症候性は約11%)であり、欧米ではGバンド分染法に替わるFirst tier testとして提唱された[2]。
単一遺伝子異常のうち、FMR1遺伝子変異は軽症の患児の2%に認め、MECP2遺伝子変異は中等度から重度の女児の1.5%に認めており、家族歴のないID患者でもよく認めることから、ルーチンで行うことが推奨されている[10]。
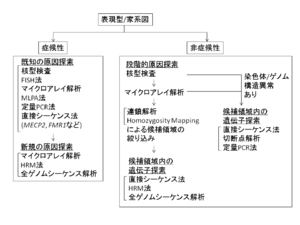
現時点でのIDの分子遺伝学的検査の流れを以下にまとめる(図5)。
症候性IDが疑われる症例は、表現型より推定される既知の原因探索を行う。既知の原因を認めなかった場合は、非症候性IDと同様の段階的な原因探索を行う。非症候性IDが疑われる症例は、まず核型検査を行い染色体異常の有無を確認し、異常を認めなければ、より微細なゲノム構造異常をみるために、マイクロアレイ解析を行う。ゲノム構造異常を認めた場合は、その領域に存在する候補遺伝子の探索、あるいは切断点近傍の遺伝子解析を行う。
ゲノム構造異常を認めない場合は、高密度SNPマイクロアレイを用いて連鎖解析やhomozygosity mappingを行い、候補領域の絞り込みを行う。候補領域内の責任遺伝子探索を続いて行うが、直接シーケンス法で遺伝子変異の探索を行う他に、コントロール配列と変異のある配列の二本鎖が解離する温度の違いを検出することで遺伝子変異の検出を行う、高解像度融解曲線分析 (high-resolution melting curve, HRM) 法を用いることも有用である。近年では次世代シーケンサーを用いた全エクソーム・全ゲノムシーケンス解析を行うことで、高速で網羅的な解析が可能となり遺伝子特定のスピードが上がっている。
展望
マイクロアレイ解析や次世代シーケンス解析などの新しい分子遺伝学検査の進歩・普及により、多くの症例を詳細に解析することができるようになった。その一端としてID関連遺伝子の多くが、シナプス形成・機能に関わるタンパク質をコードするなど、今後も多くの関連遺伝子が同定されIDの総合的理解が進むとともに、ID予防や治療につながる戦略の開発も可能になることが期待される。
参考文献
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5
van Bokhoven, H. (2011).
Genetic and epigenetic networks in intellectual disabilities. Annual review of genetics, 45, 81-104. [PubMed:21910631] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2
Miller, D.T., Adam, M.P., Aradhya, S., Biesecker, L.G., Brothman, A.R., Carter, N.P., ..., & Ledbetter, D.H. (2010).
Consensus statement: chromosomal microarray is a first-tier clinical diagnostic test for individuals with developmental disabilities or congenital anomalies. American journal of human genetics, 86(5), 749-64. [PubMed:20466091] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1
Lubs, H.A., Stevenson, R.E., & Schwartz, C.E. (2012).
Fragile X and X-linked intellectual disability: four decades of discovery. American journal of human genetics, 90(4), 579-90. [PubMed:22482801] [PMC] [WorldCat] [DOI] - ↑ ’’’ Greenwood Genetic Center XLID Update of the Atlas on X-linked Mental Retardation. 2011. http://www.ggc.org/research/molecular-studies/xlid.html’’’
- ↑ 5.0 5.1
Awadalla, P., Gauthier, J., Myers, R.A., Casals, F., Hamdan, F.F., Griffing, A.R., ..., & Rouleau, G.A. (2010).
Direct measure of the de novo mutation rate in autism and schizophrenia cohorts. American journal of human genetics, 87(3), 316-24. [PubMed:20797689] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1
Vissers, L.E., de Ligt, J., Gilissen, C., Janssen, I., Steehouwer, M., de Vries, P., ..., & Veltman, J.A. (2010).
A de novo paradigm for mental retardation. Nature genetics, 42(12), 1109-12. [PubMed:21076407] [WorldCat] [DOI] - ↑ 7.0 7.1
O'Roak, B.J., Deriziotis, P., Lee, C., Vives, L., Schwartz, J.J., Girirajan, S., ..., & Eichler, E.E. (2011).
Exome sequencing in sporadic autism spectrum disorders identifies severe de novo mutations. Nature genetics, 43(6), 585-9. [PubMed:21572417] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1
Najmabadi, H., Hu, H., Garshasbi, M., Zemojtel, T., Abedini, S.S., Chen, W., ..., & Ropers, H.H. (2011).
Deep sequencing reveals 50 novel genes for recessive cognitive disorders. Nature, 478(7367), 57-63. [PubMed:21937992] [WorldCat] [DOI] - ↑
Cooper, G.M., Coe, B.P., Girirajan, S., Rosenfeld, J.A., Vu, T.H., Baker, C., ..., & Eichler, E.E. (2011).
A copy number variation morbidity map of developmental delay. Nature genetics, 43(9), 838-46. [PubMed:21841781] [PMC] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2
Michelson, D.J., Shevell, M.I., Sherr, E.H., Moeschler, J.B., Gropman, A.L., & Ashwal, S. (2011).
Evidence report: Genetic and metabolic testing on children with global developmental delay: report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society. Neurology, 77(17), 1629-35. [PubMed:21956720] [WorldCat] [DOI] - ↑
Shevell, M., Ashwal, S., Donley, D., Flint, J., Gingold, M., Hirtz, D., ..., & Practice Committee of the Child Neurology Society (2003).
Practice parameter: evaluation of the child with global developmental delay: report of the Quality Standards Subcommittee of the American Academy of Neurology and The Practice Committee of the Child Neurology Society. Neurology, 60(3), 367-80. [PubMed:12578916] [WorldCat] [DOI]