神経板
尾松 憩、野村 真
京都府立医科大学
DOI:10.14931/bsd.3508 原稿受付日:2013年3月17日 原稿完成日:2013年3月28日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
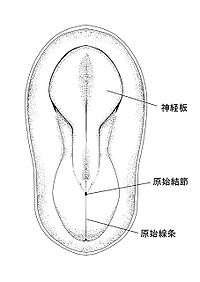
(描画:尾松憩)

(描画:尾松憩)
脊索動物の胚発生初期において、胚の背側に形成される肥厚した組織であり、中枢神経系の原基である(図1及び図2)。発生の進行に伴い、この肥厚組織の側方縁が神経板の正中線で接近し、互いに癒着して神経管を形成する。神経板の形成は、原腸陥入時に起こる神経領域の誘導(神経誘導)に依存している。また初期神経組織の領域化(神経原基のパターン形成)といった、神経発生学的に重要なイベントが神経板形成と同時に進行する。
神経誘導
胚発生の進行に伴い、外胚葉領域は骨形成タンパク質4 (BMP4) の活性により表皮として分化することが運命決定される。しかしながら、原腸形成期にオーガナイザー由来のBMP阻害分子 (Chordin、Noggin、Follistatin) が作用した外胚葉領域は、将来の神経組織として運命決定され、この領域から神経板が形成される。オーガナイザー由来の分子は前方の神経組織(将来の前脳および中脳)を誘導するのに対し、WNT、線維芽細胞増殖因子 (FGF)、レチノイン酸といった分子は後方の神経組織を誘導する[1]。
神経板における領域化
神経板が形成されると同時に、神経板の各領域が将来どのような神経組織として分化するかが決定される。この領域依存的な運命決定機構を「領域化」あるいは「パターン形成」と呼ぶ。この現象には、局所的オーガナイザー由来の分子によって誘導される特異的な転写因子の発現、転写因子同士の発現抑制機構、および転写因子によって誘導される細胞表面分子(編集コメント:これは細胞接着因子と同義でしょうか?)の機能に依存した細胞選別機構が関わっている。
前脳の領域化
将来の前脳領域は神経板の最も前端に形成される。形成直後の神経板は、しゃもじのような形をしており、将来の前脳と中脳はまだひとつながりとなっている。やがて、予定前脳と予定中脳の間に形態的なくびれが生じる。この時期、Anterior Neural Ridge (ANR)と呼ばれる組織由来のFGF8によって、前脳特異的な転写因子であるFoxG1の発現が誘導される[2]。また、前脳特異的な転写因子Pax6と中脳特異的な転写因子であるPax2、Engrailed1との間での発現相互抑制機構によって、前脳と中脳領域の境界が形成される[3]。
中脳/菱脳境界形成
神経板の前方で発現する転写因子Otx2と後方で発現するGbx2の発現抑制作用によって、Otx2とGbx2の発現境界が形成され、この部位が中脳/菱脳境界部となり、中脳を誘導するオーガナイザー分子であるFGF8を分泌するようになる[4]。
後脳の領域化
後脳領域の発生でのその初期にロンボメアと呼ばれる特異的な分節構造が形成される。それぞれのロンボメアは、Hoxファミリー分子やKrox20などの転写因子によってその運命が決定される。各ロンボメアを構成する神経上皮細胞は集合する活性をもち、これによりロンボメアの境界を越えての細胞移動の制限が生じる[5]。実際にロンボメアの細胞の親和性決定に機能している分子の1つがEph受容体とそのリガンドであるエフリンである。異なるロンボメアの細胞は特異的なEph受容体とエフリンのセットを発現しており、これらの分子の反発活性によりロンボメア境界で細胞選別が起こると考えられる[6]。
神経板形成に関連した発生異常
神経板および神経管に関連した発生異常のうち最も多いものが、神経管の閉鎖障害によるものである。神経管閉鎖障害が起こる部位また程度によって、様々な障害が生じる[7] [8]。
無脳症
神経管の頭部領域での閉鎖不全により、前脳から後脳由来の構造が大きく欠損した状態。頭骸骨も欠損している場合も多い。
二分脊椎
脊髄神経管の閉鎖不全によって生じる。神経管の背側での融合が起きないことで、神経管周囲に形成されるべき脊椎骨の形成も阻害される場合が多い。二分脊椎は、脊椎と脊髄の両方に分裂が生じ、体表面に開放部が存在する重篤なもの (嚢胞性二分脊椎) から、体表面からその異常が確認できないもの軽度なもの(潜在性二分脊椎)まで様々な障害の程度が存在する。
関連項目
参考文献
- ↑
Stern, C.D. (2005).
Neural induction: old problem, new findings, yet more questions. Development (Cambridge, England), 132(9), 2007-21. [PubMed:15829523] [WorldCat] [DOI] - ↑
Wilson, S.W., & Rubenstein, J.L. (2000).
Induction and dorsoventral patterning of the telencephalon. Neuron, 28(3), 641-51. [PubMed:11163256] [WorldCat] [DOI] - ↑
Matsunaga, E., Araki, I., & Nakamura, H. (2000).
Pax6 defines the di-mesencephalic boundary by repressing En1 and Pax2. Development (Cambridge, England), 127(11), 2357-65. [PubMed:10804178] [WorldCat] - ↑
Nakamura, H., & Watanabe, Y. (2005).
Isthmus organizer and regionalization of the mesencephalon and metencephalon. The International journal of developmental biology, 49(2-3), 231-5. [PubMed:15906236] [WorldCat] [DOI] - ↑
Fraser, S., Keynes, R., & Lumsden, A. (1990).
Segmentation in the chick embryo hindbrain is defined by cell lineage restrictions. Nature, 344(6265), 431-5. [PubMed:2320110] [WorldCat] [DOI] - ↑
Cooke, J.E., & Moens, C.B. (2002).
Boundary formation in the hindbrain: Eph only it were simple... Trends in neurosciences, 25(5), 260-7. [PubMed:11972963] [WorldCat] [DOI] - ↑ Sadler, T. W.
Langman's medical embryology.
Eleventh, North American Edition edn, (Lippicott Williams & Wikins, 2009). - ↑
Dhaulakhandi, D.B., Rohilla, S., & Rattan, K.N. (2010).
Neural tube defects: review of experimental evidence on stem cell therapy and newer treatment options. Fetal diagnosis and therapy, 28(2), 72-8. [PubMed:20689263] [WorldCat] [DOI]