選択的セロトニン再取り込み阻害薬
永安 一樹
大阪大学大学院薬学研究科 神経回路創薬学プロジェクト
DOI:10.14931/bsd.2575 原稿受付日:2025年6月6日 原稿完成日:2025年6月9日
担当編集委員:林(高木)朗子(国立研究開発法人理化学研究所 脳神経科学研究センター)
英:selective serotonin reuptake inhibitor 独:selektiver Serotonin-Wiederaufnahmehemmer 仏:inhibiteur sélectif de la recapture de la sérotonine
英略語:SSRI
選択的セロトニン再取り込み阻害薬(SSRI)は抗うつ薬の一群であり、従来の三環系抗うつ薬と比較してアセチルコリン受容体などに対する親和性をほとんど示さず、セロトニンの再取り込みを選択的に阻害することを特徴とする。中等症以上うつ病治療の第一選択薬候補としてだけでなく、社会不安障害、強迫性障害、パニック障害、心的外傷後ストレス障害に対する治療薬として、また適応外処方ではあるが全般不安症や過食症に対しても用いられている。セロトニンの再取り込みによる不活性化を阻害し、シナプス間隙におけるセロトニンの濃度を比較的選択的に上昇させることで、薬効を発揮していると考えられているものの、その他の機序の重要性を指摘する研究も多く存在する。本邦ではパロキセチン、フルボキサミン、セルトラリンおよびエスシタロプラムの4剤が臨床使用されている。
歴史的経緯
1950年代から60年代にかけて開発された三環系抗うつ薬は、その薬効に寄与すると考えられているセロトニン・ノルアドレナリン再取り込み阻害による神経伝達促進作用に加えて、様々な副作用の原因となるムスカリン型アセチルコリン受容体阻害作用、ヒスタミンH1受容体阻害作用、アドレナリンα1受容体阻害作用などを有している。上記受容体の阻害作用は、口渇、便秘、眼のかすみ、鎮静など様々な副作用の原因となることから、三環系抗うつ薬の忍容性は高くなく、治療効果と副作用のバランスを取ることが難しく十分な用量で使用することが困難であった[1]。
このような背景の下、副作用の原因となる様々な受容体の阻害作用を有さず、薬効に寄与するセロトニン・ノルアドレナリン神経伝達を選択的に促進する化合物が探索された結果、セロトニン神経伝達を選択的に促進するSSRIや、セロトニンおよびノルアドレナリン神経伝達を選択的に促進するセロトニン・ノルアドレナリン再取り込み阻害薬(selective serotonin noradrenaline reuptake inhibitor, SNRI)が開発された。以上のように、イミプラミンなどの三環系抗うつ薬もセロトニン・ノルアドレナリン再取り込みを阻害するが、上述の歴史的経緯から、SSRIあるいはSNRIに分類されることはない。
最も早く実用化されたSSRIはジメリジン (zimelidine)であり、1982年にスウェーデンで実用化されたものの副作用(ギラン・バレー症候群)のため翌年には市場から撤退を余儀なくされた[2]。現在も用いられているSSRIおよびSNRIのうち、最も早く実用化されたのはフルボキサミンであり、1983年に西ドイツおよびスイスで承認されている(米国での承認は1994年)。米国で最も早く実用化されたのはフルオキセチン (fluoxetine, 商品名Prozac、本邦未承認)であり、1987年末に米国食品医薬品局 (FDA)の承認を得ている。翌年の上市以降、(あくまでも当時の治療薬と比較してであるが)その副作用の少なさも相まって急速にその売り上げを伸ばし、累計で200億USドル以上の売り上げを記録するなど、ブロックバスターの地位を長年にわたり維持し続けた。1990年のNewsweek誌の表紙で”A breakthrough drug for depression”として、1999年のFortune誌において”Pharmaceutical Products of the Century”として取り上げられるなど、社会全体に大きな影響を与えた薬剤の一つである[3]。
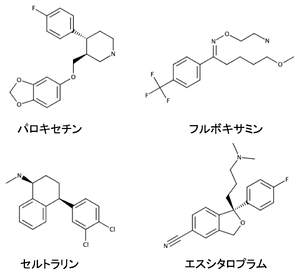
現在使用されているSSRI
本邦ではパロキセチン、フルボキサミン、セルトラリンおよびエスシタロプラムの4剤が臨床使用されているが[4](図1)、海外ではフルオキセチンに加えてエスシタロプラムのラセミ体であるシタロプラムも臨床使用されている[5]。うつ病治療の第一選択薬候補としてだけでなく、社会不安障害(セルトラリン以外の3剤)、強迫性障害(パロキセチンおよびフルボキサミン)、パニック障害(パロキセチンおよびセルトラリン)、心的外傷後ストレス障害(パロキセチンおよびセルトラリン)に対する治療薬として、また適応外処方ではあるが全般不安症(フルボキサミン以外の3剤)や過食症(フルボキサミン)に対しても用いられている[4]。
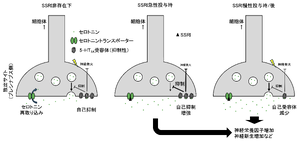
作用機序
SSRIは主にセロトニン神経に発現するセロトニントランスポーター(serotonin transporter, セロトニントランスポーター)に結合し、その機能を阻害する(図2)。一方で、ノルアドレナリントランスポーター(norepinephrine transporter, NET)あるいはドパミントランスポーター(dopamine transporter, DAT)にはほとんど結合しない(表)[6][7][8]。陽電子断層撮像法 (PET)を用いた解析からもセロトニントランスポーターに対するin vivoにおける高い占拠率(>80%)が示されている[9]。
セロトニントランスポーターはシナプス間隙に遊離されたセロトニンをシナプス前部に再取り込みすることで、その作用を終止させる[10][11] 。健常動物におけるマイクロダイアリシス法を用いた検討から、SSRIによるセロトニントランスポーターの阻害が、様々な脳部位におけるセロトニン細胞外濃度の速やかな上昇をもたらすことが明らかになっている[12][13][14]。一方で、三環系抗うつ薬やSNRIなどの他の抗うつ薬と同様にSSRIの薬効発現には数週間以上の期間を必要とするなど、セロトニン細胞外濃度上昇と抗うつ作用の間の関係については未だ不明な点が多い。またSSRIは、低用量では比較的選択的にセロトニン細胞外濃度を上昇させるが、高用量ではノルアドレナリン細胞外濃度も上昇させることから、SSRIの作用の一部にノルアドレナリンを介したものがある可能性を示唆する研究もある[13]。また、SNRIはセロトニントランスポーターに加えてノルアドレナリントランスポーターも阻害するが、SSRIと比較してSNRIの方が寛解率がより高いかについては未だ結論は出ていない[5]。
| 物質 | セロトニントランスポーター | ノルアドレナリントランスポーター | ドパミントランスポーター |
|---|---|---|---|
| フルボキサミン(pKd)[6] | 8.7 | 5.9 | 5.0 |
| フルオキセチン(pKd)[6] | 9.1 | 6.6 | 5.4 |
| パロキセチン(pKd)[6] | 9.9 | 7.4 | 6.3 |
| セルトラリン(pKd)[6] | 9.5 | 6.4 | 7.6 |
| エスシタロプラム(pKi) | 8.4[7] | 5.5[7] | 5.1[8] |
| シタロプラム(pKi) | 8.4[7] | 5.8[7] | 5.0[8] |
SSRIを含む抗うつ薬が薬効発現までに時間を要する原因については未だ完全には解明されていないものの、5-HT1A受容体の脱感作あるいはダウンレギュレーションが生じるまでの遅延であるとする説や、神経栄養因子や神経新生などにより神経可塑的変化、神経回路の再編成が生じるのに時間を要するためであるとする説など、様々な仮説が提案されている。
セロトニン神経に発現する自己抑制性の5-HT1A受容体(および5-HT1B受容体)は、細胞体/樹状突起やバリコシティーと呼ばれるセロトニン放出サイトから遊離したセロトニンにより活性化され、電位依存性カルシウムチャネルの阻害、カリウムチャネルの開口などを介してセロトニン神経活動およびセロトニン遊離にネガティブフィードバックを行っている[15][16]。SSRIなどセロトニントランスポーターの阻害薬の急性投与によりセロトニンの再取り込みが阻害されると、細胞外セロトニン濃度は上昇するものの、抑制性の5-HT1A受容体の活性化を通じてセロトニン神経活動およびセロトニン遊離が抑制されるため、細胞外セロトニン濃度の上昇は限定的なものとなる。実際、げっ歯類における検討では、SSRI急性投与による細胞外セロトニン濃度上昇が5-HT1A受容体阻害薬の共処置により増強することや、SSRI急性投与によるセロトニン神経活動低下が5-HT1A受容体阻害薬の共処置で抑制されることが示されている[17][18]。セロトニントランスポーター阻害薬の慢性投与により5-HT1A受容体が持続的に活性化することで脱感作およびダウンレギュレーションが生じ、セロトニン神経活動に対するネガティブフィードバックが解除される。この5-HT1A受容体の脱感作あるいはダウンレギュレーションに時間を要することが、SSRIなどセロトニントランスポーター阻害作用を有する抗うつ薬の薬効発現に時間を要する理由の一つであると考えられている(図2)。
一方で、抗うつ薬投与後の5-HT1A受容体量低下と抗うつ効果の間に相関がみられないとする臨床研究もあり、抗うつ薬の薬効発現における意義については不明な点も多く残されている[16]。SSRIを含む抗うつ薬の慢性投与が、セロトニン神経の自発的な活動性を(抑制性自己受容体とは無関係に)亢進させることや、脳由来神経栄養因子(brain-derived neurotrophic factor, BDNF)やサイクリックAMP応答配列結合タンパク質 (cAMP responsive element binding protein, CREB)の発現増加、神経新生の増加などを引き起こすことも明らかにされており、これらの因子を通じた神経可塑的変化や神経回路の再編成が抗うつ作用の発現に重要である可能性も示唆される[19][20][21][22]。SSRIを含む抗うつ薬は長年に渡り使用されているもののその機序の解明には未だ至っておらず、さらなる研究がまたれる。
非選択的作用
SSRIはその開発の経緯からセロトニントランスポーターのみに作用すると見なされることが多いが、その後の研究から、様々な受容体やチャネル、酵素に対しても結合することが現在では明らかになっている。フルオキセチンは、μMオーダーではあるもののNMDA型グルタミン酸受容体に対する阻害作用を有しており[23] 、フルボキサミンはシャペロン活性をもつσ1受容体に対する刺激作用を有しており、セルトラリンもσ1受容体に対して高い親和性を示すことが報告されている[24][25][26]。パロキセチンはM1受容体に対する弱い阻害作用および一酸化窒素合成酵素に対する阻害作用を有する[27][28][29]。エスシタロプラムはセロトニントランスポーターに対して極めて選択的に作用することから、少なくともその薬理作用の大部分をセロトニントランスポーターへの阻害作用で説明できるSSRIであると考えられている[5]。また、後述するシトクロムP450 (CYP)を介した薬物相互作用も少ないものの、心伝導上、QT延長などの副作用についても報告されており、必ずしも副作用が少ないことを示すものではない点には注意を要する。
薬物相互作用
抗うつ薬をはじめとする精神疾患治療薬の多くは長期間の服用を必要とすることから、不活性体への代謝阻害など、併用薬との相互作用の可能性について注意が必要である。パロキセチンはCYP2D6の強い阻害作用およびCYP3A4の阻害作用を有しており[28]、特にCYP2D6で代謝を受ける一部の薬剤(一部のβ遮断薬や統合失調症治療薬など)の作用を増強することが報告されている[30]。
エスシタロプラムについては、前述の通りCYPを介した薬物相互作用は少ないものの、QT延長を起こす薬剤との併用については注意が必要である[31]。
フルボキサミンはCYP1A2およびCYP2C19の強い阻害作用を有しており、CYP1A2で代謝を受ける筋緊張改善薬チザニジンとの併用は禁忌となっている[32]。セルトラリンについてはCYP2C19などで代謝を受け、血糖降下薬トルブタミドや胃・十二指腸潰瘍治療薬(H2ブロッカー)であるシメチジンとの併用により薬物動態学的な影響を及ぼすあるいは受けることが知られている[33]。
関連項目
参考文献
- ↑ Briley M. (1998)
Specific serotonin and noradrenaline reuptake inhibitors (SNRIs). A review of their pharmacology, clinical efficacy and tolerability. Hum Psychopharmacol Clin Exp. 13(2):99-111. doi:10.1002/(SICI)1099-1077(199803)13:2<99::AID-HUP954>3.0.CO;2-2 - ↑
Fagius, J., Osterman, P.O., Sidén, A., & Wiholm, B.E. (1985).
Guillain-Barré syndrome following zimeldine treatment. Journal of neurology, neurosurgery, and psychiatry, 48(1), 65-9. [PubMed:3156214] [PMC] [WorldCat] [DOI] - ↑
Wong, D.T., Perry, K.W., & Bymaster, F.P. (2005).
Case history: the discovery of fluoxetine hydrochloride (Prozac). Nature reviews. Drug discovery, 4(9), 764-74. [PubMed:16121130] [WorldCat] [DOI] - ↑ 4.0 4.1 伊豆津 宏二, 今井 靖, 桑名 正隆, 寺田 智祐 (2025)
今日の治療薬2025. 南江堂. - ↑ 5.0 5.1 5.2 仙波 純一, 松浦 雅人, 太田 克也 (監訳) (2023)
ストール精神薬理学エセンシャルズ第5版. メディカル・サイエンス・インターナショナル. - ↑ 6.0 6.1 6.2 6.3 6.4 6.5
Tatsumi, M., Jansen, K., Blakely, R.D., & Richelson, E. (1999).
Pharmacological profile of neuroleptics at human monoamine transporters. European journal of pharmacology, 368(2-3), 277-83. [PubMed:10193665] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2 7.3 7.4 7.5
Andersen, J., Stuhr-Hansen, N., Zachariassen, L., Toubro, S., Hansen, S.M., Eildal, J.N., ..., & Strømgaard, K. (2011).
Molecular determinants for selective recognition of antidepressants in the human serotonin and norepinephrine transporters. Proceedings of the National Academy of Sciences of the United States of America, 108(29), 12137-42. [PubMed:21730142] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2 8.3
Zhang, P., Cyriac, G., Kopajtic, T., Zhao, Y., Javitch, J.A., Katz, J.L., & Newman, A.H. (2010).
Structure-activity relationships for a novel series of citalopram (1-(3-(dimethylamino)propyl)-1-(4-fluorophenyl)-1,3-dihydroisobenzofuran-5-carbonitrile) analogues at monoamine transporters. Journal of medicinal chemistry, 53(16), 6112-21. [PubMed:20672825] [PMC] [WorldCat] [DOI] - ↑
Sørensen, A., Ruhé, H.G., & Munkholm, K. (2022).
The relationship between dose and serotonin transporter occupancy of antidepressants-a systematic review. Molecular psychiatry, 27(1), 192-201. [PubMed:34548628] [PMC] [WorldCat] [DOI] - ↑
Shen, H.W., Hagino, Y., Kobayashi, H., Shinohara-Tanaka, K., Ikeda, K., Yamamoto, H., ..., & Sora, I. (2004).
Regional differences in extracellular dopamine and serotonin assessed by in vivo microdialysis in mice lacking dopamine and/or serotonin transporters. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 29(10), 1790-9. [PubMed:15226739] [WorldCat] [DOI] - ↑
Mathews, T.A., Fedele, D.E., Coppelli, F.M., Avila, A.M., Murphy, D.L., & Andrews, A.M. (2004).
Gene dose-dependent alterations in extraneuronal serotonin but not dopamine in mice with reduced serotonin transporter expression. Journal of neuroscience methods, 140(1-2), 169-81. [PubMed:15589347] [WorldCat] [DOI] - ↑
Perry, K.W., & Fuller, R.W. (1992).
Effect of fluoxetine on serotonin and dopamine concentration in microdialysis fluid from rat striatum. Life sciences, 50(22), 1683-90. [PubMed:1375306] [WorldCat] [DOI] - ↑ 13.0 13.1
David, D.J., Bourin, M., Jego, G., Przybylski, C., Jolliet, P., & Gardier, A.M. (2003).
Effects of acute treatment with paroxetine, citalopram and venlafaxine in vivo on noradrenaline and serotonin outflow: a microdialysis study in Swiss mice. British journal of pharmacology, 140(6), 1128-36. [PubMed:14530210] [PMC] [WorldCat] [DOI] - ↑
Tao, R., Ma, Z., & Auerbach, S.B. (2000).
Differential effect of local infusion of serotonin reuptake inhibitors in the raphe versus forebrain and the role of depolarization-induced release in increased extracellular serotonin. The Journal of pharmacology and experimental therapeutics, 294(2), 571-9. [PubMed:10900234] [WorldCat] - ↑
Hajós, M., Gartside, S.E., & Sharp, T. (1995).
Inhibition of median and dorsal raphe neurones following administration of the selective serotonin reuptake inhibitor paroxetine. Naunyn-Schmiedeberg's archives of pharmacology, 351(6), 624-9. [PubMed:7675121] [WorldCat] [DOI] - ↑ 16.0 16.1
Gray, N.A., Milak, M.S., DeLorenzo, C., Ogden, R.T., Huang, Y.Y., Mann, J.J., & Parsey, R.V. (2013).
Antidepressant treatment reduces serotonin-1A autoreceptor binding in major depressive disorder. Biological psychiatry, 74(1), 26-31. [PubMed:23374637] [PMC] [WorldCat] [DOI] - ↑
Hjorth, S., Bengtsson, H.J., & Milano, S. (1996).
Raphe 5-HT1A autoreceptors, but not postsynaptic 5-HT1A receptors or beta-adrenoceptors, restrain the citalopram-induced increase in extracellular 5-hydroxytryptamine in vivo. European journal of pharmacology, 316(1), 43-7. [PubMed:8982649] [WorldCat] [DOI] - ↑
Koda, M., Kawai, H., Shirakawa, H., Kaneko, S., & Nagayasu, K. (2025).
Effect of antidepressants and social defeat stress on the activity of dorsal raphe serotonin neurons in free-moving animals. Journal of pharmacological sciences, 157(2), 113-123. [PubMed:39828391] [WorldCat] [DOI] - ↑
Nibuya, M., Morinobu, S., & Duman, R.S. (1995).
Regulation of BDNF and trkB mRNA in rat brain by chronic electroconvulsive seizure and antidepressant drug treatments. The Journal of neuroscience : the official journal of the Society for Neuroscience, 15(11), 7539-47. [PubMed:7472505] [PMC] [WorldCat] [DOI] - ↑
Nibuya, M., Nestler, E.J., & Duman, R.S. (1996).
Chronic antidepressant administration increases the expression of cAMP response element binding protein (CREB) in rat hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 16(7), 2365-72. [PubMed:8601816] [PMC] [WorldCat] [DOI] - ↑
Santarelli, L., Saxe, M., Gross, C., Surget, A., Battaglia, F., Dulawa, S., ..., & Hen, R. (2003).
Requirement of hippocampal neurogenesis for the behavioral effects of antidepressants. Science (New York, N.Y.), 301(5634), 805-9. [PubMed:12907793] [WorldCat] [DOI] - ↑
Asaoka, N., Nishitani, N., Kinoshita, H., Kawai, H., Shibui, N., Nagayasu, K., ..., & Kaneko, S. (2017).
Chronic antidepressant potentiates spontaneous activity of dorsal raphe serotonergic neurons by decreasing GABAB receptor-mediated inhibition of L-type calcium channels. Scientific reports, 7(1), 13609. [PubMed:29051549] [PMC] [WorldCat] [DOI] - ↑
Szasz, B.K., Mike, A., Karoly, R., Gerevich, Z., Illes, P., Vizi, E.S., & Kiss, J.P. (2007).
Direct inhibitory effect of fluoxetine on N-methyl-D-aspartate receptors in the central nervous system. Biological psychiatry, 62(11), 1303-9. [PubMed:17659262] [WorldCat] [DOI] - ↑
Hashimoto, K., Fujita, Y., & Iyo, M. (2007).
Phencyclidine-induced cognitive deficits in mice are improved by subsequent subchronic administration of fluvoxamine: role of sigma-1 receptors. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 32(3), 514-21. [PubMed:16495935] [WorldCat] [DOI] - ↑
Stahl, S.M. (2008).
The sigma enigma: can sigma receptors provide a novel target for disorders of mood and cognition? The Journal of clinical psychiatry, 69(11), 1673-4. [PubMed:19200426] [WorldCat] [DOI] - ↑
Yu, L.F., Zhang, H.K., Gunosewoyo, H., & Kozikowski, A.P. (2012).
From α4β2 Nicotinic Ligands to the Discovery of σ1 Receptor Ligands: Pharmacophore Analysis and Rational Design. ACS medicinal chemistry letters, 3(12), 1054-1058. [PubMed:23641311] [PMC] [WorldCat] [DOI] - ↑
Finkel, M.S., Laghrissi-Thode, F., Pollock, B.G., & Rong, J. (1996).
Paroxetine is a novel nitric oxide synthase inhibitor. Psychopharmacology bulletin, 32(4), 653-8. [PubMed:8993087] [WorldCat] - ↑ 28.0 28.1
Nevels, R.M., Gontkovsky, S.T., & Williams, B.E. (2016).
Paroxetine-The Antidepressant from Hell? Probably Not, But Caution Required. Psychopharmacology bulletin, 46(1), 77-104. [PubMed:27738376] [PMC] [WorldCat] - ↑
Sanchez, C., Reines, E.H., & Montgomery, S.A. (2014).
A comparative review of escitalopram, paroxetine, and sertraline: Are they all alike? International clinical psychopharmacology, 29(4), 185-96. [PubMed:24424469] [PMC] [WorldCat] [DOI] - ↑ パロキセチン錠 5mg 10mg 20mg「DSEP」
インタビューフォーム. - ↑ エスシタロプラム錠 10mg 20mg「TCK」
添付文書. - ↑ フルボキサミンマレイン酸塩錠 25mg 50mg 75mg「TYK」
インタビューフォーム. - ↑ セルトラリン錠 25mg 50mg 100mg「DSEP」
インタビューフォーム.