Nogo
藤谷昌司、山下俊英
大阪大学 大学院医学系研究科分子神経科学 分子神経科学
DOI:10.14931/bsd.546 原稿受付日:2012年2月24日 原稿完成日:2012年11月14日
担当編集委員:岡野 栄之(慶應義塾大学 医学部)
Nogoは脊椎動物の中枢神経細胞に対して軸索伸長の阻害効果をもち、髄鞘(ミエリン)に含まれる軸索損傷後の再生を阻害する分子であると考えられている。Nogo-Aタンパク質内には2つの軸索伸張阻害作用を有するタンパク質ドメインがあり(Δ20とNogo-66)、軸索伸長阻害のみならず、軸索の先端の成長円錐を虚脱させる作用を持っている。動物実験によりNogo-Aあるいはその下流のシグナルを阻害することにより、神経損傷時における神経軸索の再生を促すことが示されてきた。このことから軸索が損傷を受け、その再生ができないことにより、重度の後遺障害が残る脊髄損傷や多発性硬化症のような脱髄疾患における軸索再生治療への期待がかけられている。また、病態時のみならず、脳内の学習と記憶のプロセスを強化する過程において重要な役割を果たすことが分かっている。
一次構造とドメイン構造
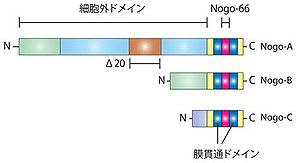
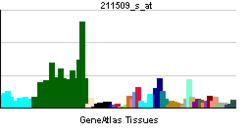
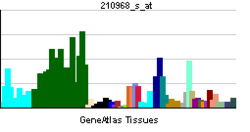
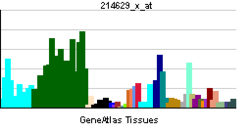
Nogo-Aタンパク質は、1163アミノ酸で構成されるタンパク質である。Nogoタンパク質の一次構造は、RTN4遺伝子によりコードされる二回膜貫通型のタンパク質である(図1)。RTN4遺伝子からは、3つのアイソフォームNogo-A,Nogo-B,Nogo-Cが作られる[1]。
軸索伸展阻害作用を持つNogo-66はNogo-A,-B,-Cに共通の66個のアミノ酸からなるドメインである。一方、もう一つの軸索伸展阻害作用を持つΔ20ドメインは、Nogo-Aのみが持つことが分かっている。Δ20ドメインが重要と考えているグループとNogo-66が重要と考えているグループに分かれているが、一般的に、Nogoの作用を指すのは、Nogo-66の作用である場合が多い。
Nogo-Aは二回膜貫通型で、図2で示されるように、アミノ末端部は細胞外に露出していると考えられている。また、アミノ末端側の膜貫通ドメインは二回膜貫通できるのに十分長いと考えられている。
発現様式
Nogo(RTN4)遺伝子は成体脳・脊髄の比較的広範な希突起膠細胞と神経細胞への発現が認められるが、タンパク質の発現は固定方法によって結果が異なるとされ、パラホルムアルデヒド固定によっては、希突起膠細胞により高い発現があると報告されている[2]。発生時期には、DCX陽性の新生神経細胞に比較的限局したタンパク質と遺伝子発現が認められる[2][3]。 一方、生後および成体脳・脊髄においては主として稀突起膠細胞そして、神経細胞に発現が認められる[2]。希突起膠細胞内では、ミエリン自体における発現はなく、細胞体での発現が高い。なお、脳や脊髄への損傷によっては発現の変化は認められない[2]。
細胞内では、他のreticulonファミリータンパク質と同様に、小胞体もしくは図2に示されるように細胞表面に発現していると考えられている。また、タンパク質はシナプス前部・後部の両方に発現しており、シナプス可塑性を担っている可能性が示唆されている[4]。
タンパク質の機能
成体神経細胞に対する軸索伸展阻害作用
ミエリン由来軸索伸展阻害分子の作用とは
神経細胞自体には再生する力があり、神経細胞を取り巻く環境が再生に適していないのではないかという仮説が提唱されていた。ミエリンが神経突起の伸展を抑制することが報告されたことから、ミエリンの中に再生を阻害している分子が存在していると考えられた。そして、Schwabらにより、ミエリンの各フラクションに対する抗体が作成され、IN-1抗体が発見された[5]。IN-1はミエリンの作用を打ち消し、また、IN-1抗体を脊髄損傷させたラットに投与すると、軸索再生と運動機能の回復が認められることが報告された。その後、3つのグループによりIN-1抗体の認識するペプチド配列をもとに、目的のタンパク質がクローニングされ、Nogoと名付けられた [6][7][8]。
受容体と細胞内シグナル
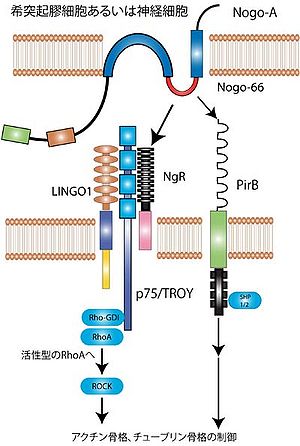
StrittmatterらはNogo-66の受容体、Nogo受容体NgRを同定した[9]。 Nogo受容体は細胞内ドメインをもたないGPIアンカー型タンパク質であり、Nogo-66に対し高親和性を示す。更に、神経栄養因子の受容体であるp75受容体がシグナル伝達を担う受容体であることが証明された[10]。p75とNogo受容体は結合して受容体複合となっている[11](図2左側)。細胞内へのシグナルはRho-GDIからRhoが解離されることによって開始される[12]。活性化されたRho/ROCK経路を介して、軸索や成長円錐の細胞骨格が制御され、軸索伸張阻害や成長円錐虚脱が起こる。
だが、p75/Nogo受容体のみでは、ある種の細胞ではNogoで刺激してもRhoが活性化しない。そこでLingo-1がp75/Nogo受容体コンポーネントとして重要と報告され、p75/Nogo受容体/Lingo-1という受容体複合によりRhoが活性化されて、軸索伸展が阻止されるという基本モデルが完成した(図2左側)[13]。
近年、paired immunoglobulin-like receptor B(PirB)が、Nogo-66に対するもう一つの受容体であることが報告された(図2右側)。PirBとNgRの両方を阻害することにより、ミエリンやNogo-66の軸索伸展阻害作用は、ほぼ完全に消失する[14]。また最近、このNogo受容体に対する内因性の不活性化因子として、LOTUSが同定されている[15]。
ミエリン由来軸索伸展阻害因子のin vivoにおける作用
当初、IN-1抗体や、NEP1-40という阻害ペプチドを用いて、脊髄損傷モデル動物の軸索再生が促進されると報告され、Nogoはin vivoで再生阻害タンパク質として働くと考えられていた。しかし、Nogoのノックアウトマウスを3つのグループが独自に作成し、脊髄損傷後の軸索再生を評価したが、グループ間で結果が異なった[16][17][18]。また、最近になり、主要な再生阻害因子(MAG,Nogo,OMgp)のトリプルノックアウトマウスにおいても脊髄損傷モデルが作成されたが、再生の促進が認められないと報告された[19]。これらの結果については様々な議論がなされている。
その他の機能
Nogoの生理的な機能も解析されている。その中では
- Critical periodの形成に関わり、成体の軸索の再編成を制御し、神経ネットワークの可塑性を制御すること
- 胎生期神経前駆細胞の放射状移動を制御すること
- βセクレターゼ活性の制御によるAPPの切断を制御すること
が報告されている。明確な証明はないが、ミエリンや、ミエリン由来の軸索伸展阻害因子は、軸索の余計な芽生えや分枝が起こることを防ぐことにより、適切な神経回路を維持するのに役立っているのではないかという考えが提唱されている[1]。
参考文献
- ↑ 1.0 1.1
Schwab, M.E. (2010).
Functions of Nogo proteins and their receptors in the nervous system. Nature reviews. Neuroscience, 11(12), 799-811. [PubMed:21045861] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3
Huber, A.B., Weinmann, O., Brösamle, C., Oertle, T., & Schwab, M.E. (2002).
Patterns of Nogo mRNA and protein expression in the developing and adult rat and after CNS lesions. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(9), 3553-67. [PubMed:11978832] [PMC] [WorldCat] [DOI] - ↑
Mathis, C., Schröter, A., Thallmair, M., & Schwab, M.E. (2010).
Nogo-a regulates neural precursor migration in the embryonic mouse cortex. Cerebral cortex (New York, N.Y. : 1991), 20(10), 2380-90. [PubMed:20093372] [PMC] [WorldCat] [DOI] - ↑
Lee, H., Raiker, S.J., Venkatesh, K., Geary, R., Robak, L.A., Zhang, Y., ..., & Giger, R.J. (2008).
Synaptic function for the Nogo-66 receptor NgR1: regulation of dendritic spine morphology and activity-dependent synaptic strength. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(11), 2753-65. [PubMed:18337405] [PMC] [WorldCat] [DOI] - ↑
Schnell, L., & Schwab, M.E. (1990).
Axonal regeneration in the rat spinal cord produced by an antibody against myelin-associated neurite growth inhibitors. Nature, 343(6255), 269-72. [PubMed:2300171] [WorldCat] [DOI] - ↑
Chen, M.S., Huber, A.B., van der Haar, M.E., Frank, M., Schnell, L., Spillmann, A.A., ..., & Schwab, M.E. (2000).
Nogo-A is a myelin-associated neurite outgrowth inhibitor and an antigen for monoclonal antibody IN-1. Nature, 403(6768), 434-9. [PubMed:10667796] [WorldCat] [DOI] - ↑
GrandPré, T., Nakamura, F., Vartanian, T., & Strittmatter, S.M. (2000).
Identification of the Nogo inhibitor of axon regeneration as a Reticulon protein. Nature, 403(6768), 439-44. [PubMed:10667797] [WorldCat] [DOI] - ↑
Prinjha, R., Moore, S.E., Vinson, M., Blake, S., Morrow, R., Christie, G., ..., & Walsh, F.S. (2000).
Inhibitor of neurite outgrowth in humans. Nature, 403(6768), 383-4. [PubMed:10667780] [WorldCat] [DOI] - ↑
Fournier, A.E., GrandPre, T., & Strittmatter, S.M. (2001).
Identification of a receptor mediating Nogo-66 inhibition of axonal regeneration. Nature, 409(6818), 341-6. [PubMed:11201742] [WorldCat] [DOI] - ↑
Yamashita, T., Higuchi, H., & Tohyama, M. (2002).
The p75 receptor transduces the signal from myelin-associated glycoprotein to Rho. The Journal of cell biology, 157(4), 565-70. [PubMed:12011108] [PMC] [WorldCat] [DOI] - ↑
Wang, K.C., Kim, J.A., Sivasankaran, R., Segal, R., & He, Z. (2002).
P75 interacts with the Nogo receptor as a co-receptor for Nogo, MAG and OMgp. Nature, 420(6911), 74-8. [PubMed:12422217] [WorldCat] [DOI] - ↑
Yamashita, T., & Tohyama, M. (2003).
The p75 receptor acts as a displacement factor that releases Rho from Rho-GDI. Nature neuroscience, 6(5), 461-7. [PubMed:12692556] [WorldCat] [DOI] - ↑
Mi, S., Lee, X., Shao, Z., Thill, G., Ji, B., Relton, J., ..., & Pepinsky, R.B. (2004).
LINGO-1 is a component of the Nogo-66 receptor/p75 signaling complex. Nature neuroscience, 7(3), 221-8. [PubMed:14966521] [WorldCat] [DOI] - ↑
Atwal, J.K., Pinkston-Gosse, J., Syken, J., Stawicki, S., Wu, Y., Shatz, C., & Tessier-Lavigne, M. (2008).
PirB is a functional receptor for myelin inhibitors of axonal regeneration. Science (New York, N.Y.), 322(5903), 967-70. [PubMed:18988857] [WorldCat] [DOI] - ↑
Sato, Y., Iketani, M., Kurihara, Y., Yamaguchi, M., Yamashita, N., Nakamura, F., ..., & Takei, K. (2011).
Cartilage acidic protein-1B (LOTUS), an endogenous Nogo receptor antagonist for axon tract formation. Science (New York, N.Y.), 333(6043), 769-73. [PubMed:21817055] [PMC] [WorldCat] [DOI] - ↑
Kim, J.E., Li, S., GrandPré, T., Qiu, D., & Strittmatter, S.M. (2003).
Axon regeneration in young adult mice lacking Nogo-A/B. Neuron, 38(2), 187-99. [PubMed:12718854] [WorldCat] [DOI] - ↑
Simonen, M., Pedersen, V., Weinmann, O., Schnell, L., Buss, A., Ledermann, B., ..., & Schwab, M.E. (2003).
Systemic deletion of the myelin-associated outgrowth inhibitor Nogo-A improves regenerative and plastic responses after spinal cord injury. Neuron, 38(2), 201-11. [PubMed:12718855] [WorldCat] [DOI] - ↑
Zheng, B., Ho, C., Li, S., Keirstead, H., Steward, O., & Tessier-Lavigne, M. (2003).
Lack of enhanced spinal regeneration in Nogo-deficient mice. Neuron, 38(2), 213-24. [PubMed:12718856] [WorldCat] [DOI] - ↑
Lee, J.K., Geoffroy, C.G., Chan, A.F., Tolentino, K.E., Crawford, M.J., Leal, M.A., ..., & Zheng, B. (2010).
Assessing spinal axon regeneration and sprouting in Nogo-, MAG-, and OMgp-deficient mice. Neuron, 66(5), 663-70. [PubMed:20547125] [PMC] [WorldCat] [DOI]