Na-K-2Cl共輸送体
井上 浩一
名古屋市立大学医学研究科統合解剖学分野
DOI:10.14931/bsd.10117 原稿受付日:2023年3月1日 原稿完成日:2023年4月23日
担当編集委員:和田 圭司(国立研究開発法人国立精神・神経医療研究センター)
英:Na-K-2Cl co-transporter
英略語:NKCC
Na-K-2Cl共輸送体は、細胞膜上に局在し、Na+、K+と2個のCl-を同時に輸送するイオントランスポーターである。高等動物ではNKCC1 (SLC12A2)とNKCC2 (SLC12A1)の2つのサブファミリーが存在し、NKCC1はユビキタスに、NKCC2は主に腎臓の尿細管に発現する。主な働きとして、細胞内外へのイオン輸送の制御と、それによる生体・細胞内の容量制御に関与する。その他、神経細胞においては、NKCC1が細胞内Cl-濃度の調節に関与し、細胞内Cl-濃度はGABAやグリシン受容体など陰イオンチャネルを介する膜電位変化(脱分極・過分極)に影響を及ぼすため、神経機能、特に生体における脳機能・精神機能に重要な役割を果たすことが示唆されている。ヒトNKCC2は低カリウム血症などを起こすBartter症候群の原因遺伝子であることが報告されている。
NKCCとは
16世紀から浮腫に対する利尿薬の治療効果が知られていた。20世紀に入り合成化学が進歩すると、1950年代にサイアザイド系利尿薬が、1960年代にループ利尿薬が開発された[1] 。ループ利尿薬の標的の分子実態を探す目的で、イヌの腎臓の膜タンパク質抽出液を用いて放射線同位元素で標識したループ利尿薬と結合する分子を同定し、モノクローナル抗体を作成した[2] 。それらを用い、λファージのcDNAライブラリーを利用した発現クローニングでNKCC1 (SLC12A2)[3]とNKCC2 (SLC12A1)[4] がクローニングされ、その後各生物のNKCC1及びNKCC2の遺伝子が次々に同定された。

NKCC1/2(オレンジ色)はいずれも12回膜貫通型の膜タンパク質で、両末端は細胞質に局在している。いずれもエクソン4によってコードされる膜貫通領域(transmembrane region; TM)2付近(緑色の領域)のアミノ酸配列がイオン輸送に重要であることが示唆されており、NKCC2では異なるエクソン4が挿入されることにより、イオンへの親和性が異なるバリアントが存在する[5]。NKCC1/2はいずれもN末の細胞質領域(P)の複数のセリン/スレオニン残基がリン酸化酵素SPAK及びOSR1によりリン酸化されることによりイオントランスポート活性が増強される。文献[6]に基づき筆者作成。
構造
Solute carrier protein (溶質輸送体タンパク質, Slc)12ファミリーに属する膜タンパク質は12回膜貫通型でN末、C末が細胞内に局在する構造を取る(図1)。NKCC1は約1200アミノ酸(サメ型は1191残基)を含み、ウェスタンブロッティングでは見かけ上195kDaほどの大きさとなる。膜貫通領域(transmembrane, TM)7-8の細胞外領域でグリコシル化(糖鎖修飾)を受けており、グルコシダーゼによる脱グリコシル化で、分子量から期待されるサイズである~130kDaでの検出となる[3] 。
ヒトのNKCC1遺伝子は5番目の染色体上にあり、27のエクソンが連なり、mRNAが作製される。21番目のエクソン(16アミノ酸をコード)がスキップしたスプライスバリアントが存在し、NKCC1B と呼ばれる。NKCC2は15番目の染色体上にあり、約1100アミノ酸(ヒト型は1099残基)を含み、NKCC1同様グリコシル化を受けている[4] 。NKCC2のORFは26のエクソンにまたがっているが、NKCC2のクローニングの際、4番目のエクソンが異なる3つのスプライスバリアント(NKCC2A, B, F)が見いだされている[7] 。
サブファミリー
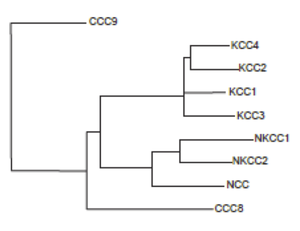
NKCCが含まれるSlc12にはNKCC1/2の他に、Na+、Cl-の共輸送体であるNa-Cl共輸送体 (NCC)とK+、Cl-の共輸送体であるK-Cl共輸送体KCC1-4が含まれる。機能未知のCCC8及びCCC9を構造上ファミリーに加える考えもあるが、相同性はNKCC、NCC、KCCと比べて低い[8](図2) 。

マウスの胎仔の腎臓組織を用いて行ったin situ hybridizationの結果[5]を模式的に表示したもの。NKCC2Fは青、NKCC2Aは緑、NKCC2Bは灰色で示す。
発現
NKCC1はユビキタスに発現している。神経細胞においては、発達につれてNKCC1の発現量が減少するとの報告があるが、ある程度成長した後も野生型とNKCC1欠損マウスでの細胞内Cl-濃度が異なっており、成長後も一定量存在するものと考えられる[9][10] 。細胞内の局在に関しては、NKCC1A/B間で異なるエクソン21に相当する16アミノ酸が極性細胞におけるNKCC1の基底膜側への局在に重要であるとの報告がある[11]。
NKCC2は腎臓特異的に発現しているが、腸管や膵臓ランゲルハンス島のβ細胞に発現するという報告もある[12][13] 。腎臓ではヘンレ係蹄の太い上行脚(thick ascending limb of Henle's loop: TAL)から糸球体付近までの遠位尿細管に発現しており、その中でのバリアントの発現分布は、NKCC2Fは腎髄質内帯の尿細管、NKCC2Aは腎髄質外帯の尿細管から糸球体付近まで、NKCC2Bは糸球体のマクラデンサに発現している[5] 。
機能
Slc12に属する分子は、Na+-K+-ATPaseによって生じるNa+、K+の濃度勾配を利用してCl-の移動を行う共輸送体(シンポーター)であり、その中でNKCCは1つのNa+、1つのK+、2つのCl-を同時に同方向に輸送する。NKCC1を介するCl-の取り込みとそれに伴う水分の流入は細胞の高張ストレスに対する細胞容積調節の主因子となっている。腎尿細管ヘンレ係蹄の太い上行脚(NKCC2優位)や唾液腺分泌上皮など極性のある細胞では一面に局在することにより、Na+やCl-等のイオンを一方向行に移行し、Na+の再吸収や分泌液の生成に作用する[14][15] 。
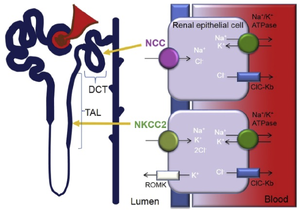
腎尿細管(TAL)ではNKCC2は尿管側に局在し、尿管内の Na+、K+、2Cl- を細胞内に流入させる。K+はROMKを介して再び尿管側へ、Na+とCl-はそれぞれCl-チャネル(ClC-Kb)とNa+/K+-ATPaseを介して血管内に輸送される。一方で、遠位曲尿細管(distal convoluted tubule: DCT)ではNKCC2の代わりにCCCファミリーの分子であるNCCがNaCl輸送に関わる。
文献[16]よりCC BY-NC-ND 4.0に基づき利用。
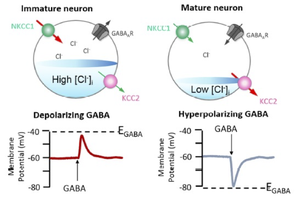
NKCC1が優位な未熟な神経細胞ではGABAA受容体の活性化により細胞内のCl-が流出し脱分極を起こす。成長につれてKCC2の発現が上昇し[Cl-]inが低下するとGABAA受容体の活性化は細胞内へのCl-の流入を起こし過分極する[17]。
神経細胞においては、神経特異的KCC2と協働し細胞内Cl-濃度の調節に関与する。上述のようにNKCC1の発現レベルの変化については統一されていないが、KCC2は発達と共に発現レベルが上昇することが知られている[18] 。このため、KCCはCl-を細胞外にくみ出す活性を持つが、神経細胞では発達につれてKCC2の発現レベルが上昇し、KCC活性がCl-を流入させるNKCC活性を上回り、細胞内Cl-濃度は低下する。神経細胞に発現するGABAA受容体やグリシン受容体は陰イオンチャネルであり、活性化すると生理的条件下ではCl-やHCO3-など陰イオンを透過する。細胞内外の陰イオンではCl-が最も多く、Cl-はHCO3-より透過性が高いため(GABAA受容体ではPHCO3-/PCl-=~0.2[19] )、Cl-が優位に透過することになるが、その場合、膜電位変化はCl-の平衡電位に近づくように変化する。平衡電位はおおむね細胞内外の当該イオンの濃度からネルンストの式から計算される。
E:平衡電位、R:気体定数、T: 温度(K)、F:ファラデー定数、z: イオンの価数、[ion]out: 細胞外イオン濃度、[ion]in: 細胞内イオン濃度
電気生理学的に平衡電位を測定することによりネルンストの式を用い、該当イオンの細胞内濃度を計算することができる。例として、NKCC1が検出できる生後1-3日のラット脳の皮質板(cortical plate)の[Cl-]inは約30 mMであるが、NKCC1が検出感度以下になる生後11-20日の大脳皮質II/III層の神経細胞の[Cl-]inは約9 mMであった[10] 。
このようにKCC2が十分発現している細胞では[Cl-]inが減少することで、GABAA受容体やグリシン受容体が活性化されると、細胞内イオンは細胞内へ流入し、過分極を引き起こすため、これらのリガンドは抑制性伝達物質として作用する。
疾患との関わり
Bartter症候群
NKCC2が関わる遺伝病として、常染色体潜性(劣性)遺伝をとる1型Bartter症候群がある[20][21][22] 。Bartter症候群は、低カリウム血症や代謝性アルカローシスなどをきたす先天性の尿細管機能障害に基づく疾患であり、他の原因遺伝子を含む型と合わせてBartter症候群をなす。Bartter症候群全体での有病率は1/100万人といわれる。1型Bartter症候群は新生児Bartter症候群とも呼ばれ、先進国では出生前から羊水過多などで発見される。他の型と比べ重篤になる傾向がある。
| 1型 | 2型 | 3型 | 4型 | 4b型 | |
|---|---|---|---|---|---|
| 臨床分類 | 新生児型 | 新生児型 | 古典型 | 新生児型 | 新生児型 |
| 責任遺伝子 | SLC12A1 | KCNJ1 | CLCNKB | BSND | CLCNKAおよびCLCNKB |
| タンパク質 | NKCC2 | ROMK | ClC-Kb | Barttin | ClC-KaおよびClC-Kb |
| 遺伝形式 | 常染色体・潜性 | 常染色体・潜性 | 常染色体・潜性 | 常染色体・潜性 | 常染色体・潜性 |
| 役割 | Na-K-2Cl共輸送体 | K+チャネル | Cl-チャネル | Cl-チャネルβサブユニット | Cl-チャネル |
| 羊水過多 | あり | あり | 約半数であり | あり | あり |
| 成長障害 | あり | あり | まれ | あり | あり |
| 尿濃縮能障害 | ++ | ++ | + | +++ | +++ |
| 腎石灰化 | あり | あり | なし | なし | なし |
| 末期腎不全 | あり | あり | まれ | あり | あり |
| 血清Mg | 正 | 正 | 正〜低 | 正〜低 | 正〜低 |
| 尿中Ca | 高 | 高 | 低〜正常〜高 | 低〜正常〜高 | 低〜正常〜高 |
| 発見時の年齢 | 胎児期 | 胎児期 | 新生児、乳児期 | 胎児期 | 胎児期 |
| 利尿薬負荷試験 | フロセミドに無反応 | フロセミド・サイアザイドともに反応 | サイアザイドに無反応 | ? | ? |
| 合併症 | ー | 新生児期高カリウム血症 | ー | 難聴 | 難聴 |
神経性聴覚障害
NKCC1に関しては、先天性の神経性聴覚障害患者に顕性遺伝のNKCC1の変異が認められている[23][24] 。特記すべきこととしては、NKCC1の完全欠損の男児が見つかっており、難聴だけでなく、知的障害や消化器症状・呼吸困難など多岐にわたる症状を呈する[25] 。
NKCC阻害薬の応用
NKCC阻害薬であるブメタニドは腎尿細管でのNKCC2によるNaClの再吸収を抑制し、体内のNaClとそれによって引き起こされる水分貯留を抑制することになるため、浮腫や(FDAの適応外ではあるが)高血圧の治療に利用される[26] 。また、神経の過剰興奮が基となるてんかん患者で既存の薬物療法に耐性のある患者にブメタニドを投与したところ、病態の改善がみられたとの報告がある[27][28] 。NKCC1とKCC2のバランスに異常が生じる可能性がある自閉症スペクトラム症候群やレット症候群、統合失調症の患者にもブメタニドが治療薬として利用できる可能性が指摘されている[29] 。
関連項目
参考文献
- ↑ 野田裕美 (2011).
利尿薬の歴史と作用機序. Fluid Management Renaissance 1:20-24. - ↑
Lytle, C., Xu, J.C., Biemesderfer, D., Haas, M., & Forbush, B. (1992).
The Na-K-Cl cotransport protein of shark rectal gland. I. Development of monoclonal antibodies, immunoaffinity purification, and partial biochemical characterization. The Journal of biological chemistry, 267(35), 25428-37. [PubMed:1460038] [WorldCat] - ↑ 3.0 3.1
Xu, J.C., Lytle, C., Zhu, T.T., Payne, J.A., Benz, E., & Forbush, B. (1994).
Molecular cloning and functional expression of the bumetanide-sensitive Na-K-Cl cotransporter. Proceedings of the National Academy of Sciences of the United States of America, 91(6), 2201-5. [PubMed:8134373] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1
Payne, J.A., & Forbush, B. (1994).
Alternatively spliced isoforms of the putative renal Na-K-Cl cotransporter are differentially distributed within the rabbit kidney. Proceedings of the National Academy of Sciences of the United States of America, 91(10), 4544-8. [PubMed:7514306] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2
Giménez, I., Isenring, P., & Forbush, B. (2002).
Spatially distributed alternative splice variants of the renal Na-K-Cl cotransporter exhibit dramatically different affinities for the transported ions. The Journal of biological chemistry, 277(11), 8767-70. [PubMed:11815599] [WorldCat] [DOI] - ↑
Garneau, A.P., Slimani, S., Fiola, M.J., Tremblay, L.E., & Isenring, P. (2020).
Multiple Facets and Roles of Na+-K+-Cl- Cotransport: Mechanisms and Therapeutic Implications. Physiology (Bethesda, Md.), 35(6), 415-429. [PubMed:33052775] [WorldCat] [DOI] - ↑
Igarashi, P., Vanden Heuvel, G.B., Payne, J.A., & Forbush, B. (1995).
Cloning, embryonic expression, and alternative splicing of a murine kidney-specific Na-K-Cl cotransporter. The American journal of physiology, 269(3 Pt 2), F405-18. [PubMed:7573490] [WorldCat] [DOI] - ↑
Reid, M.S., Kern, D.M., & Brohawn, S.G. (2020).
Cryo-EM structure of the potassium-chloride cotransporter KCC4 in lipid nanodiscs. eLife, 9. [PubMed:32286222] [PMC] [WorldCat] [DOI] - ↑
Khirug, S., Yamada, J., Afzalov, R., Voipio, J., Khiroug, L., & Kaila, K. (2008).
GABAergic depolarization of the axon initial segment in cortical principal neurons is caused by the Na-K-2Cl cotransporter NKCC1. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(18), 4635-9. [PubMed:18448640] [PMC] [WorldCat] [DOI] - ↑ 10.0 10.1
Yamada, J., Okabe, A., Toyoda, H., Kilb, W., Luhmann, H.J., & Fukuda, A. (2004).
Cl- uptake promoting depolarizing GABA actions in immature rat neocortical neurones is mediated by NKCC1. The Journal of physiology, 557(Pt 3), 829-41. [PubMed:15090604] [PMC] [WorldCat] [DOI] - ↑
Carmosino, M., Giménez, I., Caplan, M., & Forbush, B. (2008).
Exon loss accounts for differential sorting of Na-K-Cl cotransporters in polarized epithelial cells. Molecular biology of the cell, 19(10), 4341-51. [PubMed:18667527] [PMC] [WorldCat] [DOI] - ↑
Alshahrani, S., Alvarez-Leefmans, F.J., & Di Fulvio, M. (2012).
Expression of the Slc12a1 gene in pancreatic β-cells: molecular characterization and in silico analysis. Cellular physiology and biochemistry : international journal of experimental cellular physiology, biochemistry, and pharmacology, 30(1), 95-112. [PubMed:22759959] [WorldCat] [DOI] - ↑
Xue, H., Liu, S., Ji, T., Ren, W., Zhang, X.H., Zheng, L.F., ..., & Zhu, J.X. (2009).
Expression of NKCC2 in the rat gastrointestinal tract. Neurogastroenterology and motility : the official journal of the European Gastrointestinal Motility Society, 21(10), 1068-e89. [PubMed:19460103] [WorldCat] [DOI] - ↑
Khalafalla, M.G., Woods, L.T., Jasmer, K.J., Forti, K.M., Camden, J.M., Jensen, J.L., ..., & Weisman, G.A. (2020).
P2 Receptors as Therapeutic Targets in the Salivary Gland: From Physiology to Dysfunction. Frontiers in pharmacology, 11, 222. [PubMed:32231563] [PMC] [WorldCat] [DOI] - ↑
MacAulay, N., & Rose, C.R. (2020).
CrossTalk opposing view: NKCC1 in the luminal membrane of choroid plexus is outwardly directed under basal conditions and contributes directly to cerebrospinal fluid secretion. The Journal of physiology, 598(21), 4737-4739. [PubMed:32870507] [WorldCat] [DOI] - ↑
Meor Azlan, N.F., Koeners, M.P., & Zhang, J. (2021).
Regulatory control of the Na-Cl co-transporter NCC and its therapeutic potential for hypertension. Acta pharmaceutica Sinica. B, 11(5), 1117-1128. [PubMed:34094823] [PMC] [WorldCat] [DOI] - ↑
Andrews, K., Josiah, S.S., & Zhang, J. (2020).
The Therapeutic Potential of Neuronal K-Cl Co-Transporter KCC2 in Huntington's Disease and Its Comorbidities. International journal of molecular sciences, 21(23). [PubMed:33266310] [PMC] [WorldCat] [DOI] - ↑
Rivera, C., Voipio, J., Payne, J.A., Ruusuvuori, E., Lahtinen, H., Lamsa, K., ..., & Kaila, K. (1999).
The K+/Cl- co-transporter KCC2 renders GABA hyperpolarizing during neuronal maturation. Nature, 397(6716), 251-5. [PubMed:9930699] [WorldCat] [DOI] - ↑
Kaila, K. (1994).
Ionic basis of GABAA receptor channel function in the nervous system. Progress in neurobiology, 42(4), 489-537. [PubMed:7522334] [WorldCat] [DOI] - ↑
Simon, D.B., Karet, F.E., Hamdan, J.M., DiPietro, A., Sanjad, S.A., & Lifton, R.P. (1996).
Bartter's syndrome, hypokalaemic alkalosis with hypercalciuria, is caused by mutations in the Na-K-2Cl cotransporter NKCC2. Nature genetics, 13(2), 183-8. [PubMed:8640224] [WorldCat] [DOI] - ↑ 日本小児腎臓病学会. バーター(Bartter)症候群 version 1.1. 小児慢性特定疾患情報センター
- ↑ 22.0 22.1 松野下夏樹、野津寛大、飯島一誠. (2015).
Bartter症候群/Gitelman症候群. 日腎雑誌, 57, 743-750 [PDF] - ↑
McNeill, A., Iovino, E., Mansard, L., Vache, C., Baux, D., Bedoukian, E., ..., & Delpire, E. (2020).
SLC12A2 variants cause a neurodevelopmental disorder or cochleovestibular defect. Brain : a journal of neurology, 143(8), 2380-2387. [PubMed:32658972] [PMC] [WorldCat] [DOI] - ↑
Mutai, H., Wasano, K., Momozawa, Y., Kamatani, Y., Miya, F., Masuda, S., ..., & Matsunaga, T. (2020).
Variants encoding a restricted carboxy-terminal domain of SLC12A2 cause hereditary hearing loss in humans. PLoS genetics, 16(4), e1008643. [PubMed:32294086] [PMC] [WorldCat] [DOI] - ↑
Macnamara, E.F., Koehler, A.E., D'Souza, P., Estwick, T., Lee, P., Vezina, G., ..., & Tifft, C.J. (2019).
Kilquist syndrome: A novel syndromic hearing loss disorder caused by homozygous deletion of SLC12A2. Human mutation, 40(5), 532-538. [PubMed:30740830] [PMC] [WorldCat] [DOI] - ↑
Sidhu, G., & Puckett, Y. (2022).
Bumetanide. In StatPearls. Treasure Island (FL): StatPearls Publishing. [PubMed:32644607] - ↑
Eftekhari, S., Mehvari Habibabadi, J., Najafi Ziarani, M., Hashemi Fesharaki, S.S., Gharakhani, M., Mostafavi, H., ..., & Hadjighassem, M.R. (2013).
Bumetanide reduces seizure frequency in patients with temporal lobe epilepsy. Epilepsia, 54(1), e9-12. [PubMed:23061490] [WorldCat] [DOI] - ↑
Gharaylou, Z., Tafakhori, A., Agah, E., Aghamollaii, V., Kebriaeezadeh, A., & Hadjighassem, M. (2019).
A Preliminary Study Evaluating the Safety and Efficacy of Bumetanide, an NKCC1 Inhibitor, in Patients with Drug-Resistant Epilepsy. CNS drugs, 33(3), 283-291. [PubMed:30784026] [WorldCat] [DOI] - ↑
Ben-Ari, Y. (2017).
NKCC1 Chloride Importer Antagonists Attenuate Many Neurological and Psychiatric Disorders. Trends in neurosciences, 40(9), 536-554. [PubMed:28818303] [WorldCat] [DOI]
![{\displaystyle E_{ion}={\frac {RT}{Fz}}ln{\frac {[ion]_{out}}{[ion]_{in}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f33c2e265068da649d0eef292065140cf01e8347)