インターロイキン-1受容体付属サブユニット様タンパク質1
吉田 知之
富山大学医学部分子神経科学講座
DOI:10.14931/bsd.11075 原稿受付日:2025年3月31日 原稿完成日:2025年5月21日
担当編集委員:林(高木)朗子(国立研究開発法人理化学研究所 脳神経科学研究センター)
英:interleukin 1 receptor accessory protein like-1
英略称:IL1RAPL1
インターロイキン-1受容体付属サブユニット様タンパク質1 (interleukin 1 receptor accessory protein like-1; IL1RAPL1)はインターロイキン1受容体ファミリーに属する1型膜貫通タンパク質である。神経系に広く発現し、主に興奮性シナプス後部に局在する。シナプス前部の受容体チロシン脱リン酸化酵素PTPRDと結合することによって興奮性シナプスを誘導するシナプスオーガナイザーである。ヒトIL1RAPL1遺伝子はX染色短腕に存在し、X連鎖型非症候性知的障害(MRX)10, 21, 34家系の原因遺伝子として知られている。
インターロイキン-1受容体付属サブユニット様タンパク質1とは
インターロイキン-1受容体付属サブユニット様タンパク質1 (interleukin 1 receptor accessory protein like-1; IL1RAPL1)遺伝子はX染色体p22.1–21.3領域の欠損に起因するX連鎖型非症候性知的障害(MRX)家系34の原因遺伝子としてポジショナルクローニングから、1999年にJ. Chellyらのグループによって同定された[1]。インターロイキン-1受容体付属サブユニット (interleukin-1 receptor accessory protein; IL-1RAP)とおよそ50%のアミノ酸配列相同性があったことから、インターロイキン-1受容体付属サブユニット様タンパク質 (interleukin-1 receptor accessory protein-like, IL1RAPL)と名付けられた。
直後の2000年には系統的にIL-1受容体ファミリー遺伝子の探索と機能解析を進めていたJ.E. Simsらのグループがヒトゲノム配列データベースの相同性検索から、新たに2つのインターロイキン-1受容体ファミリーメンバーを発見し、three immunoglobulin domain-containing IL-1 receptor-related-1 (TIGIRR-1)およびTIGIRR-2として報告した[2]。TIGIRR-2とIL1RAPLは同一タンパク質であり、以後、IL1RAPL/TIGIRR-2はIL1RAPL1として、TIGIRR-1はIL1RAPL2として統一表記されるようになった。
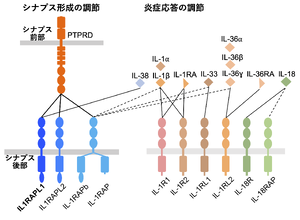
IL-1受容体ファミリーとそのリガンドの直接結合関係を実線で、間接的な結合を破線で示した。
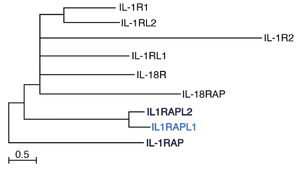
太字のメンバーはシナプスオーガナイザーとして機能する。スケールバーは1サイトあたり0.5回のアミノ酸置換を示す。文献[3]より改変。
構造
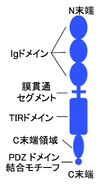
ヒトIL1RAPL1タンパク質はN末端のシグナルペプチドを含めて696アミノ酸より構成される1型膜貫通タンパク質である(図1)。細胞外領域に3つのイムノグロブリン様 (Ig)ドメインを持ち、細胞内領域にToll/Interleukin-1受容体 (TIR)ドメインを1つ持つ。このドメイン配置はIL-1受容体ファミリーの共通構造である。細胞内領域のTIRドメインよりもC末端側にはおよそ150アミノ酸より構成されるC末端領域を持つ。この領域はパラログであるIL1RAPL2とIL-1RAPの神経細胞特異的スプライスバリアント(IL-1RAPb)には存在するが、他のIL-1受容体ファミリータンパク質には存在しない(図1-3)[4]。細胞外領域のIgドメイン内には多数のN型糖鎖付加部位が存在し、糖鎖修飾を受けている[1][5]。C末端には1型PDZドメイン結合モチーフが存在する(機能については後述)[6]。また、細胞外領域の1番目と2番目のIgドメイン、あるいは1から3番目のIgドメインをコードする分泌型と考えられるスプライスバリアント転写物も報告されている[1]。
サブファミリー
3つのIgドメインと1つの細胞内TIRドメインの共通ドメイン構成をもつ9つのIL-1受容体ファミリーメンバーの一員である(図1, 2)[3]。アミノ酸配列はIL-RAPとの間で約50%、パラログのIL1RAPL2との間で62%保存されている。その他のメンバーとの相同性は15-25%程度である。ヒトゲノム中で、IL1RAPL1、IL1RAPL2、IL-1RAP遺伝子(IL1RAP)を除くすべてのIL-1受容体ファミリーメンバー遺伝子は2番染色体の長腕(2q12)にタンデムに並んで存在する。一方、IL1RAPL1及びIL1RAPL2はそれぞれX染色体の短腕(Xp22.1-21.3)と長腕(Xq22)に、IL1RAPは3番染色体長腕(3q28)に存在する。後述するように、他のIL-1受容体ファミリーメンバーとは異なり、IL1RAPL1、IL1RAPL2、IL-1RAPはシナプスオーガナイザーとして機能することからもこれら3つの遺伝子が他とは別個の進化をたどったことが窺える。
発現
マウスIl1rapl1 mRNAは胎生10.5日の胎児から成体までの脳に広く発現することが示されている[1]。主に神経細胞に発現するが、グリア細胞にも発現が確認されている。成体の脳内では広範な領域に発現するが、特に嗅球、嗅内皮質、歯状回を含む海馬、頭頂皮質、乳頭体、乳頭体上核に特に高い発現が確認されている。大脳皮質内では2/3層の、海馬歯状回では顆粒層の顆粒細胞に高い発現が確認されている。神経細胞内では興奮性シナプス後部(スパイン)に局在する[6][7]。
機能
分子機能
IL-1ファミリーサイトカインの受容体として
IL-1ファミリーサイトカイン(リガンド)がリガンド結合受容体サブユニットに結合するとリガンド結合受容体サブユニットの構造が変化し、この構造変化が付属サブユニット(シグナル伝達サブユニット)をリクルートする。このリガンドに依存した受容体の会合に伴う細胞内領域TIRドメインの2量体化がNFκBの活性化などの細胞内シグナルを惹起する[8]。当初、IL1RAPL1はリガンド結合受容体サブユニットとしても、付属サブユニットとしても機能しないことが報告された[2]。一方、神経細胞にIL-1βを添加した際に惹起されるJNKの活性化にIL1RAPL1が必要であるとの報告もあり[9]、古典的なIL-1シグナルに関与するか否かは長年にわたり謎であったが、炎症抑制性のIL-1ファミリーサイトカインの1つであるIL-38がマクロファージやγδ型T細胞のIL1RAPL1を介して炎症応答を抑制することが報告された[10][11]。
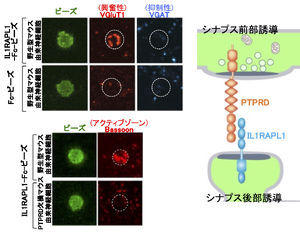
IL1RAPL1の細胞外領域をコートしたビーズとマウス大脳皮質培養神経細胞を共培養するとビーズ周囲にVGluT1(興奮性シナプス前終末マーカー)が集積するがVGAT(抑制性シナプス前終末マーカー)は集積しない(左上)。このシナプス誘導能はPTPRD欠損マウス由来の培養神経細胞に対しては認められない(左下)。右はIL1RAPL1とPTPRDによるシナプス誘導の模式図。
シナプスオーガナイザーとしての分子機能
ゼブラフィッシュ胚、大脳皮質および海馬由来培養神経細胞におけるIL1RAPL1のノックダウンが興奮性シナプスの形成を阻害することが報告されている[7][12][13]。また、IL1RAPL1ノックアウトマウスの海馬CA1や大脳皮質2/3層の錐体細胞の樹状突起スパイン数の減少が確認されている[6][14]。
これらIL1RAPL1機能欠損による興奮性シナプスの減少はIL1RAPL1のシナプスオーガナイザーとしての機能が深く関係している。シナプスオーガナイザーはシナプスを分化誘導し成熟させる機能を持つタンパク質の総称であり、細胞接着タンパク質と分泌性タンパク質型のものが存在する。通常、細胞接着タンパク質タイプのシナプスオーガナイザーは、軸索末端と樹状突起のそれぞれに発現し、細胞外領域を介したトランスシナプティックな相互作用によってシナプス前終末と後終末の分化を誘導する。線維芽細胞等の非神経細胞に発現させ、その細胞を神経細胞と共培養した際に、近接する神経細胞に対してシナプス前終末あるいは後終末を分化誘導するようなタンパク質として定義されている。
IL1RAPL1を発現する線維芽細胞とマウス大脳皮質初代培養神経細胞を共培養すると、線維芽細胞に接する神経軸索に興奮性のシナプス前終末が分化誘導されたことから、IL1RAPL1が興奮性のシナプスオーガナイザーであることが明らかになった[12][13]。このシナプス前終末の誘導には軸索膜上の受容体チロシン脱リン酸化酵素PTPRDとの結合が不可欠である[5][12](図4)。IL1RAPL1の細胞内領域には様々なシナプス後部タンパク質が相互作用することによって興奮性シナプス後部構造が分化誘導される。C末端の1型PDZドメイン結合モチーフにはPSD-95が結合し[6]、TIRドメインおよびそのC末端側の領域にはRhoGAP2[13]とMcf2-like[15]が結合することで興奮性シナプス後部が誘導される。また、IL1RAPL1の下流でJNKの活性化が起こり、PSD-95のシナプス後部への局在が調節される[6]。IL1RAPL1のパラログであるIL1RAPL2およびIL-1RAPもシナプスオーガナイザーであり、PTPRDとの結合を介して興奮性シナプスを誘導する(図1)[7]。
その他の分子機能
IL1RAPL1の相互作用タンパク質として最初に同定されたのは、C末端領域を介して結合するNeuronal calcium sensor 1(NCS1)である[16]。PC12細胞ではIL1RAPL1とNCS1の結合によってN型電位依存性カルシウムチャネルが阻害され、神経突起の伸長やエキソサイトーシスが調節される[17]。
個体における機能
独立に数系統のIl1rapl1遺伝子欠損マウスが作製され、脳の形態学的解析、電気生理学的解析、さらには行動解析を通してその個体での機能評価が進んでいる。Il1rapl1遺伝子欠損マウス系統では海馬錐体細胞の樹状突起形状の複雑化、スパイン密度の減少が観察されている[6][14][18]。電気生理学的な解析からは、小脳と扁桃体の局所的な興奮抑制バランスの変化が認められている[19][20]。行動解析からは、空間参照記憶、空間作業記憶、恐怖記憶の獲得と保持の障害が認められている[13][19]。また、社会性の増加、運動機能の亢進、行動量の亢進、不安様行動の減少も報告されている[13]。
疾患との関わり
IL1RAPL1遺伝子は元来、X染色体連鎖型の非症候性知的障害家系の原因遺伝子として同定された[1]。その後、IL1RAPL1遺伝子上のさまざまな変異が知的障害、自閉スペクトラム症、統合失調症患者から見つかっており、疾患候補遺伝子としてエビデンスの蓄積が期待される[21][22][23][24][25][26][27]。欧州X連鎖型知的障害コンソーシアムの患者のスクリーニングから、IL1RAPL1変異に起因する知的障害はX連鎖型知的障害患者の1%程度を占めると見積もられている[23]。
関連語
参考文献
- ↑ 1.0 1.1 1.2 1.3 1.4
Carrié, A., Jun, L., Bienvenu, T., Vinet, M.C., McDonell, N., Couvert, P., ..., & Chelly, J. (1999).
A new member of the IL-1 receptor family highly expressed in hippocampus and involved in X-linked mental retardation. Nature genetics, 23(1), 25-31. [PubMed:10471494] [WorldCat] [DOI] - ↑ 2.0 2.1
Born, T.L., Smith, D.E., Garka, K.E., Renshaw, B.R., Bertles, J.S., & Sims, J.E. (2000).
Identification and characterization of two members of a novel class of the interleukin-1 receptor (IL-1R) family. Delineation of a new class of IL-1R-related proteins based on signaling. The Journal of biological chemistry, 275(39), 29946-54. [PubMed:10882729] [WorldCat] [DOI] - ↑ 3.0 3.1
Rivers-Auty, J., Daniels, M.J.D., Colliver, I., Robertson, D.L., & Brough, D. (2018).
Redefining the ancestral origins of the interleukin-1 superfamily. Nature communications, 9(1), 1156. [PubMed:29559685] [PMC] [WorldCat] [DOI] - ↑
Smith, D.E., Lipsky, B.P., Russell, C., Ketchem, R.R., Kirchner, J., Hensley, K., ..., & Sims, J.E. (2009).
A central nervous system-restricted isoform of the interleukin-1 receptor accessory protein modulates neuronal responses to interleukin-1. Immunity, 30(6), 817-31. [PubMed:19481478] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1
Yamagata, A., Yoshida, T., Sato, Y., Goto-Ito, S., Uemura, T., Maeda, A., ..., & Fukai, S. (2015).
Mechanisms of splicing-dependent trans-synaptic adhesion by PTPδ-IL1RAPL1/IL-1RAcP for synaptic differentiation. Nature communications, 6, 6926. [PubMed:25908590] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3 6.4 6.5
Pavlowsky, A., Gianfelice, A., Pallotto, M., Zanchi, A., Vara, H., Khelfaoui, M., ..., & Sala, C. (2010).
A postsynaptic signaling pathway that may account for the cognitive defect due to IL1RAPL1 mutation. Current biology : CB, 20(2), 103-15. [PubMed:20096586] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Yoshida, T., Yasumura, M., Uemura, T., Lee, S.J., Ra, M., Taguchi, R., ..., & Mishina, M. (2011).
IL-1 receptor accessory protein-like 1 associated with mental retardation and autism mediates synapse formation by trans-synaptic interaction with protein tyrosine phosphatase δ. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(38), 13485-99. [PubMed:21940441] [PMC] [WorldCat] [DOI] - ↑
Fields, J.K., Günther, S., & Sundberg, E.J. (2019).
Structural Basis of IL-1 Family Cytokine Signaling. Frontiers in immunology, 10, 1412. [PubMed:31281320] [PMC] [WorldCat] [DOI] - ↑
Pavlowsky, A., Zanchi, A., Pallotto, M., Giustetto, M., Chelly, J., Sala, C., & Billuart, P. (2010).
Neuronal JNK pathway activation by IL-1 is mediated through IL1RAPL1, a protein required for development of cognitive functions. Communicative & integrative biology, 3(3), 245-7. [PubMed:20714405] [PMC] [WorldCat] [DOI] - ↑
Mora, J., Schlemmer, A., Wittig, I., Richter, F., Putyrski, M., Frank, A.C., ..., & Brüne, B. (2016).
Interleukin-38 is released from apoptotic cells to limit inflammatory macrophage responses. Journal of molecular cell biology, 8(5), 426-438. [PubMed:26892022] [WorldCat] [DOI] - ↑
Han, Y., Mora, J., Huard, A., da Silva, P., Wiechmann, S., Putyrski, M., ..., & Weigert, A. (2019).
IL-38 Ameliorates Skin Inflammation and Limits IL-17 Production from γδ T Cells. Cell reports, 27(3), 835-846.e5. [PubMed:30995480] [WorldCat] [DOI] - ↑ 12.0 12.1 12.2
Yoshida, T., & Mishina, M. (2008).
Zebrafish orthologue of mental retardation protein IL1RAPL1 regulates presynaptic differentiation. Molecular and cellular neurosciences, 39(2), 218-28. [PubMed:18657618] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2 13.3 13.4
Valnegri, P., Montrasio, C., Brambilla, D., Ko, J., Passafaro, M., & Sala, C. (2011).
The X-linked intellectual disability protein IL1RAPL1 regulates excitatory synapse formation by binding PTPδ and RhoGAP2. Human molecular genetics, 20(24), 4797-809. [PubMed:21926414] [PMC] [WorldCat] [DOI] - ↑ 14.0 14.1
Yasumura, M., Yoshida, T., Yamazaki, M., Abe, M., Natsume, R., Kanno, K., ..., & Mishina, M. (2014).
IL1RAPL1 knockout mice show spine density decrease, learning deficiency, hyperactivity and reduced anxiety-like behaviours. Scientific reports, 4, 6613. [PubMed:25312502] [PMC] [WorldCat] [DOI] - ↑
Hayashi, T., Yoshida, T., Ra, M., Taguchi, R., & Mishina, M. (2013).
IL1RAPL1 associated with mental retardation and autism regulates the formation and stabilization of glutamatergic synapses of cortical neurons through RhoA signaling pathway. PloS one, 8(6), e66254. [PubMed:23785489] [PMC] [WorldCat] [DOI] - ↑
Bahi, N., Friocourt, G., Carrié, A., Graham, M.E., Weiss, J.L., Chafey, P., ..., & Chelly, J. (2003).
IL1 receptor accessory protein like, a protein involved in X-linked mental retardation, interacts with Neuronal Calcium Sensor-1 and regulates exocytosis. Human molecular genetics, 12(12), 1415-25. [PubMed:12783849] [WorldCat] [DOI] - ↑
Gambino, F., Pavlowsky, A., Béglé, A., Dupont, J.L., Bahi, N., Courjaret, R., ..., & Humeau, Y. (2007).
IL1-receptor accessory protein-like 1 (IL1RAPL1), a protein involved in cognitive functions, regulates N-type Ca2+-channel and neurite elongation. Proceedings of the National Academy of Sciences of the United States of America, 104(21), 9063-8. [PubMed:17502602] [PMC] [WorldCat] [DOI] - ↑
Montani, C., Ramos-Brossier, M., Ponzoni, L., Gritti, L., Cwetsch, A.W., Braida, D., ..., & Sala, C. (2017).
The X-Linked Intellectual Disability Protein IL1RAPL1 Regulates Dendrite Complexity. The Journal of neuroscience : the official journal of the Society for Neuroscience, 37(28), 6606-6627. [PubMed:28576939] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Gambino, F., Kneib, M., Pavlowsky, A., Skala, H., Heitz, S., Vitale, N., ..., & Humeau, Y. (2009).
IL1RAPL1 controls inhibitory networks during cerebellar development in mice. The European journal of neuroscience, 30(8), 1476-86. [PubMed:19811529] [WorldCat] [DOI] - ↑
Houbaert, X., Zhang, C.L., Gambino, F., Lepleux, M., Deshors, M., Normand, E., ..., & Humeau, Y. (2013).
Target-specific vulnerability of excitatory synapses leads to deficits in associative memory in a model of intellectual disorder. The Journal of neuroscience : the official journal of the Society for Neuroscience, 33(34), 13805-19. [PubMed:23966701] [PMC] [WorldCat] [DOI] - ↑
Laumonnier, F., Ronce, N., Hamel, B.C., Thomas, P., Lespinasse, J., Raynaud, M., ..., & Briault, S. (2002).
Transcription factor SOX3 is involved in X-linked mental retardation with growth hormone deficiency. American journal of human genetics, 71(6), 1450-5. [PubMed:12428212] [PMC] [WorldCat] [DOI] - ↑
Tabolacci, E., Pomponi, M.G., Pietrobono, R., Terracciano, A., Chiurazzi, P., & Neri, G. (2006).
A truncating mutation in the IL1RAPL1 gene is responsible for X-linked mental retardation in the MRX21 family. American journal of medical genetics. Part A, 140(5), 482-7. [PubMed:16470793] [WorldCat] [DOI] - ↑ 23.0 23.1
Nawara, M., Klapecki, J., Borg, K., Jurek, M., Moreno, S., Tryfon, J., ..., & Mazurczak, T. (2008).
Novel mutation of IL1RAPL1 gene in a nonspecific X-linked mental retardation (MRX) family. American journal of medical genetics. Part A, 146A(24), 3167-72. [PubMed:19012350] [WorldCat] [DOI] - ↑
Piton, A., Michaud, J.L., Peng, H., Aradhya, S., Gauthier, J., Mottron, L., ..., & Rouleau, G.A. (2008).
Mutations in the calcium-related gene IL1RAPL1 are associated with autism. Human molecular genetics, 17(24), 3965-74. [PubMed:18801879] [WorldCat] [DOI] - ↑
Piton, A., Gauthier, J., Hamdan, F.F., Lafrenière, R.G., Yang, Y., Henrion, E., ..., & Rouleau, G.A. (2011).
Systematic resequencing of X-chromosome synaptic genes in autism spectrum disorder and schizophrenia. Molecular psychiatry, 16(8), 867-80. [PubMed:20479760] [PMC] [WorldCat] [DOI] - ↑
Ramos-Brossier, M., Montani, C., Lebrun, N., Gritti, L., Martin, C., Seminatore-Nole, C., ..., & Billuart, P. (2015).
Novel IL1RAPL1 mutations associated with intellectual disability impair synaptogenesis. Human molecular genetics, 24(4), 1106-18. [PubMed:25305082] [PMC] [WorldCat] [DOI] - ↑
Kanwal, A., Pardo, J.V., & Naz, S. (2022).
RGS3 and IL1RAPL1 missense variants implicate defective neurotransmission in early-onset inherited schizophrenias. Journal of psychiatry & neuroscience : JPN, 47(6), E379-E390. [PubMed:36318984] [PMC] [WorldCat] [DOI]